真菌桑黄的药用功效及栽培技术研究进展
2021-03-01任思竹史振霞张艳霞苏姗王宁闫训友
任思竹 史振霞 张艳霞 苏姗 王宁 闫训友


摘要 桑黄是一类名贵的药用真菌,富含多种活性成分,可有效防治包括肿瘤、肠胃不适、糖尿病在内的多种疾病。尽管当前桑黄已被公众所认知并接受,但这些活性化合物的复杂性及其具体药用功效仍不明确,因此,这些无毒、无副作用活性成分的研发时刻在鼓励着相关研究的广泛开展。此外野生桑黄通常需多年才能生长成熟,子实体十分珍稀,而桑黄的短缺以及市场价格的不断上涨也必然会导致人为采摘的加剧,因此研究桑黄的人工栽培技术也是促进桑黄产业可持续发展的必然途径。通过归纳近年国内外的相关文献,简述桑黄的药用功效和栽培技术的最新研究进展,以期为进一步促进桑黄深加工产品的研发、加速桑黄产业化进程提供一定的思考。
关键词 桑黄;药用真菌;活性成分;药用功效;栽培技术
中图分类号 S567.3;Q949.329 文献标识码 A
文章编号 0517-6611(2021)03-0005-05
doi:10.3969/j.issn.0517-6611.2021.03.002
Abstract Phellinus linteus is a kind of valuable medicinal fungus,which is rich in many active ingredients,it can effectively prevent and cure many diseases including tumor,diabetes and gastrointestinal diseases,etc.Recently, Phellinus linteus has been widely recognized and accepted by the public,but its complexity of these active compounds and their specific medicinal effects are still unclear.Therefore,researching and developing of these nontoxic,nonsideeffects active ingredients are encouraging the deepening of relevant researches.In addition,wild Phellinus linteus usually takes many years to grow and mature,and the fruiting bodies are very rare.The shortage of Phellinus linteus and the rising market price will inevitably lead to the intensification of artificial picking.Therefore,studying the artificial cultivation technology of Phellinus linteus can also promote the sustainable development of this industry.This study summarized the relevant domestic and foreign literature in recent years,briefly described the medicinal efficacy and the related progress of cultivation technology of Phellinus linteus,in order to further promote the research and development of Phellinus linteus deepprocessed products and accelerate the process of industrialization of Phellinus linteus.
Key words Phellinus linteus;Medicinal fungus;Active ingredients;Medicinal efficacy;Cultivation techniques
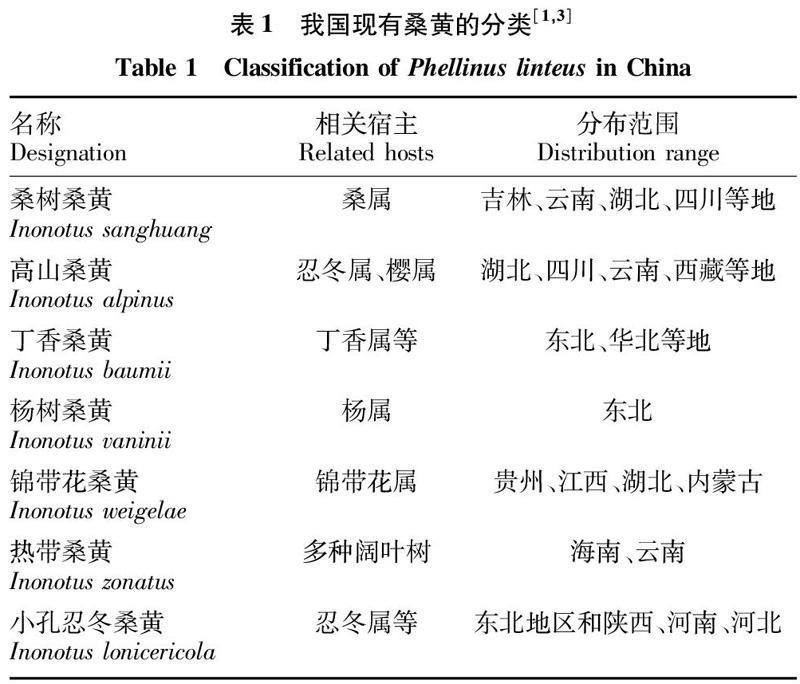
桑黃(Phellinus linteus) 属担子菌亚门、层菌纲、锈革多孔菌目,是一类名贵的食、药两用真菌[1]。传统桑黄菌分鲍氏针层孔菌(Phellinus baumii)、裂蹄针层孔菌(Phellinus linteus)、火木针层孔菌(Phellinus igniarius)、瓦宁纤孔菌(Inonotus vaninii)等不同亚类[2]。但过去行业内对桑黄分类模糊,直到近年采用形态学和分子系统学的深入研究才最终确定桑黄的具体划分,戴玉成等[3]认为桑黄种应单独划为一类,即桑黄纤孔菌,界定桑黄在我国以高山桑黄(又名藏桑黄)、桑黄纤孔菌(又名桑树桑黄)等为主的7个类群。桑黄子实体呈黄褐色、多年生且伴木质化,因寄生树种不同,形状、颜色以及药用成分上都存在一定的差异[4]。此外,桑黄分布广泛,在东北、华北、华东等地都有在杨树、松树、桑树、枣树等树干上发现桑黄子实体的相关报道[5-6]。
我国对桑黄记载较早,药学论著《神农本草经》和《药性论》分别有桑黄可治女性妇科病的记载[7-8];《本草纲目》描述桑黄有保肝养胃、排毒的功效[9]。《普济方》中则详细记录了桑黄可治小便不畅、流血疼痛,而《本经逢原》提到桑黄可补气、治疗积水和肿瘤以及咽喉肿痛[10]等多种疾病。但近代我国桑黄的研究相对缓慢,直到21世纪桑黄才逐渐得到食用菌种植业和菌物界研究人员的广泛关注,在吉林白山、山西等地形成规模化种植桑黄的产业格局。探索、挖掘桑黄的药用价值和人工栽培技术是推动桑黄产业发展的基础和原动力,笔者从桑黄的药用功效和栽培技术两方面进行综述,不但深入描述桑黄的药用成分及其作用机理和人工栽培情况,还在此基础上总结桑黄发展中存在的问题并展望产业发展的未来。
1 桑黄的药用功效
自然界分布的桑黄种类繁多(表1),根据产地和分类不同,药用成分存在一定的差异。据报道桑黄对多种疾病有效,可改善血液循环、排毒保肝、抗敏以及治疗糖尿病和口腔溃疡,另外对缓解胃肠疾病和淋巴系统疾病也有一定疗效[11]。相似于其他药用菌,桑黄水提取物含有多糖[5]、蛋白聚糖、黄酮[12]、麦角固醇、香豆素[13]、呋喃[14-15]和胞外酶[16]等生物活性成分。其中,尤以桑黄多糖的抗肿瘤功效最为显著[17]。色谱学研究表明桑黄多糖主要由葡萄糖、鼠李糖、木糖、阿拉伯糖、甘露糖等单糖单元构成[18]。Yang等[19]研究发现桑黄的杂多糖PIP60-1主要由L-海藻糖、D-葡萄糖、D-甘露糖和半乳糖按一定比例缩合而成,而Baker等[20]也在研究桑黄抗肿瘤和转移的过程中,通过硫铵沉淀、透析/浓缩以及阴离子交换色谱分离得到多糖,得出这些多糖结构上是由葡萄糖和甘露糖2种单体构成,还以建模的方式论证出这种聚糖高度分枝化、无显著数量的短侧链的结论。
1.1 抗肿瘤功效
因桑黄多糖抑制肿瘤效果明显,Xue等[21]研究发现桑黄水提物中所含多糖可有效激活体内的免疫调节功能进而抑制癌细胞活性,使之停滞在S期。Guo等[22]研究发现桑黄具有显著的抗肿瘤功能,通过调控淋巴细胞可间接提高宿主免疫力以抑制癌细胞扩散。Kim等[23]从桑黄水溶液中提取蛋白聚糖,分析出蛋白聚糖是由多糖和蛋白质共同组成;其中,蛋白质中含有谷氨酸、丝氨酸等残基,而多糖则是由甘露聚糖和木聚糖缩聚而成。时隔一年,Kim等[24]再次研究指出桑黄的水提物具有较好的抗肿瘤和提高免疫力的功效,并在桑黄中分离出酸性多糖用于培养腹膜巨噬细胞,此外,多糖还有良好的杀肿瘤和抗黑素瘤细胞效果。Han等[25]将分离出的桑黄多糖用于抑制肿瘤生长和化疗后癌细胞转移的效果研究。除多糖外,曹红妹等[16]还发现桑黄中含有多种胞外酶(如漆酶),也同样具有抑制肿瘤扩散和防止癌细胞增殖的效果。因此,未来开发桑黄多糖使之成为良好的生物型抗肿瘤药物,将是现行化学药品毒副作用强、效果不佳的理想替代。
1.2 抗氧化功效
桑黄抗氧化能力优良[26],可延缓机体衰老和清除自由基毒害。Lee等[27]在桑黄的子实体中分离出儿茶酚、鞣花酸等9种活性化合物,其中组氨酸的衍生物对自由基起清理功能,这为治疗糖尿病天然药物的合成提供可能。同样,Lung等[28]研究发现桑黄的甲醇和水提物都具有很强的抗氧化性能,其中总黄酮存在于甲醇提取物中,而热水提取中存在的抗氧化剂成分是总酚,这为功能性食品和药品的开发提供了丰富的原料来源。Park等[29]在筛选天然产物活性氧清除剂时发现,从桑黄菌丝培养液中分离出组氨酸抗氧化剂,经过10 d的发酵培养,抗氧化剂含量能够达到最高,而当发酵培养12 d后对羟基自由基的抑制作用最明显。张俊峰等[30]也探讨了桑黄的菌丝体和子实体在抗氧化活性和抑制肿瘤方面的机制,结果发现,在抗氧化能力上,桑黄菌丝醇提取物始终高于子实体醇提取物,但在抑制肿瘤方面的能力子实体要优越菌丝体;桑黄的次级代谢产物中的黄酮含量与抗氧化活性呈正相关,这为产品开发提供了基础的数据支撑。应瑞峰等[5]以一种超声波结合微波辅助的方式进行桑黄多糖的提取,其后利用多糖进行抗氧化和抑癌活性的检测,结果发现,桑黄多糖对清除超氧负离子表现出很强的能力,能明显地抑制Hela 细胞和人肝癌细胞 HepG2的细胞毒性。张珈宁等[31]以小鼠为研究对象,开展桑黄多糖醇提取物治疗日本血吸虫的相关研究,并分析出桑黄多糖对某些特定基因有上调表达的作用,进而一定程度促进下游抗氧化基因的表达,使得肝细胞的抗氧化能力大为加强。
1.3 治疗糖尿病
桑黄在治疗糖尿病方面也展现出较好的开发前景,Choi等[32]研究桑黄对胰腺切除的大鼠胰岛素分泌情况发现,与正常切除组对比,食用桑黄水提物的大鼠组在葡萄糖代谢率方面出现降低,表明桑黄对动物的胰岛素分泌有明显的改善调节功能。Kim等[33]在pH为5、培养温度为25 ℃培养桑黄15 d,菌丝生物量可达14.2 g/L,21 d培养后胞外多糖可达3.5 g/L,而且药理学试验也进一步表明由链脲佐菌素诱导而得糖尿病的大鼠,其血糖、总胆固醇和三酰甘油的浓度分别降低49%、32%和28%,这说明桑黄有预防糖尿病的疗效。Liu等[34]以大鼠为研究对象,分析固态培养时桑黄菌丝提取物对药物诱导所引发的Ⅱ型糖尿病的降血糖和降血脂的影响,发现这种化合物可以对降低血液中葡萄糖的水平、改善胰岛素的分泌水平有明显效果,而作用机理可能是由于抑制大鼠肝糖异生酶的表达和肝糖原的降解水平造成的,进而降低了肝脏中葡萄糖的产生。
1.4 免疫调节功效
日韩两国很早就已开始桑黄对免疫调节的相关研究,通过细胞调节的途径提高人体免疫力,对改善外周血细胞产生的细胞因子干扰素有积极作用。桑黄还有着极强的抗病毒疗效,Lee等[35]研究发现桑黄的甲醇提取物可控制转运过程,抑制细胞表面病毒糖蛋白的表达,进而抑制病毒的活性。此外,桑黄对改善血液循环、缓解肠道疾病和淋巴管疾病也有一定作用[36]。Fu等[37]研究了桑黄对小鼠免疫功能的影响,从自然杀伤细胞活性、脏器体重比等4个生理指标进行分析,得出桑黄口服液对提高免疫细胞的活性、增强机体免疫功能发挥着重要的作用。Kwon等[38]研究以发芽糙米培养桑黄的提取物对I型过敏反应的影响,结果发现,在发芽糙米中多酚化合物的含量显著高于桑黄的提取物,而发芽糙米的丁醇分数也一定程度上高于桑黄提取物或蒸馏产物;同时,发芽糙米丁醇在抗过敏活性方面可有效地刺激过敏反应的免疫球蛋白IgE的产生,效果优于桑黄的提取物,所以在功能性食品以及I型过敏症的预防药物方面有着广阔的开发前景。
桑黄保肝功效突出,Chen等[39]評估分离得到的桑黄提取物对乙酰氨基酚所诱导的小鼠肝损伤的修复作用,在对小鼠灌胃给药时,桑黄多糖可通过增加脂质过氧化和降低抗氧化酶活性的途径促进氧化应激,从而避免肝细胞的坏死和肝功能下降。此外,桑黄还能降低细胞色素细胞因子的表达和肝脏释放酶的水平,进而加速对乙酰氨基酚的代谢降解。
2 桑黄的栽培技术
野生桑黄受自然因素影响较大、药效降低显著,另因生长周期长,所以桑黄在自然界中的分布少(树干上生长的野生桑黄如图1),开展人工栽培桑黄是解决目前桑黄短缺的可行途径[40]。当前桑黄栽培以育种和栽培技术2个环节最为重要。
2.1 育种
菌种是桑黄栽培的基础,丰产、抗逆性强的菌株将对桑黄种植大有裨益。当前,育种研究还稍显滞后,以分子生物学为手段的基因改良实例并不多,而相比,常规的杂交和诱变育种具有随机性强、周期长等缺陷。所以,未来在加强引种的同时还需加大选育菌种的力度。祝子坪等[41]在桑黄菌种选育时发现,紫外线协同激光复合誘变的方法可增加优良菌株的筛选几率,得到性状良好、遗传稳定的桑黄菌种;与原始菌株相比,菌丝和多糖产量均有所提高。全卫丰等[42]以N+注入孢子的方法筛选出较高生物量和多糖含量的菌丝体。许谦[43]研究紫外线对桑黄原生质体作用效果时发现,致死率随照射时间延长而增大,这间接为育种提供理论性支持。张赫男等[44]以ARTP诱变桑黄的原生质体,得到3种高产黄酮的菌株,而其中一株菌的醇提取物具有较好的抗氧化活性。丁兴红等[45]利用低能离子束诱变的方法可使桑黄的多糖和总黄酮产量得到提高。这些实例都表明在相当一段时间内育种将是桑黄栽培重要的研究课题,对桑黄产业的发展起到推动性作用。
2.2 栽培研究
人工栽培桑黄分“菌丝体培养”和“出黄”两环节,与众多食用菌栽培相似,常见的固体培养以及液体深层培养均可获得桑黄的菌丝体。液体发酵可克服固体培养上的生长慢、劳动强度大等不足,同时也不受时间、空间的约束,只要培养条件适宜,短时间就可获取大量的菌丝体,节省连续化生产的时间和成本。
2.2.1 菌丝体培养。
关于桑黄的菌丝体培养,国内外的报道很多,如Hwang等[46]在摇瓶培养桑黄菌丝,30 ℃和pH为4条件下菌丝生长情况最好,胞外多糖产生量也最高,还确定桑黄培养基配方和此培养条件下,在5 L发酵罐中可得到菌丝生物量的浓度为11 g/L。Zou等[47]研究NaCl对桑黄细胞生长和多糖合成的影响发现,伴随盐浓度由1 g/L增加到7 g/L时,桑黄菌丝和胞内多糖积累量在逐渐降低,而在1 g/L到3 g/L增加时,桑黄的胞外多糖浓度却呈现递增趋势。Zou等[48]在摇瓶培养中分阶段控制pH用于桑黄的菌丝体培养,在24 h内pH维持6.5,如果继续将培养基酸化到45培养就能促进桑黄菌丝和多糖的产生,这为大面积获得桑黄菌丝体提供参数依据。杨成凤等[49]优化桑黄固、液发酵条件,得到最佳的碳和氮比例以及三角瓶培养的条件参数。宋吉玲等[6]在浙江采到野生桑黄,并以ITS序列分析鉴定为桑树桑黄,同时优化该菌种营养生长时菌丝适宜的培养条件。
2.2.2 子实体栽培。
桑黄的栽培场地多样,在日光温室(图2)、塑料大棚、废弃厂房、林地等场所都可种植桑黄。同时,栽培方式也很灵活,常见的地栽、立体栽培等都可以实现桑黄的高产栽培。早在20世纪90年代,韩国的Song等[50]就已开始桑黄的栽培探索并获成功。Hur[51]利用段木进行桑黄的生长试验,发现以蔗糖、甘露糖和葡萄糖为碳源,菌丝生长最佳;硝酸钾和硝酸钠为氮源利于菌丝生长,此外,灭菌后的短枝可很好地促进菌丝的定植,而出菇管理期以地栽模式埋入菌材后5~6个月,室温控制在31~35 ℃以及相对湿度为95%时,子实体可很快长成。
不仅如此,日本也有以室外荫棚段木埋畦栽培桑黄获得成功的案例报道[52],受此启发,我国近年多地都开展桑黄人工种植的尝试。陈艳秋等[53]在1996年从韩国引种后,获得栽培上的成功。赵昊璐等[54]采用玉米粉、木屑浸汁、大米培养基等不同母种配方进行桑黄菌丝的生长试验,选择的玉米粉适合桑黄生长,其菌丝爬行速度可达5.58 mm/d;而木屑和玉米粉的混合原种在28 ℃培养、含水量为55%、pH为6时菌丝生长最为健壮、长满培养基时间最短。吴亚召等[55]分别以麦粒和木屑为代料栽培桑黄,确定其生长的最佳温度是20~25 ℃,光照强度是300 lx,相对湿度在90%左右则可培养出质地较硬、品质好的桑黄。董宇等[56]选择响应面法优化测量桑黄的栽培条件,孙坚等[57]以4种段木(桑、柞、杨、桦)栽培桑黄并进行组间比较,发现菌丝在柞树木段上生长较快,1.5个月菌丝就可基本长满木段,可获得桑黄干品110 g,品质优良甚至可接近野生桑黄。同时,王玉珍等[58]还做了单色光对桑黄栽培产量以及氧化物酶活性的分析,发现红光利于桑黄子实体的生长,而绿蓝黄三色光可能对桑黄细胞存在一定的杀伤作用,从而影响桑黄子实体的生长。
3 结语
桑黄近年显著的药用功能已得到学术界的广泛认可,根据桑黄生长的实际情况,加上市场需求不断激增等客观因素的存在,对桑黄掠夺性开采时有发生,野生桑黄资源已濒临枯竭。所以,加大对桑黄人工栽培技术的研发力度就显得非常重要。当前,这方面工作已卓有成效,但推广种植面积还需进一步扩大,而且集约化、标准化、提质增效的栽培模式水平亟待加强。不仅如此,当下桑黄深加工水平还很低,很多桑黄的药用成分尚不明确[13],这势必将阻碍药用型口服胶囊、口服液、饮片的研发速度,同时也使得相关桑黄的保健食品、功能性饮料等产品的开发举步维艰。只有充分对桑黄野生种不断调查和开发,筛选出适于工厂化栽培的优良桑黄菌种,才可保证规模生产的持续化进行。此外,桑黄品牌和商标的申请刚刚起步,树立国人自己的品牌,走一条集育种-生产-加工-销售于一体的标准化管理体制新模式,结合适于桑黄实际生产的行业标准,将引领推动桑黄产业化的良性发展,使桑黄产业成为国民经济创收的又一支柱型产业。
参考文献
[1] 朱琳,崔宝凯.药用真菌桑黄的研究进展[J].菌物研究,2016,14(4):201-209.
[2] 劉艳,黄传书,赵珮,等.桑树桑黄人工繁育技术研究[J].蚕学通讯,2019,39(2):5-9.
[3] 戴玉成,崔宝凯.药用真菌桑黄种类研究[J].北京林业大学学报,2014,36(5):1-7.
[4] 雷萍,孙悦迎,张文隽,等.野生桑黄菌种分离与培养特性研究初报[J].食用菌学报,2007,14(2):71-75.
[5] 应瑞峰,黄梅桂,王耀松,等.桑黄子实体多糖超声波微波协同辅助提取及活性研究[J].食品研究与开发,2019,40(21):82-88.
[6] 宋吉玲,王伟科,程俊文,等.野生桑黄的分离鉴定及培养特性研究[J].西北农林科技大学学报(自然科学版),2020,48(3):129-136.
[7] 吴声华,黄冠中,陈愉萍,等.桑黄的分类及开发前景[J].菌物研究,2016,14(4):187-200.
[8] 甄权撰,尚志钧辑.药性论(辑释本)[M].合肥: 安徽科学技术出版社,2006.
[9] 秦俊哲,刘华.桑黄功效成分研究的新进展[J].食用菌,2008,30(5):1-2.
[10] 张璐著,顾漫,杨亦周校注.本经逢原[M].北京:中国医药科技出版社,2011.
[11] ZHU T B,KIM S H,CHEN C Y.A medicinal mushroom: Phellinus linteus[J].Current medicinal chemistry,2008,15(13):1330-1335.
[12] NAGATSU A,ITOH S,TANAKA R,et al.Identification of novel substituted fused aromatic compounds,meshimakobnol A and B,from natural Phellinus linteus fruit body[J].Tetrahedron letters,2004,45(30):5931-5933.
[13] 郭照辉,刘红.桑黄菌的特性及人工栽培技术[J].南方园艺,2013,24(4):54-56.
[14] KANG H S,CHOI J H,CHO W K,et al.A sphingolipid and tyrosinase inhibitors from the fruiting body of Phellinus linteus[J].Archives of pharmacal research,2004,27(7):742-750.
[15] MIN B S,YUN B S,LEE H K,et al.Two novel furan derivatives from Phellinus linteus with anticomplement activity[J].Bioorganic & medicinal chemistry letters,2006,16(12):3255-3257.
[16] 曹红妹,胡桂萍,石旭平,等.药用真菌桑黄的研究进展[J].蚕业科学,2019,45(2):285-292.
[17] SLIVA D.Medicinal mushroom Phellinus linteus as an alternative cancer therapy (Review)[J].Experimental and therapeutic medicine,2010,1(3):407-411.
[18] 秦俊哲,刘华.桑黄子实体多糖提取工艺及单糖组成研究[J].中国食用菌,2008,27(6):43-45.
[19] YANG Y,ZHANG J S,LIU Y F,et al.Structural elucidation of a 3Omethyldgalactosecontaining neutral polysaccharide from the fruiting bodies of Phellinus igniarius[J].Carbohydrate research,2007,342(8):1063-1070.
[20] BAKER J R,KIM J S,PARK S Y.Composition and proposed structure of a watersoluble glycan from the Keumsa Sangwhang Mushroom (Phellinus linteus)[J].Fitoterapia,2008,79(5):345-350.
[21] XUE Q,SUN J,ZHAO M W,et al.Immunostimulatory and antitumor activity of a watersoluble polysaccharide from Phellinus baumii mycelia[J].World journal of microbiology and biotechnology,2011,27(5):1017-1023.
[22] GUO J J,ZHU T B,COLLINS L,et al.Modulation of lung cancer growth arrest and apoptosis by Phellinus linteus[J].Molecular carcinogenesis,2007,46(2):144-154.
[23] KIM G Y,PARK H S,NAM B H,et al.Purification and characterization of acidic proteoheteroglycan from the fruiting body of Phellinus linteus (Berk.& M.A.Curtis) Teng[J].Bioresource technology,2003,89(1):81-87.
[24] KIM G Y,CHOI G S,LEE S H,et al.Acidic polysaccharide isolated from Phellinus linteus enhances through the upregulation of nitric oxide and tumor necrosis factorα from peritoneal macrophages[J].Journal of ethnopharmacology,2004,95(1):69-76.
[25] HAN S B,LEE C W,JEON Y J,et al.The inhibitory effect of polysaccharides isolated from Phellinus linteus on tumor growth and metastasis[J].Immunopharmacology,1999,41(2):157-164.
[26] SONG Y S,KIM S H,SA J H,et al.Antiangiogenic,antioxidant and xanthine oxidase inhibition activities of the mushroom Phellinus linteus[J].Journal of ethnopharmacology,2003,88(1):113-116.
[27] LEE Y S,KANG Y H,JUNG J Y,et al.Protein glycation inhibitors from the fruiting body of Phellinus linteus[J].Biological & pharmaceutical bulletin,2008,31(10):1968-1972.
[28] LUNG M Y,TSAI J C,HUANG P C.Antioxidant properties of edible basidiomycete Phellinus igniarius in submerged cultures[J].Journal of food science,2010,75(1):E18-E24.
[29] PARK I H,CHUNG S K,LEE K B,et al.An antioxidant hispidin from the mycelial cultures of Phellinus linteus[J].Archives of pharmacal research,2004,27(6):615-618.
[30] 張俊峰,张忠,汪雯翰,等.桑黄菌丝体和子实体中次级代谢产物及其活性的比较[J].菌物学报,2020,39(2):398-408.
[31] 张珈宁,瞿海燕,张金梦,等.桑黄多糖缓解日本血吸虫感染小鼠氧化应激及肝纤维化的实验研究[J].中国血吸虫病防治杂志,2019,2019,31(6):615-621.
[32] CHOI S B,PARK C H,CHOI M K,et al.Improvement of insulin resistance and insulin secretion by water extracts of Cordyceps militaris,Phellinus linteus, and Paecilomyces tenuipes in 90% pancreatectomized rats[J].Bioscience,biotechnology,and biochemistry,2004,68(11):2257-2264.
[33] KIM D H,YANG B K,JEONG S C,et al.Production of a hypoglycemic,extracellular polysaccharide from the submerged culture of the mushroom,Phellinus linteus[J].Biotechnology letters,2001,23(7):513-517.
[34] LIU Y Y,WANG C R,LI J S,et al.Hypoglycemic and hypolipidemic effects of Phellinus linteus mycelial extract from solidstate culture in A rat model of type 2 diabetes[J].Nutrients,2019,11(2):296-312.
[35] LEE D,KIM S C,KIM D,et al.Screening of Phellinus linteus, a medicinal mushroom,for antiviral activity[J].Journal of the Korean society for applied biological chemistry,2011,54(3):475-478.
[36] HAN J G,HYUN M W,KIM C S,et al.Species identity of Phellinus linteus (Sanghuang) extensively used as a medicinal mushroom in Korea[J].Journal of microbiology,2016,54(4):290-295.
[37] FU H Q,LIN X,FU H Y,et al.Effects of compound Phellinus igniarius (L.ex Fr.) Quel.Oral liquids polysaccharide on the immunologic function of mice[J].Agricultural science & technology,2015,16(6):1290-1294.
[38] KWON H K,PARK H J.Phellinus linteus grown on germinated brown rice inhibits IgEmediated allergic activity through the suppression of FcεRIdependent signaling pathway in vitro and in vivo[J].Evidencebased complementary and alternative medicine,2019,2019:1-15.
[39] CHEN C,LIU X,QI S S,et al.Hepatoprotective effect of Phellinus linteus mycelia polysaccharide (PLN1) against acetaminopheninduced liver injury in mouse[J].International journal of biological macromolecules,2020,154:1276-1284.
[40] 许彪,吴佳琳,孙婷婷,等.桑黄人工栽培研究[J].中国林副特产,2015(2):91-93.
[41] 祝子坪,李娜,曲文娟,等.桑黄菌原生质体诱变及发酵菌株选育[J].食品科学,2008,29(11):473-476.
[42] 全卫丰,汪洁,刘广建,等.N+ 离子束注入诱变选育桑黄菌株的研究[J].安徽农业科学,2013,41 (1):107-109.
[43] 许谦.药用真菌桑黄原生质体的制备和诱变[J].中国食用菌,2016,35(4):67-71,76.
[44] 张赫男,汪雯翰,曲德辉,等.利用常压室温等离子体诱变技术选育高产黄酮的桑黄菌株[J].食用菌学报,2018,25(2):49-55.
[45] 丁兴红,温成平,丁志山,等.低能离子射线诱变桑黄菌株 SH009 的初步研究[J].食用菌学报,2010,17(2):15-18.
[46] HWANG H J,KIM S W,CHOI J W,et al.Production and characterization of exopolysaccharides from submerged culture of Phellinus linteus KCTC 6190[J].Enzyme and microbial technology,2003,33(2/3):309-319.
[47] ZOU X,SUN M,GUO X.Quantitative response of cell growth and polysaccharide biosynthesis by the medicinal mushroom Phellinus linteus to NaCl in the medium[J].World journal of microbiology and biotechnology,2006,22(11):1129-1133.
[48] ZOU X,GUO X,SUN M.pH control strategy in a shaken minibioreactor for polysaccharide production by medicinal mushroom Phellinus linteus and its antihyperlipemia activity[J].Bioprocess and biosystems engineering,2008,32(2):277-281.
[49] 楊成凤,郑凌君,廖尊胜,等.桑黄液体发酵培养条件和多糖提取工艺的优化[J].中国调味品,2015,40(6):5-10.
[50] SONG C H,MOON H Y,RYU C H.Artificial cultivation of Phellinus linteus[J].The Korean journal of mycology,1997,25(2):130-132.
[51] HUR H.Cultural characteristics and logmediated cultivation of the medicinal mushroom,Phellinus linteus[J].Mycobiology,2008,36(2):81-87.
[52] 刘春辉,陈体强,林跃鑫.药用真菌桑黄的研究进展[J].菌物研究,2004,2(2):53-59.
[53] 陈艳秋,武红,傅伟杰,等.桑黄菌的人工驯化培养试验初报[J].食用菌,1997,19(1):17.
[54] 赵昊璐,赵春燕,任蜀豫,等.桑黄固体培养基选择及发菌条件探讨[J].中药材,2008,31(4):482-483.
[55] 吴亚召,吴未鸣,张文隽,等.秦巴山区野生桑黄人工栽培技术研究[J].中国食用菌,2014,33(3):20-22.
[56] 董宇,李洪玉,王娜妮,等.响应面法优化桑黄规模化人工栽培条件的研究[J].中药材,2015,38(12):2459-2463.
[57] 孙坚,傅锋,张世义,等.桑黄短段木栽培技术研究[J].现代园艺,2015(22):12.
[58] 王玉珍,马瑶,陈琦,等.单色光对桑黄生长及其抗氧化酶活性的影响[J].浙江大学学报(农业与生命科学版),2019,45(5):542-549.
