5水平冰冻混合人血清尿酸候选二级标准物质的研制
2021-02-05江雅平徐国兵
江雅平,徐国兵,刘 欧
(1.北京大学第一医院检验科,北京 100034;2.北京大学肿瘤医院检验科,北京 100142;3.清华大学第一医院检验科,北京 100016)
血清中尿酸(uric acid,UA)含量的测定可为痛风、肾脏疾病、心脑血管疾病[1]、糖尿病[2]、高血压[3]、代谢综合征[4]等多种疾病的诊断、治疗和预后评估提供重要依据。因此,UA检测结果的准确可靠对于临床极其重要。互通性好的标准物质是验证常规检测系统准确性的理想物质。UA标准物质有UA纯度标准物质SRM 913a、GBW 09202和血清基质标准物质SRM 909b、909c。纯度标准物质用于参考方法的定值,血清基质标准物质一般用于参考方法正确度的考察。SRM 913a、909b、909c和GBW 09202都为冻干粉末,这些物质在常规检测系统之间往往不具互通性,因此不能用于常规检测系统的准确性评定。目前,尚没有源于人体样本或无基质效应的UA标准物质,与待测人体样本具有相同基质的标准物质可用于UA常规检测系统精度及正确度的评价。另外,国际标准物质价格昂贵、购买和运输受限,给我国UA测定的量值溯源带来很大困难。本研究根据《标准物质/标准样品定值的一般原则和统计方法》[5](简称ISO Guide 35)的要求,采用公认无基质效应的新鲜冰冻人血清,研制了5个浓度的UA候选标准物质,并对其进行了定值、均匀性、稳定性、互通性考察,同时对定值结果进行了不确定度评价。
1 材料和方法
1.1 标准物质的制备
收集乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒为阴性,无肉眼可见脂血、溶血和黄疸的5个UA浓度混合健康人血清,分别命名为C1、C2、C3、C4、C5,确保所研制的标准物质的生物安全性符合要求。血清经离心、粗滤后,用0.22 μm的硝酸纤维素膜过滤,充分混匀后分装于1.8 mL冻存管中,0.5 mL/支,每个浓度1 000支,-70 ℃保存。混合分装全过程在无菌超净台进行。
1.2 主要仪器与试剂
硝酸纤维素膜(德国Sartorius公司)、带盖漏斗过滤器(美国Pall公司)、SHB-A型循环水式多用真空泵(郑州长城公司)、连续分配器(德国Brand公司)、冻存管(丹麦Nunc公司)。
1.3 方法
1.3.1 均匀性评价 按ISO Guide 35[5]要求,随机抽取-70 ℃保存的C1~C5各10支(分别标号为1、2、3、4、5、6、7、8、9、10),每支重复测定3次,采用DXC 800全自动生化分析仪(美国Beckman-Coulter公司)由同一操作者在尽可能短的时间内完成测量。测量顺序:第1次,1-3-5-7-9-2-4-6-8-10;第2次,10-9-8-7-6-5-4-3-2-1;第3次,2-4-6-8-10-1-3-5-7-9。对检测结果进行单因素方差分析,若P>0.05,说明样本间是均匀的。计算瓶间变异,瓶间均匀性的标准不确定度(ubb)计算公式为:
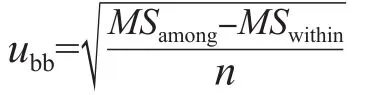
式中MSamong为组间均方,MSwithin为组内均方,n为测定次数。样品测定前,对DXC 800全自动生化分析仪进行校准后测定质控品,质控结果合格后再进行样品测定。
1.3.2 稳定性评价 随机抽取一定量C1~C5,分别于室温、4 ℃和-20 ℃放置,采用DXC 800全自动生化分析仪检测,观察其稳定性。室温和4 ℃放置的标本,分别于第1、2、3、6、7、9、11、14和15天测量UA。-20 ℃放置的标本分别于第1、6、12、19、27、42、65、93和115天测量UA。-70 ℃放置的标本,每个浓度每月随机抽取1管测量UA。每管检测2次,取均值。参照ISO Guide 35[5]要求,求出各温度条件下各水平UA浓度与时间关系的直线回归方程,对方程进行线性回归方差分析以评估稳定性。若P>0.05,说明斜率的变化无统计学意义,UA结果不随时间产生趋势性变化,即所制备的冰冻血清物质在此段时间内是稳定的。稳定性对不确定度的评价包括长期不稳定性的不确定度(ults)和短期不稳定性的不确定度(usts)。usts主要考虑样本通过运输到达使用者处过程中带来的不稳定性,若用干冰运输,并在短时间内到达,此时usts可以忽略,即usts=0。
1.3.3 定值 3家UA候选参考实验室参与C1~C5的赋值,其中2家[北京大学第一医院检验科和中生北控科技股份有限公司(简称中生北控)]用1993年日本临床化学会推荐的以高氯酸去蛋白的反相高效液相色谱紫外检测法(reversed-phase high performance liquid chromatography with ultraviolet detection,RPHPLC-UV)[6]为C1~C5赋值;另外1家为通过中国合格评定国家认可委员会ISO 17025和ISO 15195实验室认可的实验室[国家卫生健康委临床检验中心(简称临检中心)],采用同位素稀释液相色谱串联质谱法(isotope dilution liquid chromatography tandem mass spectrometry,ID-LC/MS/MS)为C1~C5赋值。北京大学第一医院检验科与中生北控都通过测量国际有证参考物质SRM 909b和2008年的国际参考实验室室间比对计划(Ring Trials for Reference Laboratories,RELA)比对样本,验证了参考方法的准确性,且通过与临检中心建立的ID-LC/MS/MS进行比对[7],以及参加2010年由国际临床化学和检验医学联合会委托德国临床化学协会组织的参考实验室间UA RELA比对,进一步验证了准确性。每个实验室对C1~C5每天测量2次(分别在上午、下午进行),连续测量5 d,剔除离群值后,取全部结果的平均值为靶值。定值结果用“靶值±总不确定度(uCRM)”表示。每次定值测量中均测定有证标准物质,保证测定结果的有效性。参照ISO Guide 35[5],标准物质的总不确定度(uCRM)是通过合成定值测量、均匀性和稳定性对特征值不确定度的贡献来评估的,计算公式为:
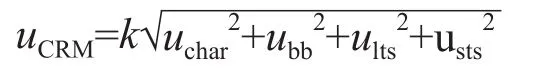
定值测量不确定度(uchar)主要为定值测定变异(s),取扩展因子k=2,计算公式为:
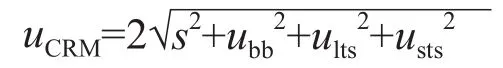
1.3.4 反复冻融 将C1~C5各取5份,-20 ℃保存,取出后室温条件下解冻2 h,再放回-20 ℃保存2 h;再取C1~C5各4份,室温解冻2 h,如此反复,使C1~C5均有反复冻融1~5次的标本。采用DXC 800全自动生化分析仪同时检测上述标本UA。采用线性回归分析C1~C5反复冻融1~5次对UA浓度的影响。
1.3.5 互通性 参照美国国家临床实验室标准委员会EP14-A2文件[8],收集39份不同浓度的UA新鲜患者血清(100~856 μmol/L)。每份血清仅由3~5份患者的标本混合获得,0.25 mL/支分装于20支冻存管。将39份新鲜血清样本和C1~C5于本实验室建立的RP-HPLC-UV和15套生化检测系统(表1)上测定2次UA,取均值,以RP-HPLC-UV法测量值为横坐标,常规方法测量值为纵坐标,采用SPSS 22.0软件计算15套生化检测系统(常规方法)与RP-HPLC-UV方法的相关方程式、相关系数、斜率的95%可信区间;绘制新鲜患者血清在RP-HPLC-UV和几种常规方法间的回归直线及95%可信区间,观察C1~C5的坐标点是否位于95%可信区间内。如在,则表明C1~C5在该检测系统的反应性与收集的新鲜患者血清相似,具有互通性。
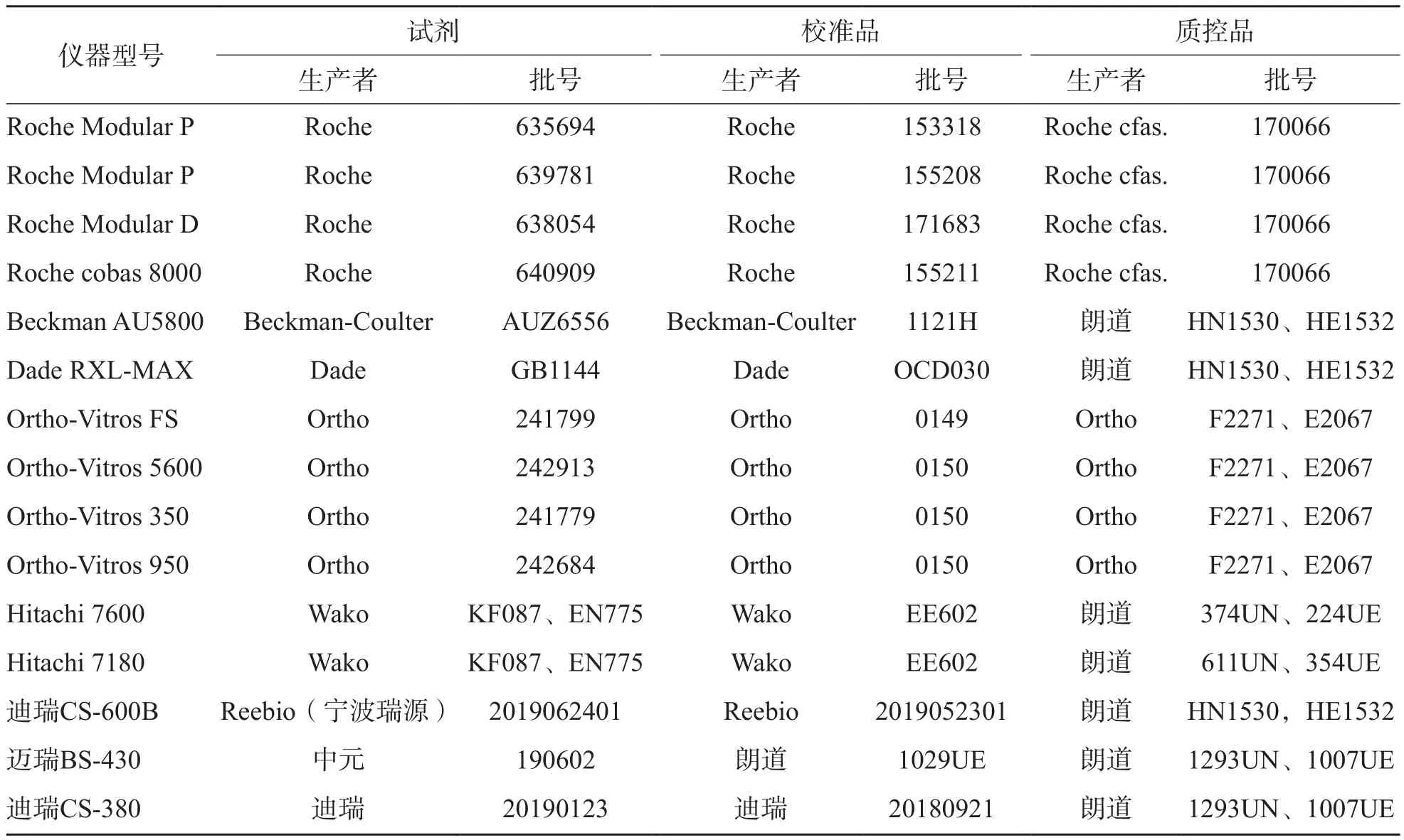
表1 15套检测系统的构成
2 结果
2.1 均匀性
C1~C5均匀性检验的原始数据均符合正态分布,单因素方差分析均显示P>0.05,说明C1~C5分装后是均匀的。瓶间变异均<1%。见表2。
2.2 稳定性
线性回归分析结果显示,C1~C5室温放置7 d和4 ℃放置9 d,UA浓度是稳定的(P>0.05),-20 ℃ UA浓度至少可稳定115 d(P>0.05)。C1~C5于-70 ℃可保存15个月,时间与浓度的直线回归方程的斜率与0无差异(P>0.05),表明浓度稳定。见表3。

表2 C1~C5均匀性调查结果
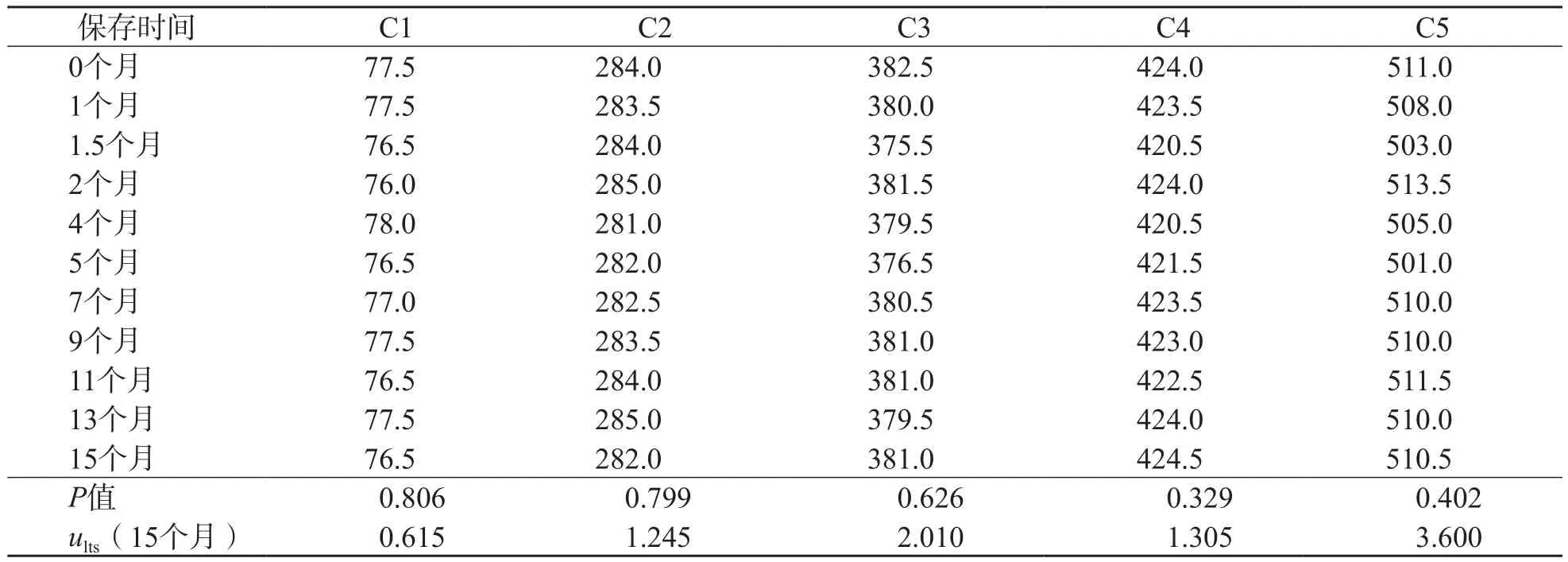
表3 C1~C5 -70℃ UA浓度稳定性调查结果 μmol/L
2.3 定值
C1~C5的靶值±uCRM分别为(70.00±3.12)、(281.67±4.69)、(383.00±6.46)、(431.00±9.95)和(520.00±12.10)μmol/L。见表4。
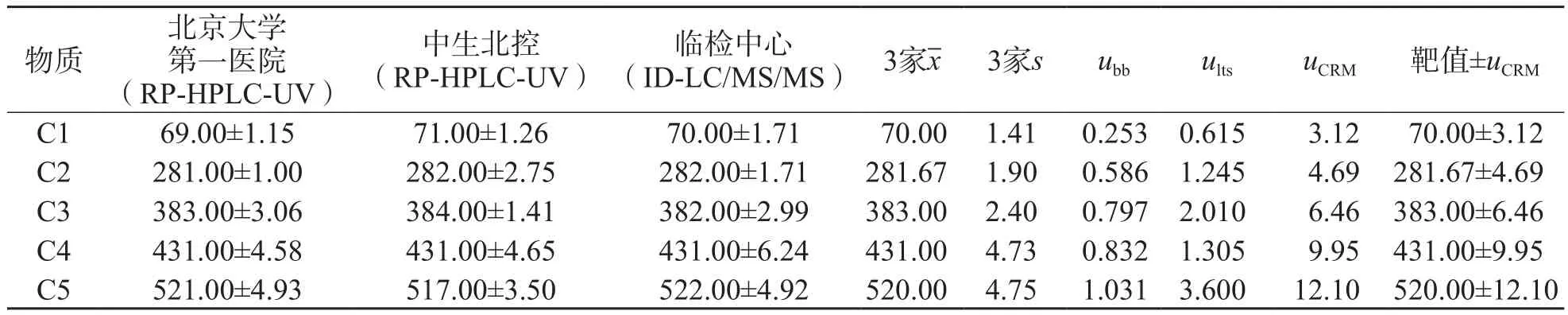
表4 C1~C5定值结果 μmol/L
2.4 反复冻融
线性回归分析结果显示,-20 ℃保存的C1~C5反复冻融1~5次,对UA浓度均无影响(P>0.05)。见图1。
2.5 互通性
39份人血清在15套生化检测系统与HPLCUV方法间UA测定结果的相关性良好,相关系数均≥0.999,见表5。C1~C5 UA测定结果坐标点均在回归直线95%可信区间内,说明制备的C1~C5同人新鲜血清样本基质相似,在这些常规检测系统上表现出良好的互通性。以Hitachi 7600系统为例,见图2。
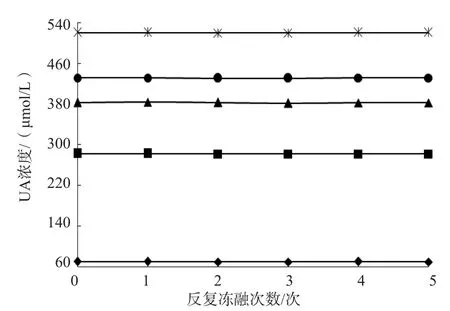
图1 -20℃保存的C1~C5反复冻融1~5次UA浓度变化
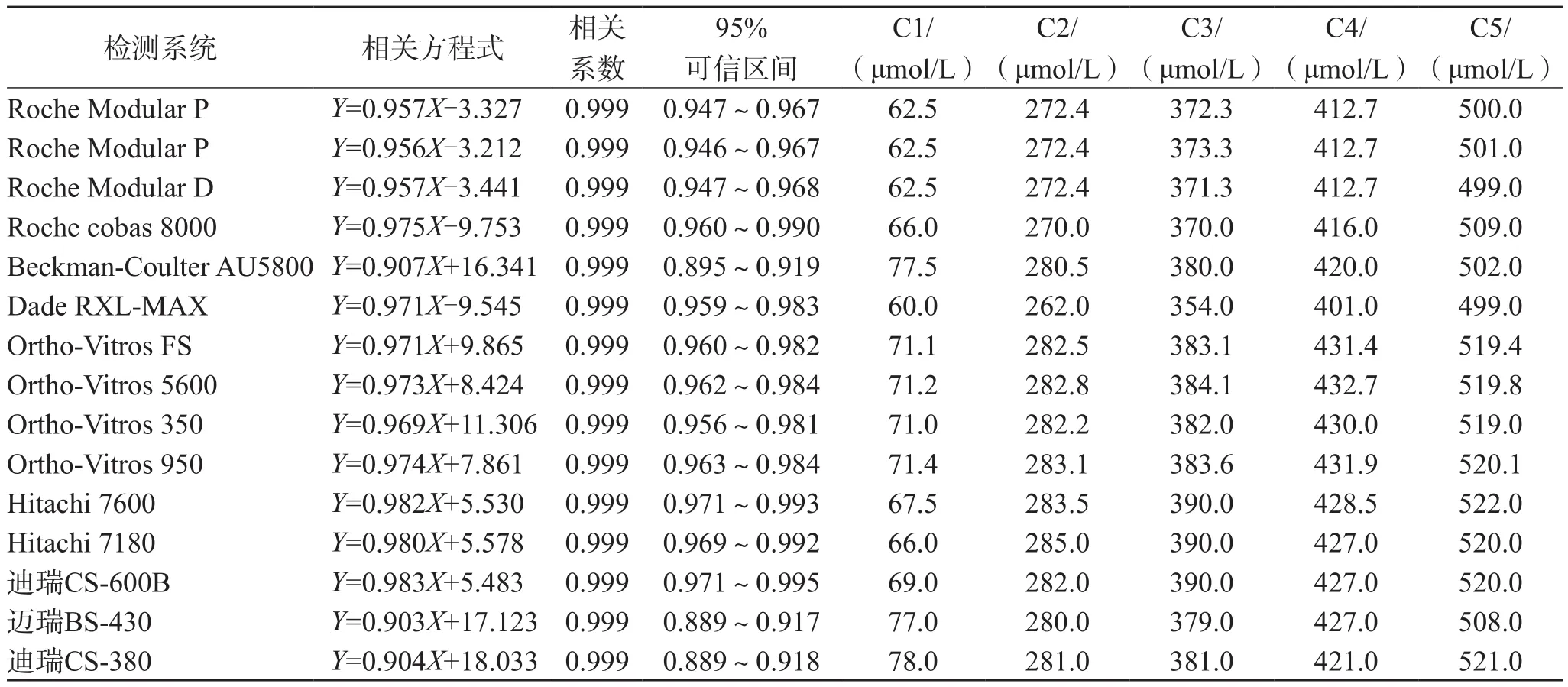
表5 15套生化检测系统与HPLC-UV方法的相关性和各方法C1~C5的检测值
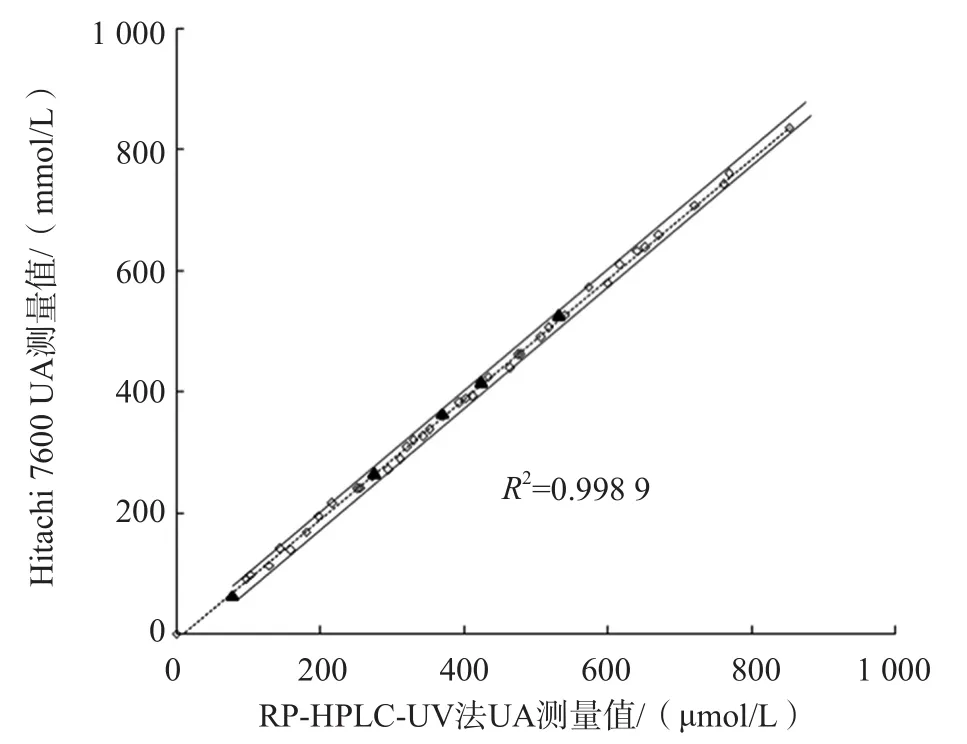
图2 C1~C5在Hitachi 7600上与血清的反应性
3 讨论
参考系统是医学检验标准化的基础,构成参考系统最重要的2个要素是参考方法和参考物质。与参考方法相比,参考物质的使用更为简单、快捷,在量值溯源和传递过程中起着非常关键的作用。互通性是指参考物质在不同分析方法间具有与人体样本相同的反应特性。具有互通性的参考物质可以用于常规方法的校准。由于基质效应,纯度标准物质在常规系统上往往不具有互通性。目前普遍使用的UA参考物质为冻干品,冻干品在制备和使用过程中,分装、冻干及复溶等会使整个溯源过程产生偏差。本研究制备的5水平UA冰冻混合人血清未使用处理过的材料或0.9%氯化钠溶液进行稀释,保证了在标准化过程中所有参考物质与天然患者血清无差异,具有相同的基质。通过15个月的观察,UA -70 ℃保存具有良好的稳定性,液体血清由于避免了因冻干、复溶等导致的误差,因此瓶间变异小,精密度较高,且使用方便。
本研究调查C1~C5互通性的同时,还调查了11份商品化的校准液和质控品在常规系统中的互通性,包括Dade校准液(3个水平)、Beckman-Coulter校准液、中生校准液、Roche cfas.校准液,朗道质控品(2个水平)和伯乐质控品(3个水平)。采用与调查C1~C5互通性相同的方法,绘制RP-HPLC-UV与常规检测系统测定39份人血清结果的回归直线图,观察11份校准液和质控品的坐标点是否在39份人血清回归直线的95%可信区间内。结果显示,高值Dade校准液在Beckman-Coulter、Ortho-Vitros、Dade、Roche和Hitachi常规检测系统中均不具互通性,Beckman-Coulter校准液在Beckman-Coulter、Ortho-Vitros、Dade、Roche和Hitachi常规检测系统中均不具互通性,中生北控和Roche cfas.校准液互通性最好,在所调查的常规检测系统中均具有互通性,高值朗道质控品在Dade、Roche和Hitachi常规检测系统中不具互通性,高值伯乐质控品在Dade、Roche和Hithachi常规检测系统中不具互通性,中值伯乐质控品在Dade和Roche常规检测系统中不具互通性。低值UA校准液或质控品较高值UA有更好的互通性。本研究制备的UA浓度为70~520 μmol/L的冰冻混合人血清物质在所纳入的15套生化检测系统中均有良好的互通性。
本研究应用制备的冰冻混合人血清评价了北京部分医院Roche、Beckman-Coulter、Ortho、Hitachi 4个品牌共20套检测系统(每个品牌5套检测系统)的分析性能,结果表明,4个品牌的UA常规检测系统的精密度、相对偏差以及总误差均符合生物学变异的适宜标准(变异系数<4.3%,偏移<4.8%,总误差<11.9%)[9],与MILLER等[10]的研究结果一致,提示UA常规检测系统具有良好的分析性能和一致性。
理想条件下,标准物质的均匀性和稳定性应采用参考方法进行评价,但参考方法运行困难,无法随时开展,故本研究选用精密度较好的Beckman-Coulter DXC 800全自动生化分析仪测量UA。综上,本研究成功制备了5个浓度的UA冰冻血清标准物质,其均匀性和稳定性良好,定值可靠,在常规检测系统上具有互通性,可作为UA候选二级标准物质用于UA常规检测系统精密度及正确度的评价,也可作为商品化校准物及质控物定值溯源的标准,进一步促进我国UA检验的标准化工作。
