IL-35和C3与脓毒症患者病情严重程度及预后的关系
2021-02-05胡森安艾红红叶雪莲成江燕
胡森安,艾红红,叶雪莲,成江燕
(广东医科大学附属高明医院检验科,广东 佛山 528500)
脓毒症属于由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)。脓毒症早期如果未得到及时、有效的控制,可进一步发展成严重脓毒症、脓毒症休克,甚至是多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。近年来,随着对脓毒症发病机制的深入了解,各种新药物、新方法不断应用于脓毒症的临床治疗中,但脓毒症的病死率依然居高不下。有研究结果显示,全球每天约有14 000例患者死于脓毒症及其并发症,脓毒症更是重症监护病房(intensive care unit,ICU)患者死亡的首要原因[1]。脓毒症的发生、发展是复杂的病理生理过程。有研究结果显示,脓毒症与感染、炎症、免疫和凝血系统功能改变等因素有关[2]。白细胞介素35(interleukin 35,IL-35)是白细胞家族新发现的成员,是重要的抗炎细胞因子,在机体免疫力调节中发挥重要的功能。有研究结果显示,感染性休克及脓毒症小鼠模型中IL-35表达升高[3]。目前关于IL-35在脓毒症患者中的变化及其与病情严重程度的关系研究较少。补体系统是患者对抗病原体感染的重要组成部分。但有研究结果显示,补体系统的过度活化会导致脓毒症病情恶化[4]。而补体系统与凝血纤溶系统存在复杂的交叉激活网络[5]。为此,本研究拟探讨脓毒症患者补体C3和IL-35变化与病情严重程度及预后的关系,以期为脓毒症的诊治提供参考。
1 材料和方法
1.1 研究对象
选取2014年1月—2018年12月广东医科大学附属高明医院ICU收治的脓毒症患者112例,去除原发性免疫缺陷病、自身免疫性疾病27例,未在ICU 24 h内采集血液样本的患者5例,最终纳入80例脓毒症患者,其中男43例、女37例,年龄48~72岁;脓毒症45例(脓毒症组),原发疾病包括脓毒症伴肺炎、严重皮肤软组织感染、急性腹泻、心肺复苏术后等;严重脓毒症患者35例(严重脓毒症组),包括脓毒症伴有急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、心血管功能障碍或多个其他器官功能障碍,其中单器官功能障碍12例(单器官功能障碍组)、MODS 16例(MODS组)、死亡(入ICU 28 d内死亡,包括抢救无效死亡、积极抢救无法恢复自主呼吸和心跳而放弃治疗的患者)7例(死亡组)。脓毒症、严重脓毒症诊断标准参照《中国严重脓毒症/脓毒性休克治疗指南(2014)》[6]。本研究经广东医科大学附属高明医院医学伦理道德委员会批准,均由研究对象本人或其家属签署知情同意书。
1.2 方法
根据患者住院期间的病史记载及辅助检查结果,记录患者年龄、性别、感染部位、基础疾病及转归等资料,辅助检查结果包括患者转入ICU后24 h内采集血标本检测血常规、体液免疫指标、凝血功能、肝功能、肾功能、心肌酶谱和IL-35的结果以及由24 h内检测值最差的临床指标计算出的急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ),记录患者病程中发生休克、MODS的情况。
1.3 检测指标
在入ICU 24 h内采集所有患者的静脉血2 mL。采用BNⅡ全自动特定蛋白分析仪(德国西门子公司)及配套试剂检测IgG、IgA、IgM、C3、C4。采用XN-1000全自动血液分析仪(日本Sysmex公司)及配套试剂检测血常规[白细胞(white blood cell,WBC)计数、血小板(platelet,PLT)计数]。丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TB)、肌酐(creatinine,Cr)、肌酸激酶MB同工酶(creatine kinase isoenzyme MB,CK-MB)试剂购自四川迈克生物科技有限公司,检测仪器为7600全自动生化分析仪(日本日立公司)。采用CA7000全自动凝血分析仪(日本Sysmex公司)及配套试剂检测凝血酶原时间(prothrombin time,PT)、国际标准化比值(international standardized ratio,INR)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,Fib)。采用酶联免疫吸附试验检测IL-35,试剂盒购自美国Biosamite公司,检测范围为18.5~4 000.0 pg/mL,最低检测限为8.6 pg/mL,标准曲线r≥0.995,批内变异系数(coefficient of variation,CV)<8%,批间CV<10%,严格按说明书进行操作。所有检测项目均采用高、低2水平质控品进行质量控制,确保检测结果准确。
1.4 统计学方法
采用SPSS 19.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用t检验。计数资料以率表示,组间比较采用χ2检验。采用Pearson相关分析和Spearman秩相关分析评估C3、IL-35与其他临床指标之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 脓毒症组和严重脓毒症组各项指标的比较
脓毒症组WBC计数及C3、C4、PLT计数、Fib水平均高于严重脓毒症组(P<0.05),PT、APTT、INR、ALT、TB、CK-MB、Cr、IL-35水平均低于严重脓毒症组(P<0.05),而2个组之间年龄、性别及IgG、IgA、IgM水平差异均无统计学意义(P>0.05)。见表1。
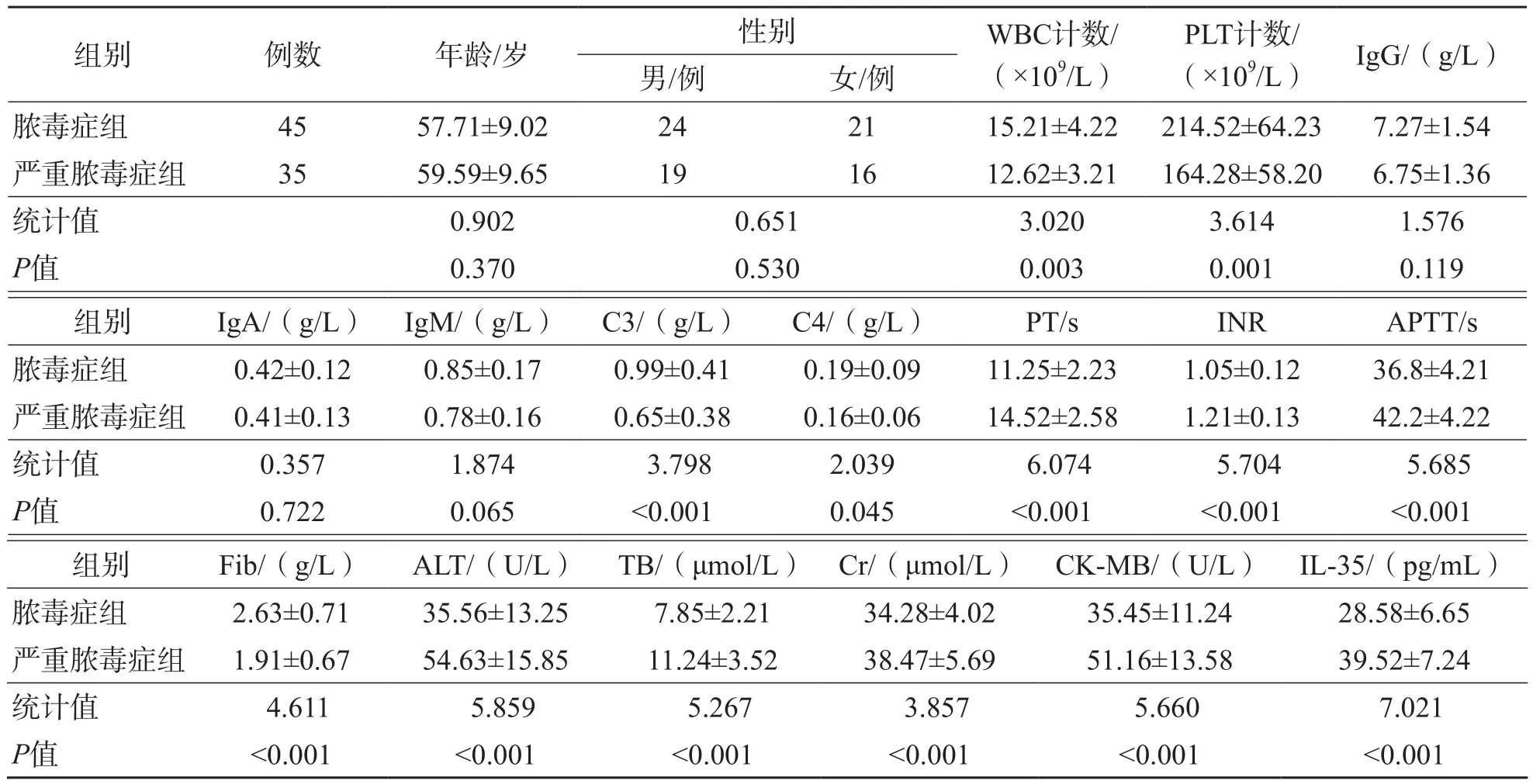
表1 脓毒症组和严重脓毒症组各项指标的比较
2.2 不同脓毒症病情患者C3和IL-35水平的比较
与脓毒症组比较,单器官功能障碍组、MODS组及死亡组C3水平均显著降低(P=0.001),且有随病情严重程度增加而降低的趋势;IL-35则显著升高(P<0.001),且有随病情严重程度增加而升高的趋势。见表2。
2.3 C3、IL-35与各项指标的相关性分析
C3与PLT计数、Fib呈正相关(r值分别为0.32、0.52,P<0.001),与PT、INR、APTT、ALT、TB、Cr、CK-MB均呈负相关(r值分别为-0.34、-0.38、-0.33、-0.31、-0.27、-0.25、-0.26,P<0.001)。IL-35与PLT计数、Fib呈负相关(r值分别为-0.33、-0.59,P<0.001),与PT、INR、APTT、ALT、TB、Cr、CK-MB均呈正相关(r值分别为0.41、0.32、0.25、0.42、0.34、0.29、0.26,P<0.001)。
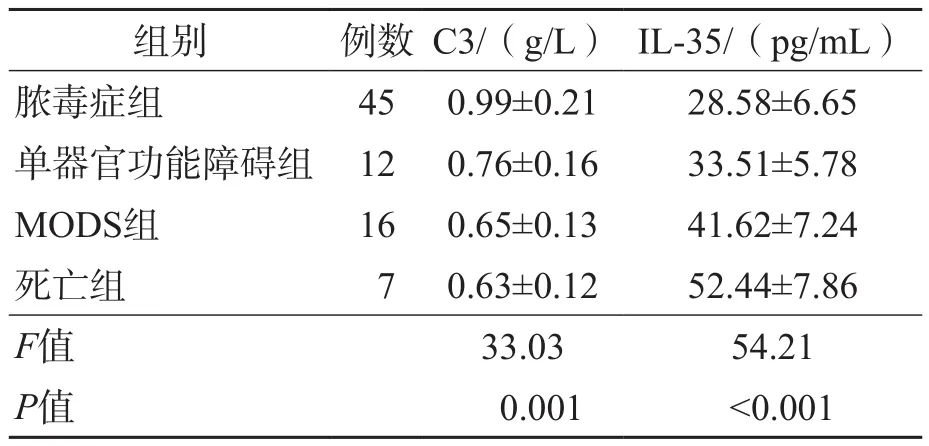
表2 不同脓毒症病情患者C3和IL-35水平的比较
2.4 C3、IL-35与脓毒症患者APACHEⅡ评分及预后(死亡)的相关性
根据APACHEⅡ评分将80例脓毒症患者分为>25分组(38例)和≤25分组(42例)。结果显示,APACHEⅡ评分≤25分组C3水平显著高于APACHEⅡ评分>25分组(P<0.05),IL-35显著低于APACHEⅡ评分>25分组(P<0.001)。见表3。
APACHEⅡ评分≤25分组C3水平与预后(死亡)呈负相关(r=-0.63,P<0.05),IL-35水平与预后(死亡)呈正相关(r=0.54,P<0.001)。
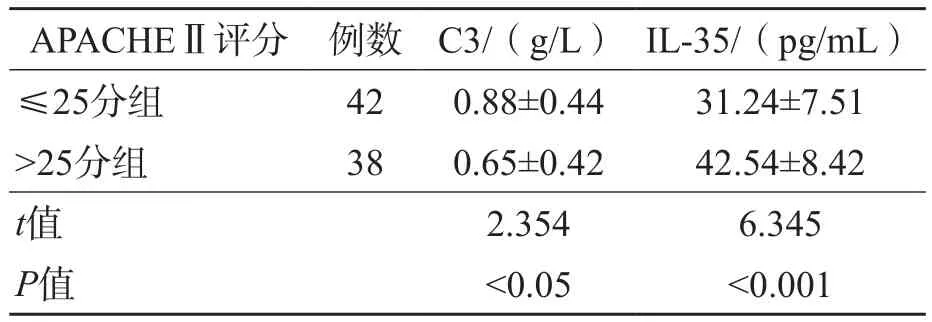
表3 不同APACHEⅡ评分脓毒症患者C3、IL-35水平的比较
3 讨论
脓毒症是由适应性免疫和固有免疫共同组成的复杂炎症反应,血管内皮系统、补体系统和凝血系统等参与了整个反应过程。另外,患者的基础疾病、年龄、基因变异、致病微生物及营养状态均影响着机体免疫反应的强弱。因此,单一控制某一方面的因素无法有效改善脓毒症患者的预后。脓毒症的早期识别及干预成为临床治疗的重要方向。
目前,新型抗炎细胞因子及共抑制分子逐渐成为临床免疫学研究中的重要方向之一,日益受到关注与重视[7]。IL-35是白细胞介素家族新发现的成员,主要由调节性T细胞产生,具有抑制效应T细胞增殖、辅助性T细胞17分化、白细胞介素47合成以及维持外周免疫耐受等重要作用。有研究结果显示,IL-35与多种疾病,如感染性疾病、脓毒症、自身免疫性疾病、炎症及肿瘤等密切相关,有望成为反映疾病病情进展和预后的新生物标志物或作为疾病治疗的新靶点[8]。有研究结果显示,脓毒症时产生IL-35的炎性细胞处于高度活化状态,导致IL-35水平升高[9]。本研究结果显示,发生随着脓毒症患者病情的加重,IL-35水平显著升高,与文献报道[10]一致,其原因可能为:在严重脓毒症以及多器官功能障碍时期,机体处于“免疫麻痹”状态,抗炎介质的表达占据优势,机体通过分泌IL-35发挥自我保护作用。本研究结果还显示,IL-35与PLT计数、Fib呈负相关(r值分别为-0.33、-0.59,P<0.001),与PT、INR、APTT、ALT、TB、Cr、CK-MB及预后(死亡)均呈正相关(r值分别为0.41、0.32、0.25、0.42、0.34、0.29、0.26,P<0.001)。在临床实际工作中,急诊脓毒症患者中有很大一部分会在72 h内快速进展为严重脓毒症,12 h内尽早使用抗菌药物有助于降低重度脓毒症患者的病死率。因此,采用APACHEⅡ评分早期判断脓毒症患者病情对患者预后评估有很大价值。本研究结果也显示,脓毒症患者的IL-35水平随APACHEⅡ评分的升高而升高,提示IL-35水平不仅可用于评估脓毒症患者病情的严重程度,或许还可作为预测脓毒症患者预后的指标。
补体系统一直被认为在脓毒症的发生、发展过程中起重要作用。但最近的研究结果显示,补体在脓毒症发展过程中起的作用具有两面性。补体的激活在机体处于脓毒症初始阶段时是免疫系统抵御病原体入侵的重要途径,低水平的C3可导致脓毒症小鼠的病死率明显升高[11]。另一方面,在严重脓毒症后期,C3转化酶抑制剂或补体活化物C5a抑制剂的使用均能提高脓毒症动物模型的生存率,表明补体系统的过度活化在脓毒症导致的器官损伤和凝血纤溶系统异常过程中起重要作用。本研究结果显示,严重脓毒症患者C3水平显著低于脓毒症患者(P<0.001),且随着病情的加重而逐渐降低。出现这种情况的主要原因可能是严重脓毒症患者补体系统被过度激活后C3被过多消耗,且随着病情的加重,作为补体生成主要场所的肝脏也受到损伤,从而导致补体生成减少。另外,本研究结果显示,C3与肝脏、肾脏、心脏等重要器官的损伤指标ALT、TB、Cr、CK-MB均呈负相关(r值分别为-0.31、-0.27、-0.25、-0.26,P<0.001)。这说明补体系统的过度活化可能参与了脓毒症患者的器官损伤,过度的免疫反应在严重脓毒症的发生、发展过程中起促进作用。目前,关于补体过度活化导致器官损伤的机制尚未被完全阐明,可能与补体系统过度激活导致炎性反应失控和组织损伤有关。补体活化物C5a能通过调节细胞因子的释放来促进粒细胞集落刺激因子产生,吸引中性粒细胞聚集,在吞噬病原体的过程中释放多种酶类物质引起组织器官损伤。补体系统与凝血及纤溶系统间存在复杂的交叉激活网络,凝血及纤溶系统可通过裂解C3、C1等激活补体系统,而补体活化物又可进一步激活凝血级联反应,二者相互激活、过度活化,最终导致病情恶化。本研究结果显示,C3与PT、INR、APTT呈负相关(r值分别为-0.34、-0.38、-0.33,P<0.001),与PLT计数、Fib呈正相关(r值分别为0.32、0.52,P<0.001),表明补体系统过度活化导致的补体消耗与凝血止血系统功能有关。因此,补体系统活化与脓毒症患者的器官损伤、凝血异常密切相关。C3水平降低与严重脓毒症患者预后(死亡)有关。
综上所述,C3和IL-35可能参与了脓毒症的发生、发展,与脓毒症患者的凝血功能障碍及器官损伤有关,或可用于脓毒症的病情判断及预后评估。但C3和IL-35在脓毒症进展中的具体作用机制还有待进一步研究。
