Sp1基因通过CD59调控T细胞急性淋巴细胞白血病细胞增殖和凋亡
2021-01-21高秋英荀利如侯丽敏
高秋英,荀利如,李 岚,侯丽敏,周 伟,王 晖*
(1陕西省人民医院血液科,西安 710068;2陕西省人民医院肾病血透中心;*通讯作者,E-mail:gqy2017@163.com)
T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)是一种血液恶性肿瘤,以骨髓和外周血中未成熟T细胞的积聚为特征,其临床表现可能包括淋巴结和其他器官的髓外白细胞增多、中枢神经系统浸润和胸腺纵隔肿块[1]。随着化放疗耐药性的出现,据统计,约15%的儿童和40%的成年患者出现复发[2]。目前,针对淋巴细胞表面抗原的单克隆抗体靶向治疗在白血病治疗中越来越受到重视[3]。
特异性蛋白1(specificity protein 1,Sp1)是序列特异性的DNA结合蛋白,Sp1对GC盒具有很强的亲和力,参与调控肿瘤细胞生长、凋亡、侵袭等多种过程[4]。有报道称,Sp1的表达水平与前列腺癌、肝癌、胃癌等癌症的恶性程度呈正相关[5]。Sp1在卵巢癌细胞中的高表达可促进卵巢癌的转移,导致预后不良,并且Sp1抑制剂和铂类药物的联合使用可延长肿瘤患者的生存时间[6]。
CD59是一种一个小分子量(18-20 kD)的膜性调节蛋白,其以糖基磷脂酰肌醇(glycosylphosphatidylinosi-tol,GPI)锚定于各种细胞膜表面,包括造血细胞、非造血细胞、组织细胞等[7]。CD59是一种补体调节蛋白,通过抑制细胞表面补体攻膜复合体(membrane attack complex,MAC)的形成保护宿主细胞免受补体的攻击[7]。有研究表明,癌症干细胞(cancer stem cells,CSC)中CD59的上调可以避免补体攻击,而CD59的沉默可以抑制体内CSC肿瘤移植小鼠的肿瘤生长[8]。在乳腺癌、非小细胞肺癌和结肠癌等癌症中,CD59的表达水平明显升高,并且与疾病分期和预后有关[9]。
目前尚不清楚Sp1及CD59在T-ALL中的表达模式,以及Sp1和CD59在T-ALL发生发展中的可能作用。因此,本研究检测了T-ALL患者骨髓标本中Sp1和CD59的表达模式,并研究了Sp1和CD59在体内和体外对细胞功能的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂 RPMI-1640培养基购自美国GIBCO公司;Lipofectamine 2000购自美国Invitrogen公司;EndoFectinTM MAX购自美国GeneCopoeia公司;细胞计数试剂盒8(CCK-8)购自广州市锐博生物科技有限公司;Transwell、Matrigel基质胶购自美国Corning公司;Dual-Luciferase Reporter Assay System购自美国Promega公司;Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自碧云天生物技术研究所;RIPA裂解液购自德国Roche公司;PVDF膜购自美国Millipore公司;ECL试剂购自南京诺唯赞生物科技有限公司;Sp1、Bcl-2、Bax、Caspase-3一级抗体购自英国Proteintech公司;β-actin、p-AKT和AKT一级抗体购自美国Affinity BioReagents公司;CD59、p-PI3K、PI3K、p-GSK3β和GSK3β一级抗体及相应的二抗购自美国Cell Signaling Technology公司;TRIzol试剂、One-Step SYBR Prime-Script RT-PCR试剂盒购自日本Takara公司。CD59的荧光素酶报告载体购自汉恒生物科技(上海)有限公司。
1.1.2 T-ALL患者骨髓标本的收集 2016年3月至2019年1月收集陕西省人民医院血液科20例T-ALL患者(T-ALL组)和20名健康受试者(健康组)的骨髓样本。参与者均未患有其他肿瘤或严重疾病。所有T-ALL患者均在本院进行临床诊断,并且在收集骨髓之前未接受任何化学疗法、放射疗法或其他治疗。收集患者的临床和病理信息(包括性别、年龄和疾病阶段等)。所有参与者均签署知情同意书。
1.2 方法
1.2.1 细胞培养 人正常外周血单个核细胞(peripheral blood mononuclear cell,PBMC)和T-ALL细胞系CCRF-CEM购自美国典型培养物保藏中心。将细胞在含有10% FBS的RPMI-1640培养基中于5% CO2和37 ℃的环境中培养。
1.2.2 细胞转染 将CCRF-CEM细胞以5×105细胞/孔的密度接种在6孔板中。参照试剂盒说明书步骤,使用Lipofectamine 2000将靶向Sp1的siRNA(si-Sp1组)或阴性对照siRNA(si-NC组)转染U251细胞。为了在CCRF-CEM细胞中过表达CD59,使用EndoFectinTM MAX将过表达CD59的pcDNA3.1质粒(pcDNA3.1-CD59组)或对照质粒(pcDNA3.1-NC组)转染到CCRF-CEM细胞中。此外,si-Sp1和pcDNA3.1-CD59共转染CCRF-CEM细胞(si-Sp1+pcDNA3.1-CD59组)。对照组细胞不做处理。将靶向Sp1的siRNA、过表达CD59的pcDNA3.1质粒及阴性对照均由上海吉玛制药技术有限公司合成。转染约48 h后,收集细胞用于后续实验。
1.2.3 qRT-PCR检测Sp1和CD59 mRNA表达水平 通过Trizol一步法提取骨髓标本或细胞的总RNA,并通过两步反转录合成为cDNA。使用合成的cDNA作为模板,通过One-Step SYBR Prime-Script RT-PCR试剂盒在ABI 7500 FAST荧光定量PCR仪上进行PCR反应。反应条件为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火30 s,70 ℃延伸30 s,最终在70 ℃延伸10 min。40个循环。引物序列见表1。β-actin作为内部对照基因,通过2-ΔΔCt方法确定基因相对表达量。

表1 引物序列
1.2.4 细胞计数试剂盒8(CCK-8)测定细胞活力 使用CCK-8评估细胞增殖。将对数生长期的细胞密度调整为5×104细胞/ml,并取100 μl细胞悬液加入96孔板中。在37 ℃、5%的CO2中孵育24,48,72 h。在24,48,72 h除去培养基,并向每个孔中加入100 μl含10 μl CCK-8溶液的新鲜培养基,然后在37 ℃下孵育2 h。用酶标仪测量每个孔在450 nm处的吸光度(OD值)。
1.2.5 流式细胞仪检测细胞凋亡 培养48 h后,收获细胞并用冷PBS洗涤两次。用1×结合缓冲液重悬细胞,并将细胞密度调整为106细胞/ml。将5 μl荧光标记的Annexin Ⅴ加入到100 μl的细胞悬液中,并在黑暗中于室温孵育10 min。然后加入5 μl PI和400 μl PBS,轻轻混合,然后立即流式细胞仪上机进行检测,检测结果表示为细胞凋亡率(%)。
1.2.6 伤口愈合实验测定细胞迁移 将细胞接种在6孔板上(1×105个细胞/孔),孵育12 h使细胞生长至80%融合。用200 μl移液枪头刮擦细胞表面,形成线性伤口,并使用显微镜拍照。将板在37 ℃、5%CO2条件下培养24 h,然后拍照。通过ImageJ测量伤口面积,通过以下公式计算伤口愈合率:伤口愈合率=[(0 h面积-24 h面积)/0 h面积]×100%。
1.2.7 Transwell侵袭实验测定细胞侵袭 将5×105个细胞悬浮在无血清培养基中,然后以2×104个细胞/孔接种到含有100 μl无血清培养基的Transwell上室中。上室预先用Matrigel基质胶涂覆。将含有10% FBS的培养基添加到下室。孵育24 h后,用棉签除去上室未侵袭的细胞,将细胞用4%多聚甲醛固定,并用结晶紫染色。在显微镜下(×200)对侵袭至下室的细胞进行拍照,使用Image-Pro Plus(IPP)图像分析软件计数侵袭细胞的数量。
1.2.8 双荧光素酶报告基因检测Sp1和CD59的靶向关系 CD59的荧光素酶报告载体包括野生型(pRL-TK-WT)和突变体(pRL-TK-Mut),并将其亚克隆到表达海肾荧光素酶的pRL-TK载体中。将细胞以1×104个/孔的密度接种到96孔板中培养24 h,然后使用Lipofectamine 2000将Sp1过表达质粒(pcDNA3.1-Sp1)和pRL-TK载体共转染细胞48 h。另外,使用Lipofectamine 2000将对照质粒(pcDNA3.1-NC)和pRL-TK载体共转染细胞48 h作为对照。48 h后收集细胞,根据制造商的方案,使用Dual-Luciferase Reporter Assay System试剂测量荧光素酶活性。相对荧光素酶活性被标准化为海肾荧光素酶活性。过表达Sp1的pcDNA3.1质粒及阴性对照由上海吉玛制药技术有限公司合成。
1.2.9 蛋白质印迹分析检测Sp1、CD59、Bcl-2、Bax、Caspase-3、p-PI3K、PI3K、p-AKT、AKT、p-GSK3β和GSK3β的蛋白表达水平 培养48 h后,收集细胞并通过RIPA裂解液在4 ℃下裂解20 min。将裂解液以12 000g离心10 min后,将上清液煮沸5 min,冰浴3 min,然后用12%SDS-PAGE凝胶分离并转移至PVDF膜上。室温下用5%脱脂奶封闭PVDF膜1 h,并在4 ℃下与一抗孵育过夜。本研究中使用的一抗及稀释浓度如下:Sp1(1 ∶1 000)、CD59(1 ∶1 000)、Bcl-2(1 ∶1 000)、Bax(1 ∶3 000)、Caspase-3(1 ∶500)、p-PI3K(1 ∶500)、PI3K(1 ∶500)、p-AKT(1 ∶1 000)、AKT(1 ∶1 000)、p-GSK3β(1 ∶500)、GSK3β(1 ∶500)和β-actin(1 ∶3 000)。然后在室温下与辣根过氧化物酶标记的小鼠抗兔IgG二抗(1 ∶500)孵育1 h。使用ECL试剂进行显影,目标蛋白标准化为β-actin。
1.3 统计学分析
使用SPSS 22.0软件对所有实验数据进行统计分析。数据表示为平均值±标准差。使用单因素方差分析及LSD检验进行多组间比较,而使用独立样本t检验进行两组间比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 Sp1和CD59在T-ALL患者骨髓及T-ALL细胞中高表达
结果显示,T-ALL患者骨髓中Sp1和CD59的mRNA表达水平均显著高于健康人(P<0.05,见图1)。CCRF-CEM细胞中的Sp1和CD59的mRNA表达水平显著高于PBMC(P<0.05,见图1)。

与健康者或PBMC相比,*P<0.05图1 Sp1和CD59在T-ALL患者骨髓及T-ALL细胞中的表达Figure 1 Sp1 and CD59 expression in bone marrow of T-ALL patients and T-ALL cells
2.2 T-ALL细胞中Sp1对CD59的调控作用
与对照组比较,si-Sp1组CCRF-CEM细胞中Sp1和CD59的mRNA和蛋白表达水平均降低(P<0.05);与对照组比较,pcDNA3.1-CD59组CCRF-CEM细胞中CD59 mRNA和蛋白表达水平升高(P<0.05),Sp1的mRNA和蛋白表达水平无显著差异(P>0.05,见图2)。
已知Sp1经典的结合位点为GGGCGG,本研究通过PROMO(http://alggen.lsi.upc.es/)网站预测了Sp1和CD59的结合位点,共有3个预测的结合位点,两个包含Sp1经典结合位点(见图3A)。本研究将该两个Sp1经典结合位点突变为AAAAAA,构建了突变型CD59报告基因载体。双荧光素酶报告基因检测结果显示,与pcDNA3.1-NC组相比,pcDNA3.1-Sp1组转染过表达Sp1的pcDNA3.1质粒中CD59的相对荧光酶活性显著升高(P<0.05,见图3B)。

与对照组相比,*P<0.05;与si-Sp1组相比,#P<0.05;与pcDNA3.1-CD59组相比,&P<0.05图2 转染靶向Sp1的siRNA和过表达CD59的pcDNA3.1质粒对CCRF-CEM细胞中Sp1和CD59表达的影响Figure 2 The effect of transfection of siRNA targeting Sp1 and pcDNA3.1 plasmid overexpressing CD59 on the expression of Sp1 and CD59 in CCRF-CEM cells
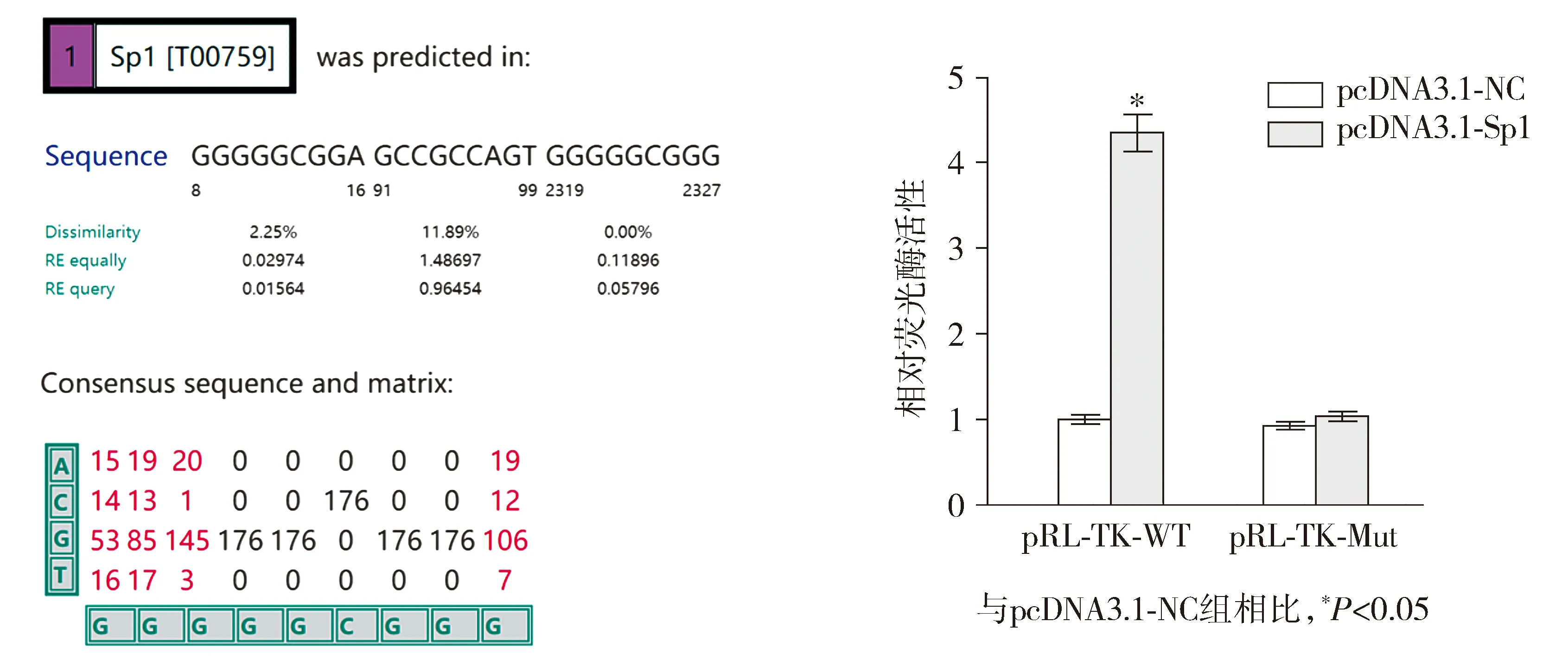
A.预测的Sp1与CD59的结合位点 B.相对荧光素酶活性图3 双荧光素酶报告基因检测过表达Sp1对CD59相对荧光酶活性的影响Figure 3 Effect of Sp1 overexpression on CD59 relative luciferase activity by dual luciferase reporter gene analysis
2.3 Sp1和CD59对T-ALL细胞增殖和凋亡的影响
CCRF-CEM细胞培养48 h和72 h时,与对照组相比,si-Sp1组细胞活力显著降低(P<0.05),而pcDNA3.1-CD59组的细胞活力显著升高(P<0.05);与pcDNA3.1-CD59组相比,si-Sp1+pcDNA3.1-CD59组CCRF-CEM细胞培养48 h和72 h时细胞活力显著降低(P<0.05,见图4)。

与对照组相比,*P<0.05;与si-Sp1组相比,#P<0.05;与pcDNA3.1-CD59组相比,&P<0.05图4 CCK-8检测Sp1和CD59对CCRF-CEM细胞增殖的影响Figure 4 Effects of Sp1 and CD59 on the proliferation of CCRF-CEM cells by CCK-8
与对照组相比,si-Sp1组的细胞凋亡率显著升高,Bcl-2蛋白表达水平显著降低,Bax和Caspase-3蛋白表达水平显著升高(P<0.05)。与对照组相比,pcDNA3.1-CD59组细胞凋亡率显著降低,Bcl-2蛋白表达水平显著升高,Bax和Caspase-3蛋白表达水平显著降低(P<0.05);与pcDNA3.1-CD59组相比,si-Sp1+pcDNA3.1-CD59组细胞凋亡率显著升高,Bcl-2蛋白表达水平显著降低,Bax和Caspase-3蛋白表达水平显著升高(P<0.05,见图5,6)。
2.4 Sp1和CD59对T-ALL细胞迁移和侵袭的影响
与对照组相比,si-Sp1组的侵袭细胞数显著降低,而pcDNA3.1-CD59组显著升高(P<0.05);与pcDNA3.1-CD59组相比,si-Sp1+pcDNA3.1-CD59组的侵袭细胞数显著降低(P<0.05)。伤口愈合测定结果显示,与对照组相比,si-Sp1组的伤口愈合率显著降低,而pcDNA3.1-CD59组显著升高(P<0.05);与pcDNA3.1-CD59组相比,si-Sp1+pcDNA3.1-CD59组的伤口愈合率显著降低(P<0.05,见图7)。
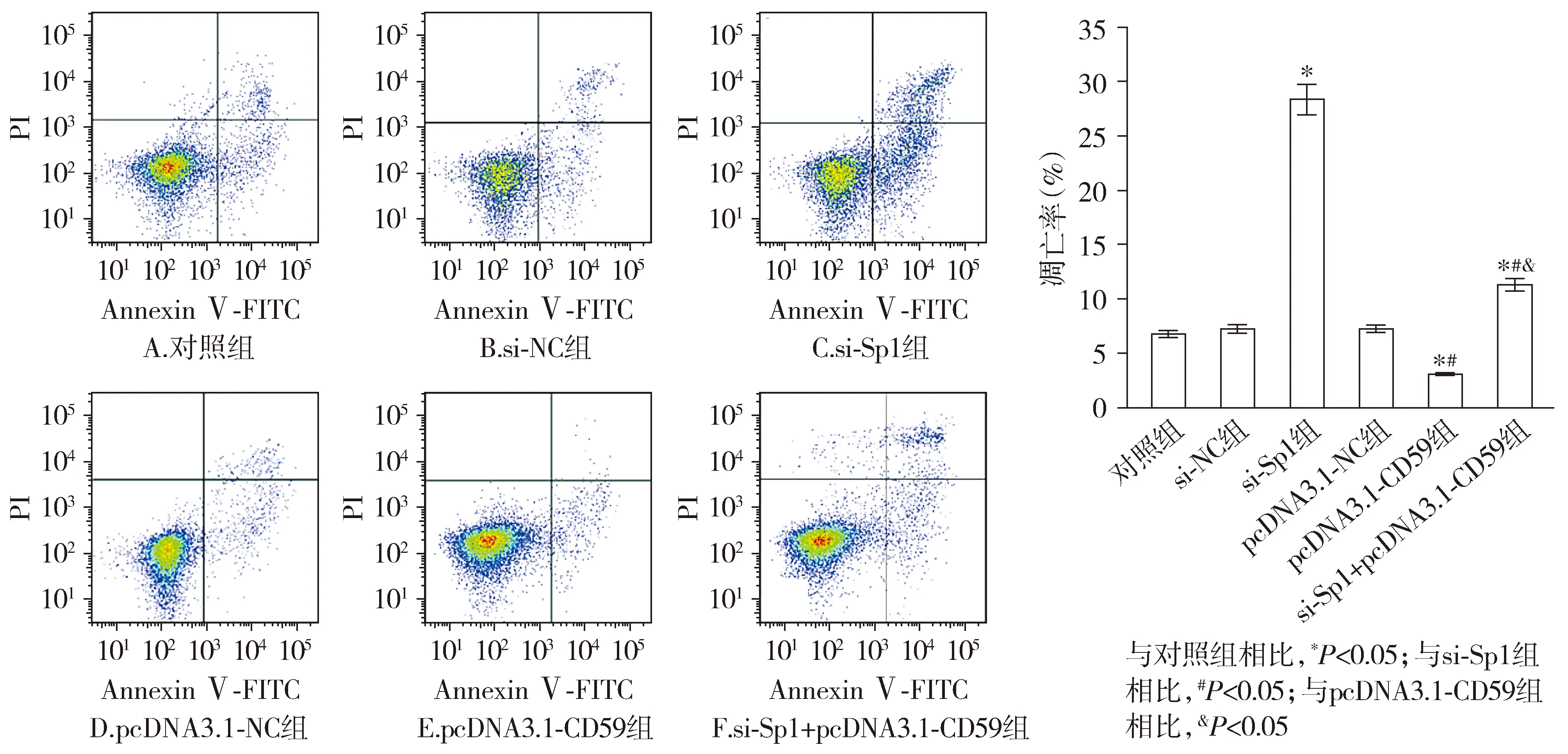
图5 Sp1和CD59对CCRF-CEM细胞凋亡的影响Figure 5 The effects of Sp1 and CD59 on the apoptosis of CCRF-CEM cells

与对照组相比,*P<0.05;与si-Sp1组相比,#P<0.05;与pcDNA3.1-CD59组相比,&P<0.05图6 Sp1和CD59对CCRF-CEM细胞中凋亡蛋白Bcl-2、Bax和Caspase-3表达的影响Figure 6 The effects of Sp1 and CD59 on the protein expression levels of Bcl-2, Bax and Caspase-3 in CCRF-CEM cells
2.5 Sp1和CD59对T-ALL细胞PI3K/AKT/GSK3β的影响
各组的PI3K、AKT和GSK3β蛋白表达水平无显著差异(P>0.05)。与对照组相比,si-Sp1组的p-PI3K、p-AKT和p-GSK3β蛋白表达水平显著降低,而pcDNA3.1-CD59组显著升高(P<0.05);与pcDNA3.1-CD59组相比,si-Sp1+pcDNA3.1-CD59组的p-PI3K、p-AKT和p-GSK3β蛋白表达水平显著降低(P<0.05,见图8)。

与对照组相比,*P<0.05;与si-Sp1组相比,#P<0.05;与pcDNA3.1-CD59组相比,&P<0.05图7 Sp1和CD59对CCRF-CEM细胞迁移和侵袭的影响Figure 7 The effect of Sp1 and CD59 on migration and invasion of CCRF-CEM cells
3 讨论
多项研究发现,Sp1参与调控肿瘤细胞生长、凋亡、侵袭等多种过程[4-6]。有报道称,Sp1的表达水平与前列腺癌、肝癌、胃癌等癌症的恶性程度、转移性和化疗耐药性有关[10]。本研究应用RT-PCR法分析了Sp1在健康人和T-ALL患者骨髓中的表达,发现Sp1在T-ALL患者中表达高于健康人。此外,本研究还发现Sp1在T-ALL细胞系CCRF-CEM中的表达水平明显高于PBMC。上述结果说明Sp1在T-ALL发生过程中异常高表达。
CD59是GPI锚定的糖蛋白,可抑制细胞表面补体攻膜复合体(membrane attack complex,MAC)的形成。同时,CD59充当第二种信号刺激剂来诱导T细胞活化,并参与免疫应答的调节[11]。Yin等[12]的研究表明,CD59在各种实体瘤和细胞中高度表达,作为补体调节蛋白,通过与C8或C9结合来阻止MAC形成,从而保护肿瘤细胞免于补体介导的细胞溶解和逃避免疫。目前,已经在HeLa、GLC-P、MCF-7和HT-29细胞中研究了CD59与肿瘤细胞凋亡之间的相关性,这些研究表明这些肿瘤细胞中CD59过表达[11-13]。本研究发现CD59在T-ALL患者骨髓中及T-ALL细胞系中的表达水平明显升高,说明CD59在T-ALL中也被异常激活。
Donev等[14]研究发现,CD59启动子区包含很多GC盒,是一种非常典型的TATA-Less启动子,CD59的转录起始点上游存在多个反式作用因子Sp1结合点。梁岩等[15]研究显示,沉默Sp1的表达有效地抑制了前列腺癌细胞PC-3中CD59的表达,说明Sp1是CD59表达调控中重要的转录因子。然而,目前尚不清楚在T-ALL中Sp1和CD59之间的相互作用。在本研究中,下调Sp1的表达后,CCRF-CEM细胞中CD59的mRNA和蛋白表达水平明显降低。然而,CD59的过表达未影响Sp1的表达。双荧光素酶报告基因检测结果也证实,Sp1可靶向调控CD59的表达。结直肠癌HT-29细胞中CD59的沉默通过促进细胞凋亡和阻断G0/G1期而提高了对化学治疗药物5-氟尿嘧啶的敏感性[12]。本研究中发现沉默Sp1可显著降低T-ALL细胞的增殖能力,并通过调控促凋亡蛋白Bax和Caspase-3和抗凋亡蛋白Bcl-2的表达来促进其凋亡。而沉默Sp1对细胞增殖和凋亡的调控作用可被CD59的过表达来逆转。说明Sp1在T-ALL细胞中的功能部分通过CD59来介导。
转移是影响癌症患者预后的最重要的因素之一,转移与癌症相关死亡的90%有关。从主要部位扩散癌细胞并在次要部位形成新的集落涉及多个过程。转录因子Sp1在黏附、迁移、侵袭、血管生成、上皮-间质转化(EMT)等转移的每个关键事件中都起着重要作用[16]。Sp1可靶向调控EMT相关蛋白(如ZEB1和Snail)以及血管生成调节剂EGFR和VEGFR3[17,18]。本研究发现,沉默Sp1可显著降低T-ALL细胞的迁移和侵袭能力,而上调CD59的表达可逆转Sp1对迁移和侵袭能力的影响。上述数据表明Sp1通过靶向调控CD59的表达来调节T-ALL细胞的转移性。
目前,包括Ras/Raf/MEK/ERK、PI3K/AKT、IL-7/JAK/STAT5和Notch1等多种信号通路调节T-ALL发生和发展过程。PI3K/AKT信号通路参与广泛的细胞内磷酸化,并发现PI3K/AKT信号通路在包括T-ALL在内的一系列白血病中均被广泛激活,从而导致了癌症的发生发展[19]。PI3K/AKT信号通路受肿瘤抑制基因PTEN的调控[20]。AKT激活后可磷酸化包括mTOR、Caspase-9和GSK3β在内的许多细胞蛋白,从而调控细胞增殖和凋亡。此外,PI3K/AKT信号通路的活化可促进癌细胞的侵袭、转移和耐药性[21]。GSK-3β是一种进化上保守的丝氨酸/苏氨酸激酶,可促进线粒体介导的内源性凋亡,GSK-3β也是PI3K/AKT信号通路的下游分子[22]。活化的AKT或ERK可引起GSK3β的Ser9磷酸化,最终导致GSK-3β失活。本研究发现,沉默Sp1可显著抑制PI3K/AKT/GSK3β信号通路,而上调CD59的表达可逆转Sp1对PI3K/AKT/GSK3β信号通路的调控作用。
综上所述,本研究表明Sp1和CD59在T-ALL中异常高表达。沉默Sp1通过靶向下调CD59的表达来抑制T-ALL细胞增殖、迁移和侵袭及PI3K/AKT/GSK3β信号通路活化,并促进细胞凋亡。Sp1和CD59有望成为T-ALL的早期诊断标志物以及可能的分子治疗靶点。
