S-033188的中间体的合成研究
2020-12-17王艳红李行舟于芳
王艳红 李行舟 于芳

摘 要:為了合成一种新型的帽状依赖性核酸内切酶抑制剂(S-033188)的重要中间体,以3,4-二氟苯甲酸和苯硫酚为合成原料,经过还原反应、开环反应、成环反应以及硫代反应,并对各种合成条件进行筛选,最终在硼氢化钠作为还原剂、2-丙醇和水作溶剂、40 ℃条件下,以较高的产率合成了S-033188的关键中间体,并通过核磁数据和高分辨质谱证明了这个化合物的正确性。该反应路线有利于大规模的工业化生产,为类似的抗流感病毒药物中醛类化合物的还原提供了重要的参考价值。
关 键 词:关键中间体;合成;流感病毒;内切酶抑制剂
中图分类号:R914.5 文献标识码: A 文章编号:1671-0460(2020)11-2452-05
Synthesis of Intermediates of S-033188
WANG Yan-hong1, LI Xing-zhou2, YU Fang1
(1. College of Chemistry, Chemical Engineering and Environmental Engineering, Liaoning Shihua University,
Fushun 113001, China;
2. Academy of Military Medical Sciences, Beijing 100850, China)
Abstract: An important intermediate of a novel cap-dependent endonuclease inhibitor (S-033188) was synthesized from 3,4-difluorobenzoic acid and thiophenol via reduction reaction, ring opening reaction, ring formation reaction and thio-reaction based on a reverse synthesis analysis method. The synthetic conditions were optimized as follows: using sodium borohydride as reducing agent, using 2-propanol and water as solvents, the reaction temperature 40 °C. Under above conditions, high yield was obtained. The correctness of this compound was proved by nuclear magnetic data and high resolution mass spectrometry.The process is beneficial to large-scale industrial production and provides important reference value for the reduction of aldehyde compounds in similar anti-influenza virus drugs.
Key words: Key intermediates; Synthesis; Influenza virus; Endonuclease inhibitor
流行性感冒病毒简称流感病毒,是引起人体上呼吸道感染的主要病原体[1-2]。流感病毒极易在人群中传播,具有极强的传染性、极快的传播速度,容易在高危人群中引起肺炎等一系列的并发疾病。虽然已有疫苗和抗病毒药物的治疗,但每年的流行性感冒还会造成约50万人死亡。在1918年 “西班牙流感”流行期间,8个月内死亡的人数达到2 000万~4 000万人[3]。另有1957年“亚洲流感”和1968年 “香港流感”,每次流感大约造成100万人死 亡[4-6]。
目前市场上大多数小分子抗流感病毒药物属于神经氨酸酶抑制剂(扎那米韦、奥司他韦、帕拉米韦)或靶向M2-离子通道抑制剂(金刚烷胺、金刚乙胺)。但这些药物,特别是靶向M2-离子通道抑制剂类的药物,易发生抗病毒耐药性的快速突变。世界卫生组织的全球流感计划报告中提到,大于 99%的季节性甲型流感病毒对金刚烷胺和金刚乙胺都有抗药性。因此,需要针对其他重要的病毒增殖过程寻找新的抗病毒化合物,流感病毒RNA依赖的RNA聚合酶(RdRp)就是一个有吸引力的药物靶点,因为它发展耐药性相对缓慢,在基因型中相对保守,对病毒的复制过程至关重要。流感病毒RdRp是一种异源三聚体,包括聚合酶催化亚基(PB1)、“帽结合”亚基(PB2)和核酸内切酶亚基(PA)。RdRp的核酸内切酶对宿主mRNA进行的“帽子抢夺”是为了产生用于病毒自身转录的引物[7-8]。流感病毒的增殖需要帽依赖性核酸内切酶(CEN)[9-11],因此CEN成为抗流感病毒药物的一个有吸引力的靶标。能够抑制CEN的物质就可以通过抑制病毒mRNA的合成来抑制病毒蛋白质的合成。抑制CEN的物质包括对位取代的2,4-二氧代丁酸[12-13]、绿茶儿茶 素[14]、苯乙基苯基邻苯二甲酰亚胺类似物[15]、C60富勒烯衍生物、3-羟基吡啶-2(1H)-酮衍生物[16]和儿茶酚[17],但这些药物尚未开发用于临床作抗流感药物。
盐野义制药公司开发的S-033188(如图1)便是一种新型的帽状依赖性核酸内切酶抑制剂,是世界上第一种可抑制流感病毒增殖的在研临床新药。该药物的研制目标是流感患者只需要服用一次就可以在一天以内抑制流感症状。Shionogi公司首席医学官Tsutae Den Nagata博士指出,与常规药物相比,单次口服S-033188可以迅速降低病毒载量和病毒释放的持续时间。
通过分析研究S-033188的结构及性质,我们设计了S-033188的关键中间体(如图1)的逆向合成路线(如图2)。
根据逆向合成路线我们最终可以合成出S-033188的关键中间体6,在合成关键中间体的过程中,化合物5和化合物6的合成至关重要,我们通过分析反应的机理、筛选多种反应条件,最终以较高收率得到目标化合物,为合成S-033188的关键中间体及合成S-033188奠定了坚实的基础,也为其他类似结构的抗流感病毒抑制剂的合成提供了非常重要的参考价值。
1 实验部分
1.1 实验试剂与设备
实验过程中,所用化学试剂均从各试剂公司购得(如表1)。
无水反应所用的试剂均为实验室重蒸收集得到。所有无氧反应均在氮气或者氩气氛下进行,低温反应均在低温反应釜中进行。我们使用的薄层层析硅胶板为烟台德行生物科技有限公司生产的GF-254硅胶板和安徽良臣硅源材料有限公司生产的GF-254硅胶板,使用的柱层层析硅胶为青岛海洋化工有限公司生产的柱层层析硅胶(200~300目)。实验所用设备有旋转蒸发仪、水泵、油泵、油浴反应锅、金属浴反应设备、低温反应装置、中压柱。
实验监测的主要手段为TLC。TLC所用的薄层层析硅胶板为铝硅胶板和玻璃硅胶板,显色途径主要为紫外灯照射,再以碘熏作为辅助显色,必要时会用高锰酸钾(加热)和磷钼酸(加热)显色。过柱纯化和重结晶为实验分离和纯化的主要手段。柱层析硅胶一般为200~300目(0.048~0.075 mm),通常使用中压柱进行分离,少数情况需用减压柱、硅胶板及液相分离。
实验化合物的正确性通过氢谱、质谱以及碳谱等验证。核磁谱图都是由Bruker AV400 和Bruker AV800测试得到。核磁一般采用氘代氯仿和氘代DMSO作为溶剂(氢谱氘代氯仿的化学位移为7.26,氢谱氘代DMSO的化学位移为2.50)。核磁氢谱峰用以下简写:单峰(s)、双重峰(d)、三重峰(t)、四重峰(q)、宽峰(b)、双二重峰(dd)、双三重峰(dt)、多重峰(m)。
1.2 实验步骤
化合物2的合成步骤(如图3):在氮气保护和-40℃的条件下,向5.00 g 3,4-二氟苯甲酸的25 mL THF溶液中缓慢滴加23 mL的2 mol/L的LDA-THF溶液。在-40 ℃中先搅拌1 h,然后再次缓慢添加5.74 g N,N-二甲基甲酰胺。添加完毕后再搅拌1 h,最后加入6 mol·L-1盐酸水溶34.25 mL到反应溶液中,温度升高到25 ℃。有机层和水层分离。用乙酸乙酯15 mL萃取水层,饱和食盐水洗涤,无水硫酸钠干燥。有机层用水清洗。减压蒸馏后,添加甲苯到殘留物中,浓缩,以获得化合物2的甲苯溶液。
化合物3的合成步骤(如图4):搅拌化合物2的甲苯溶液,边搅拌边加入17.8 mL甲苯、3.90 g苯硫酚和1.16 g樟脑磺酸,将温度升高至60 ℃。反应溶液在60 ℃条件下搅拌4 h后冷却到5 ℃。把提前配好的2 mol·L-1氢氧化钠水溶液10 mL添加到反应溶液中,再次把温度升高到25 ℃。反应溶液用甲苯萃取3次,得到的有机层再用2 mol·L-1氢氧化钠水溶液(5 mL)和水(10 mL)洗涤。将有机相浓缩后加入甲苯,直接得到化合物3的甲苯溶液。
化合物4的合成步骤(如图5):先将5.52 g氯化铝加入到25 mL甲苯中,搅拌混合物溶液并冷却至0 ℃,再向反应溶液中加入5.56 g 1,1,3,3-四甲基二硅氧烷的甲苯溶液,加料完毕后,缓慢将温度升高到25 ℃。然后将上述化合物3的甲苯溶液缓慢地滴加到反应溶液中,混合物在25 ℃搅拌2.5 h。TLC监测反应完全后,将15%的硫酸水溶液35 mL添加到反应溶液中搅拌,将其分离成有机层和水。将40 mL庚烷慢慢地加入到浓缩液中,再冷却至0 ℃。重结晶会析出白色固体,过滤重结晶产生的白色沉淀。得到的固体再用庚烷洗涤,最后得到的化合物4为白色固体。产率为66%。
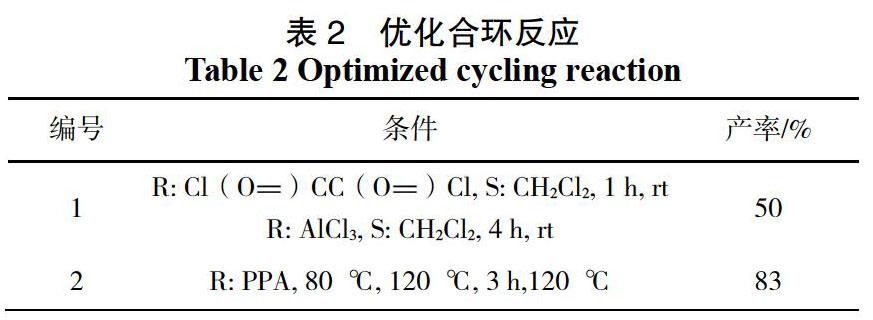
化合物5的合成步骤(如图6):向1.81 g化合物4中添加10.0 g多聚磷酸,搅拌均匀后,升温至120 ℃,然后在120 ℃下搅拌6 h。冷却至室温后,添加水,用乙酸乙酯萃取3遍,饱和食盐水洗涤有机层,用无水硫酸钠干燥有机层,过滤,得到乙酸乙酯有机相,然后将溶剂旋干,再向上述得到的化合物中加入石油醚,有白色固体缓慢析出,将析出的残渣过滤,再用石油醚洗涤3次。得到的化合物5为白色固体,产率为83%。
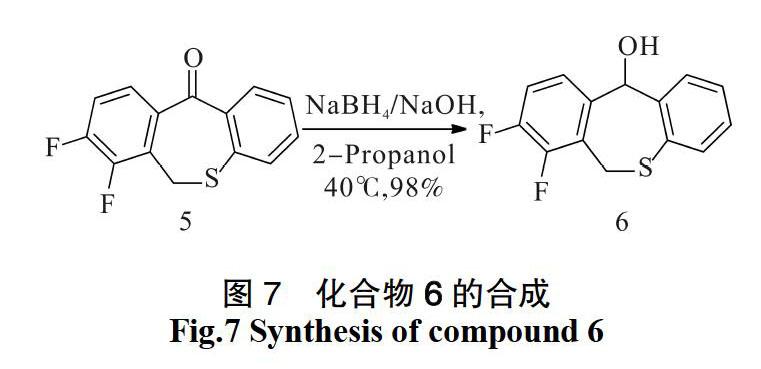
化合物6的合成步骤(如图7):将234.0 mg硼氢化钠悬浮在1.8 mL氢氧化钠水溶液中。再将4.5 g化合物5添加到20 mL 2-丙醇和2.25 mL水的混合物中,搅拌均匀,加热至40 ℃。然后将上述制备的硼氢化钠的氢氧化钠水溶液缓慢地添加到反应溶液中。将反应溶液在40 ℃条件下继续搅拌1.5 h,然后冷却到25 ℃。再向反应溶液中加入水,并进一步加入水和62%的硫酸水溶液。加完后再将反应溶液冷却到5 ℃。然后通过过滤收集产生的棕色沉淀。最后将得到的固体用水洗涤,用真空干燥箱干燥后,得到棕色固体化合物6,产率为98%。
2 结果与讨论
2.1 实验条件的优化
实验条件的改变会对反应的收率有极大的影响,所以在实验操作过程中,条件能否合理控制是需要解决的主要问题。为找到合适的条件,反应中所用到的碱、无水反应试剂、无水反应溶剂、还原剂以及反应温度等条件均需进行反复的优化。以下是一些化合物合成时的条件优化。
1)合成化合物2的条件优化:化合物2在合成初期没有控制好无水条件,导致产率过低。后经查阅文献,了解到二异丙基氨基锂(LDA)对无水操作的要求较高,为了避免空气中的水分,反应改在氮气保护下进行,且在该步反应过程中不便监测。选用溶剂时,要控制N,N-二甲基甲酰胺或四氢呋喃严格无水,这样LDA才能更好地发挥作用,因为LDA溶于非极性有机溶剂,且LDA属于非亲核性强碱,与水会发生反应。
2)合成化合物5的条件优化:起初使用的实验试剂是草酰氯和氯化铝,TLC监测反应时发现原料不能完全反应,并且体系较杂,产率仅有50%。后经查阅文献,可用多聚磷酸(PPA)反应,因为PPA作为催化剂可以催化羧酸、酯、酮、醛、醇等类型化合物的分子内环化反应。加热3 h,TLC监测,原料完全消耗,产率高达83%(如表2)。条件2相较于条件1不仅降低了反应的成本,也降低了反应后处理的难度,使合成化合物5的前4步总收率提高到55%。
3)合成化合物6的条件优化:在进行最后一步还原反应时,试过不同的還原剂和溶剂,结果发现使用硼氢化钠的氢氧化钠溶液以及异丙醇时产率最高(如表3)。这是由于LiAlH4反应性更强,能还原一些更加稳定的物质,但LiAlH4不稳定,容易水解。NaBH4却没有这样的缺陷,所以使用NaBH4产率更高。并且异丙醇相较于甲醇而言极性小、毒性轻微,因此异丙醇更加合适。
2.2 化合物的结构表征
实验得到的化合物6是棕色固体化合物,其 400 MHz核磁氢谱特征峰分析如下(图8):化学位移7.44~7.48为多重峰,积分值为1个氢;这组峰是羟基上1个氢的信号。化学位移值7.12~7.21处为多重峰,积分值为5个氢;化学位移值6.99~7.05处为双三重峰,积分值为1个氢;这二组峰是两个苯环上6个苯基氢的信号。化学位移值6.09处是单峰,积分值1个氢;这组峰是羟基所连碳原子上的1个氢的信号。化学位移值4.66~4.70处为双二重峰,积分值为1个氢;化学位移值4.18~4.22处为双二重峰,积分值为1个氢;这两组信号为与硫原子相邻的碳原子上2个氢的信号。HRMS (ESI):calcd. for C14H9F2OS-:263.2898, found 263.0336 [M-H+]-。通过上述数据显示成功的合成了S-033188的关键中间体化合物6。
3 结 论
本文以3,4-二氟苯甲酸和苯硫酚为合成原料,经过还原剂、碱、溶剂以及温度等一系列条件的筛选,获得较佳的反应条件为:硼氢化钠的氢氧化钠水溶液作还原剂、2-丙醇和水作溶剂、40 ℃的条件下反应1.5 h,最终以高达98%的产率合成了在研新药S-033188的关键中间体。这种方法不仅降低成本,便于操作,更有利于大规模的工业化生产。实验中使用相对稳定的硼氢化钠代替氢化铝锂作化合物的还原剂,硼氢化钠在碱性条件下稳定,能够更好地控制醛类化合物的还原,为此种醛类化合物的还原提供了重要的参考价值。
参考文献
[1]国家卫生和计划生育委员会,国家中医药管理局. 流行性感冒诊疗方案(2018年版)[J]. 中国感染控制杂志,2018,17(2):181-184.
[2]高海女,汤灵玲,李兰娟.流行性感冒:抗病毒治疗是关键[J].中华临床感染病杂志,2018,11(1):6-10.
[3]REID A H, TAUBENBERGER J K, FANNING T G. The 1918 Spanish influenza: integrating history and biology[J].Microbes & Infection,2001, 3(1): 81-87.
[4]VIBOUD C, SIMONSEN L, FUENTES R, et al. Global Mortality Impact of the 1957-1959 Influenza Pandemic[J]. Journal of Infectious Diseases, 2016, 213(5): 738-745.
[5]VIBOUD C, GRAIS R F, LAFONT B A P, et al. Multinational Impact of the 1968 Hong Kong Influenza Pandemic: Evidence for a Smoldering Pandemic[J]. Journal of Infectious Diseases, 2005, 192(2): 233-248.
[6]SOCIETY T R. Integrating historical, clinical and molecular genetic data in order to explain the origin and virulence of the 1918 Spanish influenza virus[J].Philosophical Transactions of the Royal Society of London, 2001, 356(1416): 1829-1839.
[7]PFLUG A, GUILLIGAY D, REICH S, et al. Structure of influenza A polymerase bound to the viral RNA promoter[J]. Nature, 2014, 516(7531): 355.
[8]JU H, ZHANG J, HUANG B. Inhibitors of Influenza Virus Polymerase Acidic(PA)Endonuclease: Contemporary Developments and Perspec- tives[J]. Journal of Medicinal Chemistry, 2017, 60(9): 3533-3551.
[9]PLOTCH S J, BOULOY M, ULMANEN I, et al. A unique cap(m7GpppXm)-dependent influenza virion endonuclease cleaves capped RNAs to generate the primers that initiate viral RNA transcription[J]. Cell, 1981, 23(3): 847-858.
[10]KUKKONEN S K, VAHERI A, PLYUSNIN A. L protein, the RNA-dependent RNA polymerase of hantaviruses[J]. Archives of Virology, 2005, 150(3): 533.
[11]NOAH D L, KRUG R M. Influenza virus virulence and its molecular determinants[J]. Advances in Virus Research, 2005, 65: 121.
[12]TOMASSINI J, SELNICK H, DAVIES M E, et al. Inhibition of cap (m7GpppXm)-dependent endonuclease of influenza virus by 4-substituted 2,4-dioxobutanoic acid compounds[J]. Antimicrob Agents Chemother, 1994, 38(12): 2827-2837.
[13]TOMASSINI J E, DAVIES M E, HASTINGS J C, et al. A novel antiviral agent which inhibits the endonuclease of influenza viruses[J]. Antimicrobial Agents & Chemotherapy, 1996, 40(5): 1189-1193.
[14]KUZUHARA T, IWAI Y, TAKAHASHI H, et al. Green tea catechins inhibit the endonuclease activity of influenza A virus RNA polymerase[J]. Plos Curr, 2009, 1(1): 1052.
[15]IWAI Y, TAKAHASHI H, HATAKEYAMA D, et al. Anti-influenza activity of phenethylphenylphthalimide analogs derived from thalidomide[J]. Bioorg Med Chem, 2010, 18(14): 5379-5390.
[16]SAGONG H Y, PARHI A, BAUMAN J, et al. 3-Hydroxyquinolin-2(1H)-onesAs Inhibitors of Influenza A Endonuclease[J]. Acs Medicinal Chemistry Letters, 2013, 4(6): 547-550.
[17]CHEN E, SWIFT R V, ALDERSON N, et al. Computation-guided discovery of influenza endonuclease inhibitors[J]. Acs Medicinal Chemistry Letters, 2014, 5(1): 61-64.
