低聚果糖辅助霉酚酸酯对db/db小鼠肾脏保护作用及其机制探讨
2020-12-04张沥文周芳芳刘韵子王伟铭
周 瑛 张沥文 周芳芳 刘韵子 刘 剑 王伟铭
糖尿病肾病(diabetic nephropathy,DN)是糖尿病相关的微血管并发症。据统计,2019年全球糖尿病患病率为9.3%(4.63亿人),预测到2045年将上升至10.9%(7亿人)[1],其中30%~40%将发展为DN[2]。既往研究[3-4]结果表明,虽然DN的病理生理学核心是代谢紊乱,但是慢性微炎症状态也是其疾病进展的重要机制。因此,抑制免疫介导的炎症反应在DN的治疗中至关重要。
霉酚酸酯(mycophenolate mofetil,MMF)是一种可以有效治疗CKD的免疫抑制剂。MMF常见的不良反应主要发生于胃肠道,临床症状包括腹泻、恶心、呕吐和腹痛等,常伴有胃、十二指肠的糜烂、溃疡和坏死,病理检测可见小肠绒毛萎缩与小肠结肠炎症反应[5]。低聚果糖(FOS)可以调节肠道菌群,减轻炎症反应[6]。本研究拟明确MMF在DN中的作用及其机制,并探讨FOS增强MMF肾脏保护作用的机制,以及其减轻MMF肠道不良反应的效果。
1 材料与方法
1.1 实验动物与分组 选择5周龄无特定病原体(SPF)级遗传背景为C57BL/KSJ的雄性db/db小鼠共30只,均由北京维通利华实验动物技术有限公司提供,并由上海交通大学医学院附属瑞金医院动物实验伦理委员会审核批准。实验动物分笼饲养于上海交通大学医学院附属瑞金医院动物房,每笼5只,环境温度为18~24℃。实验期间予自由进食、饮水,普通饲料喂养,不使用胰岛素和其他降糖药物。适应性喂养3周,在8周龄时随机分入DN组、MMF组、MMF+FOS组,每组10只。分别给予药物干预:均采用每天灌胃给药模式,DN组给予0.9%氯化钠溶液0.01 mL/(g·d),MMF组给予MMF 30 mg/(kg·d),MMF+FOS组给予MMF 30 mg/(kg·d)+FOS 100 mg/(kg·d),共16周。
1.2 主要实验仪器与药物、试剂 主要实验仪器为:小鼠代谢笼(北京佳源兴业科技有限公司)、罗氏血糖仪(美国罗氏公司)、电子天平(上海梅特勒-托利多仪器有限公司,PL-203)、全自动生物化学分析仪(深圳雷杜生命科技公司,Chemray 240)、涡旋混匀器(武汉赛维尔生物科技有限公司,MXF)、离心机(武汉赛维尔生物科技有限公司,D1008E)、石蜡切片机(德国徕卡公司)、普通光学显微镜(德国徕卡公司)。主要药物、试剂为:FOS(美国Sigma公司,F8052)、MMF(美国Sigma公司,Y0000489)、正常兔血清(武汉博士德生物工程有限公司,AR1010)、柠檬酸(p H 6.0)抗原修复液、兔抗CD8多克隆抗体、兔抗CD4多克隆抗体、兔抗IL-6多克隆抗体、辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白G(IgG,武汉赛维尔生物科技有限公司)。
1.3 标本采集 每周测定3组小鼠的体重,并经小鼠尾静脉取血测血糖。药物干预结束后,用代谢笼收集3组小鼠24 h尿液,用于测定24 h尿蛋白定量;使用1%戊巴比妥钠麻醉后行眼眶采血测血糖与血肌酐;0.9%氯化钠溶液灌注小鼠全身后,取双侧肾脏,分别称重,并截取回肠2 cm,以0.9%氯化钠溶液清洗去除粪便。
1.4 肾脏与肠道组织病理学检测 肾脏组织病理学检测:一侧肾脏2/3组织以中性甲醛溶液固定,石蜡包埋,切4μm薄片,过碘酸-希夫(PAS)染色,光学显微镜下400倍观察。回肠组织病理学检测:选取回肠上段1 cm组织,同样以中性甲醛溶液固定,石蜡包埋,切4μm薄片,H-E染色,光学显微镜下400倍观察。肾脏组织与回肠组织每张切片各选取10个视野计算平均每个视野下组织病理染色阳性面积占比。另外,选取回肠上段黏膜面组织1 mm×1 mm×1 mm泡入电子显微镜(简称电镜)液,经过1%四氧化锇固定、梯度乙醇溶液脱水、Epon812包埋,半薄切片用甲苯胺蓝染色,将组织块修成适合超薄切片的大小,厚度50 nm,载于200目铜网上,经醋酸铀和柠檬酸铅电子染色后,使用透射电镜(日本日立公司)观察、摄片。
1.5 免疫组织化学染色 将4μm肾组织切片脱蜡、水化,予柠檬酸抗原修复液行抗原修复15 min,3%牛血清白蛋白(BSA)室温封闭30 min,各自加入一抗(CD8,比例1∶1 000;CD4,比例1∶100;IL-6,比例1∶300),4℃孵育过夜,后滴加相应二抗,37℃孵育50 min,并用3,3’-二氨基联苯胺(DAB)显色。苏木精染细胞核为蓝色,DAB的阳性表达为棕黄色。光学显微镜下400倍或200倍观察,每张切片选取10个视野,计算平均每个视野下CD8+、CD4+T淋巴细胞浸润个数和IL-6阳性面积占比。
1.6 统计学处理 应用SPSS 22.0统计学软件。呈正态分布的计量资料以±s表示,多组间显著性检验采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 FOS增强MMF对db/db小鼠的肾脏保护作用 8周龄时,DN组、MMF组和MMF+FOS组小鼠的体重分别为(45.6±2.8)、(45.1±3.8)和(45.2±3.9)g;血糖分别为(26.7±5.7)、(25.0±3.4)和(23.5±4.7)mmol/L,组间差异均无统计学意义(P值均>0.05)。灌胃给药16周后,MMF组小鼠体重显著低于DN组;MMF+FOS组小鼠体重显著高于MMF组(P值均<0.05),而与DN组间差异无统计学意义(P>0.05)。MMF或MMF+FOS联合给药16周均未改善db/db小鼠随机血糖、血三酰甘油和血肌酐水平(P值均>0.05)。与DN组相比,MMF组小鼠24 h尿蛋白定量无显著变化(P>0.05),而MMF+FOS组小鼠24 h尿蛋白定量水平显著降低(P<0.05)。见表1。各组24周龄小鼠肾组织PAS染色检测显示:DN组小鼠肾小球发生严重的系膜基质增生和肾小球硬化,而MMF组和MMF+FOS组小鼠则仅表现为轻度系膜基质增生,未见明显的肾小球硬化。见图1。DN组系膜增生指数(0.362±0.042)高于(MMF组(0.235±0.032)和MMF+FOS组(0.203±0.046),差异均有统计学意义(P值均<0.05)。
表1 24周龄db/db小鼠一般情况与肾脏疾病表现(N=10,±s)

表1 24周龄db/db小鼠一般情况与肾脏疾病表现(N=10,±s)
与DN组比较:①P<0.05。与FOS+MMF组比较:②P<0.05
组别 体重(g)随机血糖(mmol/L)血三酰甘油(mmol/L)血肌酐(μmol/L)24 h尿蛋白定量(mg )DN组 58.7±2.0 25.2±4.4 2.40±0.67 115.3±42.7 1.15±0.11 MMF组 52.3±2.1①② 27.0±5.2 1.63±0.56 86.1±22.5 0.85±0.23 MMF+FOS组 57.6±2.3 29.1±5.7 1.49±0.19 87.1±22.0 0.72±0.29①
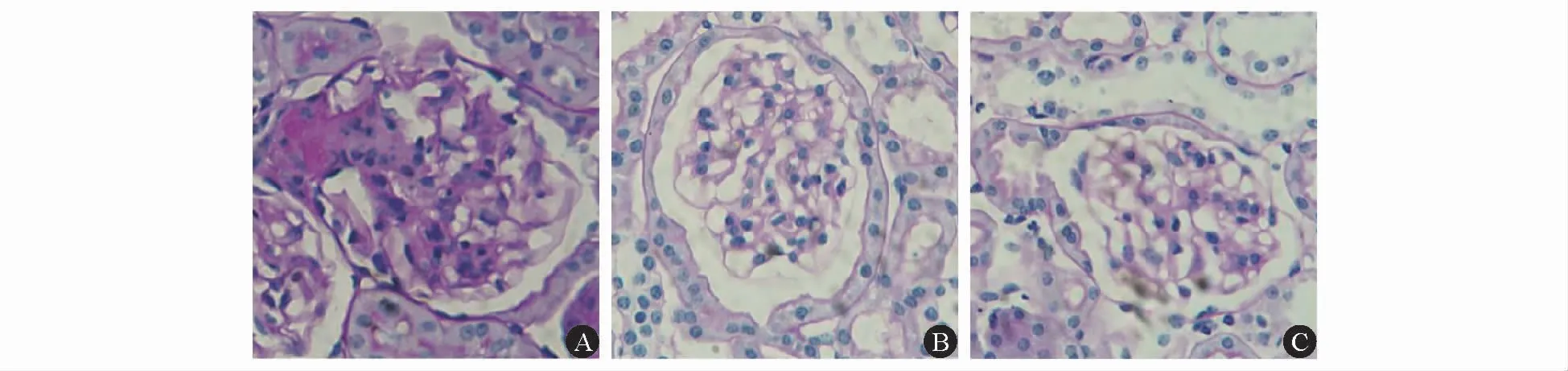
图1 24周龄db/db小鼠肾组织PAS染色(×400)
2.2 FOS联合MMF减轻db/db小鼠DN的机制 24周龄时,DN组db/db小鼠肾间质有较多CD8+T淋巴细胞浸润。与DN组相比,MMF组和MMF+FOS组肾间质CD8+T淋巴细胞的浸润数量显著减少(P<0.05)。各组肾间质CD4+T淋巴细胞浸润数量差异无统计学意义(P<0.05)。肾组织IL-6免疫组织化学染色显示,MMF组db/db小鼠肾组织IL-6表达比DN组显著下调(P<0.05);MMF+FOS组小鼠IL-6表达量亦较DN组小鼠显著降低(P值均<0.05)。见图2、表2。
2.3 FOS减轻MMF对db/db小鼠肠道屏障的损伤 对各组小鼠回肠组织进行H-E染色观察。与DN组相比,MMF组小鼠回肠肠绒毛肿胀、绒毛间隙缩小、相互挤压造成凹陷,MMF+FOS组未见上述病理学改变。进一步通过透射电镜观察各组小鼠回肠上皮细胞间紧密连接结构,MMF组小鼠呈现细胞紧密连接结构紊乱,DN组和MMF+FOS组小鼠未见明显的细胞紧密连接损伤。见图3。
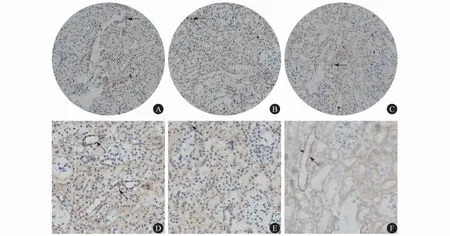
图2 24周龄db/db小鼠肾组织T淋巴细胞浸润和IL-6表达情况
表2 24周龄db/db小鼠肾脏组织T淋巴细胞浸润数量和IL-6表达比较(N=10,±s)

表2 24周龄db/db小鼠肾脏组织T淋巴细胞浸润数量和IL-6表达比较(N=10,±s)
与DN组比较:①P<0.05
组别CD8+T淋巴细胞数量(/高倍视野)CD4+T淋巴细胞数量(/高倍视野)IL-6阳性面积占比(%)DN组43.50±9.60 8.3±3.3 0.58±0.22 MMF组 24.80±9.50① 6.5±3.1 0.06±0.02①FOS+MMF组16.80±5.70① 6.4±2.5 0.12±0.04①

图3 24周龄db/db小鼠回肠组织病理学改变
3 讨 论
DN是一种较为严重的慢性疾病。长期的高血糖刺激和炎症反应,可促使DN患者肾脏病变逐步进展,最终发展为CKD甚至终末期肾病(end-stage renal disease,ESRD)。
DN前期的病理特征主要表现为肾小球系膜增生、毛细血管基底膜增厚,后期以肾小管间质纤维化为主。肾脏局部代谢紊乱引起的足细胞损伤、炎症因子激活,是DN进展的主要因素[4]。
机体长期的高血糖和(或)高血脂状态会导致晚期糖基化终末产物(advanced glycation end products,AGEs)和晚期蛋白质氧化产物(advanced oxidation protein products,AOPPs)在肾脏组织累积,促进肾脏细胞产生活性氧(reactive oxygen species,ROS),诱导细胞凋亡,并激活TGF-β、单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)、TNF-α、IL-1和IL-6等;炎症介质的激活是慢性、无菌性炎症反应驱动下肾脏组织纤维化和结构重塑的经典途径[7]。MMF活性代谢产物霉酚酸(mycophenolic acid,MPA)通过非竞争性抑制嘌呤从头合成途径的关键酶——肌苷腺苷脱氢酶(inosine monophosphate dehydrogenase,IMPDH)的活性,促使DNA合成受阻,从而抑制T和B淋巴细胞的增殖[8];此外,研究[9]结果表明,MMF抑制肾小球系膜细胞的增殖、肾小管间质单核巨噬细胞的浸润,以及多种细胞因子的产生,包括TGF-β1、MCP-1和TNF-α。既往研究[10]发现,在糖尿病大鼠中使用MMF,可以降低尿微量白蛋白水平,改善肾功能,其机制可能与MMF抑制NF-κB、TNF-α、IL-6等表达水平有关。MMF联合苯那普利能更有效地降低DN大鼠的尿蛋白和血肌酐水平,同时抑制了肾组织中的转分化相关因子α平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)和TGF-β1的表达[11]。本研究中,虽然MMF组小鼠较DN组尿蛋白量有减少趋势,但差异无统计学意义;在病理学改变方面,MMF显著改善了db/db小鼠肾脏系膜增生、毛细血管基底膜增厚等病变,且这些病理学改善不依赖于血糖值的改变。同时,MMF组肾间质的CD8+T淋巴细胞浸润数量减少,肾组织IL-6表达水平显著下调。既往研究[12]显示,链脲佐菌素(streptozotocin,STZ)诱导的1型糖尿病及其肾病后期主要表现是CD8+而非CD4+T淋巴细胞在肾脏间质浸润的增加;有学者认为,DN可能是由CD4+T淋巴细胞诱导的炎症反应促发和驱动的,而随着组织损伤程度的加重,CD8+T淋巴细胞在疾病后期的作用更加显著。本研究观察了24周龄db/db小鼠,即2型糖尿病相关肾病较晚期的病变,结果表明,MMF治疗可能通过减少DN后期CD8+T淋巴细胞的浸润比例,以及降低该细胞相关细胞因子(趋化因子)IL-6水平,进而改善肾脏病理学表型。MMF抑制免疫细胞向肾组织趋化,并减少促炎症细胞因子和(或)趋化因子的分泌,从而减弱巨噬细胞的趋化和募集,以抑制DN后期的肾脏纤维化,并延缓疾病进展[13]。
虽然,已有研究[14]证实,拮抗炎症等多种病理生理学机制可介导MMF对肾脏的保护作用,但该免疫抑制剂具有严重的消化道不良反应,如腹泻、胃肠道溃疡等。一项为期7 d的短期、大剂量MMF[100 mg/(kg·d)]干预大鼠的观察研究发现,MMF组大鼠体重下降程度显著高于其他组,且该药物作用的靶脏器主要为空肠和回肠,从而引起肠道损伤[15]。由于MMF显著的肠道不良反应,使该药物在临床的应用范围和治疗剂量受到了限制[16];因此,如何在不影响MMF肾保护作用的条件下,减少MMF的肠道不良反应成为临床研究亟须解决的问题。
本研究选择了FOS作为MMF的辅助治疗剂。一方面,FOS是多种益生菌的天然培养基,可以刺激肠道保护性菌群的生长,如双歧杆菌和乳酸杆菌[17]。既往研究[18-19]发现,在STZ诱导的Wistar大鼠糖尿病模型中,使用FOS可以有效改善实验动物体重,减少尿蛋白排泄量,也可改善糖尿病引起的肾脏组织病理学损伤。在poloxamer-407(PX-407)诱导的2型糖尿病大鼠模型中,加用FOS可以降低模型大鼠血肌酐、尿素氮和AGEs水平[20]。而在小鼠的系统性红斑狼疮模型中观察到,乳酸杆菌可以减少小鼠蛋白尿量[21],降低脾细胞中IL-6水平[22]。另一方面,肠道微生物群失调,如纤毛菌属增加,其抗原可通过激活CD8+T淋巴细胞,加速糖尿病进展[23]。CKD患者常有肠道生态失调、肠道通透性增加和脂多糖循环水平增高的现象[24],从而激活CD4+和CD8+T淋巴细胞,导致全身性炎症[25],进而加速CKD进展。本研究结果显示,在MMF基础上联合使用FOS,不仅有效减少了MMF的消化道不良反应,遏制了小鼠体重减轻,同时,更显著减少了模型小鼠24 h尿蛋白定量,改善了小鼠肾脏系膜增生和毛细血管基底膜增厚等病理学改变;机制研究显示,FOS联合MMF的肾脏保护作用,主要通过抑制组织IL-6表达和减少CD8+T淋巴细胞在肾脏浸润数量介导。
FOS除了可有效改善机体炎症反应,对肠道结构损伤也有一定的修复作用。在非酒精性脂肪肝模型中,小鼠回肠绒毛显著缩短[26],而维持肠道屏障功能至关重要的两个蛋白质闭合蛋白-1(occludin-1)和密蛋白-1(claudin-1)表达量亦显著降低,上述病理改变考虑与p38丝裂原活化蛋白激酶(p38MAPK)通路的磷酸化和激活有关;而加用FOS后可部分逆转上述病理生理学改变[27]。对80%接受空肠切除的新生仔猪使用益生菌,可以增加仔猪回肠黏膜重量及其绒毛长度,其机制可能是益生菌促进了回肠上皮细胞的增殖[28]。对5/6肾切除大鼠使用益生菌,可提高结肠中被下调的紧密连接蛋白[如claudin-1、闭锁小带蛋白(ZO)-1等]表达水平,改善肠道的通透性,减轻全身炎症反应[29]。一项针对结直肠癌术后患者的meta分析[30]发现,使用益生菌改善了肠道黏膜屏障,主要表现为occludin-1表达水平的升高、细菌易位频率的降低,以及分泌性免疫球蛋白Ig A水平的升高。Chung等[31]发现在STZ诱导的糖尿病小鼠中加用FOS后,抑制了肠道黏膜细菌的杀伤活性,减少了细菌尤其是致病性肺炎克雷伯菌易位的发生率,降低了机体内毒素水平。同样,本研究证实,FOS一定程度上可逆转MMF造成的回肠绒毛肿胀和细胞紧密连接结构的紊乱,但其具体机制需进一步研究以揭示。
综上所述,本研究证实MMF通过减少CD8+T淋巴细胞在肾脏的浸润数量,下调相关细胞因子和趋化因子IL-6的表达,以减轻DN的病理损伤程度,而其肾脏保护作用不依赖于血糖水平的下调。加用FOS后,不仅辅助了MMF对模型小鼠的肾脏保护作用,还有效减少了MMF相关的肠道结构和屏障功能损伤等不良反应。研究结果表明,FOS联合MMF在DN的治疗中具有有益作用,靶向拮抗炎症反应等机制可能是延缓DN向ESRD进展的新策略。
