桂花渣粕黄酮提取物的制备及酶法修饰
2020-11-28房仙颖周江莲王靖秋汤锋赵林果
房仙颖,周江莲,王靖秋,汤锋,赵林果*
(1.南京林业大学化学工程学院,南京 210037;2.国际竹藤中心,北京 100102)
桂花 (Osmanthusfragrans)是我国传统的名花,兼具观赏性、食用性、生态、社会和经济效应。根据桂花开花季节的不同,分为四季桂和秋桂两类;根据桂花花色的不同,分为金桂、丹桂和银桂3个品种群[1]。传统中医认为桂花入药可活血化瘀、补脾益肾,用于治疗胃痛、扭伤、牙痛以及风湿麻木等病症。然而,目前桂花的开发主要集中在浸膏、精油的提取和食材应用(桂花茶、桂花酒等)上。由于桂花浸膏和桂花精油的提取率极低[2],如果将桂花浸膏/精油提取后的桂花渣粕抛弃将造成桂花资源的浪费。另一方面,桂花中含有黄酮类化合物、酚类化合物、叶绿素、绿原酸、毛蕊花糖苷等非挥发性成分,这些成分均具有广泛的生物活性[3],特别是黄酮类化合物[4]。然而,关于桂花黄酮类化合物的应用研究非常少,也未见相关产品,原因可能与桂花提取物的活性成分研究不够细致或粗提物活性不高有关[5]。因此,这些活性物质是否残留在提取渣中、如何进一步提高黄酮类化合物的生物活性都是值得深入研究的课题。
天然黄酮多以糖苷形式存在,桂花黄酮亦是如此,包括芦丁、柚皮苷、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-β-D-吡喃葡萄糖苷等[6]。Xiao等[7]研究表明,O-糖基化数目的减少能增强黄酮抗氧化、抗糖尿病、抗炎、抗菌和抗肿瘤等活性。如果通过糖苷酶对桂花黄酮进行催化,有望增强其生物活性,进而提高应用价值[8]。通过分析桂花黄酮主要成分的种类及结构可知,其糖苷主要有葡萄糖苷,以及少量的鼠李糖苷[6]。利用优良的β-葡萄糖苷酶和α-L-鼠李糖苷酶可以选择性切断其中O-糖苷上的糖基[9]。
笔者以桂花及其渣粕为原料,用乙醇热回流法提取并用芦丁法检测其中的桂花黄酮含量;通过生物酶催化,比较催化前后桂花黄酮的生物活性。研究结果可为桂花资源的综合高效利用提供新思路,为制备生物活性更强的桂花黄酮提供技术支撑。
1 材料与方法
1.1 实验材料与试剂
桂花采摘于南京林业大学校园,品种由南京林业大学桂花登录中心鉴定,分别为金桂、银桂、丹桂和四季桂;芦丁、毛蕊花糖苷标准品购于上海阿拉丁试剂有限公司;大孔树脂HPD400购于南京姜华化玻有限公司;Roswell Park Memorial Institute-1640(RPMI-1640)、 Dulbecco’s modified eagle medium(DMEM)培养基和胎牛血清(FBS)购于美国Hyclone公司;对硝基苯酚-β-D-葡萄糖、对硝基苯酚-α-L-鼠李糖苷、1,1-二苯基-2-三硝基苯肼(DPPH)和二甲亚砜(DMSO)购于美国Sigma公司;胰酶消化液、NO检测试剂盒、噻唑蓝(MTT)、Annexin V-FITC细胞凋亡检测试剂盒和二喹啉甲酸(BCA)蛋白定量试剂盒购于上海碧云天生物技术有限公司;Cell signaling technology(CST)抗体cleaved-Caspase(含半胱氨酸的天冬氨酸蛋白水解酶)3, 6, 7, 9、cleaved-PARP和GAPDH购于上海优宁维生物科技有限公司。其他常规化学试剂均购于南京化学试剂有限公司。
小鼠RAW264.7巨噬细胞、人HepG2肝癌细胞和小鼠CT26结肠癌细胞均购自中国科学院细胞库。细胞的培养条件为RPMI-1640完全培养基(添加质量分数10%FBS),37 ℃,5%CO2;HepG2和CT26细胞的培养条件为DMEM完全培养基(添加质量分数10%FBS),37 ℃,5%CO2。
1.2 主要仪器与设备
SpectraMax190型酶标仪,美国Molecular Devices公司;1260型HPLC,美国Agilent公司;SJIA-10N-50A 型小型台式冷冻干燥机,宁波市双嘉仪器有限公司;RV 05 Basic旋转蒸发仪,德国IKA公司;CO2培养箱,美国Thermo公司;超净工作台,苏净安泰空气技术有限公司;垂直平板电泳仪、转膜仪,美国Bio-Rad公司;化学发光成像仪,美国Gene公司。
1.3 桂花黄酮的提取及含量测定
将新鲜桂花洗净于60 ℃下干燥48 h,至含水率<5%。以干燥花朵或桂花渣粕为原料,采用乙醇回流提取法提取活性成分。提取工艺为80%(体积分数)乙醇溶液, 料液比1∶50(g∶mL),70 ℃回流提取3次,每次2 h,合并滤液,用80%乙醇溶液定容至600 mL。取5 μL提取液,按照芦丁法[3]测定总黄酮含量。
1.4 桂花渣粕制备
取干燥桂花粉末适量,加入5倍于粉末质量的蒸馏水,连接挥发油提取装置,采用水蒸气蒸馏法提取桂花精油[10],回流提取5~6 h,收集挥发油。将烧瓶中的桂花-水混悬液进行减压浓缩并干燥,得到桂花渣粕。
1.5 桂花黄酮的HPLC检测条件
色谱柱为XDB-C18柱[4.6 mm×250 mm(直径×长度), 填料颗粒直径5 μm];柱温40 ℃;流动相为甲醇(A)和质量分数0.1%甲酸溶液(B):0~30 min内VA∶VB从50∶50升至80∶20, 30~37 min内VA∶VB从80∶20降至50∶50;检测波长为280,320和360 nm;进样量为10 μL;流速为0.8 mL/min。
1.6 桂花黄酮的纯化
对桂花黄酮提取液进行减压浓缩,得到水浓缩液。浓缩液经HPD400大孔树脂柱纯化,依次用3倍柱体积的水、20%(体积分数)乙醇和80%(体积分数)乙醇洗脱,收集80%洗脱部分,减压浓缩除去乙醇后,冷冻干燥,备用。
1.7 糖苷酶的制备
β-葡萄糖苷酶由重组大肠杆菌pET-20b-Tpebgl3高效表达获得,Tpebgl3基因来源于嗜热菌ThermotogapetrophilaRKU-1。α-L-鼠李糖苷酶由重组酵母菌pPICZαA-AtRha高效表达获得,AtRha基因来源于AspergillusterreusCCF 3059。上述两种基因重组菌均为南京林业大学微生物技术研究室研发,酶制剂制备及酶活力测定参照文献[11-13]。
1.8 桂花总黄酮的酶法催化
对照组:向1 000 μL反应体系中加入100 μL 100 mg/mL 的桂花黄酮储备液,900 μL纯水,再加入1 000 μL甲醇。酸水解组:向1 000 μL反应体系中加入100 μL 100 mg/mL的桂花总黄酮储备液,900 μL酸水解液(甲醇和质量分数25%HCl,体积比为 4∶1),80 ℃反应2 h后,冷却反应液,再加入1 000 μL甲醇。
β-葡萄糖苷酶(BG)/α-L-鼠李糖苷酶(Rha)催化:向1 000 μL反应体系中加入100 μL 100 mg/mL的桂花总黄酮储备液,加入90 U BG 或者25 U Rha,最后补加去离子水至1 000 μL。BG组于90 ℃反应1 h,Rha组于65 ℃反应1 h,反应结束冷却反应液,加入1 000 μL甲醇终止反应。
双酶联用Rha-BG:向1 000 μL反应体系中加入100 μL 100 mg/mL的桂花总黄酮储备液,加入25 U Rha,65 ℃反应1 h,随后加入90 U BG,待90 ℃反应1 h,加入去离子水使反应体系为1 000 μL。冷却反应液,加入1 000 μL甲醇终止反应。
双酶联用BG-Rha:同上,改变加酶顺序。
将酶解前和单独使用酸水解液、Rha和BG催化、双酶联用催化后的样品分别进行HPLC分析。
向上述水解体系中加入过量乙醇,待酶沉淀后过滤除去,将滤液用旋转蒸发仪减压干燥,制成粉末,用DMSO配成100 mg/mL的储备液,用于生物活性的评价实验。
1.9 Griess法测定抗炎活性
按照NO检测试剂盒(Griess法)说明进行:取对数期的RAW264.7细胞,计数,以2×105个/mL 的密度接种于96孔板中,每孔100 μL;培养24 h后,以不同质量浓度的化合物(1,10和100 μg/mL,每孔50 μL)及500 ng/mL 脂多糖(LPS,每孔50 μL)处理细胞。每个浓度设3个复孔,以含DMSO的培养液作对照。化合物作用48 h后,吸取细胞上清100 μL至酶标板中,加入混匀后的Griess试剂100 μL,显色10 min后540 nm处测吸光度。统计数据为3次独立实验结果的平均值±误差值。
1.10 DPPH自由基清除试验
根据文献[14]中的方法,将样品用甲醇配制成一系列质量浓度,取100 μL样品(100,300和900 μg/mL)加入100 μL DPPH溶液(0.15 mg/mL,纯甲醇为溶剂),混匀,避光放置30 min后测定514 nm处吸光度。每份样品平行操作3 次,统计数据为3次独立实验结果的平均值±误差值。计算公式如下:
清除率=[(AC-AS)/AC]×100%
(1)
式中:AC为0.1 mL DPPH溶液与0.1 mL甲醇混合后的吸光度;AS为0.1 mL DPPH溶液与0.1 mL样品混合后的吸光度。
1.11 MTT法测定抗肿瘤活性
以台盼蓝染色计数后,在96孔板中每孔接种3×103个细胞100 μL,待细胞贴壁后,每孔加入不同质量浓度化合物(1,10和100 μg/mL,每孔100 μL)共培养,于37 ℃,5%CO2培养72 h。终止培养前4 h加入20 μL MTT(4 mg/mL)培养基溶液。4 h后吸去上清,每孔加入200 μL DMSO,振荡,使沉淀完全溶解,540 nm处测吸光度,并记录读数。统计数据为3次独立实验结果的平均值±误差值。
1.12 流式细胞仪检测细胞凋亡
在6孔板中按每孔5×105个HepG2细胞种板,待细胞贴壁后加入指定浓度的化合物,培养24 h后,用磷酸缓冲盐溶液(PBS)洗一遍,消化、收集细胞。取(5~10)×104个细胞,1 000 r/min离心5 min,弃去上清,先加入195 μL Annexin V-FITC结合液,轻轻重悬细胞,再加入5 μL Annexin V-FITC,轻轻混匀。接着加入10 μL碘化丙啶(PI)染色液,混匀,室温下避光孵育10~20 min,置于冰浴中,随即用流式细胞检测仪检测。
1.13 免疫印迹分析(Western Blotting,WB)
收集经不同质量浓度化合物处理后的HepG2细胞,用预冷的PBS洗涤一次,细胞计数。各取1×106个细胞,加入150 μL的蛋白裂解液得到总细胞蛋白,用BCA法定量。以50 μg的蛋白量上样,聚丙烯酰胺凝胶(SDS-PAGE)电泳,电泳结束后,湿转法将胶上的蛋白转至聚偏氟乙烯(PVDF)膜。按抗体说明书孵育一抗和二抗,增强化学发光(ECL)法显色并于化学发光成像仪中拍照。
2 结果与分析
2.1 桂花原料及桂花渣粕中总黄酮含量的测定
分别以金桂、银桂、丹桂和四季桂的花瓣为原料,用热回流提取法提取并计算桂花中的总黄酮含量。结果表明,金桂的总黄酮含量最高,约为42.6%,且4种桂花中的总黄酮含量差异不大。采用水蒸气蒸馏法提取金桂中的桂花精油,收集桂花渣粕,采用热回流提取法对桂花渣总黄酮进行提取,测定其总黄酮含量约为38.6%,较原料花瓣中总黄酮仅有少量损失。此外,用HPLC法对桂花黄酮提取物中的毛蕊花糖苷含量进行测定,结果显示,毛蕊花糖苷在桂花渣粕中的含量约为5.50%。毛蕊花糖苷属于苯丙素苷类化合物,具有抗氧化、抗炎、抗肿瘤、促进伤口愈合、神经保护等生物活性[15]。研究结果表明桂花提取渣是一种值得精深加工的宝贵资源。
2.2 桂花黄酮的纯化及酶法催化
由于天然产物的醇提物中除了黄酮类物质,还有大量的多糖和蛋白质等物质[16]。因此,用中极性的HPD400大孔树脂对桂花黄酮进行了纯化,除去多糖、蛋白等成分。天然黄酮多以糖苷形式存在,有研究表明,糖基数量的减少有利于抗炎、氧化、抗肿瘤等活性的提升。因此,采用Rha和/或BG对桂花黄酮进行酶解处理,结果如图1所示。桂花渣粕黄酮提取物经BG催化后,在HPLC特征图谱的11.667,16.153,17.498,18.022,19.512和23.104 min位置出现峰面积的大幅增加,在10 min内出现的峰则发生了显著的峰面积减少,说明该酶仅能特异性地切掉糖苷物质末端的葡萄糖。前期研究结果显示,桂花黄酮糖苷在该检测条件下出峰时间在10 min之前,而苷元在9 min后,由此说明有一部分桂花黄酮可能被β-葡萄糖苷酶水解为苷元了,而Rha催化前后的图谱变化较小,表明桂花黄酮糖苷的末端几乎没有可被Rha切断的鼠李糖。BG和双酶联合催化的结果相似,并且双酶联合催化的加酶顺序对催化结果影响较小,说明桂花黄酮苷中末端或者次末端为葡萄糖基的较多,几乎没有鼠李糖基。
此外,通过与酸水解组的结果比较可知,糖苷酶水解具有专一性,仅会切断黄酮母核上连接的糖苷键,不会破坏黄酮母核;而酸水解无选择性,可以切断所有糖苷键甚至会破坏黄酮的母核结构。毛蕊花糖苷的糖基分子不在末端,实验结果表明这2个糖苷酶不会改变其结构(图1)。因此,桂花渣粕黄酮提取物经Rha和BG催化后,总黄酮和毛蕊花糖苷的含量不会改变,说明利用生物酶水解黄酮糖苷具有明显优势。
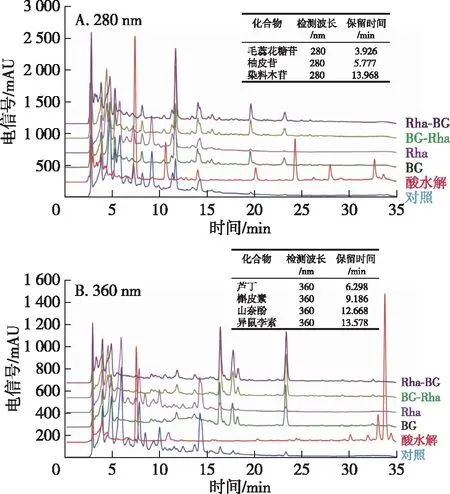
图1 桂花黄酮酶法催化前后的HPLC色谱图Fig. 1 HPLC chromatograms of Osmanthus flavonoids before and after enzymatic conversion
2.3 桂花黄酮酶法催化前后抗炎、抗氧化和抗肿瘤活性比较
用LPS诱导RAW 264.7巨噬细胞建立细胞炎症模型,通过Griess试剂显色法检测RAW 264.7细胞NO的释放量,其抗炎活性结果如图2所示。由图2可知,桂花黄酮对照组在低浓度下几乎没有抗炎活性;在10 μg/mL时,经BG催化和BG-Rha双酶催化后抗炎活性较对照组显著提高;在高浓度下,酶催化后样品的抗炎活性显著高于对照组,抑制率均达95%以上。由IC50值可看出,要达到50%抗炎抑制率,经BG催化后的桂花黄酮所需要的质量浓度最低,为8.26 μg/mL。
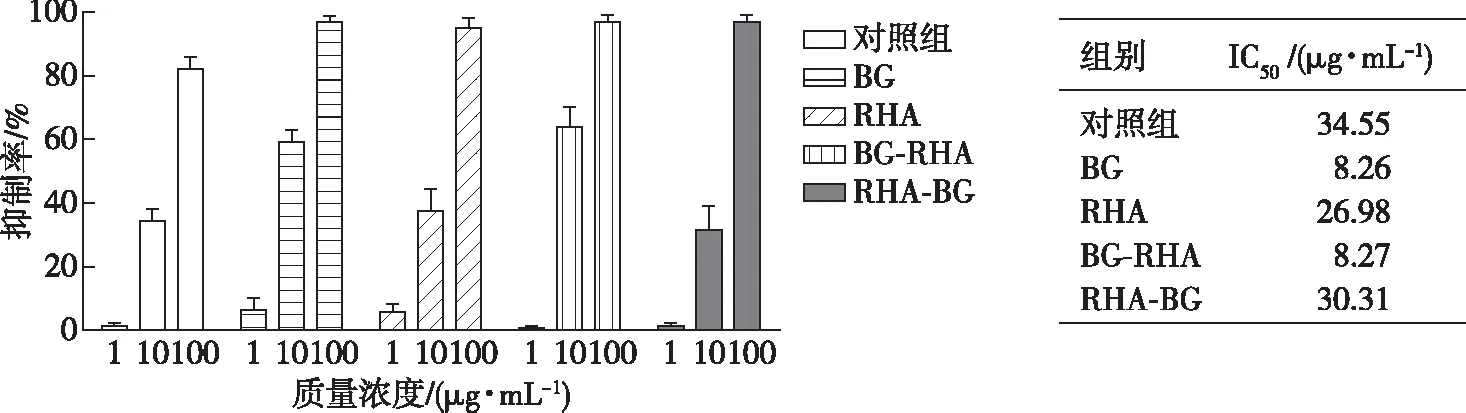
图2 桂花黄酮酶法催化前后对LPS诱导的RAW264.7细胞释放NO的抑制作用Fig. 2 Inhibition on LPS-induced NO production of RAW 264.7 cells by Osmanthus flavonoids before and after enzymatic conversion
桂花黄酮酶法催化前后对DPPH自由基清除作用的结果如图3所示,5组样品在低浓度时对DPPH自由基的清除能力都比较弱,随着浓度的升高,清除DPPH自由基能力均逐渐增强,其中经酶处理后的样品的抗氧化活性明显高于未经处理的对照组样品。经BG处理后样品的抗氧化活性最高,达到50%清除率(IC50)所需的质量浓度最低,为493.44 μg/mL。
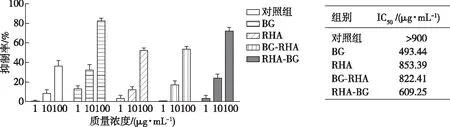
图3 桂花黄酮酶法催化前后对DPPH自由基的清除作用Fig. 3 DPPH radical-scavenging activity of Osmanthus flavonoids before and after enzymatic conversion
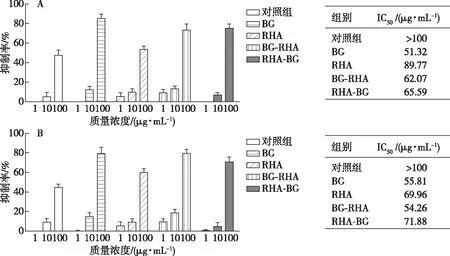
图4 桂花黄酮酶法催化前后抗肿瘤活性Fig. 4 Antitumor activity of ethanol extract from Osmanthus flavonoids before and after enzymatic conversion
酶法催化前后桂花黄酮对人肝癌HepG2细胞和小鼠结肠癌CT26细胞体外增殖的影响如图4所示。在高浓度下,酶法催化可显著提高桂花黄酮的抗肿瘤活性。BG处理后的桂花黄酮对HepG2细胞增殖的抑制率可高达85%,IC50值为51.32 μg/mL;对CT26细胞增值的抑制率可达到80%,IC50值为55.81 μg/mL。由此可知,单独使用BG催化对桂花黄酮抗炎、抗氧化和抗肿瘤活性的提高作用最强。根据HPLC图谱的分析,有一部分桂花黄酮可能被BG水解为苷元,黄酮母核上连接的糖基数的减少有利于增加上述3种活性。双酶联用虽然同样能减少黄酮母核上连接的糖基数,但部分结构的改变未能体现在HPLC图谱上,需要借助分辨度更高的检测方法才能分析出差异;Rha催化对桂花黄酮组成的影响则相对较小。因此,综合考虑酶法催化前后桂花黄酮的HPLC检测图谱变化情况、活性变化情况以及生产成本,比较适宜的方案是单独使用β-葡萄糖苷酶对桂花黄酮进行催化。通常对体内炎症的抑制和氧化水平的控制有助于肿瘤的治疗[17],酶法催化后的桂花黄酮对人源HepG2细胞的IC50值比对小鼠源的CT26细胞还低,说明桂花黄酮在防治肝癌方面有一定的开发价值。
2.4 桂花黄酮对HepG2肝癌细胞凋亡的影响
凋亡是清除肿瘤细胞的主要途径,不会给正常的细胞或周边组织带来过度损伤[18]。以BG催化后的桂花黄酮为原料,考察其抑制HepG2细胞增殖的作用机制。细胞凋亡早期的特征之一是磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,用FITC-Annexin V可检测暴露在细胞膜表面的PS;PI可以穿透凋亡晚期和死细胞的破损细胞膜,嵌入双链DNA并使细胞核染红。利用流式细胞仪检测Annexin V/PI双染的细胞可以观察细胞凋亡情况,并区分早期凋亡和晚期凋亡/坏死的细胞,结果如图5所示。由图5可知,桂花总黄酮能够诱导HepG2细胞的凋亡,在100 μg/mL的质量浓度下细胞早期凋亡率为14.90%,总凋亡率为23.88%。
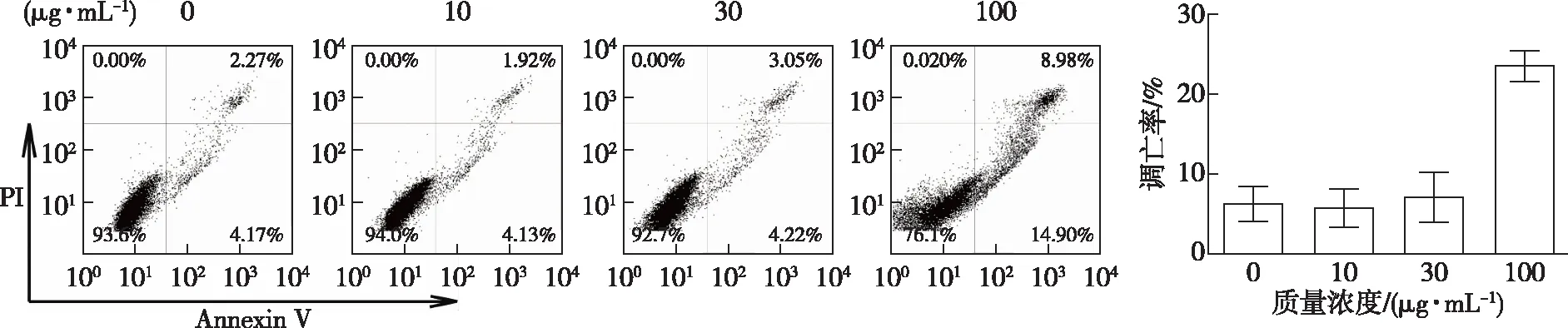
图5 β-葡萄糖苷酶催化后的桂花黄酮对HepG2细胞凋亡的影响Fig. 5 Effects of Osmanthus flavonoids transformed by β-glucosidase on apoptosis of HepG2 cells

图6 桂花黄酮对细胞凋亡通路相关蛋白表达的影响Fig. 6 Effects of Osmanthus flavonoids on the expression of related proteins in cell apoptotic pathway
Caspase家族蛋白的活化是凋亡中的关键步骤,哺乳动物细胞凋亡主要分为2个途径:一是线粒体介导的内源性通路,发生Caspase 9的剪切;另一个是死亡受体介导的外源性通路,发生Caspase 8的剪切[19]。笔者通过WB实验检测了桂花黄酮对凋亡通路相关的级联剪切蛋白表达量的影响,结果如图6所示。桂花黄酮在100 μg/mL的质量浓度下可以导致Caspase 9的剪切,进而导致Caspase 7和Caspase 3的剪切,最终促进多聚ADP-核糖聚合酶(PARP)的剪切。结果表明,桂花黄酮可能通过线粒体途径促进HepG2细胞的凋亡。
3 结 论
1)金桂花瓣以水蒸气蒸馏法提取精油后,桂花渣中的总黄酮含量还高达38.7%,与未提取精油前相比损失未超过5%,并且桂花渣中毛蕊花糖苷的含量为5.5%,故提取渣具有很好的开发价值。
2)利用β-葡萄糖苷酶、α-L-鼠李糖苷酶和双酶联用对纯化后的桂花黄酮进行催化,桂花黄酮有相当一部分以糖苷形式存在,其末端多为葡萄糖基,但末端为鼠李糖基的糖苷存在很少。
3)酶法催化后桂花黄酮的抗炎、抗氧化和抗肿瘤活性均得到了不同程度的提高。其中,经β-葡萄糖苷酶催化得到的桂花黄酮活性最好,对LPS诱导的巨噬细胞炎症模型的IC50值由34.55 μg/mL 下降到8.26 μg/mL;对DPPH自由基清除作用的IC50值由大于900.00 μg/mL下降到493.44 μg/mL;对人肝癌HepG2细胞增殖的IC50值由大于100.00 μg/mL降至51.32 μg/mL;对小鼠结肠癌CT26细胞增殖的IC50值由大于100.00 μg/mL降至55.81 μg/mL。
4) 抑制体内炎症和降低细胞氧化水平有助于肿瘤的治疗,而桂花黄酮对人肝癌HepG2细胞体外增殖表现出显著的抑制作用,提示桂花黄酮在防治肝癌方面具有一定的开发价值。通过流式细胞仪Annexin V/PI双染检测发现,桂花黄酮能够在早期诱导HepG2细胞的凋亡,并且可能是通过线粒体凋亡途径实现的。
综上所述,桂花提取精油后的渣不应直接作为废弃物处理,值得对桂花渣中的活性物质深入开发,实现桂花资源的综合高效利用。
