基于单拷贝核基因的荧光定量PCR技术检测驴奶的含量
2020-11-19王之莹李婷婷于文杰陈爱亮
王之莹,李婷婷,于文杰,乔 璐,陈爱亮
(中国农业科学院农业质量标准与检测技术研究所,北京 100081)
驴在农村经济中占有重要的地位,驴奶也具有广泛的应用。长期以来,人们一直有饮用驴奶的习惯,不仅因为它较高的营养价值,还因为它的药用价值,能够预防动脉粥样硬化、缓解牛奶蛋白过敏患者的过敏反应[1-2]。在欧美,驴奶不但是生物制剂的加工原料,更是一种流行的保健饮品。在我国,虽然有很多人饮用驴奶,但鉴于我国的产驴地区主要位于西北偏远地带,而奶制品保质期较短,运输困难,因此即使新疆每年可产驴奶4万吨,而实际用于加工的驴奶非常少,造成这一资源的巨大浪费[3]。最重要的是,目前国内尚缺乏规模完整的驴奶加工厂,市场上销售的驴奶大多源于家庭作坊,加之,与其他高营养价值的奶制品一样,驴奶的价格(80~150 元/kg)[4]相对于牛奶(约10.60 元/kg)[5]较为昂贵,从而导致驴奶成为掺假的潜在目标。出于安全考虑,饮用掺假的驴奶会危害到牛奶蛋白过敏患者的身体健康[6],因此,需要一种能够快速、灵敏地检测驴奶含量的方法,确定其是否掺假及掺假比例。
目前,物种鉴定技术主要是基于蛋白质和基于核酸的方法。基于蛋白质的检测技术包括高效液相色谱[7]、光谱技术[8]以及酶联免疫吸附测定[9],这些技术虽然测得的结果准确,但操作繁琐且需要昂贵的仪器。此外,蛋白质在加工过程中容易变性,因此在检测加工乳制品时,会降低其方法的灵敏度[10]。相比之下,DNA具有较高的稳定性,使得核酸检测技术成为物种鉴定中最常用的技术,包括普通的聚合酶链反应(PCR)[11]、荧光定量PCR[12]和等温扩增技术[13]。定性PCR比较常见,但它只能检测物种的种类,而定量PCR可以判断掺假的比例[14]。当前已有许多关于定量PCR的研究,但这些研究主要集中在线粒体基因[15],而线粒体基因在不同的物种或者组织中具有高变异性和多拷贝数,这一特点会导致定量分析存在测量误差[16]。

表1 驴特异性引物和内参引物的序列Table 1 Sequences of donkey-specific primers and reference primers
为了解决这一问题,本研究筛选了单拷贝核基因作为驴的特异性基因和通用性的内参基因,该基因在不同的物种或者组织中具有稳定且恒定表达的拷贝数(一个或者几个拷贝)[17-18]。同时,内参基因在不同的生物体或者细胞中能够稳定表达,从而避免物种间多样性的干扰[19]。本文旨在开发一种标准化荧光定量PCR方法来定量待检的灭菌乳样品中驴奶的含量。
1 材料与方法
1.1 材料与仪器
驴奶 新疆乌鲁木齐县南山哈萨克牧场;牛奶 呼伦贝尔陈巴尔虎旗陶海牧场;山羊奶 广东揭阳市揭西县亿丰牧场;牦牛奶 西藏羌塘牧场;骆驼奶 哈萨克食品直供基地;Tris、十二烷基硫酸钠(SDS) 德国Sigma-Aldrich公司;PBS缓冲液(10×) 北京索莱宝公司;蔗糖、NaCl、MgCl2、Na2HPO4、EDTA、NH4Cl、乙醇 北京国药控股化学试剂有限公司;丙酮、盐酸 北京化工厂有限责任公司;KAPA PROBE FAST qPCR Kit试剂盒 美国KAPA Biosystems公司;核酸吸附柱 北京天根生化科技有限公司。
ABI 7500荧光定量PCR仪 美国Applied Biosystems公司;DK-S24恒温水浴锅 上海森信实验仪器有限公司;Nanodrop 2000分光光度计、Heraeus Multifuge X3离心机 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 样品制备 实验所需奶制品均为灭菌乳,分别从不同牧场购买和收集,包括牛奶、山羊奶、牦牛奶、骆驼奶和驴奶。另外,将牛奶和驴奶混合,制备5%、10%、30%、50%和80%的驴奶混合物作为标准样品,以建立标准曲线。同时制备20%、50%、80%的驴奶混合物作为模拟掺假样品。每个浓度的混合样品进行三次重复。
1.2.2 DNA提取 对于市场上销售的合格的灭菌乳,其体细胞数相对稳定,且乳制品的核酸大多存在于体细胞中,因此采用Pokorska法[20]从体细胞中提取DNA。取10 mL灭菌乳,4 ℃ 8500×g 离心15 min,去除乳脂和上清液。然后用2 mL缓冲液A(15 mmol/L Tris-HCl(pH7.4~7.6)、25 mmol/L NaCl、5 mmol/L MgCl2、15 mmol/L Na2HPO4、2.5 mmol/L EDTA和1%蔗糖)洗涤含有奶制品体细胞的沉淀两次。加入2 mL裂解液B(pH8.8;6% SDS、3 mmol/L MgCl2、15 mmol/L Tris-HCl、0.5% DMSO和6%丙酮),65 ℃孵育约2 h。随后,加入450 μL的蛋白质沉淀缓冲液(2.35 mol/L NH4Cl,1.15 mol/L NaCl和38%乙醇),混合后,10 ℃ 16000×g离心8 min。将上层清液转移到一个新的离心管,加入1000 μL 100%异丙醇,然后将混合物添加到核酸吸附柱中,13400×g离心1 min,使DNA吸附到硅胶膜上,再用70%的乙醇洗涤两次,室温干燥。最后,将纯化的DNA用80 μL TE缓冲液溶解,并用Nanodrop 2000分光光度计检测提取到的DNA的浓度,DNA的浓度为5~10 ng/μL,OD260 nm/OD280 nm值为1.8~2.1。
1.2.3 单拷贝核基因设计引物 以驴生长激素受体(the growth hormone receptor)为特异基因[16],以肌肉生长抑制基因(the muscle growth-inhibiting genes)为内参基因[21],设计特异性引物和内参引物。引物和探针的序列如表1所示,由上海生工生物技术有限公司合成。
1.2.4 荧光定量PCR反应 20 μL荧光定量PCR反应混合液包括:10 μL预混液(2×),0.4 μL正向引物,0.4 μL反向引物,0.4 μL探针,0.4 μL ROX(50×),2 μL DNA提取液和6.4 μL蒸馏水(ddH2O)。反应在ABI 7500仪器中进行,扩增步骤如下:95 ℃预变性2 min;95 ℃变性30 s,60 ℃退火32 s,反应进行50个循环;72 ℃延伸2 min。每个DNA模板重复PCR反应三次,ddH2O作为模板进行空白对照(NTC),监测污染。Ct值代表各反应中荧光强度达到特定阈值的循环数[22]。
1.2.5 特异性引物和通用性引物的验证 分别使用特异性引物和内参引物在1.2.4中荧光定量PCR反应条件下同时扩增5个不同物种的乳制品的DNA样本(牛奶、山羊奶、牦牛奶、骆驼奶和驴奶),对特异性引物和通用性引物进行验证。NTC(No template control)为空白对照。
1.2.6 标准曲线的建立 将驴奶和牛奶进行混合,制备5%、10%、30%、50%和80%的驴奶掺假标准样品,并按上述方法提取DNA进行扩增。并根据以下公式建立标准曲线:
Y=Ctspecific/Ctreference
Y=a X+b
其中:Ctspecific和Ctreference分别为驴的特异性引物和内参引物的Ct值,表示驴奶和总奶的DNA拷贝数[23],然后通过绘制Y与驴奶的含量(X=驴奶/总奶)之间的关系,创建校准曲线。
1.2.7 模拟掺假样品分析 为了验证该方法的实用性,分别以20%、50%和80%的比例将驴奶与牛奶混合,进行模拟掺假实验。每个浓度在取样时都做了三个平行。用得到的标准曲线计算驴奶在混合奶中的比例,与实际掺假比例进行对比,通过回收率、标准差(SD)和变异系数(CV)来验证该方法的准确性。
1.2.8 市售驴奶样品分析 由于目前市场上的驴奶产品以纯驴奶为主,因此购买来自不同产地的驴奶,检测其是否掺假及掺假比例,包括山东济南、宁夏吴忠、河南驻马店、新疆乌鲁木齐。每个产地在取样时做了三个平行,然后提取DNA,用特异性引物和通用引物以同一个DNA模板在不同反应体系中进行扩增,将得到的Ct值用标准曲线计算驴奶的含量,从而判定其是否掺假。
1.3 数据处理
使用Office软件进行数据处理和图表的制作。
2 结果与分析
2.1 内参引物的验证
为了验证内参引物的通用性,用内参引物对不同物种的乳制品DNA进行了扩增(牛、山羊、牦牛、骆驼、驴),NTC作为空白对照。图1显示,所有物种的DNA均得到扩增,且Ct值分别为26.0367、30.5951、25.4488、28.9239和35.2356,而NTC在50个循环内没有产生任何荧光信号,说明了内参引物的通用性。同时,也证明了所有这些物种的乳制品都可以提取DNA进行PCR扩增。
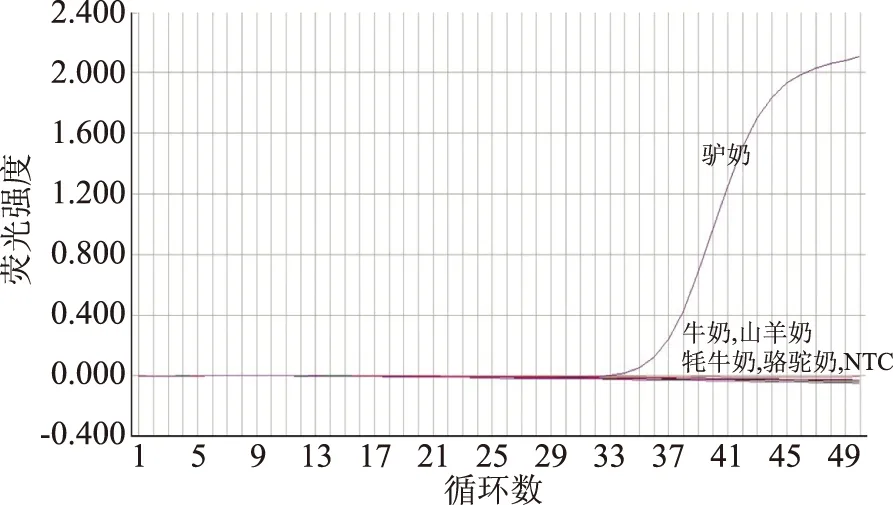
图1 内参引物的荧光扩增曲线Fig.1 Fluorescent amplification curves of reference primer
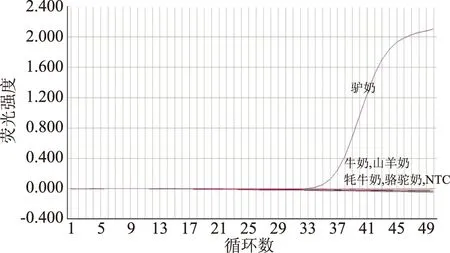
图2 驴特异性引物的荧光扩增曲线Fig.2 Fluorescent amplification curvesof donkey-specific primers
2.2 特异性引物的验证
利用牛奶、山羊奶、牦牛奶、骆驼奶和驴奶的DNA进行荧光定量PCR反应,判断基因的特异性。如图2所示,仅驴奶的DNA得到了扩增,Ct值为35.1474,而其他无关物种的DNA在50个循环内没有出现荧光信号。因此,该引物对目标物种具有较高的特异性。
2.3 标准曲线的建立
根据驴奶含量(驴奶/总奶)与Ct值(特异/内参基因)的线性关系,建立了一种标准化分析方法。由于内参基因可以在驴、牛等哺乳动物中恒定表达,无论采用何种DNA提取方法,由提取方法造成的DNA浓度的差异都能随着内参基因的表达显示不同的Ct值。而且,一般情况下,特异性基因和内参基因的PCR扩增效率会稍有差异,但通过以内参基因为对照的标准曲线可以消除不同的DNA提取方法、以及特异性基因和内参基因的PCR扩增效率产生的误差。即以内参基因作为对照,根据不同百分比含量的驴奶所建立的标准曲线,能够计算待检样品中驴奶的百分比含量,而非计算所含驴奶的具体毫升数。如图3所示,当驴奶含量在5%~100%的范围内,决定系数(R2)达到0.9650,标准曲线为y=-0.0023x+1.2288,表明了驴奶含量与Ct值之间具有良好的线性关系。该标准曲线不仅显示了该方法的准确度较高,同时表明了在可疑样品中可以检测出5%~100%的驴奶含量。
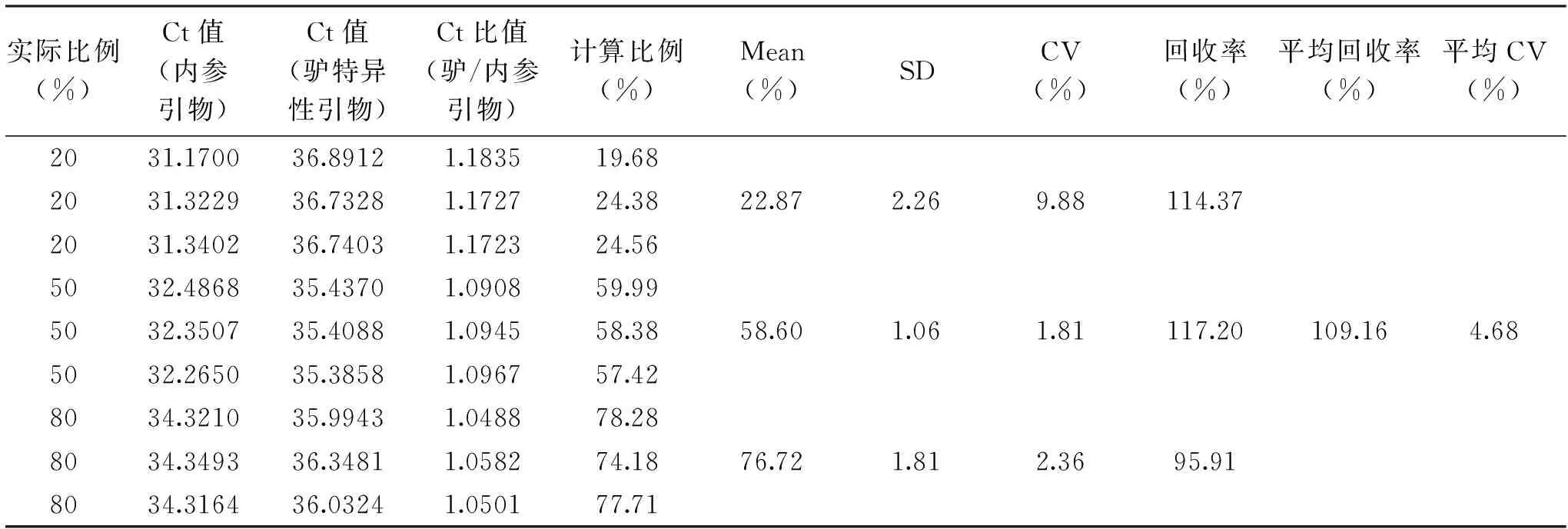
表2 模拟掺假样品的计算Table 2 Calculation of the simulated adulterated milk mixtures
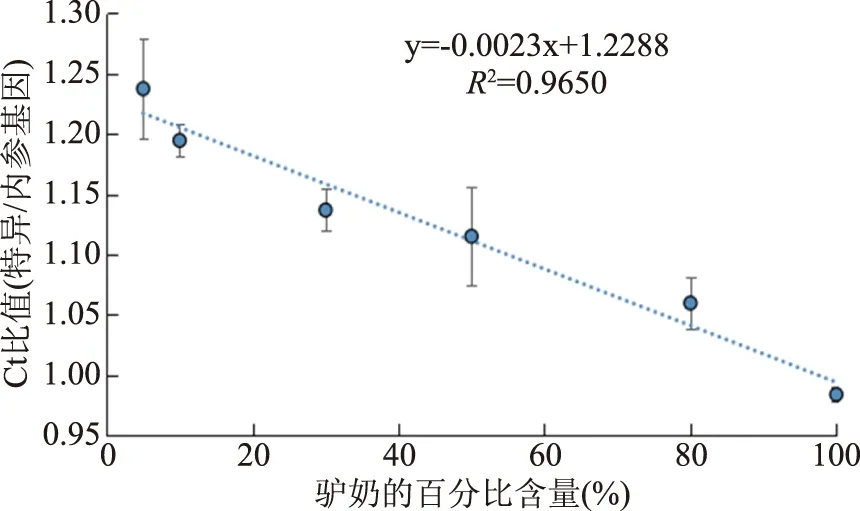
图3 驴奶含量定量的标准曲线Fig.3 Normalized calibration curve forthe quantitation of the donkey milk content
2.4 模拟掺假样品分析
对含有20%、50%和80%的驴奶的模拟掺假样品进行分析,通过提取DNA进行扩增,对得到的Ct值采用建立的标准曲线进行计算,将计算的驴奶含量与实际的驴奶含量进行对比。表2的结果显示,模拟样品的回收率为95%~120%,CV<10%,平均回收率为109.16%,平均CV值为4.68%,所有偏差结果均在10%的可接受范围内[24],证实了该方法的准确性。
2.5 市售驴奶样品分析
对购买的来自山东济南、宁夏吴忠、河南驻马店、新疆乌鲁木齐的驴奶样品进行分析。
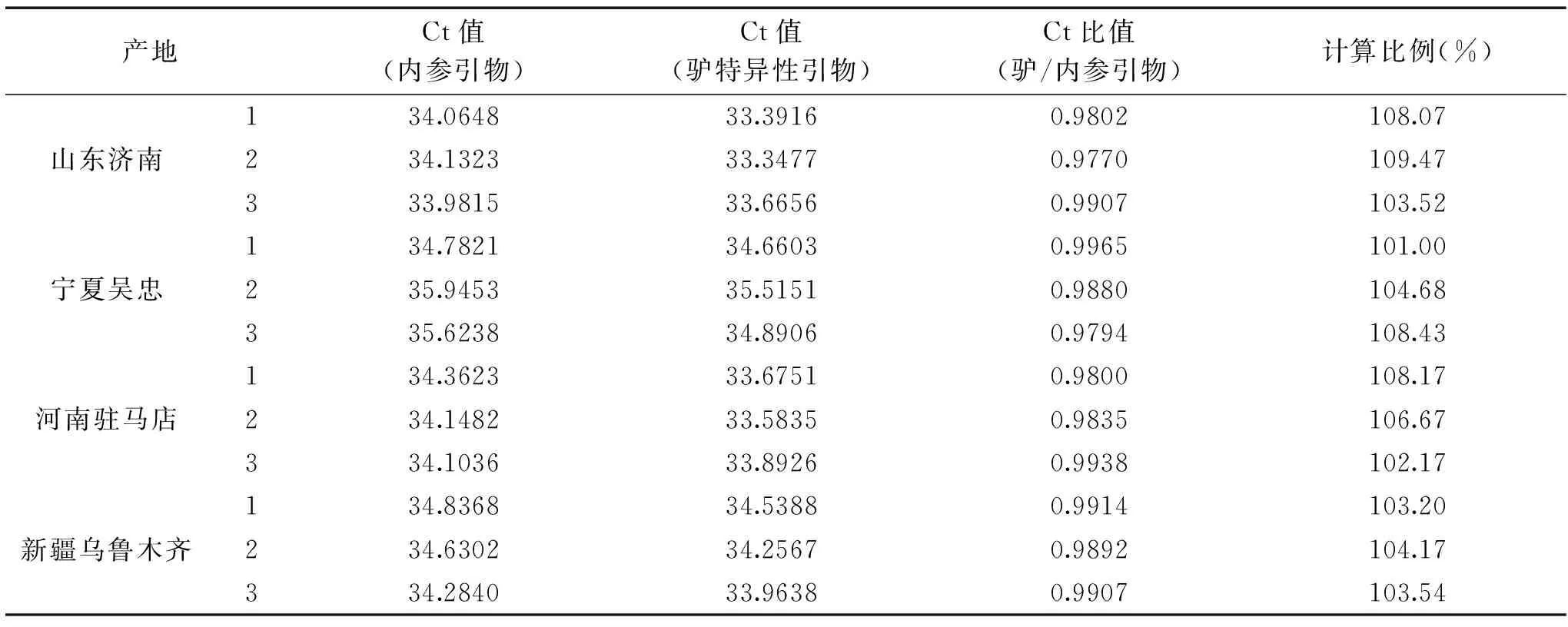
表3 市售驴奶样品的计算Table 3 Calculation of donkey milk samples for market
表3结果显示,这些样品中驴奶含量的计算结果均接近100%,表明目前市场上纯驴奶的销售具有一定的真实性。但鉴于这些驴奶的价格相对较高(约30~40元/250 mL),因此驴奶的品质也会相对有保证。
3 结论
驴奶业属于“朝阳产业”,随着其营养价值和药用价值的逐渐开发,驴奶有望得到更广泛的应用[25]。然而,目前市场上销售的驴奶大多源于家庭作坊,且由于驴奶价格较为昂贵,存在一些不法商家为了牟取暴利而用价格较为低廉的牛奶对驴奶进行掺假的可能性。在>5%的掺假含量才能获得经济利益[17]的基础上,需要建立一种能够快速、灵敏地检测驴奶含量的定量方法以确定其是否掺假及掺假比例。
本研究开发了一种标准化荧光定量PCR方法来定量检测驴奶的含量。基于单拷贝核基因设计PCR引物,能够控制因不同细胞中线粒体基因拷贝数不同带来的误差。同时,以内参基因为对照,基于驴奶含量与Ct值的标准曲线的建立能够消除DNA提取率、PCR扩增效率导致的误差。通过该标准曲线(R2=0.9650),能够在5%~100%范围内推断驴奶的含量。最后,为了验证方法的准确性,对含20%、50%和80%的驴奶的模拟掺假样品进行分析,结果为平均回收率为109.16%,平均CV值为4.68%。综上所述,这种荧光定量PCR方法能够快速、灵敏地检测混合奶制品中驴奶的含量,确定其是否掺假及掺假比例,为驴奶的市场监督提供了技术支持。
