藤黄果果实羟基柠檬钾盐的提取工艺优化与鉴定
2020-11-19宋雅慧韩晏麒金晨钟张雪娇胡一鸿
曾 媛,宋雅慧,俞 泉,韩晏麒,金晨钟,2,王 艳,2,张雪娇,2,胡一鸿,2,*
(1.湖南人文科技学院农药无害化应用重点实验室,湖南娄底 417000; 2.湖南人文科技学院,湖南省农田杂草防控技术与应用协同创新中心,湖南娄底 417000)
藤黄果(GarciniacambogiaL.)是一种广泛分布于南亚热带地区的藤黄科乔木,其果实部分的果皮中富含羟基柠檬酸,果实具有酸味,在南亚国家常被用来作为食物调料和传统药物[1-3]。羟基柠檬酸是ATP柠檬酸裂解酶的强竞争性抑制剂,具有抑制脂肪酸合成和促进糖原异生的作用,能够增高人体对丙酮酸和乳酸的利用率,从而起到抑制食欲的目的。羟基柠檬酸能够调节肥胖人群的胰岛素和血脂水平,并能提升身体中血清内的5-羟基色胺的含量,起到加速身体中能量消耗的作用,而且目前没有发现适量摄入羟基柠檬酸具有明显的毒副作用[4-5]。因此,在国内外市场上,羟基柠檬酸常作为减肥功能性食品的有效成分加以应用[6-8]。近年的研究也表明,羟基柠檬酸还能抑制肾内草酸钙结晶的生成和瓦解泌尿系统的草酸钙结晶的功效[9]。
羟基柠檬酸是含有2个羟基和3个游离羧基的有机酸,其特定的分子结构使其在常规的分离提取过程中极易自身缩合成内酯,导致提取物的生物学活性丧失,甚至对动物体产生一定的毒副作用[10]。目前工业制备上从藤黄果中提取羟基柠檬酸主要采用3种方法:水提取法[11]、有机溶剂提取法[2]和离子交换层析提取法[12]。国内外市场上的藤黄果提取物主要采用上述3种方法用藤黄果的果皮制备。但藤黄果干燥后,其果皮与果肉很难分离,而且现有工艺制备的藤黄果提取物的主要成分为羟基柠檬酸内酯,而不是游离的羟基柠檬酸[2,13],目前仍未见高效分离提取游离羟基柠檬酸工艺的报道。因此,本试验以藤黄果果实(全果)为原料,采用水提取法,用KOH保护游离羟基柠檬酸以制备羟基柠檬酸钾盐,以料液比、浓缩倍数、酒精度数、pH为考察因素,获取游离羟基柠檬酸盐的最佳制备方法,并对提取的羟基柠檬酸进行定性与定量检测,以期为优化工业化生产羟基柠檬酸提供参考。
1 材料与方法
1.1 材料与仪器
藤黄果果实(全果) 贵州黎平博远生态农业科技有限公司;羟基柠檬酸标准品 购自ChromaDex公司(色谱纯);藤黄果提取物 购自NowFoods公司;偏矾酸铵 购自南京试剂公司;硫酸钠 购自国药集团;其他试剂 均为国产分析纯。
40~70%vol酒精度计 河北武强华鹏仪器厂;N-1100V-WB旋转蒸发仪 东京理化器械株式会社;L535R低速冷冻离心机 湖南湘仪;LC-10Avp plus高效液相色谱仪、AUW120D精密分析天平 日本岛津;MLS-3750全自动蒸汽灭菌锅 日本三洋。
1.2 实验方法
1.2.1 羟基柠檬酸提取 参照Lewis[14]的方法加以改进。自然风干藤黄果果实后,取粉碎至40目的藤黄果果实粉末25 g,加入蒸馏水混匀,于115 ℃高压蒸煮15 min,冷却后用5层医用纱布过滤挤压出滤液,滤液于4000×g离心15 min,55 ℃减压蒸发浓缩上清液,然后在浓缩液中按1∶1 (v/v)加入95%乙醇沉淀果胶,双层纱布过滤后滤液4000×g离心15 min除去果胶沉淀,上清液中加入95%乙醇用40~70%vol酒精度计在室温下调节溶液酒精度数至额定值,然后加入40% KOH调节pH,形成油状沉淀后弃上清液,沉淀用95%乙醇洗涤3次,再用无水乙醇洗涤沉淀2次后置于常温下过夜,然后于60 ℃下减压蒸发,干燥后称重。
1.2.2 单因素实验
1.2.2.1 料液比对羟基柠檬酸得率的影响 分别取25 g藤黄果果实粉末,固定浓缩倍数为5倍、酒精度数为60%vol、pH为10,分别在料液比为1∶10、1∶14、1∶18、1∶22的条件下,测定羟基柠檬酸得率。
1.2.2.2 浓缩倍数对羟基柠檬酸得率的影响 分别取25 g藤黄果果实粉末,固定料液比为1∶10、酒精度数为60%vol、pH为10,分别在浓缩倍数为1、3、5、7的条件下,测定羟基柠檬酸得率。
1.2.2.3 酒精度数对羟基柠檬酸得率的影响 分别取25 g藤黄果果实粉末,固定料液比为1∶10、浓缩倍数5倍,pH为10,分别在酒精度数为40、50、60、70%vol的条件下,测定羟基柠檬酸得率。
1.2.2.4 pH对羟基柠檬酸得率的影响 分别取25 g藤黄果果实粉末,固定料液比为1∶10,浓缩5倍,酒精度数60%vol,分别在pH为9、10、11、12的条件下,测定羟基柠檬酸得率。
1.2.3 正交试验 通过单因素实验,选取液料比、浓缩倍数、酒精度数、pH为考察因素,以羟基柠檬酸得率为考察指标,设计4因素3水平正交试验优化工艺条件,因素水平表见表1。
1.2.4 羟基柠檬酸得率 羟基柠檬酸得率按如下公式计算:
式(1)
1.2.5 藤黄果果实羟基柠檬酸的鉴定与定量分析 将提取的样品、羟基柠檬酸标准品和NowFoods公司的藤黄果提取物进行显色反应、薄层层析的初步鉴定,高效液相色谱定量分析,判定本试验提取的样品。
1.2.5.1 显色反应 显色反应参照Bainto等[15]的方法。称取0.1 g待测样品溶于50 mL 3.0%的磷酸溶液中,40 KHz、0.5 W/cm2超声波处理30 min后取1 mL上清液,加入3 mL 1%偏矾酸铵,静置30 min后点样置于白色搪瓷片上观察。
1.2.5.2 薄层层析检测 取0.1 g待测样品溶于0.9 mL 3.0%的磷酸溶液中,40 KHz、0.5 W/cm2超声波处理30 min后用0. 45 μm水性微孔滤膜过滤,点样在活化后的GF254薄层层析硅胶板(2.5×7.5 cm)上,以甲醇∶水=6∶1 (v/v)为展开剂。层析完毕后采用5%偏矾酸铵溶液显色。Rf值按如下公式计算:
式(2)
1.2.5.3 高效液相色谱检测 参照惠战锋等[16]的方法。采用LC-10Avp plus高效液相色谱仪检测,色谱柱为Wondasil C18(250 mm×4.6 mm,5 μm),流动相为0.05 mol/L硫酸钠,用硫酸调整pH至2.3,流速为1 mL/min。取50 mg待测样品溶于40 mL 3.0%的磷酸溶液中,超声波处理30 min后用0. 45 μm水性微孔滤膜过滤,每次上样量为20 μL,采用紫外检测器于210 nm处检测,采用0.01~0.20 mg/mL的色谱纯羟基柠檬酸绘制外标曲线进行纯度测算。
1.3 数据处理
进行3次单因素实验的平行实验,并在正交试验获取的最优条件下进行3次平行实验验证结果。采用SPSS 19.0进行差异显著性比较(P<0.05)(LSD法),结果以平均值±标准误差(M±SE),用小写字母标注显著性差异。
2 结果与分析
2.1 单因素实验
2.1.1 料液比对羟基柠檬酸得率的影响 由图1可知,随着料液比的增大得率先增大后减小。当料液比为1∶14时,羟基柠檬酸得率达到最大,为2.04%,随后随料液比的增大得率缓慢下降。在一定范围内,当料液比增大,浸提的水分子则能与浸提物充分接触,提高亲水的羟基柠檬酸的得率。但当料液比继续增大,浸出的效率达到峰值后,由于浸出物的浓度随溶剂的体积而稀释,会造成浸出物不稳定,同时减压蒸发浓缩时间也会相应增长,过长的加热会使羟基柠檬酸形成内脂[17],也会造成得率下降。因此,采用料液比1∶14。

图1 不同料液比对羟基柠檬酸得率的影响Fig.1 Effects of different solid liquid ratios on recoveryrate of hydroxycitric acid from G. cambogia L.注:用小写字母标注显著性差异(P<0.05);图2~图4同。
2.1.2 不同浓缩倍数对羟基柠檬酸得率的影响 由图2可知,随着浓缩倍数的增大得率先增大后减小。当浓缩倍数为5倍时,得率为1.58%。当浓缩倍数达到7倍时,得率显著下降(P<0.05),仅为0.46%。由于浓缩过程是在55 ℃的温度下进行,设定浓缩倍数过高时,长时间的高温使得羟基柠檬酸容易形成内脂,降低了得率。因此,采用浓缩倍数为5倍。
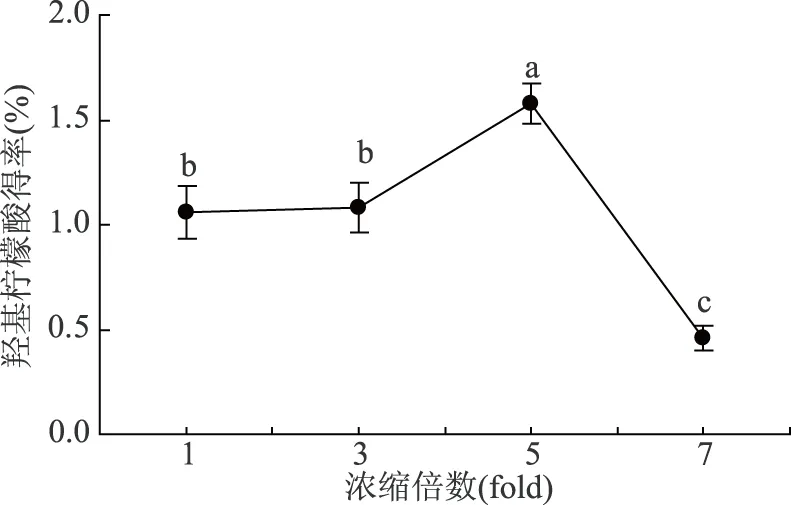
图2 不同浓缩倍数对羟基柠檬酸得率的影响Fig.2 Effects of different condensive folds on recoveryrate of hydroxycitric acid from G. cambogia L.
2.1.3 不同酒精度数对羟基柠檬酸得率的影响 由图3可知,随着酒精度数的增加得率先增大后减小。当酒精度数达到60%vol时,得率达到最大值,为1.18%。随着酒精度数的继续增大,得率开始下降。采用乙醇使羟基柠檬酸沉淀是在溶液的一定极性范围之内的,通过加入乙醇调整溶液的极性而产生沉淀。当溶液的酒精度数达到60%vol时,羟基柠檬酸的溶解度达到最低,充分沉淀出来。因此,采用酒精度数为60%vol。
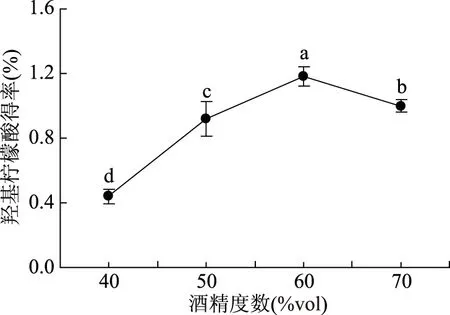
图3 不同酒精度数对羟基柠檬酸得率的影响Fig.3 Effects of different alcohol degrees on recoveryrate of hydroxycitric acid from G. cambogia
2.1.4 不同pH对羟基柠檬酸得率的影响 由图4可知,随着pH的增加得率先增大后减小,当pH为11时,得率达到最大值,为1.56%。羟基柠檬酸为弱酸,在碱性条件下能形成盐。但碱性条件偏大时,过高浓度的OH-离子可能会破坏羟基柠檬酸盐的稳定性,溶液极性的改变会导致乙醇沉淀效率下降[14,18]。因此,采用pH为11。

图4 不同pH对羟基柠檬酸得率的影响Fig.4 Effects of different pH on recovery rate ofhydroxycitric acid from G. cambogia
2.2 正交试验结果分析
在单因素实验的基础上,选取液料比、浓缩倍数、酒精度数、pH进行4因素3水平的正交试验,以获取最佳提取条件。
正交试验结果见表2。通过表2直观分析显示,理论最佳提取条件为:A3B2C2D3,即料液比为1∶18、浓缩为5倍、酒精度数为60%vol、pH为12。影响藤黄果羟基柠檬酸提取效果的因素大小顺序依次为A(液料比)>B(浓缩倍数)>D(pH)>C(酒精度数)。在此优化提取条件下进行3次验证实验,得率为3.24%±0.32%,高于表2试验组合中的最高值,说明正交试验结果合理。
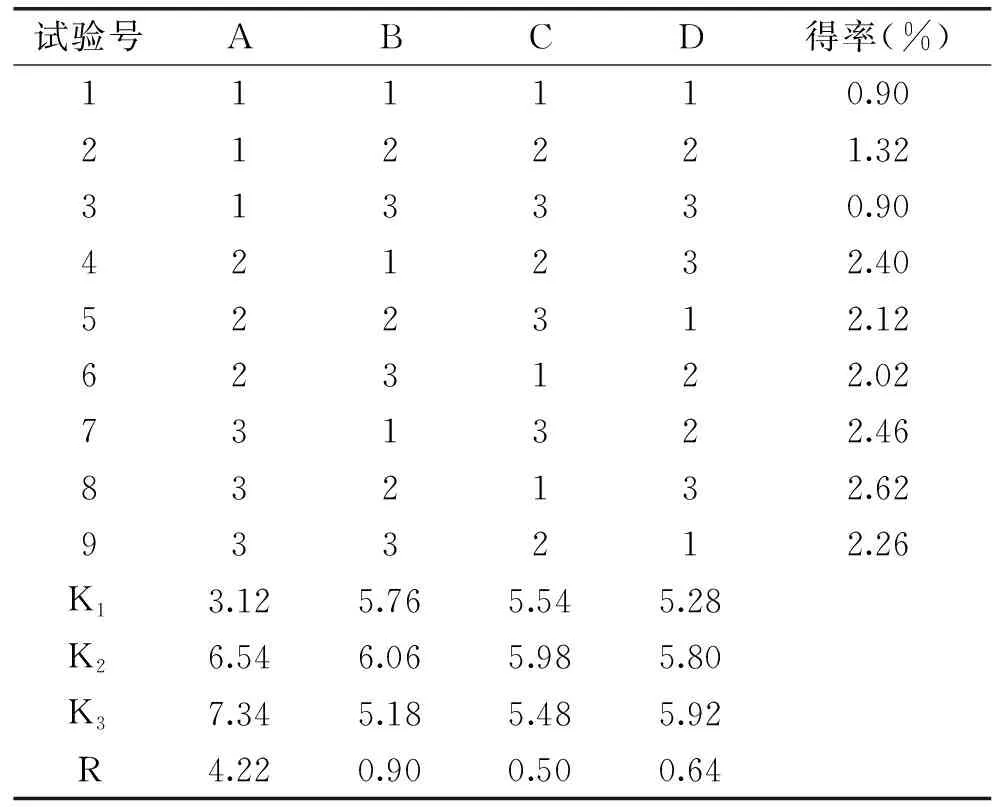
表2 正交试验结果Table 2 Results of orthogonal test
以极差值最小的C因素为误差列[19],正交试验结果进行方差分析和F检验,发现料液比相对于得率存在显著性差异(P<0.05),而浓缩倍数、酒精度数、pH对得率的影响并不显著(P>0.05)(表3)。
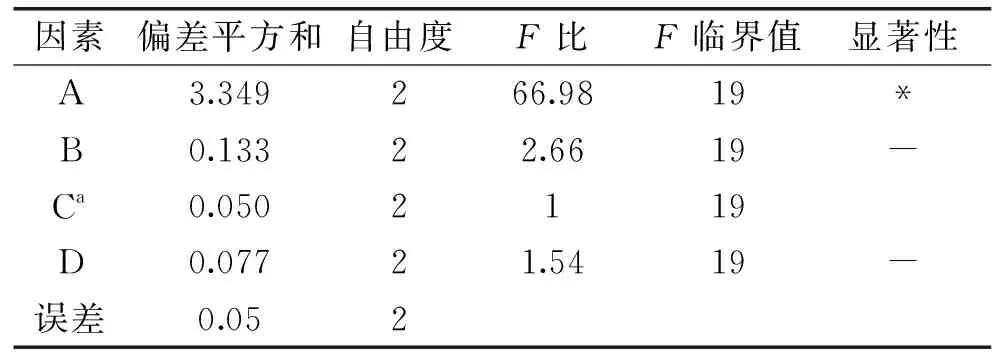
表3 正交试验方差分析Table 3 Variance analysis of orthogonal test results
2.3 显色反应与薄层层析
用偏矾酸铵进行显色反应,发现羟基柠檬酸标准品、藤黄果果实羟基柠檬酸和Now Foods藤黄果提取物均呈红棕色,而柠檬酸呈淡黄色(图5)。薄层层析的结果显示,羟基柠檬酸标准品、柠檬酸、藤黄果果实羟基柠檬酸和Now Foods藤黄果提取物的Rf值无明显差异,均在0.69~0.71之间,但柠檬酸的Rf值稍低(图6)。说明显色反应和薄层层析能够定性鉴定羟基柠檬酸和与其结构相似的柠檬酸。

图5 偏矾酸铵显色反应检测羟基柠檬酸Fig.5 Chromogenic reaction with ammoniummonovanadate analysis of hydroxycitric acid注:1:柠檬酸;2:羟基柠檬酸标准品;3:藤黄果果实羟基柠檬酸;4:NowFoods藤黄果提取物。

图6 薄层层析分析检测羟基柠檬酸Fig.6 Thin layer chromatographic analysis of hydroxycitric acid注:1:羟基柠檬酸标准品;2:柠檬酸;3:藤黄果果实羟基柠檬酸;4:NowFoods藤黄果提取物。
2.4 高效液相色谱检测
将提取的样品进行高效液相色谱检测,发现在保留时间2.90 min处出现吸收峰,与羟基柠檬酸标准品(2.96 min)和NowFoods公司的藤黄果提取物(2.88 min)保留时间一致,但NowFoods公司的藤黄果提取物在5.63 min处还有1个更强的杂质峰(图7),可判定本试验提取的样品为藤黄果果实羟基柠檬酸。经3次重复,外标法测得藤黄果果实羟基柠檬酸的纯度为52.10%±0.53%,NowFoods公司的藤黄果提取物羟基柠檬酸的纯度为34.42%±0.48%。

图7 高效液相色谱检测羟基柠檬酸Fig.7 HPLC analysis of hydroxycitric acid注:a:羟基柠檬酸标准品;b:藤黄果果实羟基柠檬酸;c:NowFoods藤黄果提取物。
3 结论
本试验在单因素实验的基础上,通过正交试验及方差分析,得到了水提取法提取藤黄果果实羟基柠檬酸的最佳条件为料液比为1∶18、浓缩为5倍、酒精度数为60%vol、pH为12。在该试验条件下,羟基柠檬酸的得率为3.24%±0.32%。该方法采用KOH在偏碱性条件下保护了游离羟基柠檬酸,提取物色谱检测为单峰,说明不含羟基柠檬酸内酯,现有工艺的提取产物主要为羟基柠檬酸内酯,在常温下羟基柠檬酸内酯与羟基柠檬酸的比例高达9∶1[2],而最终产品中的羟基柠檬酸内酯残留可能对人体产生毒副作用[10,20]。采用偏矾酸铵显色和薄层层析对羟基柠檬酸进行了初步鉴定,采用高效液相色谱法测定藤黄果果实羟基柠檬酸的纯度为52.10%±0.53%。本试验工艺参数对现有藤黄果羟基酸制备工艺的改进具有较强的参考价值。
