鸽源产肠毒素大肠杆菌O55分离株的鉴定及其致病性研究
2020-11-18张跃东任玉鹏张焕容杨劲松葛润洲
张跃东,罗 薇,任玉鹏,张焕容,杨劲松,王 斌,葛润洲
(西南民族大学生命科学与技术学院,成都 610041)
大肠杆菌(Escherichia coli)是人类和其他动物肠道菌群组成的一部分[1],因为具备调节肠道生态平衡、维生素合成及生物拮抗等功能,一度被认为是肠道健康菌群,直到20世纪中叶,才发现部分大肠杆菌具有较强的致病性,此类大肠杆菌有特殊的血清型。致病性大肠杆菌可通过污染的水源、食物、用具等经消化道、呼吸道以及皮肤开口和黏膜等造成机体感染,引起包括大肠杆菌性败血症、腹泻、气囊炎、肉芽肿、蜂窝织炎等病症,主要危害年幼者[2-3]。
目前已确认的大肠杆菌O抗原有196种[4],O血清型中有162种与腹泻有关,70多种与禽大肠杆菌病有关,以O1、O2、O8、O18、O35、O78、O88等常见[2,5]。产肠毒素大肠杆菌(enterotoxigenicEscherichia coli,ETEC)是一种危害儿童、旅行者及幼龄动物的重要病原菌,为非侵入性胃肠感染,即黏膜感染[6],可引起剧烈水样腹泻致使机体迅速脱水而死亡,即肠毒素(heat-labile toxin,LT)、耐热性肠毒素(heat-stable enterotoxin,ST),通过激活腺苷酸环化酶和鸟苷酸环化酶引致腹泻[7]。禽致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC)的称谓主要源于兽医界,许多APEC都属于肠外致病性大肠杆菌,因缺乏深入的研究,其分类归属的致病型尚不清楚[2-3]。ETEC主要是人和哺乳动物病原,对禽类致病的现象并不常见。有报道鸵鸟体内分离获得的APEC O15可表达STb,在腹泻雏鸡肠内发现有ETEC[2,8-9],分离自鹌鹑体内的致病性大肠杆菌可表达LT基因[10]。对鸭源致病性大肠杆菌毒力基因检测时,发现鸭源致病性大肠杆菌携带ETEC黏附素F5基因,认为是人和哺乳动物ETEC所携带的黏附素基因[11-12]。2017年4月,四川省成都市某赛鸽公棚的赛鸽陆续发病、死亡,本研究自病、死赛鸽的肝脏分离出7株致病性大肠杆菌,经检测发现有6株分离菌携带黏附素F5基因、肠毒素基因sta、lt[11],而黏附素、肠毒素普遍被认为是ETEC的结构;此6株分离菌中有3株血清型为O55[13],血清型O55的致病性大肠杆菌与幼龄儿童腹泻相关[2,14],虽然禽的肠道有耐热肠毒素的功能受体,但极少能从禽体内分离出与人腹泻病有关的大肠杆菌的血清型以及产生不耐热和耐热肠毒素的菌株[3]。为证实鸽源O55分离株是否真正表达了黏附素与肠毒素基因,并具备ETEC的特性,本研究选用黏附素凝集试验、兔回肠结扎试验、乳鼠灌胃试验等经典试验,确定其分类。以生物学试验中常用的哺乳动物纲SPF级昆明鼠为试验动物,通过口服的途径感染O55分离株,了解O55分离株对机体造成的病理损伤及抗原分布,为鸽源产肠毒大肠杆菌O55对哺乳动物、人类的致病性研究提供实验参考,具有一定公共卫生学意义。
1 材料与方法
1.1 菌株来源2017年4月自四川省成都市某赛鸽公棚的病、死赛鸽肝脏分离出6株携带黏附素F5基因、肠毒素基因sta、lt的致病性大肠杆菌,此6株病原菌有3株血清型为O55[13]。
1.2 试验动物3日龄SPF级昆明鼠乳鼠、20~22 g SPF级昆明鼠、2 kg新西兰兔,均购自成都达硕试验动物有限责任公司。
1.3 主要试剂及设备CaYE(致病性大肠埃希氏菌产毒培养基)购自青岛高科技工业园海博生物技术有限公司;F5阳性血清购自成都百盛科创生物科技有限公司;E.coliAntibody购自NOVUS;头孢曲松钠购自大连美仑生物技术有限公司;透射电镜(Tecnai F20)为美国FEI公司生产;数码三目摄像显微镜(BA200 Digital)为麦克奥迪实业集团有限公司生产。
1.4 分离菌毒力基因检测为了解6株分离菌其他毒力相关基因携带情况,参照文献[15-16]的研究,选取与HPI毒力岛、I型菌毛、P菌毛、铁摄取系统、肠细胞脱落位点毒力岛、CoIV质粒等相关的8对毒力基因引物进行检测,引物序列见表1,由生工生物工程(上海)股份有限公司合成。
以上毒力基因的反应体系均为25 μL:PCR Mix 12.5 μL,ddH2O 8.5 μL,上、下游引物各1 μL,DNA模板2 μL。反应条件:98℃预变性2 min;98℃变性10 s;X℃退火40 s;72℃延伸50 s,共35个循环;72℃延伸10 min,4℃反应结束。X为扩增不同毒力基因的退火温度,其中扩增毒力基因fyuA、fimC、papA、fimH退火温度为50℃;扩增tsh、eaeA、iss、irp-2的退火温度为52℃。PCR反应产物选用1.5%浓度琼脂糖凝胶电泳检测。参考文献[17]中关于细菌毒力基因克隆转化的研究,对阳性PCR产物进行克隆、转化,将鉴定结果为阳性的菌株,送至生工生物工程(上海)股份有限公司测序,将测序结果与基因文库中公布的序列进行相似度比较,以确保检测到相应的基因。

表1 毒力基因引物序列Table 1 Primer information for each virulence gene
1.5 O55分离株菌毛电镜观察应用2%磷钨酸负染O55分离菌菌悬液,Tecnai F20型透射电镜观察并照相,该试验在四川大学望江校区分析测试中心完成。
1.6 O55分离株黏附素及肠毒素测定参考文献[18-19]等研究,选用凝集试验和D-甘露糖抗性试验检测黏附素F5;兔回肠结扎试验、乳鼠灌胃试验检测肠毒素。
1.7 O55分离株致病性观察通过腹腔注射途径测定O55分离株对SPF昆明鼠半数致死量(lethal dose 50%,LD50)。参考文献[20]的研究,选用头孢曲松钠清除昆明鼠肠道菌群,以100LD50的剂量,口服感染昆明鼠,于感染后6 h、12 h、24 h、48 h、72 h、96 h、120 h、168 h分别采集感染鼠的心脏、肝脏、脾脏、肺脏、肾脏、十二指肠、空肠、回肠、结肠9个组织器官,固定并制作石蜡切片,进行HE染色及间接免疫酶组织化学染色。
2 结果
2.1 分离菌毒力基因检测结果6株分离菌毒力基因检测结果:fimH与papA均为100%(6/6),fyuA为66.7%(4/6),eaeA与iss均为50%(3/6),irp-2、fimC与tsh均为33.3%(2/6),阳性样本均扩增出与目的片段大小相符的片段,测序得到的序列与基因文库中公布的相应毒力基因相似度均高,确保检测到了相应的毒力基因,PCR检测毒力基因琼脂糖凝胶电泳图见图1。提示分离菌具有较强的致病性。卡方检验显示不同菌株之间毒力基因携带种类差异显著(P<0.05)。选择同期检测携带毒力基因种类较多的O55分离株进行后续研究。
2.2 O55分离株菌毛电镜观察结果选择同期检测携带毒力基因种类较多的O55分离株进行电镜观察,Tecnai F20透射电镜下,可见菌体为杆菌,有纹理褶皱,形态似花生,周身长有大量密集的菌毛,有鞭毛(图2、图3)。
2.3 O55分离株黏附素及肠毒素测定结果O55分离株可引起F5阳性血清凝集,D-甘露糖抗血凝反应结果显示,O55分离株稀释液接近1∶16时仍可引起3%鸡红细胞凝集。结合电镜观察结果与凝集试验结果,证明O55分离株具有菌毛黏附素F5。
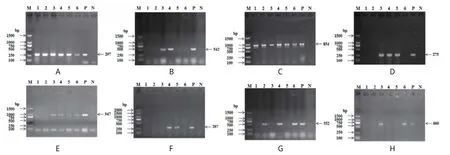
图1 6株分离菌毒力基因PCR检测凝胶电泳图Fig.1 PCR Amplification results of virulence gene
兔回肠结扎试验结果显示:O55分离株表现出其毒力(图4),计算结扎肠段长度与肠内液体比值,生理盐水及CaYE培养基对照组小于1,表现为阴性;各肠毒素试验组结扎肠段长度与肠内液体比值大于1,表现为阳性。证明O55分离株可表达热敏肠毒素LT。
选用乳鼠灌胃试验测定ST:测定肠道及其内容物与剩余体重比值,见表2。结果经加热处理的肠毒素液组(冷却至室温后再进行试验)与未经加热处理的肠毒素液组的比值均大于0.085,为阳性,且经加热处理与未加热处理的肠毒素液组之间,试验结果差异不显著(P>0.05),提示肠毒素液耐热;CaYE对照组、生理盐水对照组该比值均小于0.074,为阴性。结合肠毒素基因sta检出,stb未检出的结果,表明O55分离株可表达STa。
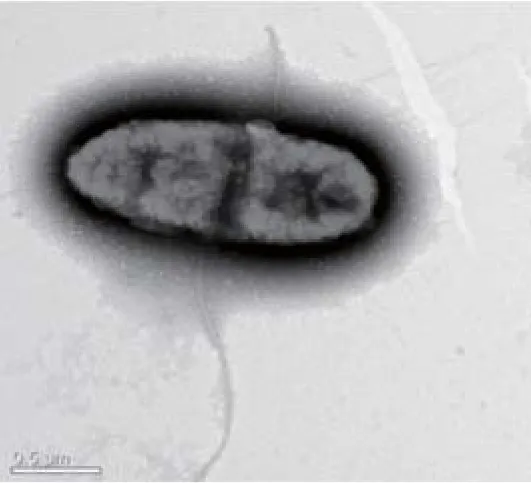
图2 杆菌,周身布满密集菌毛(×12 000)Fig.2 Bacilli with intensive pilus (×12 000)

图3 杆菌,周身布满密集菌毛(×20 000)Fig.3 Bacilli with intensive pilus (×20 000)
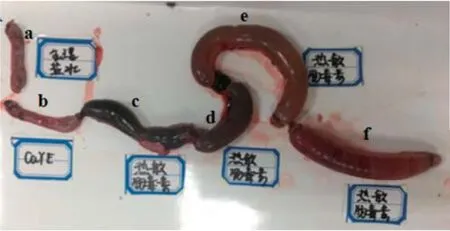
图4 兔回肠结扎试验测定热敏肠毒素Fig.4 The rabbit intestinal-loop assays for detection of LT
2.4 致病性观察结果经Feiller精确矫正,95%的置信区间下,Bliss法[21]计算出的O55分离株对20 g左右SPF昆明鼠的LD50为1.66×105CFU/只。口服感染昆明鼠的活菌数为2.8×107CFU。感染后6 h,除脾脏外,试验鼠被检器官组织均有损伤,随时间推移,损伤有不同程度的加重,直至被观察的168 h,其中肝脏、肾脏、肺脏、空肠和回肠的病变程度较为严重。各组织脏器部分时间点病理组织学观察结果见图5。心肌肌间血管扩张、充血,肌纤维变性、坏死(图5A)、炎性细胞浸润;肝细胞呈现弥漫性空泡变性、坏死(图5B),炎性细胞浸润,肝血窦扩张、淤血,168 h肝组织内有多个炎性细胞灶;感染后24~72 h脾小结增生、生发中心扩张(图5C),红髓区脾血窦扩张、充血,168 h有炎性细胞灶状坏死;肺部呈现局域性的肺间隔增宽,间隔毛细血管扩张、充血(图5D),炎性细胞浸润,168 h肺泡腔、支气管腔出现游离的红细胞;肾脏感染初期,肾小球细胞增多,肾小囊腔变窄、消失,近曲小管上皮细胞肿胀,管腔变窄、消失,部分管腔内有粉红色絮状物,远曲小管管壁变薄,管腔变大,间质血管扩张、充血。被检各肠段以空肠、回肠病变明显,感染后6 h空肠肠绒毛刷状缘有脱落,黏膜下层炎性细胞浸润,12 h肠绒毛断裂脱落,固有层炎性细胞、红细胞增多,24~168 h肠绒毛呈现水肿(图5G);回肠肠绒毛断裂脱落(图5H),黏膜下层血管扩张充血,固有层血管充血、出血,炎性细胞浸润,96~168 h肠腺萎缩,间质增宽。
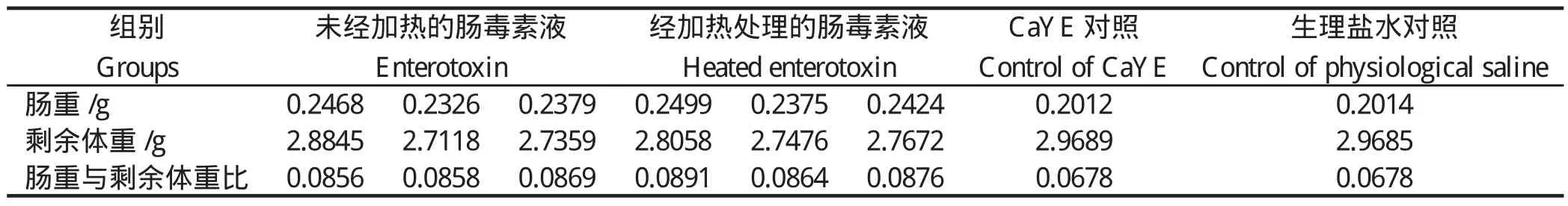
表2 乳鼠灌胃试验显示的肠重与剩余体重比值结果Table 2 The ratios of intestinal weight and rest corpse weight of sucking mice
感染后6~168 h,试验昆明鼠的10个被检部位持续检测到O55抗原。阳性信号主要出现在心肌纤维的肌浆、胞浆(图6A),肝细胞细胞质(图6B),脾脏淋巴细胞间质(图6C),肺泡上皮细胞(图6D),肾小管上皮细胞间质(图6E),十二指肠肠绒毛和肠腺上皮细胞质和细胞间质(图6F),空肠、回肠肠绒毛上皮细胞、黏膜细胞质及细胞间质(图6-G~H),结肠肠黏膜上皮细胞及黏膜下层(图6I)。
3 讨论
致病性大肠杆菌具有特殊的血清型,玻片凝集法是用来检测大肠杆菌临床分离株血清型的传统方法,因血清型众多,K抗原能干扰O抗原凝集反应,检测时需121℃高压2 h破坏K抗原,此方法操作繁琐,相对耗时长,费用高,目前临床医学多选用检测大肠杆菌携带的特定毒力基因判定其致病性[22]。本研究自2017年4月临诊大肠杆菌病病死赛鸽的肝脏中分离到6株致病性大肠杆菌,其中有3株血清型为O55,此6株分离菌均携带黏附素F5基因、肠毒素基因sta、lt[13],此类基因是医学上检测产肠毒素大肠杆菌(ETEC)的标志性基因。ETEC主要是人和哺乳动物病原,对禽类致病的现象并不常见。有报道:鸵鸟体内分离获得的APEC O15可表达STb,在腹泻雏鸡肠内发现有ETEC[2,8-9],分离自鹌鹑体内的致病性大肠杆菌可表达LT基因[10];对鸭源致病性大肠杆菌毒力基因检测时,发现鸭源致病性大肠杆菌携带ETEC黏附素F5基因,认为是人和哺乳ETEC所携带的黏附素基因[11-12]。虽然禽的肠道有耐热肠毒素的功能受体,却极少能分离出与人腹泻病有关的大肠杆菌血清型以及产生不耐热和耐热肠毒素的菌株[3]。根据前期对分离菌的生物学特性实验,检测到O55分离株携带黏附素F5基因、肠毒素基因sta、lt,属于产肠毒素大肠杆菌(ETEC)的标志性基因,有学者认为,ETEC主要是人和哺乳动物的病原,判定产肠毒素大肠杆菌,在检测到相应标志性基因的同时,还需要通过生物学试验证明分离株真正表达其毒力因子。为确定O55分离株是否为ETEC,采用黏附素凝集试验、D-甘露糖抵抗血凝试验、兔回肠结扎试验、乳鼠灌胃试验,确定黏附素与肠毒素基因是否表达,结果显示O55分离株能够表达这些毒力因子,符合产肠毒素型大肠杆菌的判定标准,为ETEC。
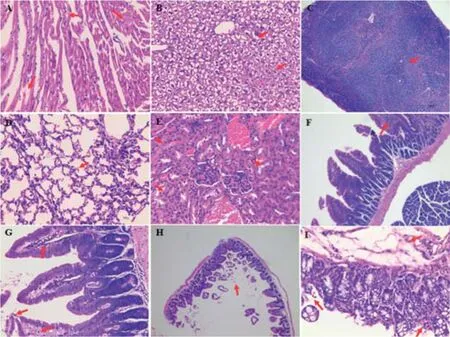
图5 昆明鼠感染O55分离株病理学观察Fig.5 Pathology observation of O55 isolate artificially infected Kunming mice

图6 昆明鼠人工感染O55分离株抗原分布Fig.6 Distribution of positive signal of O55 isolate artificially infected Kunming mice
国内外很多城市的居民和鸽子接触比较多,根据比利时信鸽协会的统计,其国民平均每人拥有信鸽近千羽。缅甸仰光的街头、悉尼的马丁广场以及我国济南的泉城广场等地,观赏鸽较多,与人互动亲密,对人类健康的潜在危害也值得关注。本研究分离自鸽子肝脏的致病性大肠杆菌毒力基因携带情况为:fimH100%(6/6)、papA100%(6/6)、fyuA66.7%(4/6)、eaeA与iss均为50%(3/6)、irp-2、fimC与tsh均为33.3%(2/6)。papA基因是P菌毛的标志性检测基因[23],P菌毛是定植于实质脏器内所必须的菌毛,引起败血症的大肠杆菌分离株中检出率较高,多与人、狗及猪尿道大肠杆菌感染有关,导致急性肾盂肾炎[16];fimH基因为I型菌毛的D-甘露糖特异性黏附素,是细菌体外定植禽类呼吸道所必须的,可介导菌毛黏附于宿主细胞,结合I型菌毛检测的标志性基因fimC的检出率(33.3%),表明分离菌中I型菌毛、P菌毛是广泛存在的;eaeA是位于LEE毒力岛上的基因,可介导细胞黏附于肠上皮细胞[3];iss基因存在于CoIV质粒上,多数可从禽致病性大肠杆菌中检测到,编码的蛋白Iss属于外膜蛋白的一部分,可提高细菌毒力,是重要的致病因素[24],tsh基因也是位于CoIV质粒上的基因片段,与气囊损伤有关,在禽致病性大肠杆菌中普遍存在,但在非致病性大肠杆菌中很少被检出[3],其编码的Tsh蛋白可能与致病性大肠杆菌的铁摄取能力相关,在感染早期有助于细菌定植在宿主呼吸道,可使细菌在低铁环境中摄取铁[15];fyuA和irp-2是构成HPI毒力岛的重要基因,可作为检测HPI是否存在的标志[25]。HPI毒力岛的检出率与菌株的致病力呈明显的正相关,可在耶尔森氏菌和大肠杆菌之间水平传播[26]。资料显示,APEC可能是人源大肠杆菌的毒力基因储存库,鸽也是大肠杆菌的天然储存宿主[3,27-28],APEC的毒力因子可水平转移至与人类相关的致病性大肠杆菌上[3,29]。赛鸽在比赛时常远距离飞翔,经过多个城市,通过粪便排出病原,其携带的毒力基因可对人类的健康造成潜在的危害,值得关注。
大肠杆菌通过粘膜定植或皮肤开口进入宿主体内。黏附定植决定于多种黏附因子,这些黏附因子有助于细菌与受体的结合以及随后的繁殖。细菌在生长繁殖过程中合成能损害宿主,使机体发生病变、出现症状甚至死亡的毒性物质[3]。内毒素对组织无严格的选择作用,可引起发热,使血循环中的白细胞骤减,当内毒素进入循环,损伤微循环血管上皮细胞,形成血栓,使有效循环血量减少,造成广泛性、弥漫性血管内凝血(disseminated intravascular coagulation,DIC),使组织缺血性坏死[2]。入血的内毒素首先对肝脏造成损伤[30],产生急性期蛋白、肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)及白介素-6(IL-6)。光镜下肝脏在感染6 h、96 h、120 h后出现大量肝细胞发生弥漫性空泡变性、炎细胞浸润等损伤,肝脏小叶间中央静脉周围细胞的损伤程度相对较为严重,这可能与含有细菌的血液血流方向有一定的关系,确认O55分离株可以造成试验鼠肝脏的严重损伤,影响其功能,造成保护防御功能减弱,加强细菌经血液进入其他脏器而造成的损伤[31]。从多器官组织切片观察的结果来看,感染期间,试验鼠心脏、脾脏、肺脏、肾脏等实质器官出现了程度不同的泛嗜性病变,如感染期间,肾小管间质出现的粉红色均染物质,可作为机体蛋白尿的判定依据,脾脏的病变损伤会影响机体的免疫机能,此外内毒素也会抑制巨噬细胞活性,有利于大肠杆菌的存活和扩散[3]。本实验O55分离株对机体肝脏、肺脏、心脏、肾脏的损伤,与王景[19]对O24 ETEC分离株人工感染试验动物的研究结果相似,但病变较之严重。本研究鸽源O55分离株可造成脾脏的损伤,与其实验观察结果不一致,可能与病原的毒力、试验动物的差异有关;与于学辉[16]报道的鸭致病性大肠杆菌引起的实质脏器的损伤相似。
大肠杆菌在生长过程中合成分泌的外毒素,毒性较强,对组织器官有一定的选择性,通过与靶器官的受体结合,进入细胞而发挥作用。最为人所知的是ETEC所产生的,由质粒编码的ST与LT。LT可激活肠毛细血管上皮细胞腺苷酸环化酶,增加环腺苷酸产生,使肠粘膜细胞分泌亢进,引起腹泻;STa可激活回肠上皮细胞刷状缘绒毛上的鸟苷酸环化酶,增加环鸟苷酸的产生,引起分泌性腹泻。血清型O55的致病性大肠杆菌,其病原依靠黏附力,黏附于十二指肠道、空肠与回肠上段黏膜,破坏微绒毛刷状缘,引起幼龄动物、儿童腹泻,甚至死亡,死亡率高[2]。本研究鸽源O55分离株具有黏附素F5,且表达肠毒素STa、LT;F5主要定植于宿主空肠和回肠[32],STa的高分泌部位是空肠[33],在光学显微镜下,感染鼠肠道各段均呈现肠绒毛及肠黏膜的损伤和炎症反应,以空肠和回肠损伤严重。十二指肠在感染后的12~96 h呈现出程度不同的轻微损伤,绒毛断裂脱落,固有层炎性细胞增多;感染后12 h,空肠、回肠多处绒毛水肿,绒毛断裂、脱落,固有层血管充血出血,炎性细胞浸润,粘膜下层淋巴样小结增生,96 h回肠肠腺萎缩,间质增宽;感染后24~120 h的结肠黏膜下层出现粉红色絮状物及浸润的炎性细胞。空肠和回肠黏膜下层存在有丰富的淋巴集腺,当病原入侵该区域时,此处非特异性免疫现象较为强烈,炎性细胞所释放的致炎因子,一方面可杀伤入侵病原,另一方面也可造成该处组织细胞的损伤[31,34],各段肠组织结构的损伤,不仅影响食物的消化吸收,造成营养不良,也有助于肠致病菌穿越损伤的肠粘膜,并在宿主机体的内环境存活下来[3]。与王景[19]的研究相比,分离菌对机体空肠、回肠的损伤相符,符合产肠毒素大肠杆菌的致病特性,但本实验试验动物肠道的炎性反应更为剧烈,绒毛水肿和绒毛损伤更为严重,可能与O55血清型有关。
本研究分离得到的6株携带黏附素F5基因,肠毒素基因sta、lt的鸽源致病性大肠杆菌株毒力基因检测结果为fimH与papA均为100%(6/6),fyuA66.7%(4/6),eaeA与iss均为50%(3/6),irp-2、fimC与tsh均为33.3%(2/6),提示分离菌具有较强的致病性。O55分离株表达了黏附素F5,产生肠毒素STa、LT,符合产肠毒素大肠杆菌的判定标准。鸽源产肠毒素大肠杆菌O55分离株对试验鼠有致病性,可造成小鼠多个脏器的持续性损伤,以肝脏、肺脏、肾脏、空肠、回肠较为严重,抗原主要位于感染部位细胞质或细胞间质。
