盐麸子对细胞氧化损伤及3T3-L1细胞分化的影响
2020-11-12蔡圣宝张成庭胡小松易俊洁
蔡圣宝 张 璇 张成庭 胡小松 易俊洁*
(1 昆明理工大学农业与食品学院 昆明650500 2 中国农业大学食品科学与营养工程学院 北京100083)
多酚类化合物是指化学结构式中含有酚羟基的一类植物次级代谢产物的总称。多酚类物质包括酚酸类、黄酮类、鞣酸单宁类和花色苷类[1]。在植物体中多酚的存在状态主要有3 种:游离态多酚、酯化态多酚和结合态多酚[2]。游离态多酚中主要含有花色苷、原花青素和类黄酮类,酯化态多酚主要是酚酸类,结合态多酚则是与蛋白质、葡萄糖、纤维素和木质素等结合在一起的存在于植物初生壁和次生壁中[3]。研究表明多酚类物质具有多种生物活性,例如,具有很强的活性氧和氧自由基的清除能力[4],也具有抗菌、抗病毒和消炎的作用[5]。多酚类物质还具有抗肿瘤和抗癌变的作用[6],也可以降低心脑血管[7]和糖尿病等[8]疾病发生的可能性。
漆树科盐肤木属包含250 多个植物种类[9],主要分布于温带和热带地区,该属植物在中国主要分布在云南、四川和贵州等地,在国外,绝大多数的盐肤木属分布在北美地区以及太平洋地区[9]。大多数盐肤木属植物常被用作植物园林景观树种[10],除此之外,还有少部分被用来制作调味品[11]。盐肤木属植物适应性非常强,耐干旱瘠薄,生长快,不占用其它农作物用地[12],具有一定的经济价值和较好的开发前景。盐麸子是中国盐肤木(Rhus chinensis Mill.)的果实,富含油脂,可以用来榨油,2013年1月4日卫生部批准中国盐肤木的果油为新资源食品[13]。除此之外,盐麸子也常常被当地人用作酿醋的原材料。有研究表明盐麸子粕中含有13 种化合物,主要为槲皮素和原儿茶酸,其提取物能抑制PC12 细胞的凋亡[14]。段文昌[15]研究了盐肤木不同生产期的果实中黄酮类化合物及其抗氧化作用,结果显示,随着果实成熟度的增加,盐肤木果实中黄酮含量总体呈上升趋势且其对羟自由基和O2-自由基有一定的清除效果。本课题组前期研究发现,盐麸子3 种溶剂提取物和3 种状态多酚的提取物中主要组成成分为槲皮苷和杨梅苷[16-17],另外,盐麸子不同提取物还具有良好的DPPH 和ABTS 自由基清除能力以及抑制胰脂肪酶活性的作用。然而,对于这6 种提取物保护细胞免于H2O2损伤的作用以及抑制3T3-L1 前脂肪细胞分化的活性还未见报道。本文研究盐麸子的不同酚类物质对细胞氧化损伤的保护作用以及对前脂肪细胞3T3-L1-MBX 分化的抑制作用,以期为盐麸子的应用提供科学依据。
1 材料与方法
1.1 原料与试剂
成熟的盐麸子采摘于云南腾冲 (2017年11月),贮藏在-20 ℃;2',7'-二氯荧光黄双乙酸盐(DCFH-DA)、地塞米松、胰岛素、MTT、胰蛋白酶-EDTA 消化液、罗格列酮、青霉素-链霉素、多聚赖氨酸、3-异丁基-1-甲基黄嘌呤(IBMX)、油红O 染料,美国sigma-Aldrich 公司;凋亡试剂盒,北京四正柏公司;3T3-L1-MBX 前脂肪细胞,美国ATCC细胞库;胎牛血清、DMEM 高糖培养、磷酸盐缓冲溶液基,美国康宁公司;本研究中使用的所有标准品均购自成都曼斯特生物科技有限公司。所有其它化学品和溶剂均为分析纯级。
1.2 仪器与设备
Alpha 1-2 LD plus 冷冻干燥机,德国Christ公司;SpectraMax M5 多功能酶标仪,美国Molecular Devices 公司;Guava easyCyte 6-2L流式细胞仪,美国Millipore 公司;CCL-170B-8 CO2培养箱、AC2-6S1 Alrstream A2 生物安全柜,新加坡ESCO 公司。
1.3 试验方法
1.3.1 盐麸子3 种溶剂提取物和3 种状态多酚的提取 首先将盐麸子用冷冻干燥机冻干,再用高速打粉机将其粉碎,过60 目筛,备用。不同溶剂提取步骤如下:盐麸子粉(30 g)分别加入3 种提取溶剂(300 mL 80%甲醇、80%乙醇和80%丙酮)中,在25 ℃下,超声提取30 min 后过滤,收集滤液,相同的提取条件下重复提取2 次。收集的滤液用旋转蒸发器在40 ℃下浓缩,除去有机试剂。将浓缩液进行冷冻干燥后获得粉状提取物,并保存在-20℃待用。
3 种状态多酚的提取方法参考文献[18-19],并在此基础上稍加修改。以料液比1∶5 加入正己烷,在室温下振荡15 min,重复3 次,对样品进行脱脂处理。脱脂的盐麸子粉(30 g)中加入150 mL提取液(提取液为70%甲醇和70%丙酮按体积比1∶1 混合),于25 ℃条件下超声提取30 min,过滤并收集滤液,此过程重复2 次。采用旋转蒸发仪除去有机试剂,收集水相提取物,用于提取游离和酯化的馏分。游离态多酚的提取:采用6 mol/L 盐酸将水相提取物的pH 值调至2,用乙醚和乙酸乙酯体积比为1∶1 的混合液萃取,直至萃取液无色为止。将萃取液旋转蒸发并冻干,得到游离态多酚,存储在-20 ℃。酯化态多酚提取:在室温下,向剩余水相中以1∶1 的体积比加入4 mol/L NaOH,水解4 h,随后用6 mol/L 盐酸将pH 值调至2,剩余步骤与提取游离态多酚一致。结合态多酚提取:提取游离态多酚和酯化态多酚后,将剩余的固体残渣按料液比1∶1 加入4 mol/L NaOH 水解4 h,随后用6 mol/L 盐酸将pH 值调至2,其余步骤同游离态多酚。这6 种提取物的酚类物质组成及含量参考文献[16-17],主要组成成分为槲皮苷和杨梅苷。
1.3.2 盐麸子对H2O2诱导的HepG2 细胞内ROS水平的影响
1.3.2.1 H2O2浓度选择 用含有10%FBS 的DMEM 培养基培养HepG2 细胞,然后接种200 μL 浓度为1×104个/mL 的细胞于96 孔板中,在37 ℃,5%CO2培养箱中培养24 h,弃去培养基后加入不同浓度的H2O2培养6 h。采用MTT 法检测细胞存活率[20],即向96 孔板中加入100 μL 的MTT 溶液(0.5 mg/mL)再培养4 h,去除MTT 溶液后加入200 μL 的DMSO 溶液,振荡摇匀,于波长570 nm 处测定吸光值。
1.3.2.2 盐麸子对H2O2诱导的HepG2 细胞内ROS 水平的影响 ROS 检测方法参考文献[21],并稍加修改。预试验发现样品质量浓度为80 μg/mL 时,不存在细胞毒性,故在此质量浓度下进行细胞内ROS 含量的检测。加入2 mL 浓度为2×104个/mL 的细胞于6 孔板中培养24 h,并设立空白组、氧化损伤模型组、样品组和阳性对照组(VC)继续培养24 h (其中空白组和氧化损伤模型组只加入新鲜培养基)。24 h 后,弃掉培养基,空白组加新鲜培养基,其余组加入选定浓度的H2O2继续培养6 h。培养结束后用胰酶消化细胞,用含有10%FBS 的DMEM 培养基终止消化,并用PBS 清洗细胞。加入1 mL 的DCFH-DA(10 μmol/L)于培养箱中孵育20 min。孵育结束后用无血清培养基清洗掉多余探针,采用流式细胞仪检测各组细胞内的ROS 水平。
1.3.3 盐麸子抑制H2O2诱导的HepG2 细胞凋亡的检测 细胞凋亡检测参照文献[22]以及试剂盒说明书,操作步骤同ROS 测定步骤。首先用H2O2处理6 h,之后用离心管收集培养基,并用胰酶消化细胞,吸入离心管中,混合均匀,离心收集细胞。用400 μL 的1×结合缓冲液悬浮细胞,加入5 μL的Annexin V-FITC,避光反应15 min 后加入10 μL 的PI 染色液混匀,孵育5 min,用流式细胞仪检测各组的细胞凋亡水平。
1.3.4 盐麸子对3T3-L1-MBX 前脂肪细胞的作用
1.3.4.1 前脂肪细胞的诱导分化 取1.5 mL 2×104个/mL 活力很好的3T3-L1 MBX 前脂肪细胞,接于经多聚赖氨酸处理后的24 孔板中,放置培养箱培养2 d。当细胞长满后,继续培养2 d。向24 孔板中加入分化培养基(由1.0 μmol/L 的地塞米松,0.5 mmol/L 的IBMX,4 μg/mL 的胰岛素,2 μmol/L的罗格列酮溶液,90% DMEM 以及10% FBS 构成) 继续培养3 d,随后加入维持培养基培养4 d(由4 μg/mL 的 胰 岛 素,90% DMEM 以 及10%FBS 构成)。诱导分化期间每隔2 d 换1 次培养基。
1.3.4.2 盐麸子提取物抑制3T3-L1 MBX 前脂肪细胞分化 前期研究发现,盐麸子的3 种溶剂提取物和3 种状态多酚提取物中最主要的酚类成分为杨梅苷和槲皮苷,同时前期试验表明盐麸子3种溶剂提取物和3 种状态多酚提取物以及杨梅苷和槲皮苷在60 μg/mL 时,对3T3-L1-MBX 前脂肪细胞没有细胞毒性[16-17]。因此,将盐麸子的3 种溶剂提取物,3 种状态多酚提取物以及2 种主要酚类物质——杨梅苷和槲皮苷分别加入分化培养基以及维持培养基内,使得最终样品质量浓度均为60 μg/mL,并设立空白组 (只有含有10%FBS 的DMEM 培养基) 和对照组(不含样品的分化培养基)。培养11 d 后,用油红O 对细胞进行染色并观察脂肪细胞生长情况,最后用异丙醇对油红O 染料进行溶解,并在波长490 nm 下检测各组吸光值,计算各样品对抑制3T3-L1 MBX 前脂肪细胞分化的抑制率。
1.3.4.3 对诱导分化的脂肪细胞进行油红O 染色油红染色方法参考文献[23],并在此基础上稍加修改。细胞培养结束后,将细胞用PBS 缓冲溶液清洗2 次后加入10%的甲醛溶液在室温下将细胞固定30 min,采用PBS 缓冲溶液和纯水清洗3 遍,洗掉剩余的甲醛溶液。加入1.2 mg/mL 的油红O 染料(按水和异丙醇体积比4∶6 配制)在室温下染色10 min。染色结束后吸出多余油红O 液体,并用纯水清洗3 遍,在显微镜下观察脂肪细胞状态。
1.4 数据统计分析
所有数据以平均值±标准误差表示,每组试验做3 次平行。采用Tukey 单因素方差分析(P<0.05)。所有数据均用Origin 8.5 处理。
2 结果与分析
2.1 盐麸子对H2O2 诱导的HepG2 细胞内ROS水平的影响
2.1.1 H2O2浓度选择 不同浓度H2O2对细胞存活率影响的结果如图1所示。由图可知,随H2O2浓度逐渐增加,细胞存活率逐渐下降,均与空白组有显著差异(P<0.05)。根据文献[22]报道,当细胞存活率在50%左右时,氧化损伤模型构建效果较好。本研究中,当H2O2浓度在0.2~0.7 mmol/L 时,细胞存活率虽然在下降,但对细胞的损伤较轻,建模效果不好。当H2O2浓度为0.8~0.9 mmol/L 时,细胞存活率为55%左右,而且细胞存活率在此浓度范围内没有显著差异(P>0.05)。然而当H2O2浓度继续增大到1 mmol/L 时,细胞存活率下降到48%左右,因此,最终选定采用1 mmol/L 的H2O2用于细胞损伤。虽然也有文献报道[24]采用2 mmol/L 的H2O2,这可能是由于H2O2生产厂家批次以及细胞培养条件差异所致。
2.1.2 盐麸子对H2O2诱导HepG2 细胞内ROS 水平的影响 盐麸子不同提取物对H2O2诱导HepG2 细胞内ROS 水平的影响结果如图2、图3所示。由图可知,当用1 mmol/L 的H2O2诱 导HepG2 细胞后,细胞内ROS 含量与空白组相比显著增多(P<0.05)。将空白组细胞内的ROS 水平定为100%,经H2O2诱导过的HepG2 细胞内ROS 含量增至380%,增加了3.8 倍。经过5 μg/mL 的VC处理后的细胞内ROS 含量为210%,显著低于H2O2组(P<0.05)。另外,经过80 μg/mL 的盐麸子乙醇提取物、甲醇提取物、丙酮提取物以及游离态多酚处理后的细胞内ROS 含量显著低于H2O2组(P<0.05),与空白组ROS 含量基本相当,并且这4 种提取物处理后的细胞内ROS 含量之间也没有显著性差异(P>0.05)。同样经过80 μg/mL 盐麸子的酯化态多酚和结合态多酚处理后的细胞内ROS 含量显著低于H2O2组(P<0.05),然而相比上述4 种提取物,酯化态多酚和结合态多酚对细胞内ROS 产生的抑制作用较弱,其含量分别为260%和350%。有研究报道,苦菊提取物也对H2O2诱导HepG2 细胞的氧化损伤引起的ROS 增高有改善作用[25],然而保护作用最好的情况下,所用苦菊提取物的质量浓度为100 μg/mL,高于本试验所用质量浓度。

图2 盐麸子的6 种提取物对H2O2 诱导HepG2 细胞内ROS 水平的影响Fig.2 The effects of six extracts of Rhus chinensis Mill.fruits on ROS level in the H2O2-induced HepG2
2.2 盐麸子对H2O2 诱导的HepG2 细胞凋亡率的影响
盐麸子对H2O2诱导HepG2 细胞凋亡的结果如图4、图5所示。由于在正常生长过程中也会有细胞凋亡,故空白组细胞的凋亡率为5.95%。当HepG2 细胞经H2O2处理后,细胞凋亡率为空白对照组的3 倍(P<0.05),并且由流式图可知,H2O2诱导HepG2 细胞凋亡主要为中晚期凋亡。与氧化损伤模型组相比,阳性对照VC 对H2O2诱导HepG2 细胞凋亡没有显著的保护作用,其细胞凋亡率同氧化损伤模型组没有显著性差异(P>0.05),并且VC 组细胞凋亡主要发生在早期凋亡。经过盐麸子80 μg/mL 乙醇提取物、甲醇提取物、丙酮提取物和游离态多酚处理,可以显著抑制H2O2诱导HepG2 细胞的凋亡(P<0.05),并且这4 种提取物的抑制作用效果无显著性差异 (P>0.05)。同时,80 μg/mL 的酯化态多酚和结合态多酚也能够显著抑制H2O2诱导HepG2 细胞的凋亡,并且酯化态多酚的作用要强于结合态多酚,然而与上述4种提取物相比,其抑制凋亡作用较弱(P<0.05)。有研究表明[22],紫米多酚提取物在100 μg/mL 时能显著抑制H2O2诱导的细胞凋亡,凋亡率减少了3 倍,而盐麸子乙醇提取物、甲醇提取物、丙酮提取物和游离态多酚在80 μg/mL 时,也能显著抑制H2O2诱导HepG2 细胞的凋亡(P<0.05)。除此之外,盐麸子的6 种提取物对H2O2诱导HepG2 细胞凋亡抑制作用的趋势同其对H2O2诱导HepG2 细胞内ROS 产生的抑制作用趋势相同,表明盐麸子不同提取物可能是通过减少细胞内的ROS 生成,从而减少细胞的凋亡,由这些结果可以说明盐麸子对H2O2诱导HepG2 细胞的氧化损伤具有较强的保护作用。因此,盐麸子可以作为很好的天然抗氧化剂进一步开发,应用于食品和保健行业。
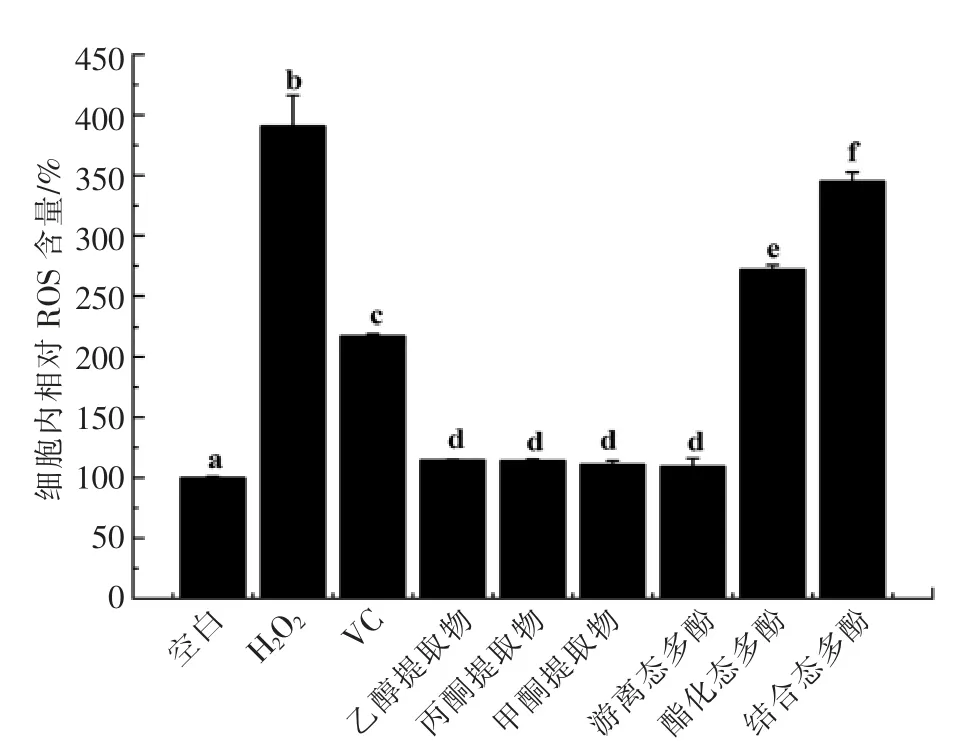
图3 盐麸子的6 种提取物(80 μg/mL)对H2O2(1 mmol/L)诱导HepG2 细胞内ROS 水平的影响Fig.3 The effects of six extracts of Rhus chinensis Mill.fruits (80 μg /mL) on ROS level in the H2O2-induced (1 mmol/L) HepG2

图4 盐麸子的6 种提取物(80 μg/mL)对H2O2 诱导的HepG2 细胞凋亡的影响Fig.4 The effects of six extracts of Rhus chinensis Mill.fruits (80 μg/mL) on the apoptosis in the H2O2-induced HepG2

图5 盐麸子6 种提取物(80 μg/mL)对H2O2(1 mmol/L)诱导HepG2 细胞凋亡的影响Fig.5 The effects of six extracts of Rhus chinensis Mill.fruits (80 μg/mL) on the apoptosis in the H2O2-induced (1 mmol/L) HepG2
2.3 盐麸子对3T3-L1 MBX 前脂肪细胞分化的作用
盐麸子不同提取物及杨梅苷和槲皮苷对3T3-L1 MBX 前脂肪细胞分化的作用如图6所示。由图6可知,空白组的细胞基本没有分化成脂肪细胞,而加了诱导分化液的对照组的3T3-L1 MBX前脂肪细胞很大一部分细胞都分化成了脂肪细胞,经过油红O 染色后显示为红色。甲醇提取物、乙醇提取物、丙酮提取物和游离态多酚处理后细胞分化率显著降低。另外,相较于对照组来说,槲皮苷和结合态多酚对3T3-L1 MBX 的分化也有一定的抑制作用,然而与上述4 种提取物相比,其抑制作用较弱。酯化态多酚和杨梅苷对3T3-L1 MBX 前脂肪细胞的分化基本没有抑制作用。

图6 盐麸子6 种提取物及杨梅苷和槲皮苷(60 μg/mL)对3T3-L1 MBX 前脂肪细胞分化的影响(100×)Fig.6 The effects of six extracts of Rhus chinensis Mill.fruits,myricitrin and quercitrin (60 μg/mL)on differentiation of 3T3-L1 preadipocytes (100×)
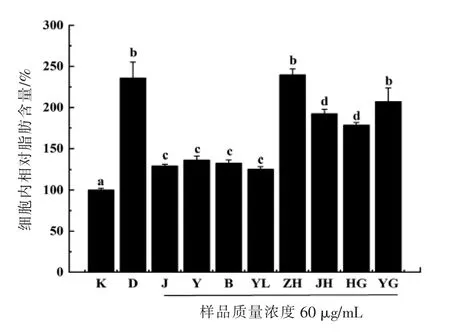
图7 分化的脂肪细胞的相对脂肪含量Fig.7 The relative fat content of differentiated adipocytes
利用异丙醇将细胞内的油红O 溶解后,在波长490 nm 处测定吸光值,进一步确定各样品对3T3-L1 MBX 前脂肪细胞分化的抑制作用。将空白组的脂肪含量设为100%,检测各样品处理后的试验组分化细胞的相对脂肪含量,其结果如图7所示。对照组的相对脂肪含量比空白组增加了约2.7 倍。而甲醇提取物、乙醇提取物、丙酮提取物和游离态多酚试验组之间,相对脂肪含量没有显著性差异(P>0.05),含量约为空白组的1.25 倍,与对照组相比含量显著下降(P<0.05)。结合态多酚和槲皮苷试验组细胞中脂肪含量同空白组相比,存在显著性差异(P<0.05),含量约为空白组的2倍,均显著低于对照组(P<0.05)。而酯化态多酚和杨梅苷试验组的相对脂肪含量,同对照组相比没有显著性差异 (P>0.05),与图6观察结果一致。结合图6和图7可知,甲醇提取物、乙醇提取物、丙酮提取物和游离态多酚试验组具有较好抑制3T3-L1 MBX 前脂肪细胞分化的作用,而槲皮苷和杨梅苷对其抑制作用较弱。因此,推测提取物中可能存在其它对3T3-L1 MBX 分化存在抑制作用的活性物质,也有可能是提取物中多种物质协同作用,从而发挥出抑制3T3-L1 MBX 前脂肪细胞分化的效果,这些推测需要后续试验进一步证实。
3 结论
本文以盐麸子为原料,采用3 种溶剂(80%甲醇、80%乙醇和80%丙酮) 对其多酚组分进行提取,并提取了盐麸子中的游离态多酚、酯化态多酚和结合态多酚,系统地探讨了盐麸子不同酚类提取物对细胞氧化损伤的保护作用以及抑制3T3-L1MBX 前脂肪细胞分化的活性。结果表明,盐麸子的3 种溶剂提取物对H2O2诱导的HepG2 细胞氧化损伤具有良好的保护作用,能显著降低细胞内的ROS 含量,减少细胞凋亡,并且这3 种提取物之间没有显著性差异(P>0.05)。盐麸子的3 种状态多酚提取物中,游离态多酚对HepG2 诱导的细胞氧化损伤的保护作用最强,其次是酯化态多酚,最后是结合态多酚。盐麸子的甲醇提取物、乙醇提取物、丙酮提取物和游离态多酚在60 μg/mL时具有较强的抑制3T3-L1 MBX 前脂肪细胞分化的作用,而盐麸子的结合态多酚以及主要多酚槲皮苷对3T3-L1 MBX 前脂肪细胞分化的抑制作用较弱,酯化态多酚和杨梅苷几乎没有抑制作用。综上所述,盐麸子不同酚类提取物具有较好的生物活性,可进行进一步的研究和开发利用。
