藻蓝色素蛋白下调RIPK1表达并抑制肺癌A549细胞的增殖和迁移
2020-11-12吴婷婷王成涛
李 爽 郝 帅 王 静 闫 燕 赵 磊 吴婷婷 王成涛
(北京食品营养与人类健康高精尖创新中心 北京市食品添加剂工程技术研究中心 北京100048)
肺癌是目前全球发病率和死亡率非常高的恶性肿瘤,已经成为危害我国居民健康最主要的恶性肿瘤之一[1]。肺癌可分为非小细胞肺癌(Nonsmall cell carcinoma,NSCLC)和小细胞肺癌(Small cell carcinoma,SCLC),其中非小细胞肺癌最常见,约占肺癌发病率的85%,严重危害国民健康[2]。天然活性抗肿瘤物质有毒性低,活性高等优点,是抗肿瘤研究的热点之一。深入探究其作用机理能够为肿瘤的靶向治疗奠定基础。
藻蓝蛋白(C-phycocyanin,C-PC)是一种存在于蓝藻、红藻等藻类中的天然活性物质,在螺旋藻中含量较高[3],是藻胆蛋白的重要组成部分。它由脱辅基蛋白亚基(α,β)和藻蓝素辅基结合形成,以完整的六聚体结构存在于细胞内,担任能量的传递和贮存功能[4-5]。藻蓝蛋白作为天然蓝色色素蛋白,具有优良的抗氧化[6],抗炎等活性[7],能有效预防和治疗多种疾病,已被列为我国允许使用的天然食品着色剂[8]。此外,藻蓝色素蛋白在抗肿瘤方面优势明显。相关研究表明藻蓝色素蛋白对肝癌、乳腺癌、结肠癌、卵巢癌、宫颈癌、喉癌以及胰腺癌均有不同的抑制作用[9-15]。本研究以非小细胞肺癌A549 为模型,探究藻蓝蛋白对肺癌增殖机制的影响。
RNA 干扰(RNA interfering,RNAi)是由与靶基因序列同源的双链RNA (Double-stranded RNA,dsRNA)引发的,广泛存在于生物体内的序列特异性基因转录后的沉默过程[16]。RNAi 技术因操作简单,特异性强,高效性等特点,而被广泛应用于药物靶基因的筛选、肿瘤治疗等领域[16]。Zou等[17]将外源性小干扰RNA(Small interfering RNA,siRNA)转染入肺癌细胞株H1975 中,抑制Bcl-2 表达,从而诱导肺癌细胞凋亡。Zhang 等[18]利用RNAi 技术,转染MTA1 siRNA 进入喉癌细胞株HEP-2,证实了MTA1 可促进HEP-2 细胞的侵袭、黏附和迁移行为。Ying 等[19]设计了MTA1 siRNA,沉默鼻咽癌细胞株C666-1 潜伏膜联蛋白2A 基因,使细胞周期阻滞在G0/G1 期,抑制细胞增殖。本研究采用高通量转录组学测序技术,对藻蓝蛋白参与调控抑制肺癌细胞增殖的相关靶点进行筛选,获得一个潜在的调控基因RIPK1,并利用RNAi 技术特异性地沉默RIPK1 的表达,验证藻蓝蛋白是否通过下调RIPK1 抑制A549 细胞的增殖和迁移。本研究结果为抗癌天然功能性物质的开发利用奠定坚实的理论基础,同时为人类肿瘤治疗提供新颖的解决方案。
1 材料与方法
1.1 材料与试剂
RIPK1-siRNA、阴性对照siRNA,上海吉玛制药技术有限公司;阳离子脂质体转染试剂Lipofectamine 3000,美国Invitrogen 公司;藻蓝蛋白由内蒙古农业大学惠赠;1%青霉素-链霉素、吉姆萨染液,美国Corning 公司;DMEM 细胞培养基、Opti-MEM 减血清培养基、培养皿、96 孔板、6 孔板,美国Gibco 公司;胎牛血清,天津康源生物技术公司;FastQuant cDNA 第一链合成试剂盒、SuperReal 荧光定量预混试剂增强版,天根生物技术(北京) 有限公司;Mouse anti-β-Actin,Rabbit anti-RIPK1,Rabbit anti-MMP2,美国Cell Signaling Technology 公司;RIPA 细胞裂解液、PMSF 蛋白酶抑制剂,北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
BioSpectrum 凝胶成像仪,美国UVP 公司;超净工作台,上海博迅医疗生物仪器股份有限公司;漩涡振荡器,德国IKA 公司;BSA224S 型数字电子天平,德国Sartorius 公司;CFX96 Touch qPCR 检测系统,美国Bio-Rad 公司;SpectraMax i3 连续波长多功能酶标仪,美国MD 公司;流式细胞仪FACSJAZZ,美国BD 公司;恒温CO2细胞培养箱,德国Heraeus 公司。
1.3 试验方法
1.3.1 细胞培养 人类非小细胞肺癌A549 细胞培养于T 25 的培养瓶,培养基为10%胎牛血清、1%青霉素-链霉素双抗DMEM 培养基。培养条件为37 ℃,5%CO2。
1.3.2 细胞转染 经预试验采用100 nmol/L 浓度转染细胞,首先用DEPC 水将RIPK1-siRNA,阴性对照siRNA 提前配制成浓度为20 μmol/L 的储存液备用。提前1 d 将细胞均匀的铺在96 孔板、6 孔板、60 mm 的培养皿中,确保第2 天转染时细胞的汇合度为70%,转染时先将RIPK1 siRNA,阴性对照溶于Opti-MEM 减血清培养基中,同样将阳离子脂质体转染试剂Lipofectamine 3000 溶于Opti-MEM 减血清培养基中,将二者轻柔混匀室温孵育10 min,将转染复合物均匀滴加在细胞中,培养箱中培养12 h 换液,48~72 h 后做相关试验。
1.3.3 MTT 法检测肺癌A549 细胞体外生长情况收集对数生长期的细胞,血球计数板计数后以每孔5 000 个的细胞量铺于96 孔板中,细胞贴壁生长后添加4.8 μmol/L 纯品藻蓝蛋白,并加入10 μL MTT,4~6 h 后加入SDS-HCl 裂解液,12 h 后测定波长570 nm 处的吸光值。连续测定5~6 d,记录数据。
将转染RIPK1 siRNA,阴性对照的细胞培养24 h,胰酶消化后同样以每孔5 000 个细胞量均匀铺于96 孔板中,待细胞贴壁后加入混有10 μL MTT 的培养基,4~6 h 后加入100 μL SDS-HCl 裂解液,12~16 h 后测定波长570 nm 处吸光值。同样操作连续测定5~6 d,记录试验数据并绘制细胞生长曲线。
1.3.4 克隆形成试验检测肺癌A549 细胞的集落形成能力 将处于对数生长期的细胞铺到6 孔板中,每孔细胞数为200 个,待24 h 细胞贴壁生长后,加入浓度为4.8 μmol/L 的纯品藻蓝蛋白的全培养基培养1~3 周,当克隆数约50 个时,使用吉姆萨染液对集落染色,统计细胞克隆数。
同样,将转染RIPK1 siRNA,阴性对照24 h后的细胞按以上操作处理。
1.3.5 流式细胞术检测肺癌A549 细胞周期 收集转染48 h 的A549 细胞,200 μL PBS 重悬细胞,用1 mL 注射器将细胞均匀缓慢的打到4 ℃预冷的70%酒精中,尽量使细胞单个分散,4 ℃固定24 h 以上。收集固定的细胞,用4 ℃预冷的PBS 洗细胞2 次,洗净残留的70%酒精,在每个样品中添加终质量浓度为50 μg/mL 的RNase,37 ℃消化40 min,加入碘化丙啶(PI)于4 ℃避光染色30 min 后上机检测。
1.3.6 划痕试验检测A549 细胞迁移情况 转染待细胞汇合度达到100%后用蓝枪头划出划痕,培养基洗去细胞碎片,于24 h 和48 h 分别对同一位置拍照,并计算迁移率。
1.3.7 荧光定量PCR 检测相关基因mRNA 表达水平 收集用于试验的细胞,利用Trizol 法提取细胞总RNA。根据试剂盒反转录为cDNA。荧光定量PCR 采用3 步法,扩增引物序列如下表1所示。

表1 qRT-PCR 引物序列Table 1 The primer sequences of qRT-PCR
1.3.8 免疫印迹试验检测蛋白质的表达水平 收集藻蓝蛋白处理的细胞和转染48 h 的细胞,利用RIPA 裂解液提取细胞全蛋白,Bradford 法测定蛋白质浓度。将提取的蛋白中加入6×蛋白质上样缓冲液,煮10 min 后吹打混匀,经SDS-PAGE 电泳、转膜、封闭、一抗孵育过夜、二抗孵育等操作后,利用发光液显色,带有目的条带的胶片经洗片机显影定影后,经扫描仪扫描拍照保存。
2 结果与分析
2.1 藻蓝蛋白对A549 细胞的体外增殖能力的影响
图1为4.8 μmol/L 的藻蓝蛋白处理A549 细胞后的细胞生长曲线,由图1可以看出,试验组从第2 天开始生长速率降低,第4 天以后生长速率受到显著抑制。以上结果表明,藻蓝蛋白对肺癌A549 细胞的生长在一定程度上有抑制作用。
2.2 藻蓝蛋白对A549 细胞集落形成能力的影响
为了探究藻蓝蛋白对肺癌A549 细胞的克隆形成能力的影响,将4.8 μmol/L 的藻蓝蛋白处理的细胞接种到6 孔板中培养2~3 周,观察集落形成情况,图2显示,高浓度的藻蓝蛋白处理细胞后,细胞的集落数减少,克隆形成能力变弱。以上结果可以表明藻蓝蛋白抑制了细胞的集落形成能力。

图1 藻蓝蛋白对A549 细胞的体外增殖能力的影响Fig.1 The effects of C-phycocyanin on the in vitro enhancement of A549 cells
2.3 藻蓝蛋白对A549 细胞体外迁移能力的影响
划痕试验结果如图3a所示,4.8 μmol/L 剂量的藻蓝蛋白作用于肺癌A549 细胞使其体外迁移能力减弱,显微镜拍照划痕结果可知试验组在划痕24,48 h 后向划痕中央迁移的距离大于对照组,经统计,迁移率如图3b所示,迁移率显著减小。以上说明藻蓝蛋白能抑制肺癌A549 细胞的体外迁移能力。

图2 藻蓝蛋白对A549 细胞集落形成能力的影响Fig.2 The effects of C-phycocyanin on colony forming ability of A549 cells

图3 藻蓝蛋白对A549 细胞的体外迁移能力的影响Fig.3 The effects of C-phycocyanin on the migration in vitro of A549 cells
2.4 通过转录组学的测序分析筛选得到RIPK1差异基因
为了进一步探究藻蓝蛋白影响A549 细胞的调控机制,采用高通量转录组技术对藻蓝蛋白处理前后的细胞进行了差异基因的筛选,共筛选出了2 970 个差异表达基因 (其中1 539 个上调基因,1 431 个下调基因)。随后对差异基因进行了KEGG 通路富集分析。图4显示,与肿瘤细胞增殖以及肿瘤发生相关的TNF,NF-κB,Wnt 等多种信号通路均有显著富集,进一步提示藻蓝蛋白抑制肺癌A549 细胞的增殖的机制可能与抑制这些信号通路活性相关。
本文筛选了与NF-κB 信号通路相关的差异表达基因,其中包括可能调控NF-κB 的关键上游基因受体相互作用蛋白激酶1(Receptor interacting proteinkinase1,RIPK1),转录组分析结果显示RIPK1 在藻蓝蛋白处理后出现显著下调,推测藻蓝蛋白能够通过下调RIPK1 的表达而抑制A549细胞增殖。
2.5 检测转染小干扰RNA 沉默RIPK1 沉默效率
采用RNAi 技术特异性沉默RIPK1 的表达,观察RIPK1 沉默后肺癌A549 细胞增殖和体外迁移能力。图5显示了荧光定量PCR、免疫印迹法验证RIPK1 的沉默效果,由图5可知,siRNA 的转染使A549 细胞RIPK1 的基因及蛋白表达水平均受到明显抑制,以上结果可以充分说明所设计的siRNA 能有效沉默RIPK1,可以进行后续试验。

图4 差异表达基因KEGG 富集柱状图Fig.4 Enrichment histogram of KEGG differentially expressed gene

图5 转染小干扰RNA 沉默RIPK1 检测沉默效率Fig.5 The silencing efficiency was detected by the small interfering RNA silencing RIPK1
2.6 沉默RIPK1 对A549 细胞体外增殖能力的影响
接下来对沉默RIPK1 后的细胞表型进行了探究。图6显示了A549 细胞转染RIPK1 siRNA,Neg.siRNA 后的生长曲线。结果表明,从转染后的第1 天开始试验组细胞的生长就受到抑制,并且随着时间增加,抑制效果更加明显。以上结果初步证实了沉默RIPK1 的表达可抑制A549 细胞的生长。
2.7 沉默RIPK1 对A549 细胞集落形成能力的影响

图6 沉默RIPK1 对A549 细胞体外增殖能力的影响Fig.6 The effects of silencing RIPK1 on the in vitro proliferation of A549 cells
为了验证RIPK1 对A549 细胞的集落形成能力的影响,将转染的细胞进行克隆形成试验。由图7可知,沉默RIPK1 组细胞克隆形成数显著减少,表明肺癌A549 细胞的集落形成能力减弱,提示沉默RIPK1 降低了肺癌A549 细胞的独立生存能力,该结果与藻蓝蛋白处理结果一致,进一步说明藻蓝蛋白能够通过下调RIPK1 的表达抑制A549细胞的增殖。

图7 沉默RIPK1 对A549 细胞集落形成能力的影响Fig.7 The effects of silencing RIPK1 on colony forming ability of A549 cells
2.8 沉默RIPK1 对A549 细胞周期分布的影响
由细胞的生长和集落形成能力相关试验可知,沉默RIPK1 对细胞的增殖有一定抑制作用。实验室前期研究结果表明,藻蓝蛋白能够使A549细胞阻滞在G1 期,从而无法正常合成DNA,抑制细胞增殖[4]。为了进一步探究沉默RIPK1 后对肺癌A549 细胞周期分布的影响,采用流式细胞术测定细胞内DNA 含量,并对细胞周期进行分析。图8显示,与对照组相比,RIPK1 沉默后,细胞G1 期所占的比例显著增加,细胞周期被阻滞在了G1期。这与藻蓝蛋白处理A549 细胞的结果一致。
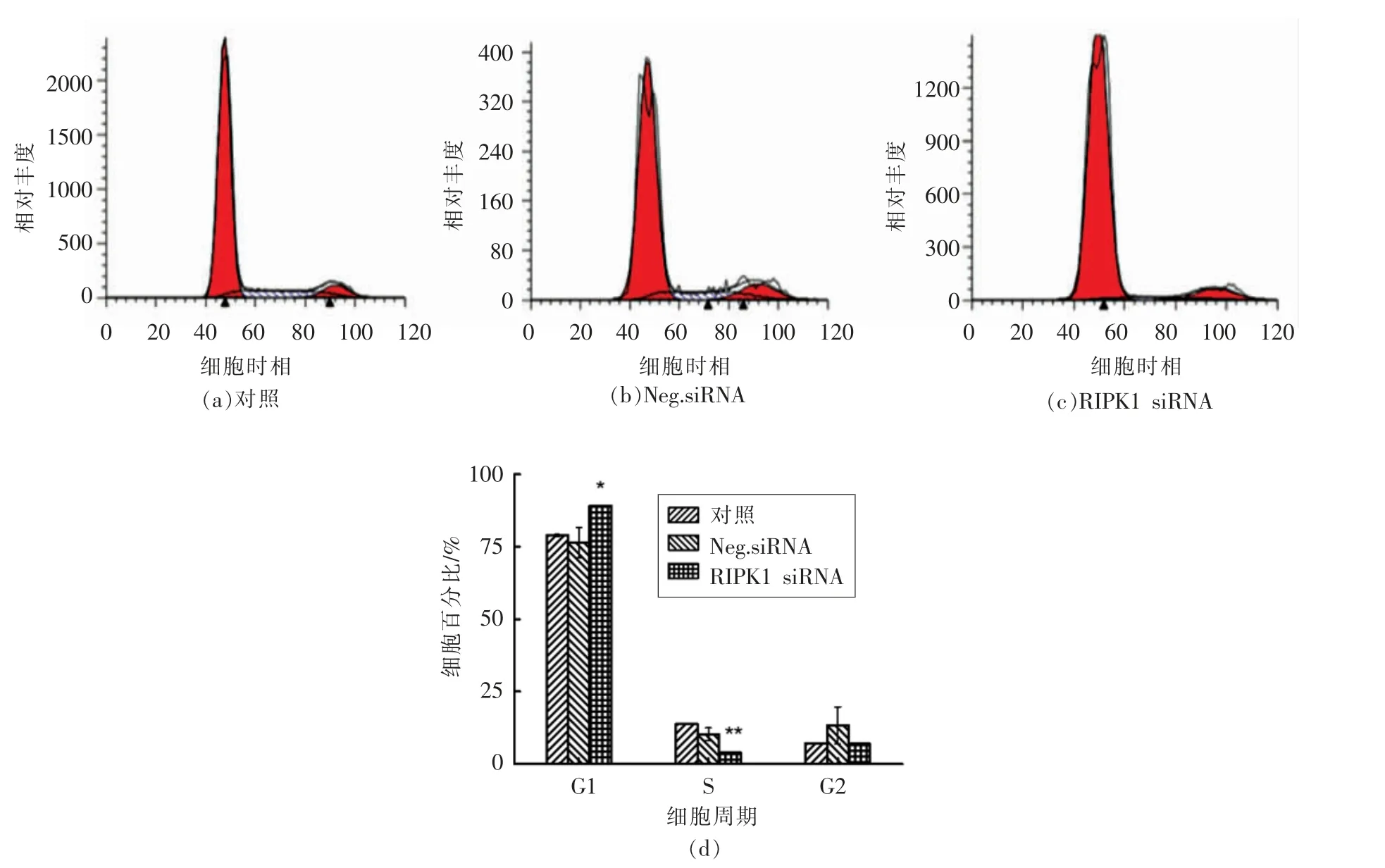
图8 沉默RIPK1 对A549 细胞周期分布的影响Fig.8 The effects of silencing RIPK1 on the cycle distribution of A549 cells
细胞周期的每一个阶段都受到一个保守的血清素/苏氨酸蛋白激酶家族的CDKs 和周期蛋白家族Cyclin 的严格调控,CDKs-cyclin 复合体是细胞周期进程的中心调控因子,CyclinE-CDK2 复合体能调节晚期G1 期和早期S 阶段DNA 合成的诱导,对细胞G1/S 转换至关重要。随着细胞周期的发展,CyclinA 取代了CyclinE 与CDK2 形成复合体,然后在S 期控制DNA 合成和复制。同时周期抑制因子P27 作用于CDK2,共同调控细胞周期[20-23]。图9为荧光定量PCR 检测周期基因表达图,结果显示,沉默RIPK1 后,CyclinA,CyclinE,CDK2 表达下调显著,同时周期抑制因子P27 表达上调,表明藻蓝蛋白可以通过下调RIPK1 表达而抑制肺癌A549 细胞的增殖。
2.9 沉默RIPK1 对A549 细胞体外迁移能力的影响

图9 A549 细胞沉默RIPK1 对周期相关基因表达水平的影响Fig.9 The effects of silencing RIPK1 on the expression level of cyclone-related genes of A549 cells
将A549 细胞铺在6 孔板中过夜培养,第2 天当细胞汇合度达到70%时进行细胞转染,培养至细胞汇合度为100%时,划出划痕,如图10a,对划痕同一位置分别在24,48,72 h 拍照,观察划痕宽度变化,结果显示,转染RIPK1 siRNA 组划痕宽度大于2 个对照组,即试验组迁移率显著小于对照组(图10b)。

图10 沉默RIPK1 对A549 细胞的体外迁移能力的影响Fig.10 The effects of silencing RIPK1 on the migration in vitro of A549 cells
采用免疫印迹试验进一步验证A549 细胞迁移能力。显示沉默RIPK1 使细胞MMP2 蛋白表达水平下调,表明沉默RIPK1 可抑制A549细胞的体外迁移能力。
3 讨论与结论

图11 A549 细胞沉默RIPK1 对迁移蛋白表达水平的影响Fig.11 The effect of silencing RIPK1 on the expression level of migration of protein of A549 cells
本文以非小细胞肺癌A549 细胞系为模型,探究藻蓝蛋白抗肺癌增殖的机制。首先采用4.8 μmol/L 剂量的藻蓝蛋白处理A549 细胞,结果显示藻蓝蛋白能显著降低细胞存活率和生长速率,降低细胞克隆形成能力和细胞体外迁移能力。为了进一步研究藻蓝蛋白调控细胞增殖的机制,采用高通量测序技术,对藻蓝色素蛋白处理前后的A549 细胞进行转录组差异分析,发现所涉及的基因主要参与细胞增殖、迁移、凋亡过程,尤其是与NF-κB 信号通路相关,并成功筛选出差异基因受体相互作用蛋白激酶1,利用RNAi 技术沉默RIPK1,在转录水平和蛋白水平上检测沉默效果。与转染Neg.siRNA 组相比,基因表达量下调到0.28,免疫印迹结果也显示蛋白表达显著下调。转染细胞的生长曲线、细胞周期以及划痕迁移率试验的结果显示,沉默RIPK1 后,细胞生长速率显著降低,集落形成能力减弱,细胞周期阻滞在G1期,体外迁移能力减弱,与藻蓝蛋白处理A549 细胞的表型相同。因此,本研究表明藻蓝色素蛋白能够通过下调RIPK1 表达抑制非小细胞肺癌A549的增殖,为进一步揭示藻蓝色素蛋白抗肺癌细胞增殖的机制奠定了基础。
