紫苏迷迭香酸的提取工艺及质谱鉴定
2020-10-22张锦华张敏范三红
张锦华,张敏,范三红*
(1.山西大学 生命科学学院,太原 030006;2.特色植物资源研究与利用山西省重点实验室(山西大学),太原 030006)
紫苏是一种既可以做药材又可以做食材的植物,有紫绿色的茎和叶,其花朵比较大,为粉白色。紫苏的适应性很强,一般在野地、荒山、河边、树下都能看见它的身影[1]。在中国,紫苏最早是作为中药用于治疗感冒风寒,这是因为紫苏性温,古人均用其叶晒干以热水冲泡来驱寒;而如今紫苏的营养被大众所知,人们用紫苏来烹制菜肴、做调味剂;紫苏籽也可以经过专业的加工制成食用油,除此之外,紫苏中的一些多酚物质如迷迭香酸可以制成香料用于化妆品中[2]。
迷迭香酸(rosemary acid,RosA)是一种水溶性的酚酸类化合物,分子式为C18H16O8,分子量为360.33,稳定性较好[3]。研究发现紫苏花、叶、杆、籽中都有迷迭香酸的存在,其中花和叶中含量较多,紫苏粕中也有迷迭香酸。迷迭香酸含量会因紫苏的品种及采收期不同而不同,黄亮辉等人研究了不同采收期的紫苏叶和白苏叶中迷迭香酸的含量,结果发现双紫苏叶、单紫苏叶和白苏叶的最佳采收期均为8月份[4]。迷迭香酸也可以通过植物组织培养来生产,培养液中各种因素(糖浓度、溶氧量、NH4NO3、KNO3)对迷迭香酸含量的影响,国内外也做了大量的研究。随着对迷迭香酸的深入研究发现,RosA不仅具有超强的抗氧化性及抑菌性[5],它还可以通过提高黑色素的含量和促进酪氨酸酶的表达来抑制光致癌[6]。除此之外,它还有提高机体免疫力、保护神经元细胞[7]、抑制病理血管的生成等生理功能。
提取迷迭香酸的方法有很多,如超声波提取法、酶辅助超声提取法、有机溶剂提取法和热水提取法等,黄丹丹等用酶辅助超声提取贵州地区紫苏迷迭香酸,在最佳提取条件下,得到1.426 mg/g的迷迭香酸,而只用纤维素酶来提取紫苏迷迭香酸,在优化条件下得到6.17 mg/g迷迭香酸[8],此法虽然提高了迷迭香酸的得率,但纤维素酶水解纤维素产生了单糖或寡糖,引入了太多杂质,为后期纯化迷迭香酸增加了一定的难度。梅喜刚等人用硫酸提取紫苏粕中的迷迭香酸,最终得到(0.541±0.02) mg/g的迷迭香酸[9],周平等人用乙醇来提取青岛地区紫苏迷迭香酸,在最佳工艺下迷迭香酸含量为10.061 mg/g[10],研究发酵和发芽对迷迭香酸的影响很少,但余茜等用NaCl-CaCl2处理大豆,可以使大豆中的酚类物质实现富集[11];程磊等人用酵母菌发酵生产赤藓糖醇,提高了赤藓糖醇的产量[12]。
本研究分析了单面红紫苏、双面红紫苏、紫苏3号中迷迭香酸的分布和含量,并对其提取工艺进行了优化;进一步研究了在发酵和发芽条件下紫苏迷迭香酸含量的变化情况,为后期迷迭香酸的提取以及综合利用提供了理论支持。
1 材料与方法
1.1 材料与仪器
单面红、双面红、紫苏3号:来自山西省百草盛生物科技有限公司;迷迭香酸标品:白色结晶粉末,纯度为99.46%,来自上海融禾医药科技发展有限公司;发酵用培养基:蒸馏水30 mL、无水葡萄糖0.67 g、磷酸二氢钾0.03 g、七水合硫酸镁0.05 g、氯化钠0.01 g、硫酸铵0.17 g。
DZKM-D-2数显恒温水浴锅 天津市大港区红衫实验设备厂;Agilent Tecnnologies 126 InfinityⅡ高效液相色谱仪 安捷伦科技有限公司;HRHPY-300恒温培养摇床 青岛海尔特种电冰柜有限公司。
1.2 试验方法
1.2.1 RosA的提取
单面红、双面红和紫苏3号 3种不同品种紫苏的叶、茎、籽经粉碎后过20目的筛子,取1 g原料用于提取,以料液比为1∶50(W/V)加入50%的乙醇溶液,然后在65 ℃水浴锅中加热35 min,抽滤,抽滤后的残渣再提取一次,把两次的滤液合并后用蒸发仪旋出滤液中的乙醇,用20%的盐酸调节其pH 为2.0~2.5,最后用料液比为5∶3(V/V)的乙酸乙酯萃取3次,旋干萃取液,用2 mL甲醇溶解后过0.22 μm的有机滤膜待用。
1.2.2 RosA的测定与得率的计算
RosA含量用HPLC测定,色谱条件:色谱柱为Agilent TC-C18柱(4.6 mm×250 mm,5 μm);检测波长:330 nm;柱温:30 ℃;流动相:乙腈∶0.1%磷酸为30∶70,流速为1.0 mL/min。
标准曲线的绘制:将迷迭香酸标品配制成1 mg/mL浓度,从配制好的标品溶液中分别吸取0.02,0.04,0.06,0.08,0.1 mL置于1 mL甲醇中,将其配制成20,40,60,80,100 μg/mL系列标准溶液[13]。采用高效液相色谱法测定,纵坐标(Y)用峰面积表示,横坐标(X)用系列标准溶液浓度表示。RosA得率如下:
式中:ρ为提取液中RosA的质量浓度,mg/mL;V为甲醇的体积,mL; m为紫苏质量,g。
1.2.3 HPLC-MS对RosA的鉴定
将提取液中迷迭香酸用HPLC-MS技术进行质谱鉴定,参考文献[14],迷迭香酸测定的HPLC条件:采用WATERS BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,检测波长为330 nm,柱温40 ℃,进样量20 μL,流速0.20 mL/min,流动相为0.1%甲酸和乙腈,按照以下流程洗脱:初始流动相为5%乙腈,维持3 min后线性变化为30%乙腈,维持7 min后又变为80%乙腈,2 min后变为95%乙腈,0.5 min后回到初始流动相。质谱条件:所有的气体均采用氮气,离子源(HESI),喷雾电压:2.5 kV;毛细管温度:320 ℃;探针加热器温度:300 ℃,负离子扫描,扫描范围100~1500 m/z[15,16]。
1.2.4 RosA提取优化工艺
1.2.4.1 单因素试验
选取单面红紫苏叶做工艺优化,将原料粉碎后过20目筛子,称取1 g用于单因素试验,固定乙醇浓度50%,加热时间30 min,温度60 ℃,考察料液比为1∶20、1∶30、1∶40、1∶50、1∶60(W/V)迷迭香酸的得率。固定料液比为1∶50(W/V),加热时间30 min,温度60 ℃,考察30%、40%、50%、60%、70%乙醇的迷迭香酸得率。固定料液比为1∶50(W/V),乙醇浓度40%,温度60 ℃,考察加热时间20,25,30,35,40 min的迷迭香酸得率。固定料液比为1∶50(W/V),乙醇浓度40%,加热时间35 min,考察温度为50,55,60,65,70 ℃的迷迭香酸得率。
1.2.4.2 响应面优化试验
对单因素试验结果分析后,选择料液比、乙醇浓度及提取温度3个因素做响应面优化。响应值为迷迭香酸的得率,设计响应面因素水平见表1。
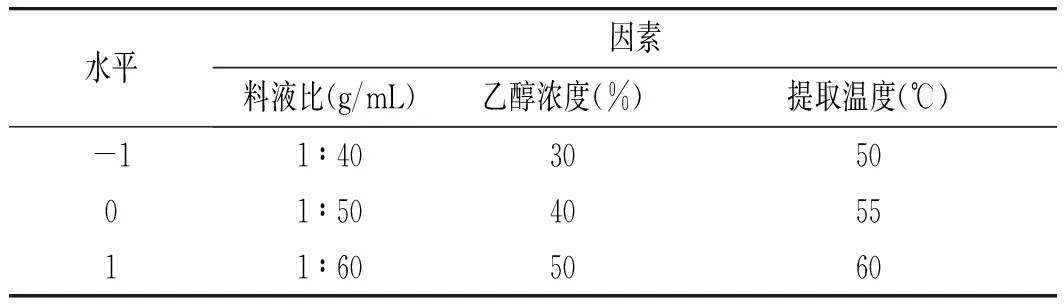
表1 响应面因素水平表Table 1 The factors and levels of response surface
1.2.5 微生物发酵对紫苏RosA含量的影响
1.2.5.1 菌种的活化
用无菌水将高活性干酵母粉溶解后涂布到马铃薯固体培养基上,在28 ℃的培养箱中培养1 d。待菌长成后,再进一步活化,重复活化几次,以便得到较纯的酵母菌。以上操作均在超净工作台中进行[17]。
在牛肉膏蛋白胨培养基上接种干酪乳酸菌菌种,在37 ℃培养箱中培养1 d,待菌长成后,再进一步活化。为了得到较纯的乳酸菌,重复活化几次。以上操作均在超净工作台中进行。
1.2.5.2 菌悬液的制备
配制马铃薯液体培养基和牛肉膏蛋白胨液体培养基各50 mL,分别接种活化好的酵母菌和干酪乳酸菌,之后在28,37 ℃的摇床中震荡培养1 d,转速为160 r/min。等到菌液浑浊后,将其在4000 r/min低速离心机中离心15 min,弃清液,用20 mL无菌水将沉淀制成菌悬液[18]。
1.2.5.3 微生物发酵紫苏
取单面红紫苏作为试验品种,将其叶、籽、杆粉碎过筛后各取1 g于30 mL发酵用培养基中,分别加入2 mL活化好的酵母菌和干酪乳酸菌悬液,并在28 ℃和37 ℃的160 r/min摇床中发酵3 d后提取迷迭香酸并测定。
1.2.6 紫苏籽发芽对RosA含量的影响
挑选颗粒饱满的3种品种优良的紫苏籽,用自来水浸种24 h后放入发芽机中发芽,温度为(25±5) ℃,每天定时喷洒自来水以保证紫苏籽湿润[19]。待发芽后将发芽的紫苏籽于30 ℃烘干粉碎过20目筛子,称取1 g后参照方法1.2.1测其迷迭香酸。
1.3 数据处理
本试验的响应面设计采用Design-Expert 10软件中的Box-Behnken设计,图形采用Origin 9绘制,试验数据均做3次平行处理,标准偏差采用Excel软件处理。
2 结果与分析
2.1 不同品种紫苏的叶、茎、籽中RosA含量的测定
迷迭香酸标品的线性回归方程y=45.299x-40.22,R2=0.9984。液相色谱图见图1。样品中具有和标品同样的保留时间,为5.775 min。
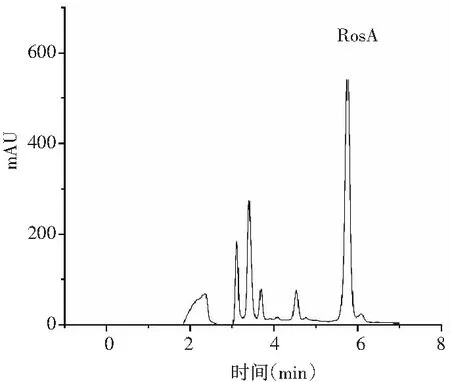
a.样品峰图
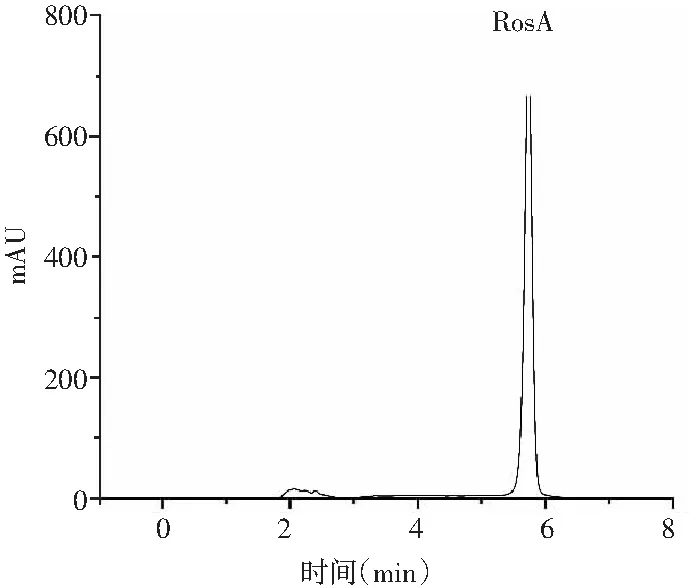
b.标品峰图
单面红、双面红和紫苏3号的各部位中迷迭香酸含量见表2。迷迭香酸含量最多的是单面红的叶,为1.27 mg/g,其次是双面红叶和单面红籽,分别为0.93 mg/g和1.00 mg/g。紫苏3号籽和叶中的含量无明显差异,分别为0.70 mg/g和0.72 mg/g,单面红茎、双面红茎和籽中迷迭香酸含量分别为0.39,0.45,0.50 mg/g。而迷迭香酸含量最少的是紫苏3号茎,为0.04 mg/g,可见迷迭香酸的含量在紫苏品种中具有一定的多样性。
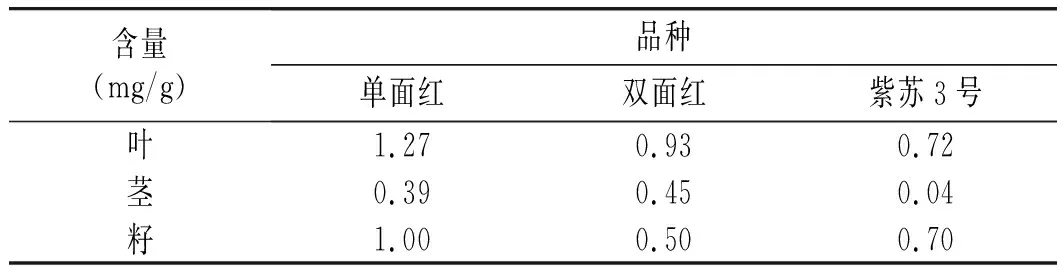
表2 3种不同紫苏的叶、茎、籽中迷迭香酸含量Table 2 The rosemary content in leaves, stems andseeds of three different kinds of perilla
2.2 HPLC-MS对RosA的鉴定
采用HPLC-MS对提取液中的目标产物进行鉴定,迷迭香酸标品及样品的总离子流色谱图和一级、二级质谱图见图2和图3。总离子流谱图显示,在同一保留时间下样品与标品有相同的吸收峰,而样品的母离子为m/z=359.077([M+H]+)、子离子为m/z=161.023,检测结果与标品相同,确定样品中的目标产物为迷迭香酸。
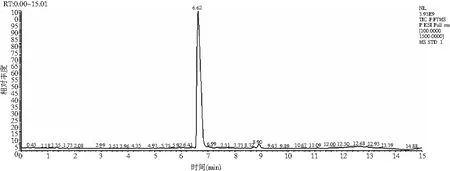
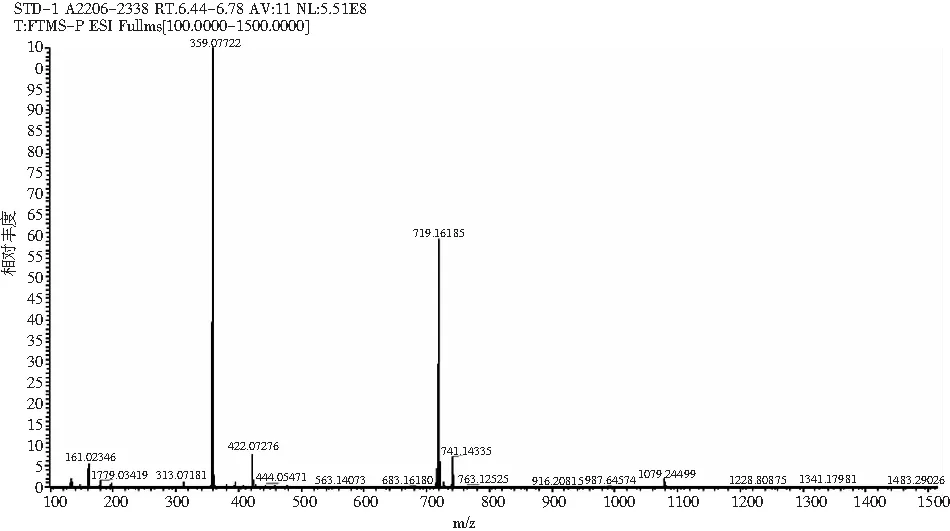
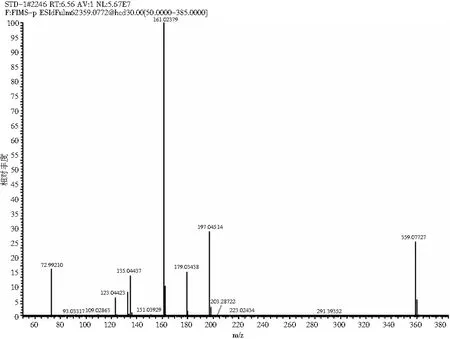
图2 迷迭香酸标品 HPLC-MS图Fig.2 HPLC-MS diagrams of rosemary acid standard samples
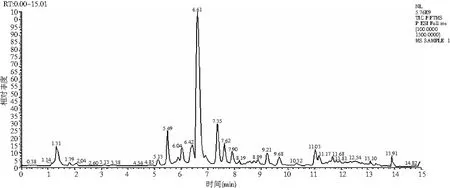
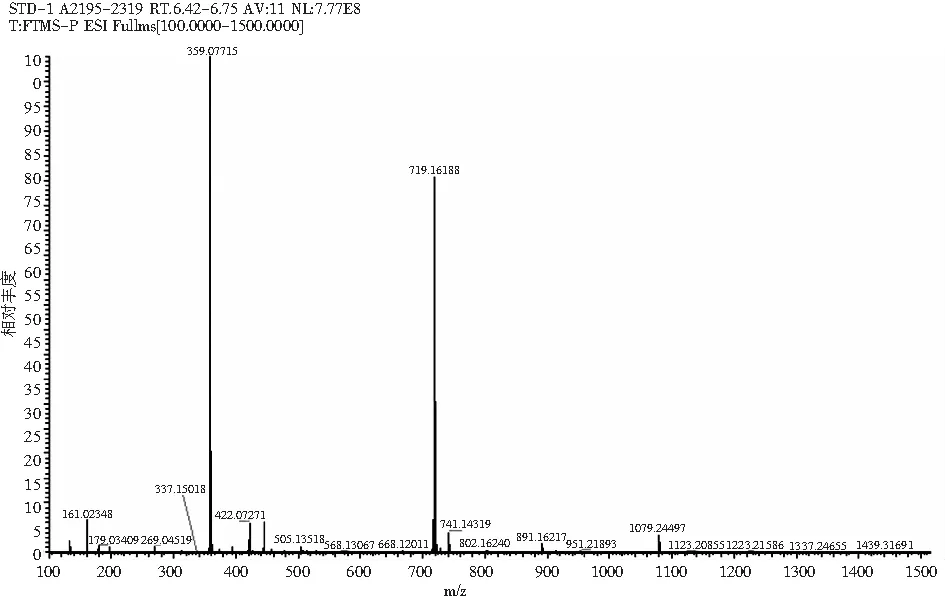
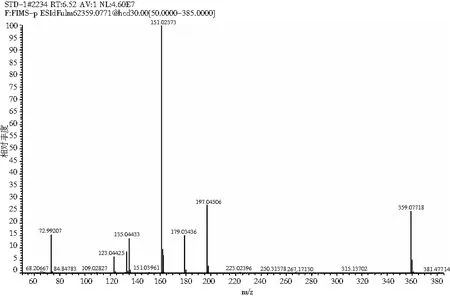
图3 样品HPLC-MS图Fig.3 HPLC-MS diagrams of samples
2.3 单因素试验结果
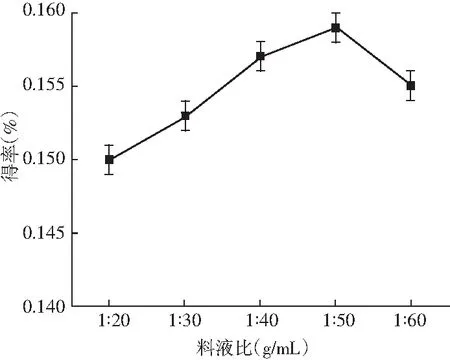
图4 料液比对迷迭香酸得率的影响 Fig.4 Effect of ratio of solid to liquid on the yield of rosemary acid
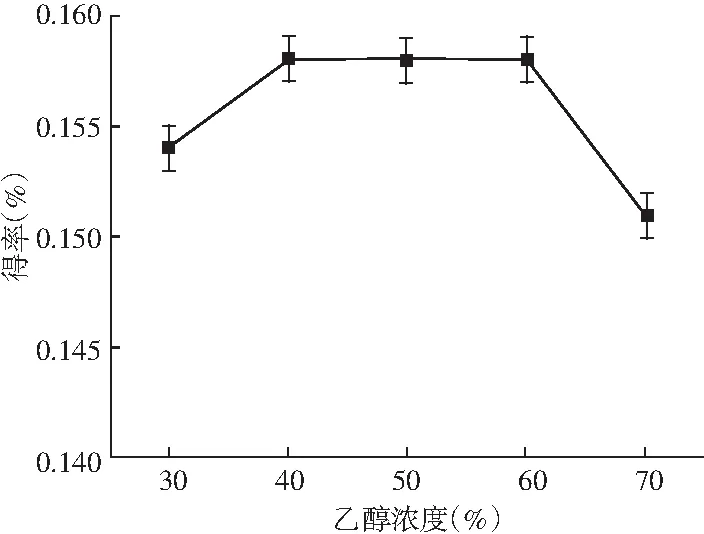
图5 乙醇浓度对迷迭香酸得率的影响Fig.5 Effect of ethanol concentration on the yield of rosemary acid
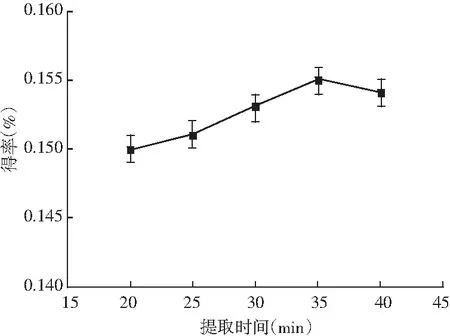
图6 提取时间对迷迭香酸得率的影响 Fig.6 Effect of extraction time on the yield of rosemary acid
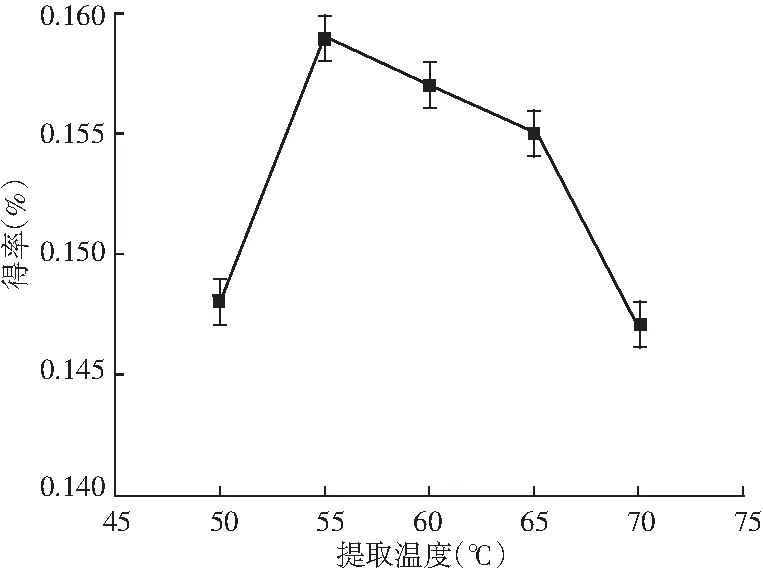
图7 提取温度对迷迭香酸得率的影响Fig.7 Effect of extraction temperature on the yield of rosemary acid
由图4可知,乙醇浓度、提取时间和提取温度不变时,料液比不断增加,迷迭香酸的得率近乎直线上升,原因是溶剂量越多,原料与溶剂可以更好地接触,当料液比为1∶50时得率达到最大,而1∶60时得率下降,因此选取最佳的料液比为1∶50。由图5可知,其他因素不变,乙醇浓度在30%~40%之间时,得率随乙醇浓度的增大也随之增大,40%、50%、60%时得率相同且达到最大,之后得率随乙醇浓度的增大反而急速减小,可能乙醇浓度越大,将紫苏中的其他物质提取出来,迷迭香酸提取受到了影响,因此最佳的乙醇浓度为40%。由图6可知,提取时间在20~35 min时,得率在缓慢稳定上升,当提取时间达到35 min时得率最高,继续延长提取时间,得率略微下降,所以35 min为提取的最佳时间。由图7可知,迷迭香酸得率随提取温度的升高先骤然增大,55 ℃时有最大得率,高于55 ℃后,得率先缓慢下降,65 ℃后又急速下降,可能是温度过高,迷迭香酸在高温下降解或转化为其他物质,因此最佳的提取温度为55 ℃。可见提取时间对迷迭香酸提取率的影响不显著,而其他3个因素对迷迭香酸的提取有显著影响,所以进一步选择料液比、乙醇浓度和提取温度3个对迷迭香酸得率影响较大的因素做响应面试验。
2.4 响应面试验结果
2.4.1 模型的建立及显著性检验
为了研究响应值与3个变量之间的逻辑关系,用Design-Expert 10.0软件中的Box-Behnken对试验进行设计,响应面试验设计结果见表3。迷迭香酸得率(Y)与料液比(A)、乙醇浓度(B)和提取温度(C)之间的二次多项式方程:Y=0.16+0.016A+0.012B-0.0001826C+0.005959AB+0.005977AC+0.006262BC-0.012A2-0.026B2-0.016C2。
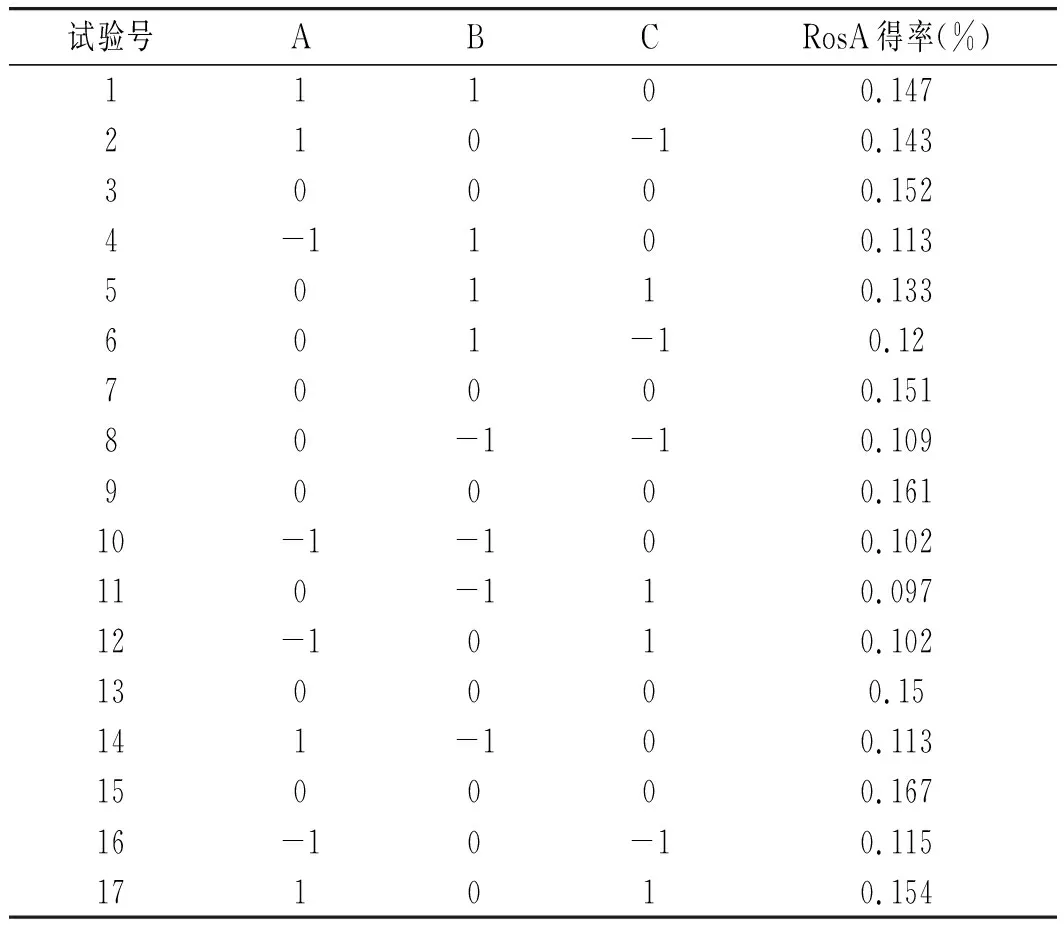
表3 响应面分析试验设计与结果Table 3 Response surface analysis test design and results
用Design-Expert 10.0软件对所得的回归方程进行检验,结果见表4。试验模型的P值是0.0005,远低于0.01,表明该试验的模型是极显著的,失拟项的P值为0.515>0.05,说明误差不显著,而且模型线性相关系数R2为95.74%,调整决定系数RAdj2为90.27%,表明该模型具有很高的拟合度,因此该模型可以用来分析和预测试验结果。一次项A,B及二次项A2、B2、C2对结果有显著影响(P<0.05)。
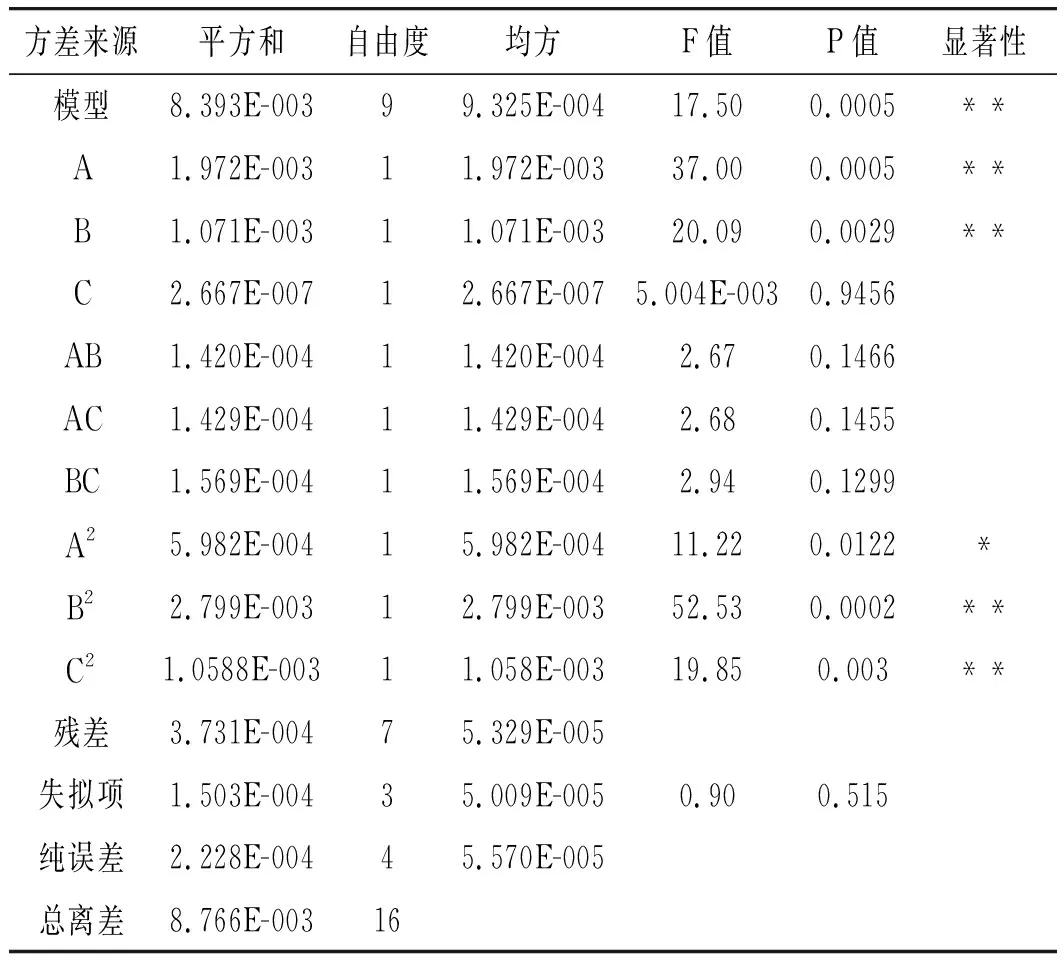
表4 回归方程各项方差的分析结果Table 4 Analysis results of variances of regression equations
2.4.2 响应面分析及优化
响应面图及对应的等高线图见图8。
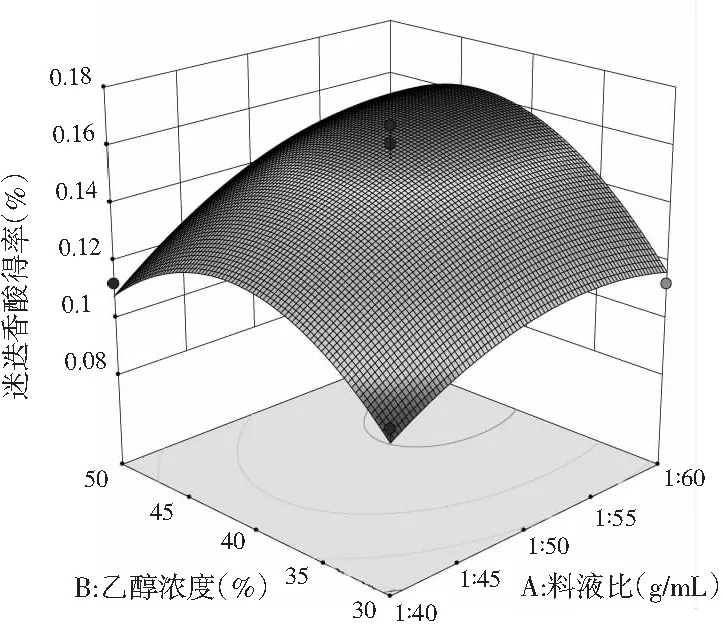
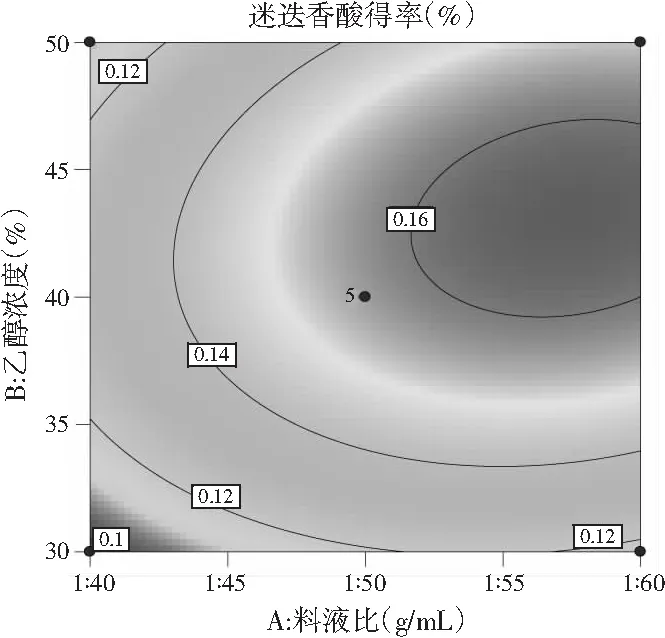
a.乙醇浓度(%)与料液比(g/mL)

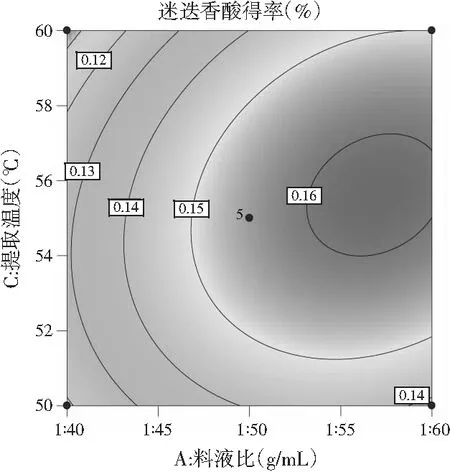
b.提取温度(℃)与料液比(g/mL)
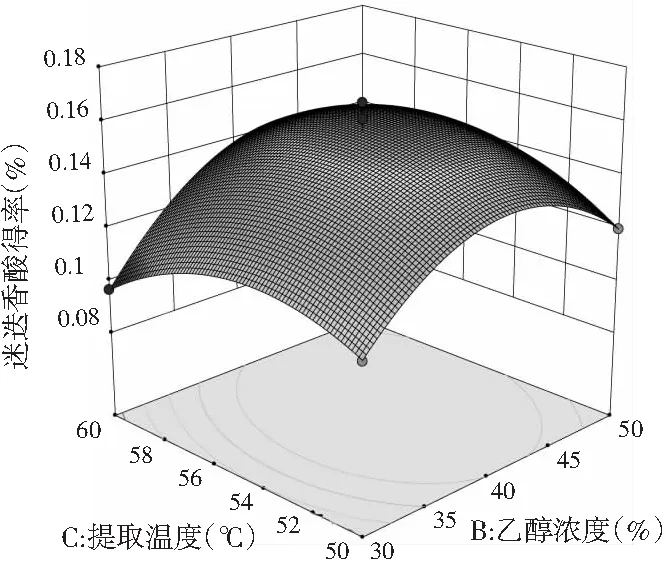
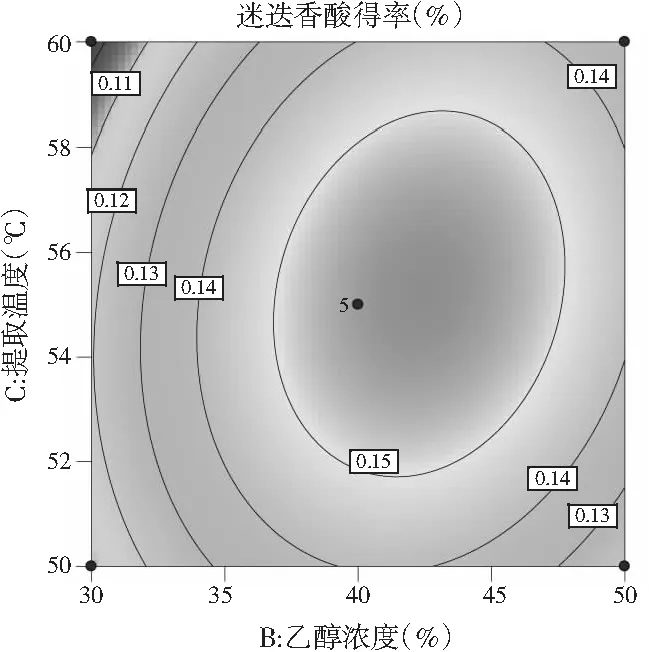
c.提取温度(℃)与乙醇浓度(%)
由图8中a可知,乙醇浓度为30%~40%时,料液比不断增大,迷迭香酸得率也在不断增大,只是越往后增大的幅度不大,乙醇浓度在40%~50%之间,迷迭香酸得率随料液比的增大而增大,增大幅度较大,当料液比为1∶40~1∶50时,迷迭香酸得率随乙醇浓度的增大呈现先升后缓慢下降的趋势;而料液比为1∶50~1∶60时,迷迭香酸得率随乙醇浓度的增加急剧升高且无明显下降趋势。由图8中b可知,当提取温度在50~55 ℃范围内,迷迭香酸得率随料液比的增大缓慢上升,55~60 ℃时迷迭香酸得率随料液比增大先迅速升高到最高点后缓慢下降;而当料液比一定时,迷迭香酸得率随着提取温度的增大呈现出先增后降的趋势。由图8中c可知,当提取温度为50~55 ℃时,迷迭香酸得率随乙醇浓度的增加呈现先上升后下降的趋势,且上升和下降趋势显著;提取温度在55~60 ℃范围内,迷迭香酸得率随乙醇浓度的增加先呈现大幅度升高后趋于平缓;而乙醇浓度固定不变时,迷迭香酸含量随温度的变化先小幅度上升后小幅度下降。
2.4.3 试验结果验证
用软件分析后,提取迷迭香酸最优条件是料液比为1∶57.804、乙醇浓度为43.427%、提取温度56.064 ℃, 为了试验的可行性修正为料液比为1∶60、乙醇浓度为40%、提取温度为55 ℃。取1 g粉碎后的单面红紫苏叶,按照上述最优条件做3次验证试验,迷迭香酸平均得率为0.161%±0.002%,与理论值0.164%相近,因此说明该响应面设计十分合理。
2.5 微生物发酵对单面红紫苏不同部位中RosA含量的影响
用酵母菌和干酪乳酸菌发酵单面红,单面红中迷迭香酸含量变化情况见图9。
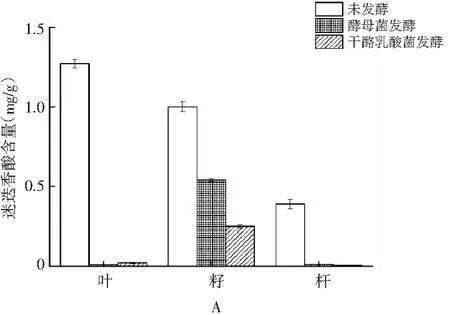
图9 微生物发酵紫苏Fig.9 Microbial fermentation of perilla
由图9可知,单面红无论是用酵母菌还是乳酸菌发酵,其中的迷迭香酸含量都大大减少了,比较直观的是紫苏叶和紫苏杆。酵母菌发酵后紫苏叶中的迷迭香酸含量从1.27 mg/g骤降至0.008 mg/g,降了99.4%,紫苏杆中的迷迭香酸含量从0.39 mg/g骤降为0.01 mg/g,降了97.4%;而干酪乳酸菌发酵之后紫苏叶和杆分别下降了98.4%和9%。酵母菌发酵紫苏籽后迷迭香酸含量从1.0 mg/g减少为0.54 mg/g,减少了46%;干酪乳酸菌发酵后紫苏籽中的迷迭香酸含量从1.0 mg/g减少为0.25 mg/g,减少了75%。推测其原因,一方面可能是微生物在发酵过程中,迷迭香酸作为营养物质被微生物利用代谢掉了,另一方面可能是紫苏中的多酚氧化酶在相应的环境活性增强,将迷迭香酸氧化为其他物质。
2.6 紫苏籽发芽对RosA含量的影响
处理后双面红紫苏籽没有萌芽状态,单面红和紫苏3号紫苏籽在培养箱中发芽后迷迭香酸含量变化见图10。
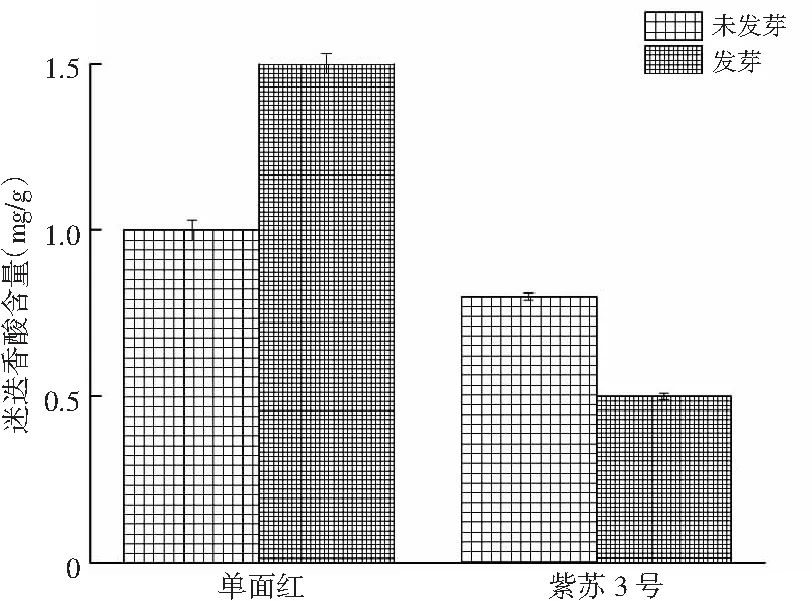
图10 发芽后迷迭香酸含量Fig.10 Rosemary acid content after germination
由图10可知,单面红紫苏籽发芽后迷迭香酸含量从未发芽时的1.0 mg/g升高到1.5 mg/g,升高了50%,紫苏3号紫苏籽中迷迭香酸含量从未发芽时的0.8 mg/g下降到0.5 mg/g,降低了37.5%,而双面红未能发芽,由此可见通过籽发芽处理可以显著提高单面红籽中迷迭香酸含量。
3 结论
本试验用乙醇水溶液来提取3种不同品种紫苏中的迷迭香酸,过程简单,通过水浴加热,使细胞高温破碎,其中的迷迭香酸大量流出,相对于酶法提取来说也减少了杂质的引入,减少了后期的纯化步骤。迷迭香酸的分布和含量具有一定的多样性,不同品种紫苏中迷迭香酸的含量不同,同一品种不同部位的含量也不同,试验处理中由山西省百草盛生物科技有限公司提供的单面红紫苏叶中迷迭香酸含量最高,为1.61 mg/g。Design-Expert 10.0软件中的Box-Behnken试验设计优化出提取迷迭香酸的最佳条件为料液比1∶60、乙醇浓度40%、提取温度55 ℃。在最优条件重复3次试验,得出迷迭香酸得率为0.161%±0.002%,比黄丹丹等人用酶辅助超声提取高了0.018%,进一步通过 HPLC-MS来鉴定提取液中的目标物,发现目标物的一级质谱图和二级质谱图与迷迭香酸标品完全相同,由此确定试验的目标产物为迷迭香酸。
用真菌酵母菌和细菌干酪乳酸菌分别发酵单面红,发现单面红的叶、籽、杆中迷迭香酸含量都大大减少了。酵母菌在缺氧环境下,将紫苏中的糖类转化为二氧化碳和乙醇,迷迭香酸结构中含有羧基,乙醇中的羟基和羧基在合适的条件下可能会发生化学反应,相类似乳酸菌异型发酵产生的乙醇也可能会与迷迭香酸中的羧基发生反应,降低了迷迭香酸含量。其次,紫苏细胞壁有多酚氧化酶的存在,发酵过程中可能会产生促进多酚氧化酶活性的物质,使得迷迭香酸含量大大减少,这与Seyed M B H等用植物乳杆菌发酵伏牛花汁,发现发酵后花汁总酚类化合物、花色苷和抗坏血酸含量显著降低的结论一致[20]。而单面红紫苏籽发芽以后,迷迭香酸含量比发芽之前增加了50%,可能与发芽过程中酶的作用、促进活性物质的转化有关,这与余茜等人用盐发芽大豆使大豆酚类物质富集的结论一致,但富集的机理需进一步研究。
