miRNA-33a对马拉松跑导致心肌纤维化的调控作用
2020-10-20徐承建祝捷
徐承建 祝捷

摘 要:目的:通过动物实验建模和细胞学实验验证miRNA-33a对马拉松跑导致心肌纤维化的调控作用。方法:通过动物实验建模对实验大鼠进行马拉松跑训练,检测miRNA-33a的变化情况及心肌形态学差异,以分析实验大鼠左心室心肌纤维化对心功能的影响程度。通过细胞学实验证明miRNA-33a对CFb合成胶原蛋白、分化等的调控作用。 结果:1)检测各组大鼠的心功能状况:相比对照组(CG),实验组(EG)大鼠的左心室射血分数(LVEF)和左心室短轴缩短率(LVFS) 均显著下降 (P<0.05);而相比实验组(EG),miRNA-33a +EG组大鼠的LVEF显著提高、LVFS显著增长。2)Q-PCR检测显示:与对照组(CG)相比,实验组(EG)的miRNA-33a显著上调(P<0.05);与实验组(EG)相比,miRNA-33a +EG组的miRNA-33a则显著下降(P<0.05)。3)HE染色结果显示:miRNA-33a +EG的大鼠心肌纤维结构紊乱得到缓解,且肌细胞体积明显缩小。Masson染色结果显示:miRNA-33a +EG的大鼠胶原纤维数量显著减少,心肌纤维结构排列相对有序。与实验组(EG)相比,miRNA-33a +EG胶原蛋白容积分数显著下降(P<0.05)。4)Western blot检测结果显示:转染miRNA-33a 模拟物后,CFb细胞I型胶原蛋白、III型胶原蛋白、CTGF的蛋白含量均显著增加(P<0.05);转染miRNA-33a 抑制剂后,CFb细胞I型胶原蛋白、III型胶原蛋白、CTGF的蛋白含量均显著减少(P<0.05)。5)Western blot检测结果显示:miRNA-33a 模拟物显著增加CFb细胞a-SMA的蛋白含量(P<0.05); miRNA-33a 抑制剂显著降低CFb细胞a-SMA的蛋白含量(P<0.05)。结论:miRNA-33a可显著改善马拉松跑导致心肌纤维化的病理变化,為后续研究提供了干预靶点。
关键词:miRNA-33a;马拉松;心肌纤维化;心脏成纤维细胞
中图分类号:G 804.5 学科代码:040302 文献标识码:A
Abstract: Objective: To verify the regulation of miRNA-33a on myocardial fibrosis resulted from marathon through animal and cytological experiments. Methods: The variation of miRNA-33a in the left ventricle and the morphology of myocardial morphology is to be verified by zoological experiments, so as to analyze the degree of left ventricular fibrosis in rats. Through cytological experiments, it is to prove that miRNA-33a regulates the function of CFb synthesis of collagen and differentiation in the cytological layer. Results: 1) Determination of cardiac function in each group: Compared with control group(CG), the left ventricular ejection fraction (LVEF) and left ventricular short axis shortening rate(LVFS) of EG group were significantly lower(P<0.05) in the experimental group(EG); LVEF and LVFS in the miRNA-33a antago-miR+EG group were significantly increased in EG. 2) Q-PCR showed that the expression of miRNA-33a was significantly up-regulated in EG compared with CG(P<0.05). Compared with EG, miRNA-33a antago the expression of miRNA-33a in the -miR+EG decreased significantly(P<0.05). 3) HE staining showed that the disorder of tissue structure arrangement in miRNA-33a antago-miR+EG was alleviated, and the myocyte volume was significantly reduced. Masson staining showed that the number of collagen fibers in miRNA-33a antago-miR+EG was significantly decreased. The muscle fibers are arranged in a relatively orderly manner. Compared with EG, the collagen volume integral of the miRNA-33a antago-miR+EG significantly decreased(P<0.05). 4) Western blot analysis showed that transfection of miRNA-33a mimics increased the expression/content of type I, type III collagen and CTGF in CFb cells at mRNA/protein level (P<0.05); transfection of miRNA-33a inhibitor The expression/content of type I, type III collagen and CTGF decreased at the mRNA/protein level(P<0.05). 5. Western blot analysis showed that miRNA-33a mimics significantly increased a-SMA protein content in CFb cells(P<0.05). Transfection of miRNA-33a inhibitor significantly decreased a-SMA protein content in CFb cells(P<0.05). Conclusion: miRNA-33a can significantly improve the pathological process of myocardial fibrosis resulted from marathon. It provides a good target for intervention for subsequent research.
Keywords:miRNA-33a; marathon; myocardial fibrosis; cardiac fibroblasts
近年来,因马拉松跑引发运动损伤甚至猝死的案例逐年增加,这引发了研究者对马拉松跑及长跑训练对心脏是否会造成病理性损伤的质疑[1-3]。自2011年有研究提出各类耐力性运动可能会造成心肌纤维化(简称“MF”)损伤以来,近年又有研究显示,以马拉松为典型的长期大强度耐力训练可诱发MF,马拉松运动员的MF发生率显著高于一般人[2,4]。还有研究显示:MF是多种心血管疾病的病理生理基础,譬如心肌病、高血压、恶性心律失常和心功能不全等[5]。MF的发生与心肌炎症反应、心肌细胞凋亡和自噬等均有关[6-7]。例如,马拉松的大强度运动训练,可能促使机体因细胞因子活化等,激活上述机制,导致心脏成纤维细胞(简称“CFb”)分化为心脏肌成纤维细胞(简称“CMF”),这种肌成纤维细胞的繁殖活性和胶原蛋白合成能力比静息状态下的CFb显著增强,胶原蛋白过度堆积,即可导致心肌纤维化的发生[5,8],但具体作用机制有待深入开展运动性心肌纤维化的病理研究予以明确。
微小核糖核酸(miRNA)是内源性的非编码RNA,通过识别并结合在其基因3-末端未翻译区的互补序列,从而在转录后水平上抑制该基因的变化。miRNA参与多种生物功能过程,譬如细胞繁殖、分化和死亡、机体新陈代谢、血管生成等,是重要的基因表达调控过程之一。由此可见,研究miRNA参与心肌纤维化的病理生理过程可為干预马拉松所致MF提供理论参考。目前已发现多种miRNA参与调控心肌纤维化过程,诸如miRNA-21、miRNA-45可以促进心肌纤维化的发生,而miRNA-24、miRNA-29、miRNA-101和miRNA-133a可抑制心肌纤维化的发生[9-11]。其中,miRNA-33a在CFb中表达多样,有研究发现其与高密度脂蛋白胆固醇的代谢相关,抑制miRNA-33a可抑制线粒体呼吸过程和ATP产生,且能促使ABCA1变化,从而能抑制巨噬细胞胆固醇外流,抑制动脉粥样硬化的形成,由此推断,miRNA-33a可能是潜在的马拉松所致MF的干预靶点[12]。
本研究通过动物学及细胞学实验探讨miRNA-33a对马拉松跑所致心肌纤维化的调控作用,以期明确miRNA-33a在其中的作用机制。
1 实验器材及方法
1.1 实验动物
选取SPF级雄性SD大鼠50只,由南方医科大学动物实验中心提供(质量合格证编号:11651301251428)。大鼠饲养于南方医科大学中心实验室,饲养环境为清洁级,温度维持在20 ~22 ℃。分笼饲养,每笼2只,每周换垫料、消毒笼具2次,饲养至体质量为220 ~250 g时备用。
1.2 实验仪器及耗材
实验仪器及耗材包括:超净工作台、酶标仪、二氧化碳培养箱、倒置显微镜、恒温水浴锅、水平离心机、低温高速离心机、涡旋混匀器、眼科剪、眼科镊、磁力搅拌器、PH计、纯水仪、陶瓷研磨器、western blot电泳仪、电转仪、western blot电泳槽及电转夹、水平摇床、成像仪、称量天平、超声破碎仪、紫外检测仪、制冰机、PCR仪、4 ℃冰箱、-20 ℃冰箱、-80 ℃冰箱等。
1.3 实验建模
适应性饲养大鼠1 周后开始进行马拉松跑适应性训练。马拉松跑的条件:封闭小动物平板跑台仪,跑道长为340 mm、宽为135 mm,并外罩有机玻璃,主动轴与驱动电机相连。依据Bedford[13]研制的大鼠跑台运动负荷等级表,设为5级运动负荷,每级速度分别为8 m/min、16 m/min、20 m/min、24 m/min、27 m/min,每级跑道倾角分别为0 °、5 °、10 °、10 °、10 °,在1 min内匀速递增至下一级,直至第5级。通过每天45 min跑台适应性训练后剔除不适应大鼠。将剩余大鼠依照随机数字表法分为3组:对照组(简称“CG”)、实验组(简称“EG”)、miRNA-33a拮抗剂注射实验组(简称“miRNA-33a+EG”)。
CG大鼠正常饲养不予任何处理,并传代CG的心脏成纤维细胞进行后续细胞学实验;EG大鼠于平板跑台仪进行马拉松跑模拟训练6周,于大鼠力竭时取出休息10 min后恢复训练,确保每日分次训练时间之和不少于120 min;miRNA-33a antago-miR+EG大鼠则于训练前3天根据大鼠的体质量,将200 pMoL/kg的miRNA-33a antago-miR稀释于1 mL灭菌PBS溶液,予大鼠以尾静脉注射,连续3天后开始进行马拉松跑训练,训练方案同EG。
1.4 超声心动仪
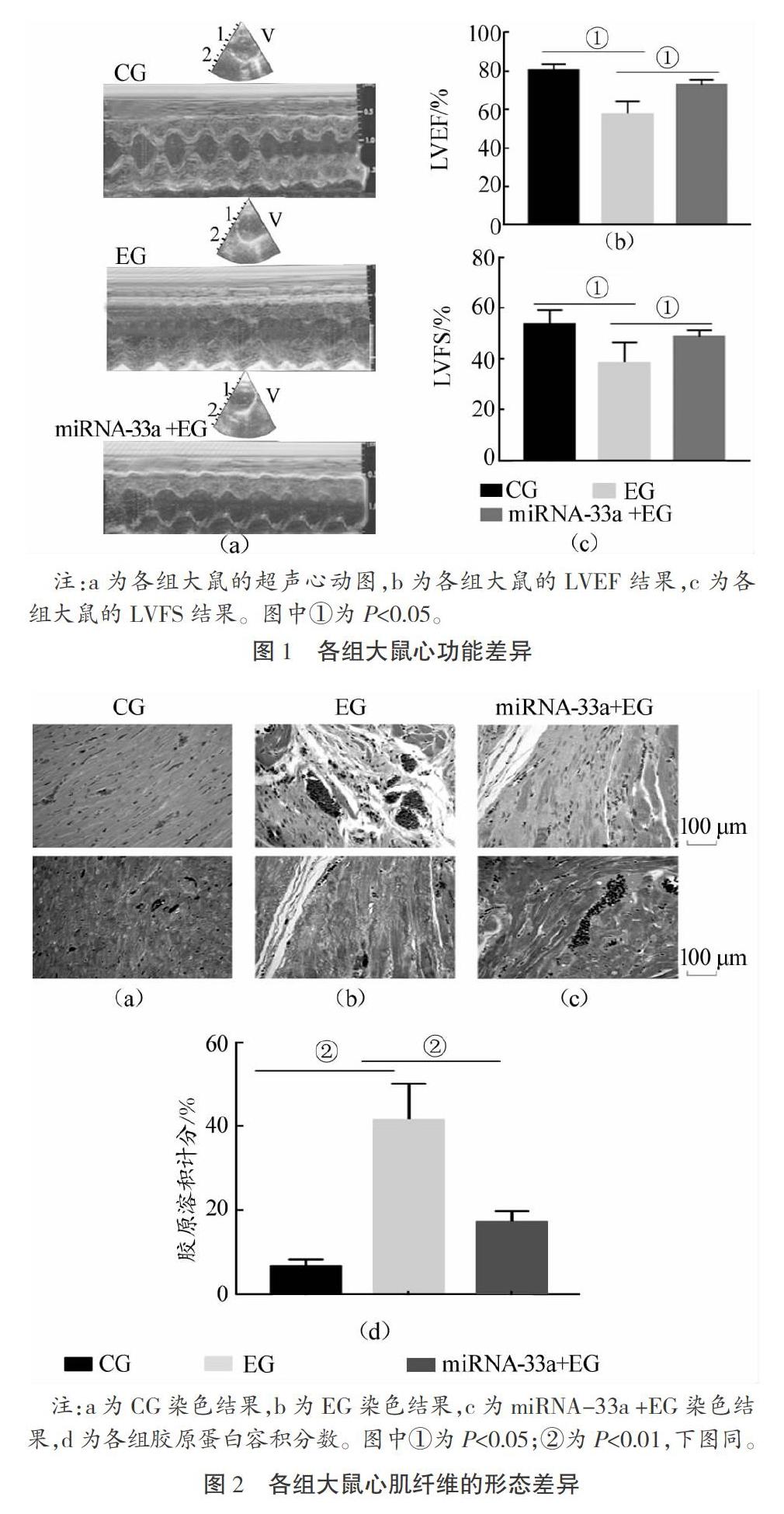
马拉松跑训练6周后用超声心动仪检查各组大鼠的心功能状况:通过腹腔注射戊巴比妥钠溶液诱导麻醉,诱导麻醉成功的表征为呼吸频率变慢、四肢紧张度降低、夹趾反应阴性。之后,仰卧位固定大鼠,大鼠左前胸部皮肤涂抹耦合剂,固定超声探头后进行M型和B型超声检查,分别采集图像3次。超声检查过程中要注意大鼠的呼吸频率和心率,避免过度按压探头引起呼吸、心跳骤停。本论文的检测指标主要包括左心室射血分数(简称“LVEF”)和左心室短轴缩短率(简称“LVFS”),以分析马拉松跑导致心肌纤维化对心功能的影响程度。
1.5 病理组织学染色
超声检查结束后,对各组大鼠进行心脏取材。使用Q-PCR检测各组大鼠左心室心肌miRNA-33a的变化情况。使用石蜡包埋、切片之后,使用HE染色观察各组大鼠左心室各类心肌细胞的形态差异,使用Masson染色观察各组大鼠左心室各类纤维的形态差异。
1.6 细胞学实验
本研究的细胞学实验分为4组:空白对照组(简称“BCG”)、阴性对照组(简称“NCG”)、miRNA-33a模拟物转染组、miRNA-33a抑制剂转染组。
传代CG大鼠的CFb进行细胞学实验。转染前一日采用6孔板对消化细胞进行接种,细胞数量为2×105孔,细胞培养基为1 500 μL。次日,当细胞融合度达50%~70%时再进行转染。用250 μL无血清OPti-MEM培养基分别稀释5 μL miRNA-33a的模拟物和抑制剂,缓慢混匀,在室温下孵化5 min。用250 μL无血清OPti-MEM培养基稀释4 μL脂质体Lipofectamin 2000,缓慢混匀,在室温下孵化5 min。将稀释的miRNA-33a 的模拟物和抑制剂分别与Lipofectamin 2000充分混匀,混合液置于室温下孵化20 min,将混合液倒入含有1 500 μL细胞培养基的培养孔中,缓慢混匀。静置于37 ℃的二氧化碳培养箱内,每隔4~6 h换溶液,miRNA-33a 的模拟物和抑制剂的最大浓度应为50 Nm,在转染48~72 h后进行实验。
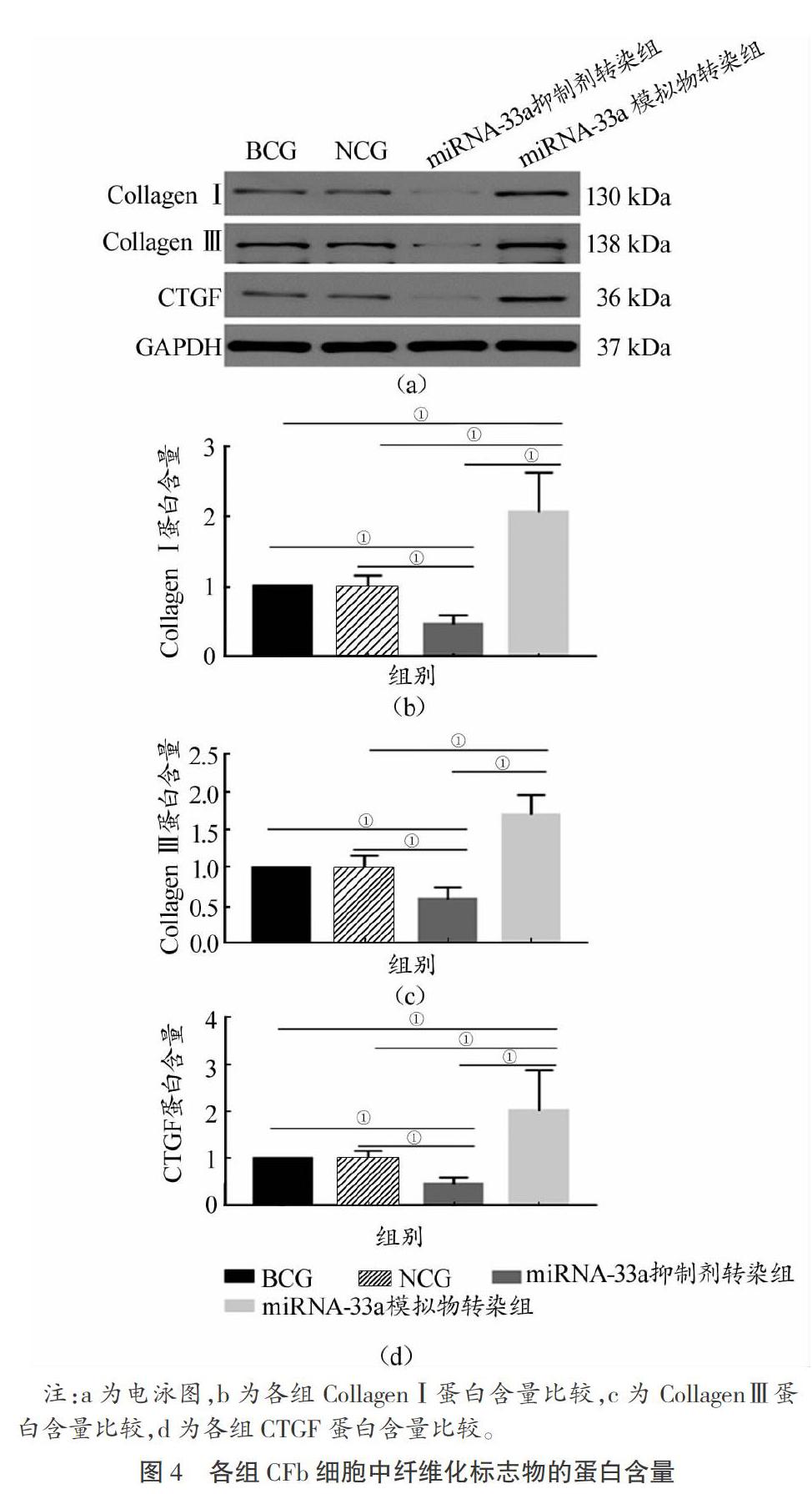
使用Q-PCR检测各组细胞miRNA-33a的变化;然后使用Q-PCR、Western blot检测胶原蛋白的主要成分,即Ⅰ型胶原蛋白(CollagenⅠ)、Ⅲ型胶原蛋白(CollagenⅢ)及其编码蛋白Col1A1/Col3A1的差异,另检测促CFb细胞活化并合成胶原蛋白的结缔组织生长因子(简称“CTGF”)的差异;使用Western blot检测肌动蛋白-α(简称“a-SMA”)的变化以明确CFb细胞分化为CMF的情况。
1.7 统计学方法
应用Excel 2016软件建立数据库,使用双次录入法以完成数据核对与逻辑纠错。基于SPSS21.0软件完成数据处理,设定双侧P<0.05为差异具有统计学意义。对计量数据进行Kolmogorov-Smirnov检验:符合正态分布的计量数据表示为均数±标准差(Mean±SD/SEM),两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用SNK法;不符合正态分布的计量数据以中位数及四分位数表示,两组间及多组间比较采用秩和检验。
2 研究结果
2.1 实验建模
剔除未通过适应性训练的4只大鼠,剩余大鼠被随机分入3组,其中:CG为18只、EG及miRNA-33a+EG分别为14只,在实验建模6周后完成实验。
2.2 超声心动检测结果
各组大鼠的心功能状况:相比CG大鼠,EG大鼠的LVEF及LVFS均显著下降(P<0.05);相比EG大鼠,miRNA-33a+EG大鼠LVEF及LVFS均显著提高(P<0.05),如圖1所示。
2.3 心肌组织病理组织学分析结果
与EG大鼠相比,miRNA-33a+EG大鼠的心肌纤维结构紊乱得到缓解,且肌细胞体积明显缩小。使用Masson染色观察各组大鼠左心室各类肌纤维的形态差异:与EG相比,miRNA-33a +EG胶原纤维数量显著减少,心肌纤维排列相对有序。进一步使用IPP6.0分析Masson染色结果显示:与EG相比,miRNA-33a +EG胶原容积分数显著减少(P<0.05)。如图2所示。
2.4 细胞学实验结果
分离、传代、转染CFb细胞之后,Q-PCR检测结果显示:转染miRNA-33a模拟物能显著上调CFb细胞的miRNA-33a水平(P<0.05),转染miRNA-33a抑制剂则显著下调CFb细胞的miRNA-33a水平(P<0.05)。这说明细胞学模型造模成功。基于细胞学模型进一步检测得出如下结果:1)使用Q-PCR检测各组Col1A1、Col3A1及其CTGF的mRNA的水平。相比BCG和NCG,转染miRNA-33a模拟物后,上述指标的mRNA均显著增长(P<0.05);相比BCG和NCG,转染miRNA-33a抑制剂后,上述指标的mRNA均显著减少(P<0.05),如图3所示。2)使用western-blot检测各组CollagenⅠ、CollagenⅢ及其CTGF的蛋白含量,其结果与mRNA变化规律一致,即:相比BCG和NCG,转染miRNA-33a模拟物后,上述指标的蛋白含量均显著增加(P<0.05);相比BCG和NCG,转染miRNA-33a抑制剂后,上述指标的蛋白含量均显著减少(P<0.05),如图4所示。3)相比BCG和NCG,miRNA-33a模拟物转染组的CFb细胞的α-SMA显著增加(P<0.05);相比BCG和NCG,miRNA-33a抑制剂可在蛋白水平抑制CFb细胞的α-SMA显著减少(P<0.05),如图5所示。
3 讨论
在进行马拉松跑时,缺氧等可导致心肌组织中各种胶原纤维蛋白堆积、Ⅰ型胶原蛋白纤维、Ⅲ型胶原蛋白纤维的比例严重失调,心室壁僵硬度增加、心室壁运动功能逐渐失调、心室顺应性降低,在早期可引起舒张功能障碍,逐渐地可导致心室收缩功能减弱,从而引起心肌纤维化、恶性心力衰竭的发生。
随着CFb大量分化为CMF,其繁殖能力显著增强,分泌合成Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、CTGF等的能力显著提高,显著加速了马拉松跑所致心肌纤维化的发生,因此,寻找到能够抑制CFb繁殖、合成胶原蛋白、分化的靶点,对延缓或抑制马拉松跑导致的心肌纤维化的病变过程,具有十分重要的临床意义。
目前,有研究发现,多种miRNA参与调控心肌纤维化过程,诸如miRNA-21可以促使心肌纤维化的发生,而miRNA-24、miRNA-29、miRNA-101和miRNA-133a可抑制心肌纤维化的发生[14]。由此可见,研究miRNA参与心肌纤维化的病理生理过程可为临床干预心肌纤维化确定新的治疗方案。另有研究显示:miRNA-33a在心脏成纤维细胞中变化多样,与高密度脂蛋白胆固醇的代谢相关,抑制miRNA-33a的变化可抑制线粒体呼吸过程和ATP产生,且能增加ABCA1的表达,从而能抑制巨噬细胞胆固醇外流,抑制动脉粥样硬化的形成,由此可见,miRNA-33a可能是一个潜在的心血管疾病的干预靶点[15-16]。然而,miRNA-33a对于马拉松跑所致MF的影响尚未见有研究。
鑒于此,本研究进行了动物实验和细胞学实验,试图初步探讨miRNA-33a对于马拉松跑所致MF的调控机制:在动物学实验中,拮抗剂miRNA-33a显著改善马拉松跑导致心肌纤维化大鼠的心功能,并缓解心肌组织的病理学变化;细胞学实验进一步证实,miRNA-33a具有增强CFb细胞分泌胶原蛋白的能力,并能促进CFb细胞分化为CMF细胞,以进一步加速MF进程;抑制miRNA-33a变化可以在细胞学实验中得到相应的反向结果。该结果显示,miRNA-33a通过影响CFb细胞分化,促进其合成胶原蛋白,从而加快马拉松跑导致心肌纤维化的进程,构成后续心血管疾病的病理生理基础。
4 结论
通过建立马拉松跑训练的动物实验模型,研究结果显示,长期大强度的马拉松跑训练可导致心肌纤维化。从miRNA-33a这一作用靶点探讨其中的病理生理机制,为进一步揭示马拉松跑所致MF的发生机制、预防机制、干预途径奠定了一定的理论基础。后续有必要深入开展运动性心肌纤维化病理与发病机制研究。
参考文献:
[1]常芸.运动性心律失常研究现状与展望[J].中国运动医学杂志,2015,34(1):59.
[2] 陈雷.高强度马拉松训练后AngⅡ介导小鼠心肌细胞损伤中TLR4信号通路的作用[J]. 北京体育大学学报,2016,39(12):56.
[3] 刘长江,武洋,邵培培,等. 马拉松力竭对冠脉结扎致大鼠慢性心衰模型的优化[J]. 中国临床药理学与治疗学,2017,22(12):1340.
[4] 黄传业,聂金雷,田野. 运动引起心肌肌钙蛋白T释放:心肌可逆性损伤的证据与心肌适应性改变的信号[J]. 中国运动医学杂志,2012,31(8):723.
[5] ZHANG D, CUI Y, LI B, et al. MiR-155 regulates high glucose-induced cardiac fibrosis via the TGF-β signaling pathway[J]. Molecular Biosystems, 2016, 13(1): 215.
[6] LIU X, XU Y, DENG Y, et al. MicroRNA-223 regulates cardiac fibrosis after myocardial infarction by targeting rasa1[J]. Cellular Physiology & Biochemistry, 2018, 46(4): 1439.
[7] BOON R A, IEKUSHI K, LECHNER S, et al. MicroRNA-34a regulates cardiac ageing and function[J]. Nature, 2013, 495(7439): 107.
[8] XU X, TAN X, TAMPE B, et al. Epigenetic balance of aberrant rasal1 promoter methylation and hydroxymethylation regulates cardiac fibrosis[J]. Cardiovascular Research, 2015, 105(3): 279.
[9] COELHO L L , PEREIRA I R , PEREIRA M C D S , et al. Trypanosoma cruzi activates mouse cardiac fibroblasts in vitro leading to fibroblast-myofibroblast transition and increase in expression of extracellular matrix proteins[J]. Parasites & Vectors, 2018, 11(1): 72.
[10] LIU Y, ZHAO D, QIU F, et al. Manipulating PML sumoylation via silencing UBC9 and RNF4 regulates cardiac fibrosis[J]. Molecular Therapy the Journal of the American Society of Gene Therapy, 2017, 25(3): 666.
[11] HUANG Y, QI Y, DU J Q, et al. MicroRNA-34a regulates cardiac fibrosis after myocardial infarction by targeting smad4[J]. Expert Opin Ther Targets, 2014, 18(12): 1355.
[12] MATKOVICH S J, WANG W, TU Y, et al. MicroRNA-133a protects against myocardial fibrosis and modulates electrical repolarization without affecting hypertrophy in pressure-overloaded adult hearts[J]. Circulation Research, 2010, 106(1): 166.
[13] BEDFORD T G, TIPTON C M, WILSON N C, et al. Maximal oxygen consumption of rats and its changes with various experimental procedures[J]. Journal of Applied Physiology Respiratory Environmental & Exercise Physiology, 1979,47(6): 1278.
[14] SUN L, MOCHLY-ROSEN D. Protein kinase Cε regulates histone deacetylase 6 in cardiac fibrosis journal of cardiac failure[J]. Journal of Cardiac Failure, 2008, 14(6): 78.
[15] DAI B, CUI M, ZHU M, et al. STAT1/3 and ERK1/2 synergistically regulate cardiac fibrosis induced by high glucose[J]. Cellular Physiology & Biochemistry International Journal of Experimental Cellular Physiology Biochemistry & Pharmacology, 2013, 32(4): 960.
[16] KIM J, KIM J, LEE S H, et al. Cytokine-like 1 regulates cardiac fibrosis via modulation of TGF-β signaling[J]. Plos One, 2016, 11(11): 166480.
