钌催化的手性苯基/苯并噻唑甲醇的转移氢化合成
2020-10-16陈淡宜张福梅张紫媚文思妙妙刘祈星周海峰
陈淡宜,张福梅,何 丹,张紫媚,钟 芬,文思妙妙,刘祈星,周海峰
(三峡大学生物与制药学院,天然产物研究与利用湖北省重点实验室,宜昌 443002)
苯并噻唑及其衍生物作为生物二级代谢产物中常见的结构单元,具有良好的生物活性,被广泛应用于农药、医药和材料等领域[1].此外,手性偕二芳基甲醇也是合成许多天然产物的重要中间体[2~5].目前,手性偕二芳基甲醇的合成方法主要有3种:(1)生物催化的不对称还原[6,7];(2)金属有机亲核试剂与不饱和化合物的不对称加成[8];(3)化学催化的不对称还原[9].化学催化的不对称还原具有原子经济性高、对映选择性好及底物适应性广等优点,是众多不对称合成方法中最为理想的一种.不对称转移氢化是在手性催化剂的作用下,活泼氢从氢原子供体转移加成到氢接受体的不饱和官能团上的还原反应[10].不对称转移氢化的氢原子供体大多为廉价易得的还原试剂,如异丙醇、甲酸钠、甲酸、甲酸/甲酸钾及甲酸/三乙胺混合体系等.与氢化反应相比,不对称转移氢化具有反应不需要压力容器、氢供体廉价易得、副产物易于处理及催化剂在水氧条件下更稳定等优越性.
1995年,Noyori等[11]首次合成了手性二苯基乙二胺金属络合物催化剂,并将其应用于不对称合成领域.该催化剂化学性质稳定,可在空气、水、酸及碱条件下使用,催化活性和对映选择性(e.e.)高,反应条件温和,底物适应性广,价格相对便宜,目前已商业化,是不对称还原反应中最优秀的手性催化剂之一[12].最近,本课题组[13~19]在手性二胺金属络合物催化剂催化的不对称转移氢化方面做了很多工作,如利用手性二胺钌络合物催化剂,以甲酸钠作为氢源,实现了含邻位取代苯基/吡啶甲酮化合物的不对称转移氢化,产物e.e.值高达99.9%[13].另外,针对无邻位取代苯基/吡啶甲酮直接进行不对称还原反应时对映选择性差的问题,引入了可去除N-氧化物作邻位取代基,以手性二胺铱络合物为催化剂,通过不对称转移氢化,高对映选择性地合成了手性苯基/吡啶基甲醇,e.e.值高达98.2%[14].虽然关于手性芳基/杂芳基甲醇的不对称合成方法已有大量报道[20~24],对苯基/噻唑甲酮类化合物的不对称还原也有报道[25,26],但有关苯基/苯并噻唑甲酮类化合物的不对称还原还未进行系统研究[22].
鉴于手性苯基/苯并噻唑甲醇类化合物在药物领域的潜在应用价值,在前期研究工作基础上,本文以2-甲基苯基/苯并噻唑甲酮为原料,异丙醇/水混合物为溶剂,甲酸钠为氢源,在手性二胺钌络合物催化作用下,通过不对称转移氢化,合成了一系列具有较高对映选择性的苯基/苯并噻唑甲醇类化合物.
1 实验部分
1.1 试剂与仪器
(1S,2S)-1,2-二苯基乙二胺购于韶远化学科技(上海)有限公司;二氯(对甲基异丙基)钌二聚体、二氯(五甲基环戊二烯基)合铑二聚体和二氯(五甲基环戊二烯基)合铑二聚体购于上海麦克林生化科技有限公司;催化剂N-{(1S,2S)-1,2-二苯基-2-[2-(4-甲基苄氧基)乙基氨基]乙基}-4-甲基苯磺酰胺(氯)钌(Ⅱ)[(S,S)-C1]和氯{[(1S,2S)-(+)-2-氨基-1,2-二苯基乙基](4-甲基苯磺酰)氨基}(均三甲苯)钌(II)[(S,S)-C3]购于梯希爱(上海)化成工业发展有限公司;硼氢化钠(NaBH4)购于国药集团化学试剂有限公司;苯基/苯并噻唑甲酮为自制;所用溶剂均为分析纯.
Bruker AV 400 MHz型核磁共振波谱(NMR)仪,瑞士Bruker公司;Waters 1525EF型高效液相色谱(HPLC)仪,沃特世科技(上海)有限公司;SHB-ⅢA型循环水式多用真空泵,上海豫康科教仪器设备有限公司;EYELA SB-1100型旋转蒸发仪,上海爱朗仪器有限公司;低温冷却液体循环泵,巩义市英峪予华仪器厂;X-4型数字显示显微熔点测定仪,北京泰克仪器有限公司.
1.2 实验过程
1.2.1 外消旋体的合成 在10 mL干燥试管中加入50.6 mg(0.2 mmol)2-甲苯基/苯并噻唑甲酮和2 mL甲醇,然后缓慢加入75.66 mg(2 mmol)NaBH4,在室温下搅拌至反应完全,加入饱和NaHCO3溶液,用乙酸乙酯萃取,无水Na2SO4干燥,减压蒸馏除去溶剂,用薄层层析色谱分离提纯,得到2-甲苯基/苯并噻唑甲醇外消旋体(rac-2a).采用相同方法合成其它外消旋化合物rac-2b~rac-2z.
1.2.2 催化剂的合成 在10 mL试管中加入0.005 mmol金属二聚体、0.015 mmol手性二胺单磺酰氯、0.02 mmol三乙胺和0.5 mL CH2Cl2,室温下搅拌0.5 h,分别用水、饱和NaHCO3和饱和NaCl溶液洗涤,减压除去溶剂,得到手性二胺金属络合物催化剂,无需纯化,直接用于不对称转移氢化反应.
1.2.3 手性苯基/苯并噻唑甲醇的合成 在10 mL干燥试管中加入50.6 mg(0.2 mmol)2-甲苯基/苯并噻唑甲酮、2.5%(摩尔分数)手性二胺金属络合物催化剂、2.0 mmol(136 mg)HCOONa和2.0 mL水/异丙醇(i-PrOH)混合溶液(体积比1:1),在30℃下搅拌12 h,用乙酸乙酯(5 mL×3)萃取,有机层经Na2SO4干燥,浓缩,用薄层色谱分离纯化,得到2-甲苯基/苯并噻唑甲醇(2a).采用相同方法合成其它手性苯基/苯并噻唑甲醇化合物2b~2z.
2 结果与讨论
2.1 反应条件的筛选
所合成手性苯基/苯并噻唑甲醇类化合物的理化性质及核磁共振数据分别列于表1和表2.化合物的核磁共振谱图及液相色谱图见图S1~S104(见本文支持信息).
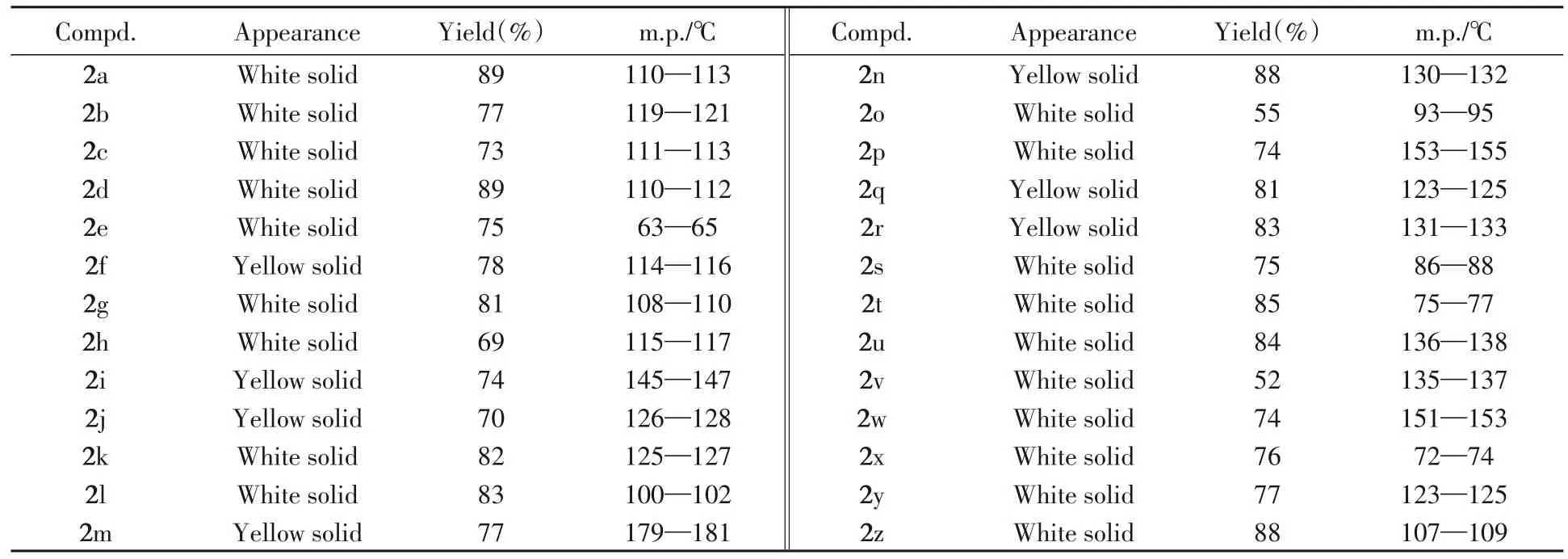
Table 1 Appearance,yields and melting point data of target compounds 2a—2z

Table 2 1H NMR and13C NMR data of target compounds 2a—2z

Continued
以手性二胺金属络合物催化邻甲苯基/苯并噻唑甲酮的不对称转移氢化为模型反应,对反应条件进行了优化,结果列于表3.首先,对催化剂进行筛选(表3中Entries 1~9),催化剂结构示意图见Scheme 1.结果表明,不同的催化剂对反应产率和对映选择性的影响较大,当使用催化剂(S,S)-C1~C3时,e.e.值均高于96%,尤其是催化剂(S,S)-C3,e.e.值高达99%.使用催化剂(S,S)-C4~C9时,e.e.值较低.对氢源和溶剂进行了考察,发现当使用不同比例的甲酸/三乙胺(TEA)作为氢源时,e.e.值均降低,甚至不发生反应(表3中Entries 10和11).对催化剂用量进行了筛选.当降低催化剂用量为2.5%(摩尔分数)时,产率和e.e.值均保持不变(表3中Entry 12);当催化剂用量低至1%(摩尔分数)时,反应产率有明显降低(表3中Entry 13).对溶剂的筛选结果表明,当使用其它醇类与水的混合溶剂时,如H2O/MeOH,H2O/C2H5OH和H2O/CF3CH2OH,反应产率明显降低(表3中Entries 14~16);当使用非质子性溶剂与水的混合物作溶剂时,如H2O/CH2Cl2,H2O/DMSO,H2O/DMF和H2O/CHCl3,e.e.值有所下降(表3中Entries 17~20);以纯水作为溶剂,反应不发生.综上,确定了最佳反应条件:(S,S)-C3(摩尔分数2.5%)为催化剂,甲酸钠(摩尔分数1000%)为氢源,i-PrOH/H2O混合溶液(体积比1∶1)为溶剂,在30℃下反应12 h.

Table 3 Optimization of reaction conditionsa

Scheme 1 Structures of catalysts
2.2 底物的拓展
在确定的最佳反应条件下,考察了不同取代基对反应的影响.由表4可见,当苯环邻位取代基为卤素取代基F,Cl,Br或CF3时,e.e.值均高于90%(化合物2b,2c,2d和2e);当邻位基为含活泼氢的羟基时,e.e.值仅为31%(化合物2f);当苯环对位含卤素(F和Cl),吸电子基团(NO2和CF3)或供电子基(CH3,OCH3和OH)时,得到中等程度的对映选择性,e.e.值为50%~86%(化合物2g~2m);当苯环间位为供电子基(OCH3)时,e.e.值仅为58%(化合物2n);当间位为吸电子基团(CF3和NO2)时,e.e.值为81%和85%(化合物2o和2p).对含邻位基的双取代底物进行了研究,当邻位基为非活泼氢基团时,双取代产物的对映选择性高,e.e.值为89%~97%(化合物2q~2t);当邻位取代基为OH时,e.e.值为59%(化合物2u).对于1-萘基/苯并噻唑甲酮和2-萘基/苯并噻唑甲酮的还原产物,前者的对映选择性远远高于后者(化合物2w:94%e.e.vs.化合物2v:55%e.e.).对其它苯基/氮杂环甲酮的不对称转移氢化反应进行了尝试,如苯基/苯并呋喃甲酮、苯基/苯并噁唑甲酮和苯基/噻唑甲酮,发现还原产物的对映选择性一般.
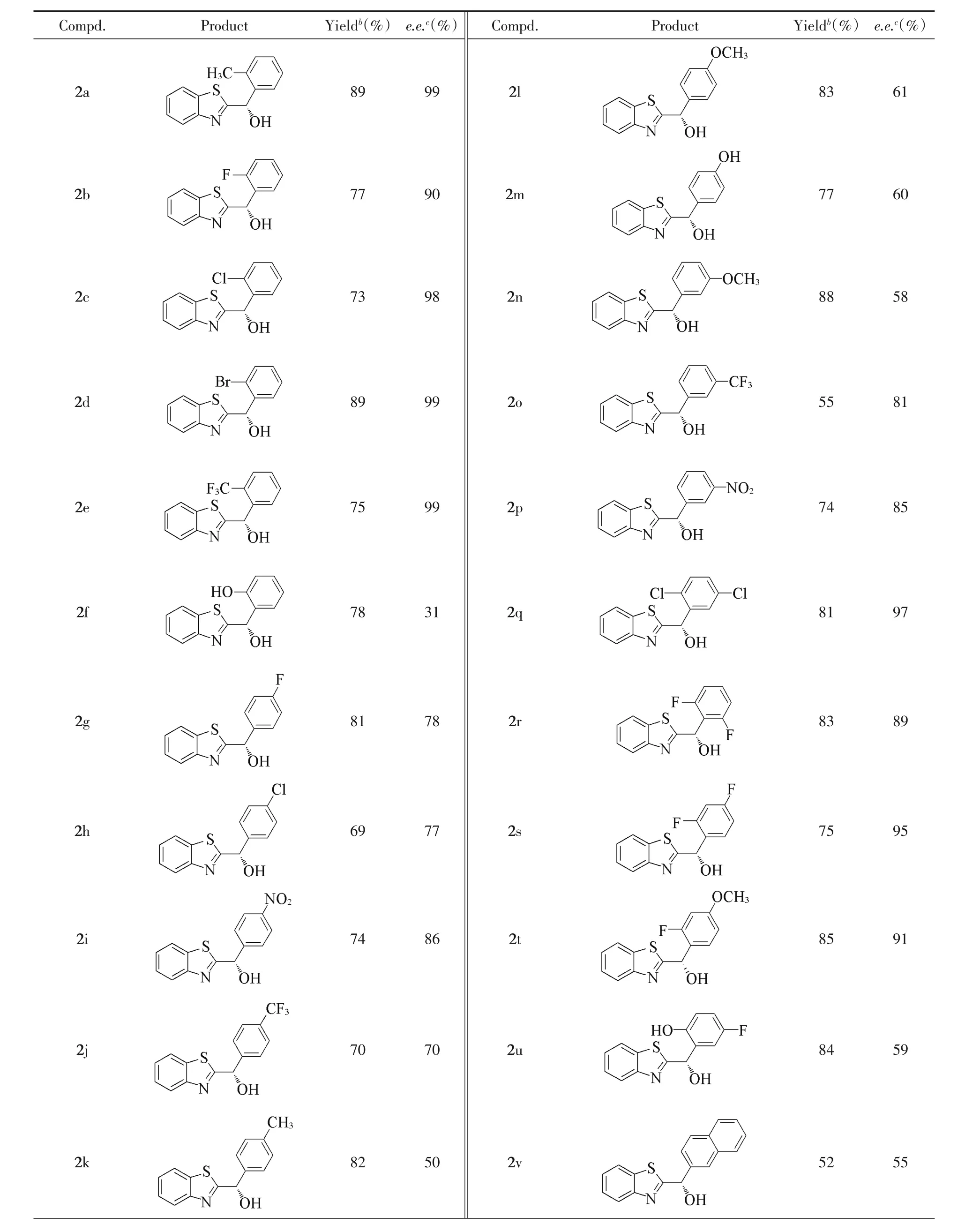
Table 4 Substrate scope for the productsa

Continued
2.3 底物构型及对映选择性分析
通过对底物构型与对映选择性结果进行分析可知,当苯环具有邻位取代基时(羟基除外),无论是吸电子基团还是供电子基团,由于空间位阻效应,2个芳基的区分度大,不对称转移氢化所得产物的对映选择性普遍较高,大部分具有90%以上的e.e.值.而苯环对位和间位具有取代基时,由于2个芳基区分度小,对映选择性普遍偏低.1-萘环取代的产物(化合物2w)对映选择性远远高于2-萘环取代的产物(化合物2v),进一步验证了邻位取代基对偕二芳基甲酮不对称还原反应的对映选择性具有非常重要的影响[14].
3 结 论
以手性二胺钌络合物为催化剂,建立了一种苯基/苯并噻唑甲酮的不对称转移氢化方法,以较高的产率和对映选择性得到系列手性苯基/苯并噻唑甲醇化合物.通过研究底物的适应性发现,邻位取代基对反应的对映选择性具有重要影响.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200246.