幽门螺杆菌通过其优势蛋白组分活化肥大细胞的致病机制研究
2020-09-22吴登艳杜茂涛谭燃景
吴登艳,杜茂涛,谭燃景
幽门螺杆菌(Helicobacterpylori, Hp)是一种常见的致病性微需氧革兰氏阴性杆菌,全世界人口中Hp感染率已过半。在病理状态下,Hp定植于胃黏膜上皮细胞、进一步释放毒力因子并引起机体强烈的免疫和炎症反应,它的感染与多种类型胃炎、消化性溃疡以及胃癌等疾病密切相关,但其致病机制尚未完全明确[1]。肥大细胞作为一种胃肠道粘膜固有层细胞,在细菌防御和炎症反应中发挥重要作用,大量研究表明,在Hp感染相关性疾病中,胃肠道粘膜中肥大细胞的数量和活性均增加[2-3],提示肥大细胞的活化在Hp感染的致病过程中发挥重要作用。因此,探究Hp对肥大细胞的活化作用对于揭示Hp感染相关性疾病的发病机制具有重要的意义。
虽然已有研究揭示Hp的空泡毒素(VacA)和中性粒细胞激活蛋白(NAP)对肥大细胞有激活作用[4-6],后者的活化可释放组胺,合成β-氨基己糖苷酶以及分泌IL-3、TNF-α、IFN-γ等多种炎性因子[7-9],参与Hp致病,但目前关于Hp对肥大细胞作用的研究仅停滞于极个别蛋白水平,Hp全菌及其蛋白组分对人肥大细胞的活化作用尚缺乏系统性的分析和研究。
因此,本研究拟同时评估3种Hp全菌制剂:Hp的尿素裂解液(能使细菌充分裂解,蛋白充分变性,能较好的部分模拟在体激活方式。尿素裂解液具有不电离,呈中性,蛋白质复性后除去不会造成大量蛋白质沉淀,利于分子筛组份筛选)、Hp的超声裂解上清(细菌裂解充分,大分子蛋白容易断裂,即单纯全菌裂解蛋白的体外激活)、福尔马林灭活(细菌充分灭活,模拟死亡细菌的激活作用)的Hp对人LAD2肥大细胞株的直接活化作用;并用分子筛将Hp全菌尿素裂解液分解成30个连续分子量梯度的蛋白组分,拟从Hp全菌蛋白层面筛选出对LAD2肥大细胞活化效力最强的蛋白质组分,并模拟肥大细胞活化的即刻反应和延迟效应,评价最强蛋白组分对肥大细胞潜在的炎性介质释放的剂量依赖和时间依赖作用,同时拟用液相色谱-质谱分析方法明确最强-蛋白组分的具体成分;为进一步全面揭示Hp感染的致病机制提供依据,为治疗Hp感染提供新的靶点。
1 材料与方法
1.1Hp培养及不同细菌制剂的制备
1.1.1细菌培养 Hp26695(ATCC○R700392 )菌株的扩增培养[10]:将菌株保种液均匀涂布于Hp固体培养基(P0701哥伦比亚血琼脂平板,重庆庞通生物有限公司)上,5% O2、10% CO2、85% N2、37 ℃培养48 h。长出菌落后转入含10%胎牛血清的布氏肉汤液体培养基继续培养至对数分裂期。
1.1.23种Hp全菌制剂的制备
1.1.2.1Hp尿素裂解液 PBS缓冲液重悬洗涤菌液3次后离心,取适量菌体沉淀,加入8 mol/L尿素溶液。
1.1.2.2Hp超声裂解上清/可溶性Hp超声裂解物 将收集的菌体重悬于PBS中,置于冰水混合浴中超声裂解(80 W,10 min)。将裂解后悬液于4 ℃低温离心(10 000 g×5 min),收集离心后上清,BCA法试剂盒(Sigma-Aldrich, USA)测定蛋白浓度。
1.1.2.3福尔马林灭活的Hp 将Hp菌体沉淀用0.3%福尔马林溶液重悬,并置于慢速摇床37 ℃孵育6 h,用PBS反复重悬洗涤3次后制备成Hp-PBS悬液。
1.1.3实时荧光定量聚合酶链式反应(real time quantility Polymerase chain reaction,qRT-PCR)检测Hp菌量 参考文献[11]设计16S rRNA上游引物:5′-TTTGTTAGAGAAGATAATGACGGTATCTAAC-3′, 16SrRNA下游引物:5′-CATAGGATTTCACACCTGACTGACTATC-3′, Hp16sRNA probe, FAM-CGTGCCAGCAGCCGCGGT-TAMRA)。根据Premix ExTaq试剂盒(Takara,宝生生物)说明加入Hp菌体模板、上游引物、下游引物和探针进行反应。qRT-PCR条件:95 ℃ 1 min;95 ℃ 15 s、60 ℃ 20 s,共行39次循环;采集荧光。根据标准品16s RNA浓度的LOG值及CT值绘制标准曲线方程,并计算每个标本的实际菌量。
1.1.4Hp尿素裂解液中脂多糖(Lipopolysaccharide, LPS)的去除与检测[12]使用Triton X-114两相分离技术去除Hp尿素裂解液中的LPS。将1%的Triton X-114与Hp尿素裂解液在0 ℃下混合5 min,以确保溶液均匀。37℃孵育5 min,形成两相。观察分层,离心取上清。分别用凝胶过滤和透析去除残留的Triton X-114,并对去除后裂解液中的LPS含量进行检测(Triton X-114 3次去除后,LPS的含量低于鲎试剂的检测限)。
1.1.5Hp蛋白组分(Protein components,PCs)的制备 将三氯乙酸加入到已去除LPS的Hp尿素裂解液中,调整三氯乙酸至10%浓度,4 ℃条件下过夜使蛋白组份充分沉淀,离心后再将此沉淀通过透析去除三氯乙酸。利用分子筛通过连续离心将上一步纯化后Hp裂解液分离成具有不同分子量梯度范围的30个PCs,用BCA法试剂盒测定每种PC蛋白浓度,同时取样行SDS-PAGE蛋白凝胶电泳并凝胶成像系统分析。
1.23种Hp制剂及其PCs对人LAD2肥大细胞株的直接活化作用的检测
1.2.1LAD2肥大细胞株培养 将人LAD2肥大细胞株(NIH, USA)用含2 mmol/L谷氨酰胺、100 ng/mL人干细胞生长因子(Peprotech, UK)及青-链霉素的无血清StemPro-34培养基(Invitrogen Gibco, USA)于 37 ℃、5% CO2,细胞培养箱培养。每间隔1~2 d半量换液1次。约7~10 d细胞进入对数生长期,可用于下一步实验。
1.2.23种Hp全菌制剂对LAD2肥大细胞活化作用的检测
1.2.2.13种Hp制剂预处理LAD2肥大细胞 将3种Hp制剂稀释成不同的浓度梯度,分别和终浓度为1×106/mL的LAD2细胞共培养30 min,3种细菌制剂的终浓度分别为:Hp尿素裂解液及超声裂解上清(50、100、150、200 μg/mL),福尔马林灭活的Hp[(1.25、2.5、5.0、10) ×107CFU/mL]。阳性对照为1 μmol/L伊屋诺霉素(Sigma, USA)和LAD2肥大细胞共培养体系[13],阴性对照为加入等量PBS的LAD2肥大细胞培养体系。同时,为了排除尿素对LAD2肥大细胞的影响,也检测了终浓度为80、160、320、640 μmol/L的尿素溶液与1×106/mL LAD2肥大细胞的共培养体系。以上每个体系终体积为1 mL/孔,每个培养条件设3复孔、实验重复3次。
1.2.2.2β-氨基己糖苷酶释放率检测 30 min后将以上共培养体系置于冰水浴终止反应,收集不同反应体系并离心,分别收集上清和细胞沉淀,各细胞沉淀分别用1% Triton X-100重悬裂解,以释放细胞内的β-氨基己糖苷酶。用人β-氨基己糖苷酶A ELISA试剂盒(CUSABIO, USA)分别检测每个反应体系上清和细胞沉淀中的β-氨基己糖苷酶含量,β-氨基己糖苷酶释放率(%)=上清中β-氨基己糖苷酶量/(上清+细胞沉淀的β-氨基己糖苷酶量)。
1.2.2.3甲苯胺蓝染色计算脱颗粒率 离心收集各细胞沉淀,用新鲜配制的甲醛/冰醋酸(3∶1)液固定并细胞涂片,风干后0.1%的甲苯胺蓝染液染色2 min,95%酒精分色10 s,去离子水洗涤2次。再次风干后中性树脂封片并在光学显微镜下观测,每张涂片连续计数5个高倍镜视野,计算脱颗粒率。
1.2.330种Hp-PCs对LAD2肥大细胞潜在活化作用的检测 将150 μg/mL终浓度的Hp尿素裂解液和10 μg/mL终浓度的各PCs分别和1×106/mL LAD2肥大细胞共培养30 min,检测不同培养体系中LAD2肥大细胞的β-氨基己糖苷酶释放率。将上一步所得的6种β-氨基己糖苷酶释放率高于15%的PCs稀释成不同浓度梯度(1、2、4、8 μg/mL),分别和1×106/mL LAD2肥大细胞共培养30 min。检测不同培养体系中LAD2肥大细胞的β-氨基己糖苷酶释放情况。
1.3Hp优势性蛋白组分PC17对LAD2肥大细胞的潜在激活效应的检测
1.3.1即刻效应的检测 将最终筛得的Hp优势性PC17组分稀释成不同浓度(1、2、4、8 μg/mL),分别和1×106/mL LAD2肥大细胞共培养30 min。ELISA法检测不同PC17浓度下LAD2肥大细胞的β-氨基己糖苷酶释放率和组胺、TNF-α释放水平(Histamine ELISA kit, Cloud-Clone, Houston, TX, USA; Human TNF-α ELISA kit, Dakewe, Shenzhen, China)。
在以上细胞实验中,通过4%台盼蓝染色和细胞计数监测不同条件下LAD2肥大细胞活力,确保不会导致明显的细胞死亡。
1.4液相色谱串联质谱方法(Liquid chromatography-mass spectrometry,LC-MS/MS)分析Hp优势的PC17的成分 用胶内酶消化法将PC17条带从SDS-PAGE蛋白电泳凝胶中切下并制备上样样品[14],用LTQ Orbitrap Velos Pro 质谱仪联合Easy-nLC 1000 分析系统对制备好的PC17上样样品进行液相色谱串联质谱分析,并通过Proteome DiscovererTM1.4将数据与GenBank中Hp-26695的NCBI.fasta 数据库进行比对。
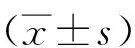
2 结 果
2.13种Hp全菌制剂能有效活化人LAD2肥大细胞 β-氨基己糖苷酶释放检测示,100、150、200 μg/mL的Hp尿素裂解液和超声裂解上清预处理组,及 (2.5、5.0、10) ×107CFU/mL的福尔马林灭活Hp预处理组中的LAD2肥大细胞均能被有效活化(P<0.05),并且这3种制剂对LAD2肥大细胞活化能力随着其浓度的增加而增大。在相同的工作浓度下,Hp尿素裂解液的活化能力优于Hp超声裂解上清(P<0.05)(图1)。
分别与阴性对照比较,①P<0.05,②P<0.01, ③P<0.001; 与200 μg/mL Hp超声裂解上清比较,④ P<0.005; 与阴性对照比较,⑤P>0.05 图1 不同Hp制剂预处理的LAD2细胞的β-氨基己糖苷酶释放率Fig.1 β-Hexosaminidase release rate of LAD2 cells pre-treated by different Hp preparations
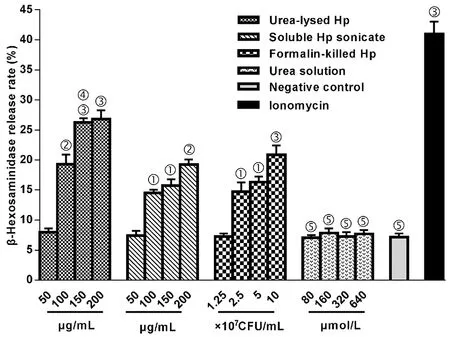
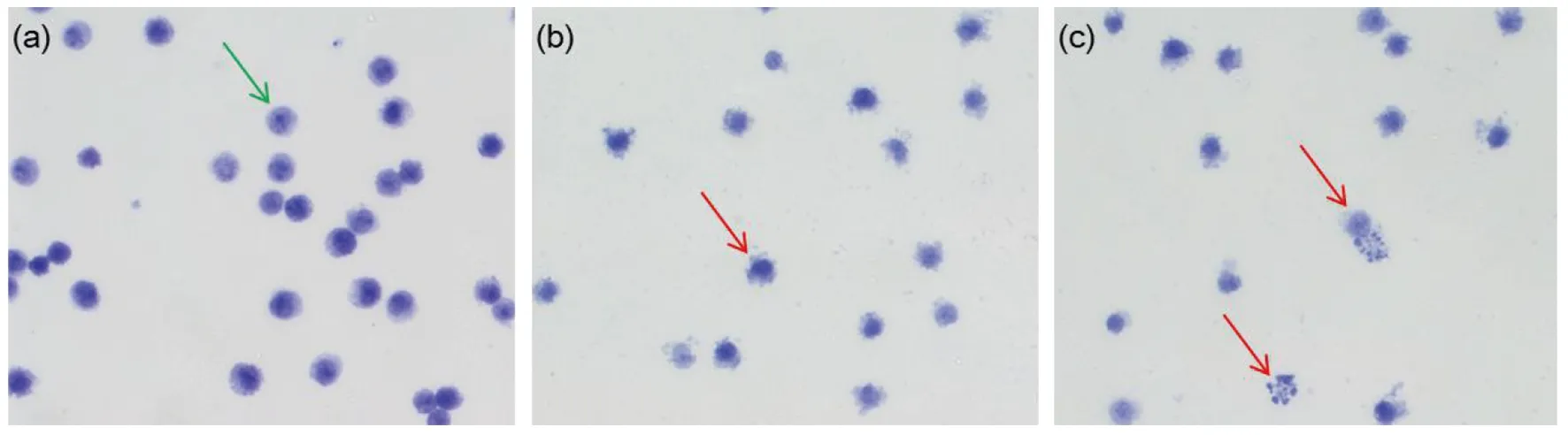
甲苯胺蓝染色显示:LAD2肥大细胞胞浆中的颗粒呈现紫红色,细胞核呈现深蓝色,未脱颗粒的细胞有均质性的胞浆和完整的胞膜(绿色箭头),而脱颗粒的细胞则细胞膜连续性破坏,胞浆颗粒从细胞喷射出呈放射状外观(红色箭头)(图2);3种Hp制剂作用下的LAD2肥大细胞脱颗粒率趋势,与β-氨基己糖苷酶释放率趋势基本一致(图3)。
(a)阴性对照,(b)1 μmol/L伊屋诺霉素预处理,(c)200 μg/mL Hp尿素预处理。×200倍光镜, bar=50 μm。图2 LAD2细胞的甲苯胺蓝染色Fig.2 Light microscope feature of LAD2 cells
与阴性对照比较,③P<0.001图3 不同Hp制剂预处理的LAD2细胞的脱颗粒率Fig.3 Degranulation ratio of LAD2 cells in different pre-treated groups by different Hp preparations
2.2Hp中最具LAD2肥大细胞活化作用的优势性PCs是PC17
2.2.1Hp 30种PCs对LAD2肥大细胞的直接活化作用 我们用分子筛离心将Hp尿素裂解液分成30个连续分子量梯度范围的组分(图4),命名为PC1-PC30。对这些PCs引起LAD2肥大细胞β-氨基己糖苷酶释放率的检测显示:在10 μg/mL的作用浓度下,PC3、9、10、17、27、28表现出较其余PCs更强的LAD2肥大细胞活化能力,与阴性对照比较,它们的促β-氨基己糖苷酶释放率均大于15%(P<0.001)(图5)。
自噬是维持细胞内环境稳态和实现自我更新的重要途径[2,65]。早在1995年,Nitatori等[66]报道短暂性CCAO可诱导沙土鼠海马CA1神经元组织蛋白酶B阳性自噬溶酶体增加和神经元损伤。近年来,自噬在缺血性神经元损伤中的作用受到关注,胶质细胞自噬与神经元损伤的关系亦被报道。但是,脑缺血后自噬的分子调控机制尚不完全清楚,自噬在脑缺血过程中起保护还是损伤作用一直存在争议[2]。
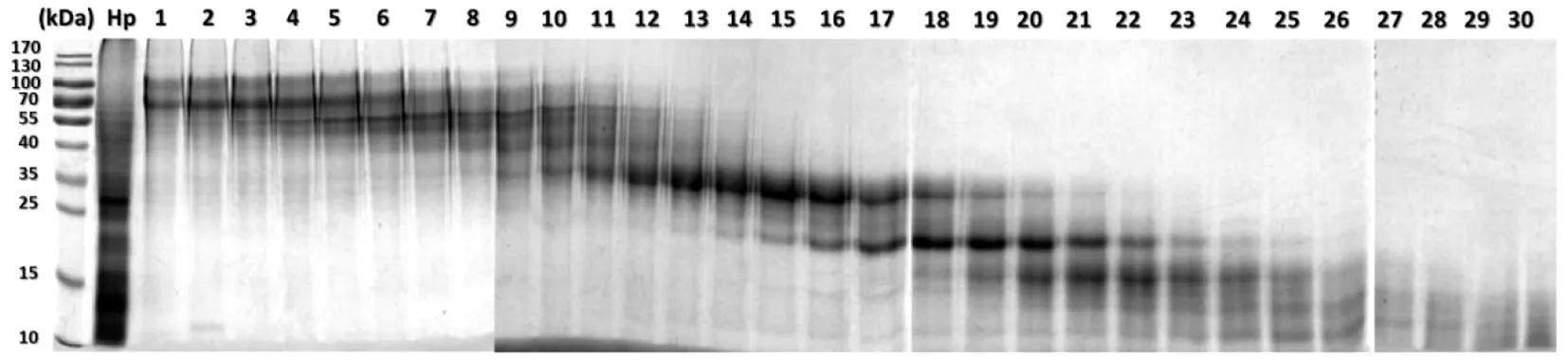
图4 Hp 30种连续分子量梯度的PCsFig.4 Display of Hp-PCs with different molecular weight ranges in SDS-PAGE

与阴性对照比较β氨基己糖苷酶释放率>15%,③ P<0.001图5 Hp 30种PCs对LAD2肥大细胞的直接活化作用Fig.5 Activation effects of 30 kinds of Hp-PCs on LAD2 cells
2.2.2Hp 6种优势性PCs对LAD2肥大细胞的潜在量效作用 通过检测不同浓度PC3、9、10、17、27、28促LAD2肥大细胞β-氨基己糖苷酶释放率显示,这6种PCs对LAD2肥大细胞的活化作用随着作用浓度的增加而增大。在2、4、8 μg/mL工作浓度下,PC17表现出较其它5种PCs更优的促β-氨基己糖苷酶释放能力,而且4 μg/mL的PC17和150 μg/mL Hp尿素裂解液的促β-氨基己糖苷酶释放率相当(P>0.05)。至此,我们在Hp中筛选出对LAD2肥大细胞有最强活化作用的PC17组分(图6)。
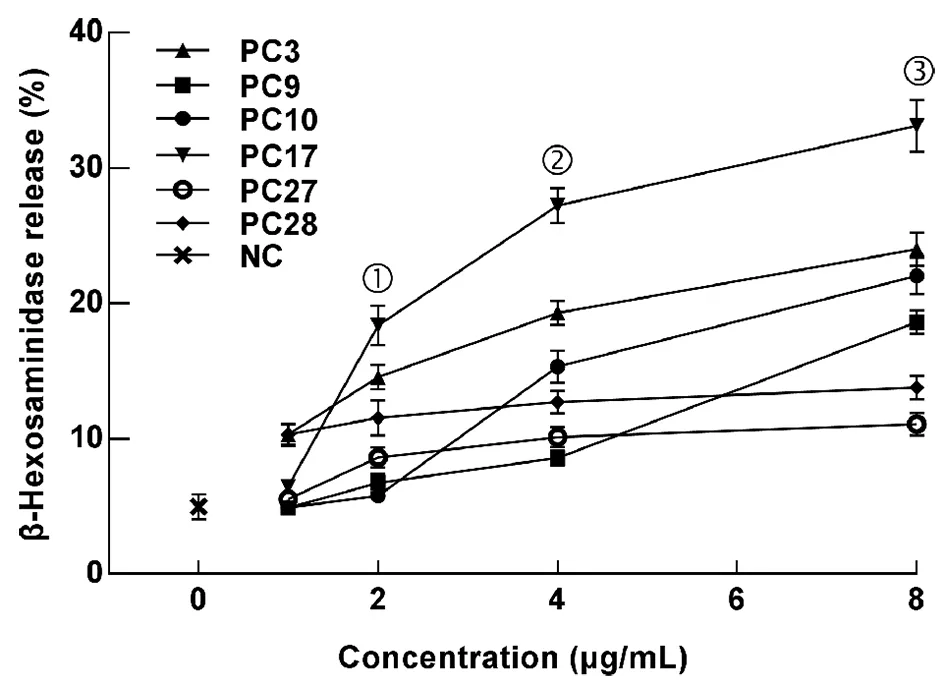
分别与2 μg/mL PC3, 9, 10, 27, 28预处理组比较,① P<0.05;分别与4 μg/mL PC3, 9, 10, 27, 28预处理组比较,② P<0.01;分别与8 μg/mL PC3, 9, 10, 27, 28 预处理组比较,③P<0.01;NC为 阴性对照。图6 Hp 6种优势性PCs对LAD2肥大细胞的活化作用Fig.6 Activation effects of top-six PCs on LAD2 cells
2.3PC17的蛋白质组分分析 通过将PC17的LC-MS/MS数据与GenBank中Hp-26695的NCBI.fasta数据库比对揭示,PC17主要包含23种蛋白质,它们的分子量在21~35 kDa之间(图7、表1)。
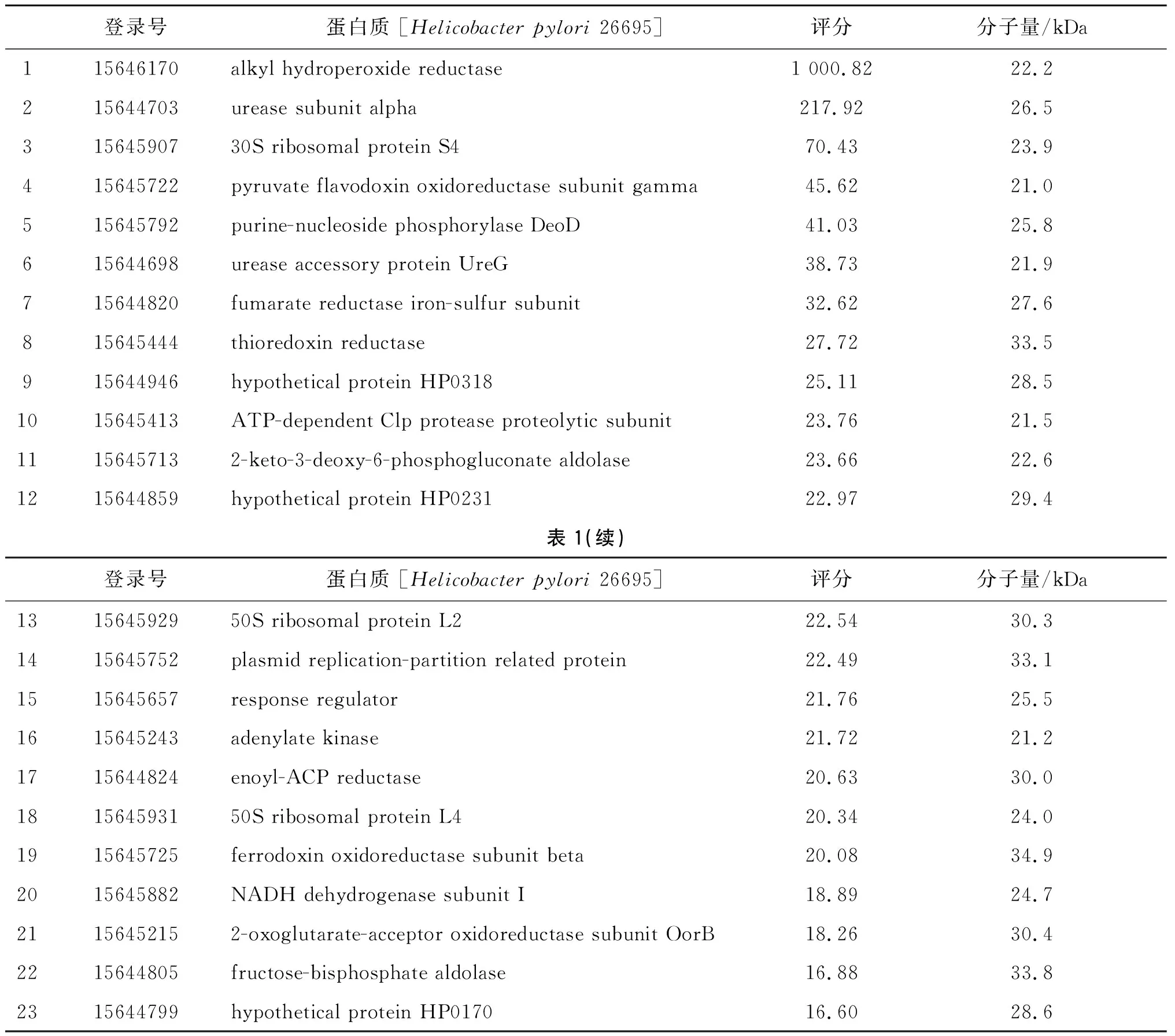
表1 与GenBank Hp-26695数据库比对确定PC17主要蛋白成分Tab.1 Proteins identification of PC17 against the GenBank of Hp-26695
以滞留时间内的质荷比表示(6~110 min)图7 PC17的质谱图Fig.7 Mass spectrum of PC17
2.4PC17对LAD2肥大细胞潜在的活化效应 为了明确PC17 对LAD2肥大细胞的具体激活效应,我们模拟了肥大细胞活化的即刻反应和延迟效应,评价了30 min内PC17促LAD2肥大细胞释放组胺、TNF-α的效能,以及共培养0.5、6、12、24 h后,促LAD2肥大细胞释放IL-3、IL-4、IL-17A、IFN-γ和LTB4的效能,结果显示:在30 min内,终浓度分别为2、4、8 μg/mL的PC17和150、200 μg/mL的Hp尿素裂解液均能有效激活LAD2肥大细胞释放β-氨基己糖苷酶、组胺和TNF-α,且这3种炎性介质的释放水平与刺激浓度呈正量效关系。就引起LAD2肥大细胞释放组胺和TNF-α的效能来看,PC17最小工作浓度分别为1 μg/mL和2 μg/mL,而Hp尿素裂解液最小工作浓度分别为100 μg/mL和150 μg/mL;就引起这3种炎性介质释放水平来看,4 μg/mL的PC17大致和150 μg/mL的Hp尿素裂解液效能相当(t1=0.441,t2=2.099,t3=0.441,P>0.05)(图8 (a)、(b)、(c))。
随着作用时间延长,4 μg/mL PC17和150 μg/mL Hp尿素裂解液均能显著刺激LAD2肥大细胞释放IL-3、IFN-γ和LTB4(6、12、24 h),这些炎性介质的释放水平与共培养时间呈正量效关系。并且,PC17的促IL-3释放水平在6、12、24 h,促IFN-γ释放水平在0.5、 6、 12、24 h,促LTB4释放水平在0.5、6 h,均优于Hp尿素裂解液(P<0.05);而两者促LTB4释放水平在12, 24 h无统计学差异(P>0.05)(图8 (d)、(e)、(f))。
4 μg/mL的PC17和150 μg/mL 的Hp尿素裂解液均不能有效激活LAD2肥大细胞释放IL-4、IL-17A,分别同阴性照比较,差异无统计学意义(P>0.05)。
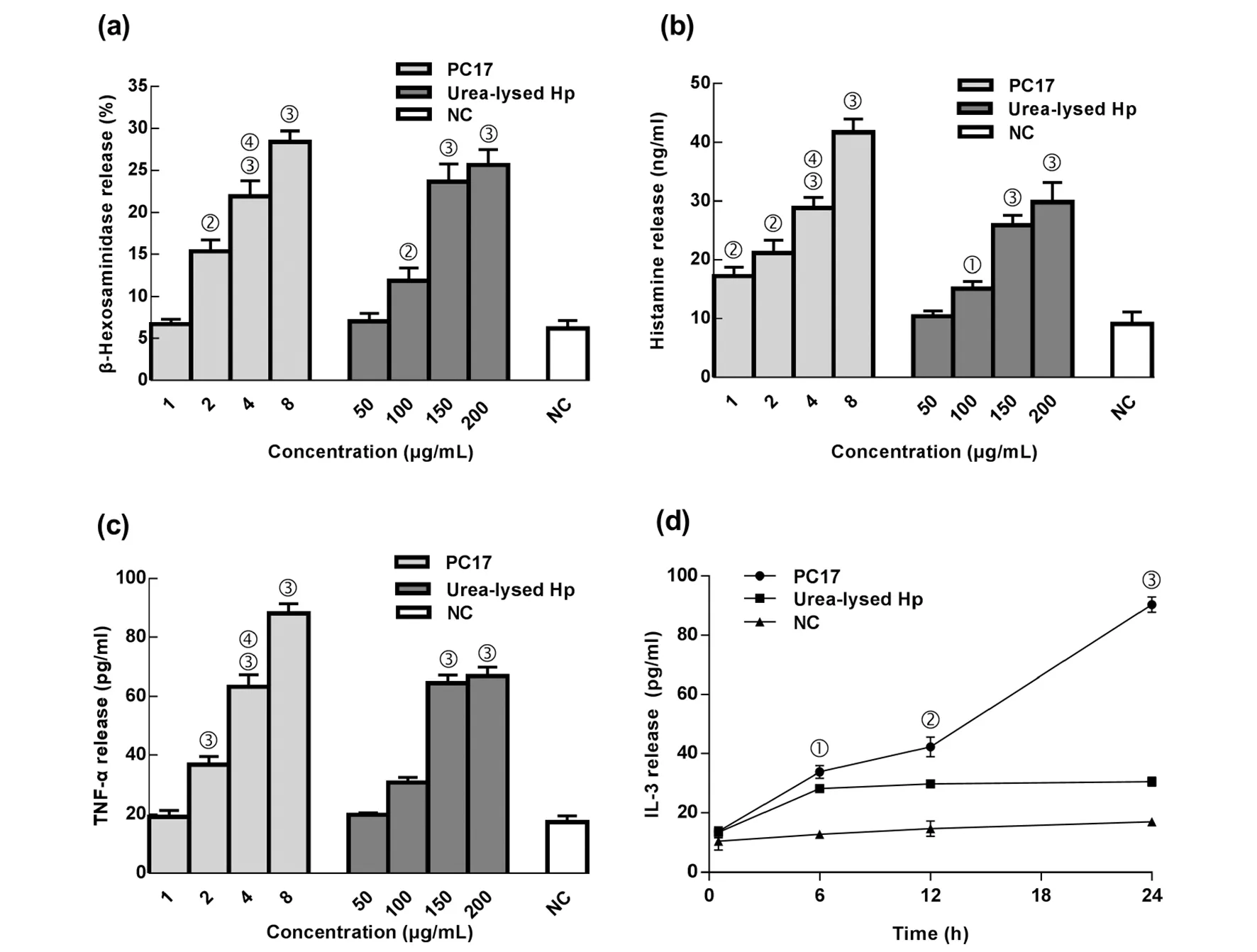
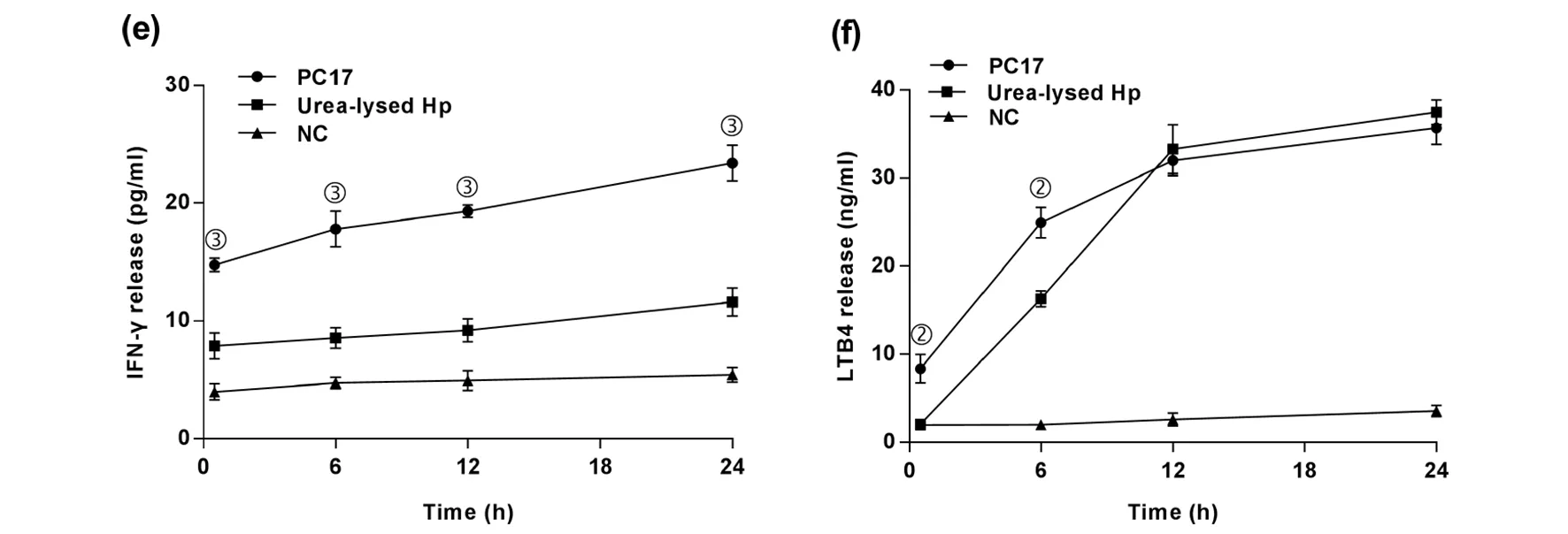
(a)β-氨基己糖苷酶释放, (b) 组胺释放, (c)不同浓度的PC17和Hp尿素裂解液促 TNF-α 释放。分别与阴性对照比较,① P<0.05,②P<0.01,③ P<0.001;与150 μg/mlHp尿素裂解液预处理组比较,④P>0.05。不同时间PC17和Hp尿素裂解液促(d) IL-3释放, (e) IFN-γ释放, (f) LTB4释放,与同一时间点Hp尿素裂解液预处理组比较: ① P<0.05,② P<0.01,③ P<0.001。NC:阴性对照。图8 PC17促LAD2肥大细胞释放炎性介质的作用Fig.8 Inflammatory mediators release from LAD2 cells induced by PC17
3 讨 论
Hp感染极其普遍,西方国家的感染率为25%~50%,而少数发展中国家甚至高达70%[15]。Hp感染与一些胃肠道系统疾病的发生和发展有密切关系,然而其致病机制仍未完全揭示,大量研究表明,Hp感染后胃肠道粘膜的肥大细胞数量及活性均增加[2-3],并且Hp的VacA和NAP蛋白有直接激活人或鼠肥大细胞的作用[4-6],提示肥大细胞的活化在Hp感染的致病机制中发挥重要作用。肥大细胞广泛分布于胃肠道粘膜固有层,它既是速发性变态反应的效应细胞,也是各种炎症形成发展过程中的关键细胞。Hp感染后寄生于胃粘膜上皮细胞,很难被机体彻底清除,可长期释放一些毒力蛋白如VacA和CagA等破坏胃肠道防御层完整性,引起粘膜糜烂或溃疡形成[16],给细菌及其代谢产物与粘膜固有层的肥大细胞接触提供了有效途径。因此,推测Hp感染后能够通过对胃肠道粘膜肥大细胞的潜在活化作用触发/参与Hp感染相关性疾病的发病。
为了验证这一推论,我们检测了3种Hp全菌制剂(Hp尿素裂解液、Hp超声裂解上清、福尔马林灭活的Hp)对人LAD2肥大细胞株的直接作用,结果显示,这3种全菌制剂均能在短时间内引起LAD2肥大细胞脱颗粒率和β-氨基己糖苷酶释放率增加,而且这种潜在活化效能呈剂量依赖性(图1)。但是,Hp主要通过哪种具体成分活化肥大细胞仍未可知。
尽管已有研究发现Hp的VacA、NAP等蛋白有直接激活肥大细胞的作用[4-6],但由于Hp菌体成分复杂,以上的研究仅限于单个蛋白水平,仍未能全面系统的揭示Hp对肥大细胞的直接活化作用。据此,我们将Hp尿素裂解液分解成为连续分子量梯度的30组蛋白组分,并评价它们对肥大细胞的活化效能。我们发现,其中有6组蛋白组分(PC3、9、10、17、27、28)均展示出了潜在的LAD2肥大细胞活化效应(图2 B),并且,PC17对LAD2肥大细胞激活作用最强(图2 C)。至此,我们首次从Hp全菌中筛选出了对LAD2肥大细胞潜在活化效应最强的蛋白成分。
鉴于肥大细胞活化后可合成和释放多种炎性介质,激发级联的炎症反应。接下来我们评价了Hp尿素裂解液和其PC17促LAD2肥大细胞炎性介质释放的潜在效能。研究发现不同浓度的PC17可以在短时间内激活LAD2肥大细胞释放β-氨基己糖苷酶、组胺以及TNF-α(图4 A、B、C),并且这种活化效应与PC17的工作浓度呈正量效关系。非常明确,肥大细胞被激活后首先释放胞浆颗粒中预合成的炎性介质,如β-氨基己糖苷酶、组胺、TNF-α、类胰蛋白酶、糜蛋白酶等[7-9]。组胺有很强的血管活性和平滑肌收缩效应,还可以和胃壁细胞H2受体结合,刺激胃酸分泌,直接导致胃粘膜损伤。同时,TNF-α能够趋化白细胞并进一步加重炎症反应,而中性粒细胞的浸润则是Hp致病的重要要机制之一,它可以释放大量细胞酶、溶酶体酶、氧自由基、花生四烯酸代谢产物等导致胃粘膜进一步受损[17]。由此,我们可以得出结论:Hp或主要通过其PC17组分,在短时间内活化LAD2肥大细胞,同时使细胞释放预先合成的炎性介质,且这种活化效应呈浓度依赖性。换句话说,在那些与Hp感染相关的胃肠道疾病中,Hp可能通过直接触发的方式使肥大细胞活化并脱颗粒,这一过程中最有效的作用成分可能集中在PC17蛋白组分中。
鉴于肥大细胞快速活化后的数小时内,可以发生以合成和释放新的炎性介质为特点的延迟效应[9],因此,我们也就PC17 对LAD2肥大细胞的活化作用进行了时间依赖性评估。我们发现,PC17或Hp尿素裂解液均能够有效促LAD2肥大细胞分泌IL-3、IFN-γ和LTB4,并且这种促分泌效应呈时间依赖性。随着反应时间的增加,PC17较Hp尿素裂解液促LAD2细胞分泌更多的的 IL-3和IFN-γ(图4 D,E),促LTB4分泌在两组均随时间增加而达到高水平(图4 F)。在两类预处理组中,LAD2肥大细胞释放IL-4、IL-17A的水平随时间无显著变化(数据未展示)。已揭示IL-3参与了嗜酸性粒细胞的生长、存活和活化[18],而嗜酸性粒细胞浸润是胃肠道Hp感染的组织学特征之一;IFN-γ、LTB4可以招募淋巴细胞、单核细胞、中性粒细胞,在促发炎症和组织损伤中发挥重要作用[8,19]。因此,我们认为,在那些与Hp感染相关性疾病病程中,Hp主要利用它优势性的PC17组分,不仅可能迅速激活肥大细胞释放胞内存储的炎性因子导致胃肠道的急性损伤,而且可能通过促肥大细胞不断合成和分泌更多的炎性介质如IL-3、IFN-γ、LTB4等诱导级联的炎症反应,产生持续性损伤。尽管IL-4和IL-17被报道在Hp感染相关性疾病发病中发挥了一定作用[11],但在我们的研究中,并没有发现PC17有促肥大细胞释放这两种炎症介质的能力。这至少可以表明,Hp并不能通过直接促肥大细胞分泌IL-4和IL-17而致病。本研究还发现,即使PC17的工作浓度(4 μg/mL)明显低于Hp尿素裂解液(150 μg/mL),PC17仍可能活化LAD2肥大细胞,促其释放和150 μg/mL Hp尿素裂解液预处理水平相当的β-氨基己糖苷酶、组胺、TNF-α、LTB4(图4 A,B,C,F),以及水平更高的IL-3、IFN-γ(图4 D,E)。因此我们有理由推论,PC17对LAD2肥大细胞的作用可以代表Hp对人肥大细胞的主要潜在活化作用。
肥大细胞作为一种组织固有细胞,不仅可以通过高亲和力的IgE受体参与适应性免疫反应,也能对细菌感染作出反应,参与先天免疫反应[20]。一些肥大细胞的表面受体,如Toll样受体(TLR)TLR2、TLR4,可以识别细菌并引起细胞活化[21],因此我们推测,Hp,尤其是其PC17组分,可能通过被肥大细胞TLRs识别并进一步触发先天性免疫应答而参与其致病进程。
为了进一步揭示PC17的具体成分,我们对其进行了LC-MS/MS分析表明,PC17主要包含23种分子量区间在21~35 kDa的蛋白(表1)。虽然目前对这23种蛋白的肥大细胞活化作用知之甚少,但其中的Hp脲酶及其亚基已被推测具有肥大细胞活化效力,因为它可能与可诱发大鼠肥大细胞释放组胺的刀豆脲酶有相同的性质[22]。
综上所述,本研究明确了Hp对人LAD2肥大细胞株潜在的直接活化作用,并首次从Hp全菌中系统地筛选出对LAD2肥大细胞活化作用可能的最强的蛋白组分,探究了其致病效能和具体蛋白质成分。虽然本研究并不尽善尽美,PC17中具体效应蛋白质仍需要进一步确定,但该研究一定程度上揭示了Hp感染相关性疾病的发病机制,为找到针对性治疗的靶点提供线索。
利益冲突:无
