基于GEO数据分析参与MERS-CoV感染致病的信号传导通路和关键分子
2020-09-22师浩桐张淑婷樊卫萍李军锋
师浩桐,张淑婷,樊卫萍,李军锋,姚 红
近年来高致病性冠状病毒多次暴发流行侵扰人类,从2003年中国暴发的SARS-CoV,到2012年的中东地区流行的中东呼吸综合症冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)[1]再到2019年年底的新型冠状病毒(2019-nCoV)。这些病毒的暴发流行引发了人类对该类病毒深入研究的热潮。其中MERS-CoV是2012年6月首次在沙特阿拉伯地区发现的目前为止的致病率最高、致死率最高的冠状病毒[2],蝙蝠可能为其第一宿主[3],骆驼被证明是其中间宿主,已经证明该病毒可以在骆驼之间相互传播,而后发生了从骆驼到人之间的传播[4]。该病毒感染人后除少数患者以胃肠道症状为首发体征的病例外,主要引起的呼吸道症状,后续可能会发生呼吸窘迫,缺氧发生进而导致呼吸衰竭[5]。
截止到2019年11月,全球有2 494人感染了MERS-CoV,这些患者分布在全球27个国家,包括沙特阿拉伯、韩国、伊朗、约旦、卡塔尔、英国、美国、中国和泰国,其中有858人死亡(病死率:34.4%),其中大部分病例来自于阿拉伯地区。这种病毒较其他冠状致病性更强,致死率更高。MERS-CoV感染宿主致病机制依然不清楚,对其致病机制的研究将有利于制定更为有效的防控策略,以及开发出更高效的治疗和防护手段。
病毒是依赖于宿主细胞进行复制和传播的一类微生物。病毒感染宿主细胞,与宿主之间存在复杂的相互作用。通过影响宿主基因表达是病毒维护自身生存和复制的重要策略,也是病毒影响宿主细胞功能引起疾病的重要原因。MERS-CoV是基因组为长度约27~32 kb的单链正义RNA病毒,病毒蛋白组较为复杂。与其他RNA病毒比较,与该病毒相关受到病毒调控的宿主因子虽有一些报道,但认识仍处于早期阶段[6]。目前还没有针对MERS-CoV感染引起宿主细胞特别是呼吸细胞基因表达改变的系统全面分析的文献报道。MERS-CoV主要通过感染呼吸道的细胞,引起呼吸系统及全身疾病。为了更全面的理解MERS-CoV与呼吸道上皮的相互作用,全面分析参与保护病毒、促进病毒复制和致宿主疾病的宿主因子。我们拟选择MERS-CoV感染呼吸道上皮基因表达谱数据进行分析。对病毒引起的宿主表达差异基因进行筛选,分析这些基因功能,细胞分布,参与的生物过程及参与的细胞信号通路。分析这些异常的信号通路是否参与病毒致病,为确定病毒致病的分子机理提供帮助。我们还将从差异表达分子中筛选致病关键分子,为寻找新的治疗靶标,探索新的治疗策略提供数据。
1 研究方法
1.1数据集的获取和分析 在美国国立生物中心(US National Center for Biotechnology Information, NCBI)网站GEO(gene expression omnibus )数据库中搜索MERS-CoV感染的肺相关细胞的芯片数据。检索关键词MERS-CoV 查询到ID号为200100504,芯片数据编码为:GSE100504。该芯片为MERS-CoV标准株EMC2012病毒感染的人气道上皮细胞,以每个细胞5 个PFU病毒量感染病毒,包括50个样品,分为对照细胞组和感染细胞组,两组收集的时间点为感染后0、12、24、36和48 h计5个时间点,每个时间点有5个平行感染重复。
1.2差异表达分析 使用基于Bioconductor项目中的GEOquery和limma R包的在线分析工具GEOR分析各个时间点的对照组和实验组的各个基因的表达情况,以典型的差异最明显的48 h的时间点作为差异分析的数据。筛选差异P<0.05,表达值增加或降低两倍以上的基因作为差异基因,差异基因的表达分布展示则依据其表达增加或降低倍数及P值,使用R语言的ggplots2包制作火山图。
1.3差异基因的功能富集 以上述筛选到的差异明显表达上调和表达下调的基因作为研究对象,使用生物信息数据库DAVID(the Database for Annotation, Visualization and Integrated Discovery)对筛选出基因的分子功能(Molecular Function, MF)、参与的生物过程(biological process, BP)和细胞组成(cellular component, CC),以及在细胞中参与的KEGG(京都基因与基因组百科全书 Kyoto Encyclopedia of Genes and Genomes)信号通路。
1.4差异基因相互作用分析及关键基因筛选 以上述差异基因为分析对象, 使用String 网站在线分析基因之间的相互作用,构建相互作用的网络。设置最小相互作用分数为highest confindence 0.900,对得到的网络数据引入cytoscape中Network,使用cytoscape软件中的cytohubba插件计算,选择degree拓扑分析法前10个基因,作为基因相互作用网络中起关键作用的节点基因。
2 结 果
2.1MERS-CoV感染的对支气管上皮细胞基因表达的影响 使用GEOR在线分析GEO数据库GSE100504表达谱芯片数据。研究MERS-CoV感染的支气管上皮原代细胞,在不同时间点未感染组和感染组之间的基因表达差异。选择差异最为明显的感染48 h作为研究对象进行差异倍数分析。选择P<0.05,且基因表达差异大于两倍的基因作为差异表达基因。结果筛选到了差异表达基因1 553个基因,其中表达增加850个,表达降低703个,各个基因表达差异及P值分布使用R语言的 ggplot2包分析得到火山图(图1),其中绿色点为差异明显的基因分布点。
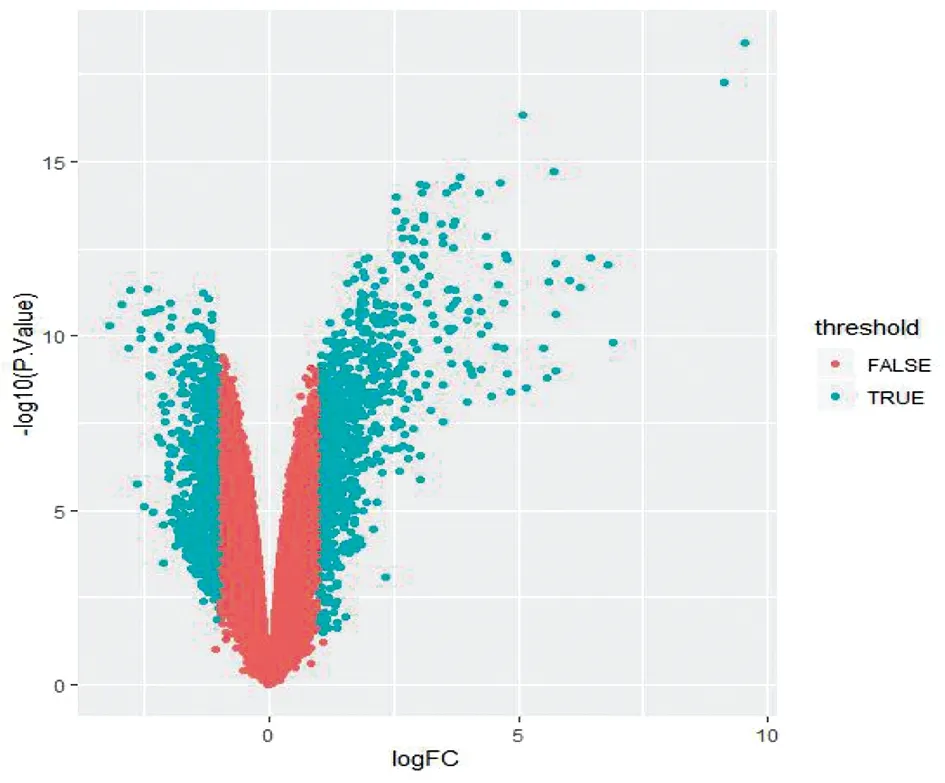
Volcano Plot indicated up-regulated and down-regulated mRNAs. The abscissa represents log2FC and the ordinate represents log10(adjusted P-value). The green plots represent different expression genes图1 MERS-CoV感染的对支气管上皮细胞基因表达的影响Fig.1 Effect of MERS-CoV infection on gene expression of bronchial epithelial cells
2.2差异基因的基因功能分析 通过研究病毒感染细胞差异基因的功能,可以发现参与疾病的基因。为了研究MERS-CoV病毒引起的细胞基因改变是否参与病毒的致病,首先研究这些基因在细胞中的功能,对上述MERS-CoV感染引起支气管上皮细胞基因表达差异明显的基因进行GO功能注释。分别以表达上调和表达下调的基因为研究对象,分析差异表达基因的功能、细胞组成及参与的生物过程。结果显示:表达上调分子广泛分布于支气管上皮细胞的胞质、角质化包膜、细胞外空间、核小体、线粒体外膜、MHCI类蛋白质复合物、中间丝等细胞不同区域(图2A)。在分子功能上具有与白介素1受体,双链RNA,CXCR3趋化因子受体等分结合特性,这些分子部分属于结构分子,转录因子、趋化因子等,部分具有功能酶等活性(图2B)。主要参与病毒防御反应、抑制病毒复制、免疫反应、炎症反应、细胞凋亡以及参与干扰素信号通路和Ikβ激酶/NF-κβ介导通路等生物过程(图2C)。
而表达下调的分子则主要分布于支气管上皮的运动纤毛、微管、中心体、细胞器膜、细胞外泌体和细胞质等区域(图2D)。这些分子在功能上参与微管运动,结合铁离子,NADH/NAD以辅助细胞能量供应的呼吸链,具有氧化还原酶,醛酮还原酶(NADP)醇脱氢酶活性等分子功能(图2E)。主要参与了细胞氧化还原,醛代谢过程,支气管上皮纤毛形态发生、组装和运动,细胞微管运动,以及细胞分裂时的染色体分离过程(图2F)。
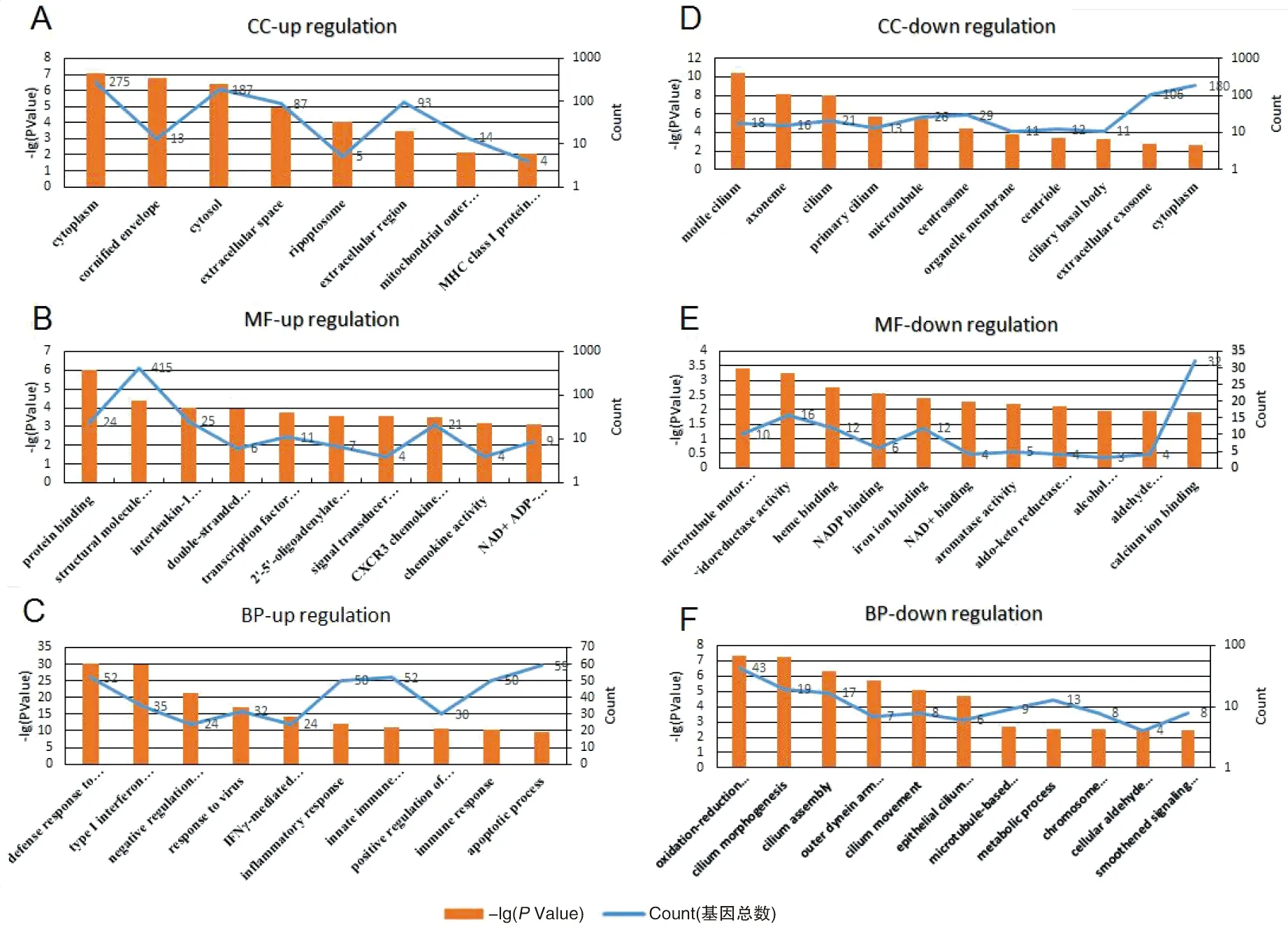
The top enriched Gene Ontology (GO) terms in biological process, cellular component, molecular function and biological process of the differently expressed genes. Top 10 enriched CC (cell component) of the upregulated DEGs (A) and downregulated DEGs(D); Top 10 enriched MF (molecular function) of the upregulated DEGs (B) and downregulated DEGs (F). Top ten enriched BP (biological process) of the upregulated DEGs (C) and downregulated DEGs (F). (C) The yellow histogram represents -log10 (P-Value), and the blue line represents the total number of related genes.图2 差异表达基因GO功能分析Fig.2 Gene ontology (GO) enrichment analyses of the differentially expressed genes
2.3差异基因参与的主要KEGG通路分析 KEGG是一个整合了基因组、化学和系统功能信息的数据库。用于分析分子水平的信息,尤其是基因组测序和其他高通量生成的大规模分子数据,集中了解生物系统高级功能的实用工具。为了更明确的理解MERS-CoV对细胞功能的影响,分析了感染MERS-CoV病毒引起的细胞表达增加和表达下降两类基因参与的KEGG通路。结果发现:MERS-CoV感染上调的信号通路包括,甲型流感、单纯疱疹感染和麻疹感染引起的信号通路,还参与了TNF、Toll样受体、NOD样受体和Jak-STAT信号通路并且能参与细胞因子与受体相互作用以及参与胞浆DNA传感途径(图3A)。而病毒感染后细胞表达下降的分子则主要参与了糖酵解/糖异生通路、影响了细胞色素P450对药物和外源物质代谢,对药物、碳、视黄醇、谷胱甘肽、丙酮酸等多种物质的代谢,以及类固醇激素的合成(图3B)。
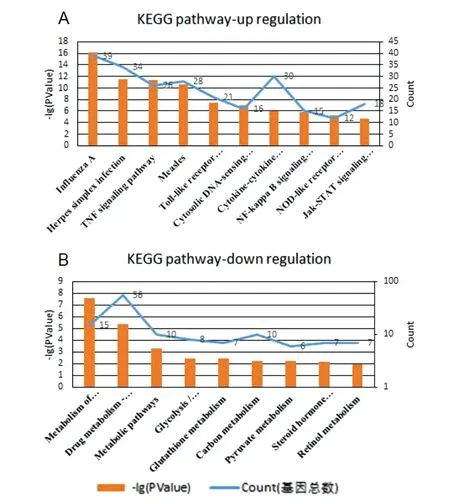
Top ten enriched pathways of the upregulated genes(A), and the downregulated genes(B). The yellow histogram represents P-Value and the blue line represents the total number of related genes.图3 差异基因与的KEGG通路分析Fig.3 Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway analyses of the differentially expressed genes
2.4差异基因相互作用网路分析和关键分子的筛选 细胞内的蛋白质通过非共价键的相互作用形成蛋白复合体是其存在于机体每个细胞的生命活动过程中发挥作用的主要形式。研究病毒感染差异基因之间的相互作用有助于挖掘疾病机制及起关键作用的分子。分别以MERS-CoV病毒感染后细胞内表达增加的基因和表达降低的基因为研究对象,分析基因间的相互作用(图4)。结果这些分子之间存在复杂的相互作用。对相互作用网络使用cytoscape软件的cytohubba插件进行拓扑结构评分,发现:在表达上调的基因形成相互作用网络中,IRF7、HLA-A、IRF1、OASL、IRF9、HLA-B、OAS1、HLA-E、HLA-F和OAS2为关键的hub基因。而在表达下调的基因形成复杂的相互作用网络中,CDK1、DLGAP5、TOP2A、NUSAP1、CCNB2、KIF20A、BIRC5、CCNB1、CENPF和PBK为关键的Hub基因(表1)。
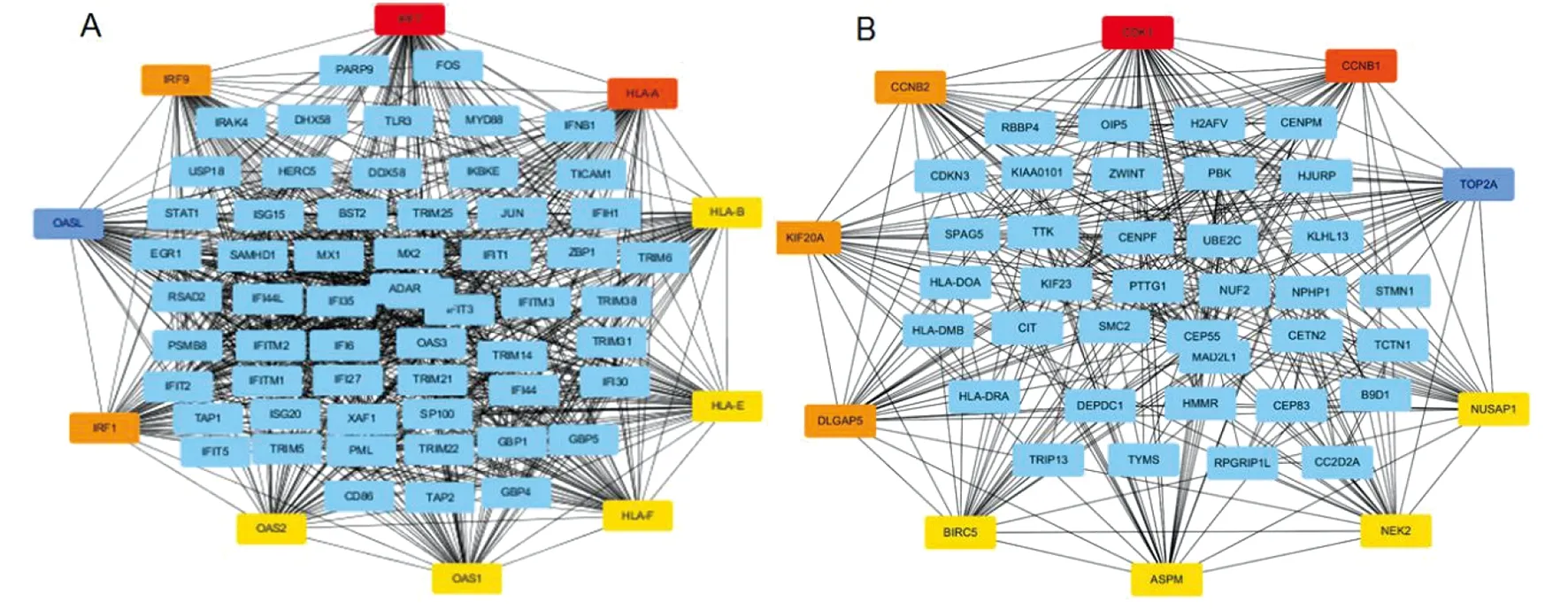
The up-regulated (A) down-regulated (B) genes were analyzed for the interaction network图4 差异表达基因相互作用网路分析Fig.4 Protein-protein interaction (PPI) network analysis of the differentially expressed gene
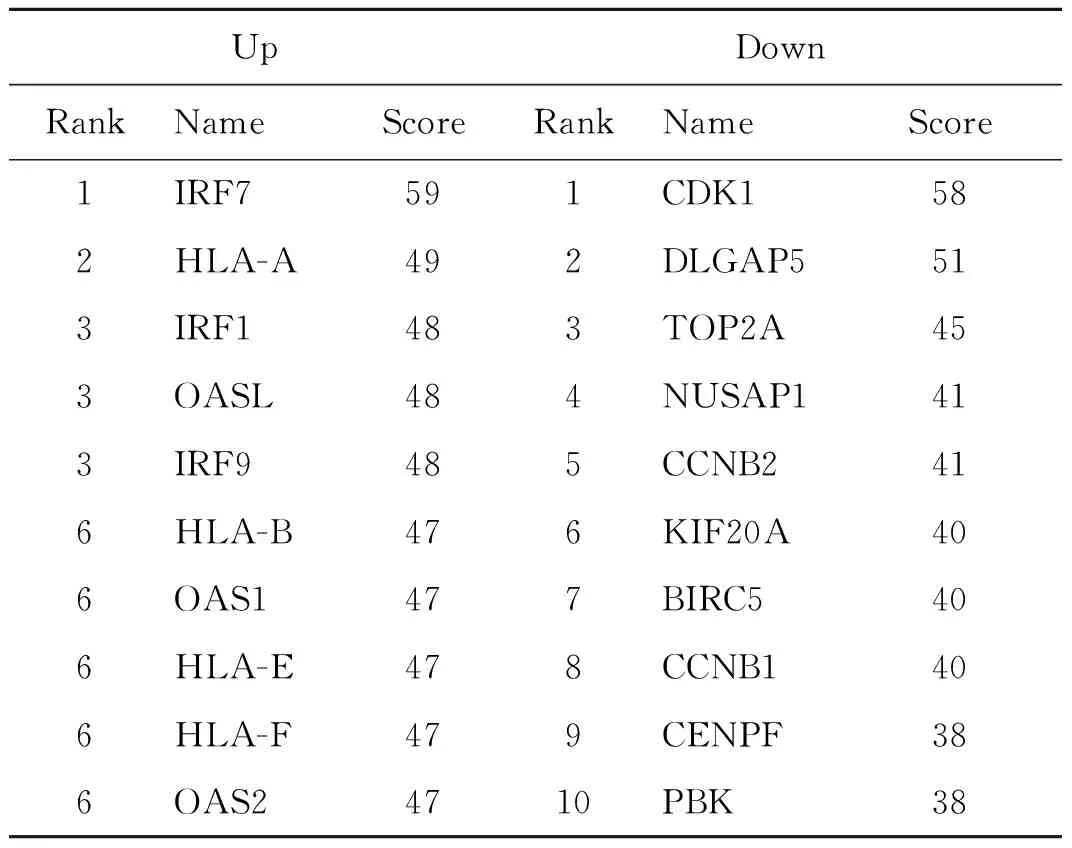
表1 差异基因相互作用网络中的关键分子Tab.1 Top 10 hub genes identified in protein-protein interaction(PPI) network of the differentially expressed gene
3 讨 论
自2012年新型冠状病毒MERS-CoV病毒由动物传播给人类被发现以来,不断有新发感染新病例的报道。该病毒具有高致病性和高致死性的特性。其致病和致死机制研分子机理虽有很多的研究但仍不完全清楚。目前已知MERS-CoV病毒主要通过其S蛋白与细胞上的DPP4受体结合感染细胞[7],感染呼吸道,引起呼吸系统为主的相关疾病,包括咳嗽、发热、呼吸急促、胸痛,严重者会发生呼吸衰竭。病理上以弥漫性的肺泡损伤为主要特征,免疫生化检测显示病毒主要存在于肺泡上皮细胞中[8]。因此,病毒对肺上皮细胞功能的影响在病毒致病中起到了重要的作用。
生物体的一切生命现象都与基因有关,细胞的正常的生理功能通过维持正常基因表达状态来实现的。研究病原体对宿主基因表达的影响,将有利于探索病原体感染宿主后病原体破坏宿主对病原体的抵抗机制,以及病原体本身对宿主细胞、组织乃至机体产生的病理改变,对于明确其分子机制具有重要意义。为了研究高致病性的MERS-CoV病毒的致病机制,本研究选择了MERS-CoV标准病毒株(HCoV-EMC/2012 strain)感染原代的肺支气管上皮细胞的表达谱数据进行分析,该数据集包含了严格的实验组和对照组,每组5个平行对照,还含有具有0~48 h 5个不同感染时间点。初步分析显示相同基因组内信号均一性良好,提示整体实验误差较小。以高质量且丰富的表达谱数据做为研究对象,将有助于降低分析的假阳性和假阴性。
在对基因的差异表达分析中发现,病毒感染引起了宿主细胞大量基因表达改变。以P值小于0.05且差异两倍以上为筛选标准,累计筛选到1 553个差异表达基因,其中表达增加的850个基因,表达下降的703个基因(图1)。为了研究这些差异基因在细胞中的功能以及是否参与致病,我们对这些表达增加和下降的基因分别进行了GO分析和KEGG信号通路分析,分析了这些基因在细胞中的位置分布,分子功能以及参与的生物学过程。结果发现: 差异表达的基因广泛分布于细胞的各个组分,分子功能各异,这些分子参与了细胞多种生物学过程和信号通路。
其中表达上调的基因主要参与对病毒的防御以及对抗病毒的复制,且与细胞的免疫反应和炎症反应有关。与多种细胞干扰素通路和细胞的凋亡有关。促进了机体免疫和炎症的发生,这些与临床特征相符。而细胞的抗病毒作用则是机体具有的天然对抗MERS-CoV的作用。从分析结果可知:引起免疫和炎症反应仍是MERS-CoV病毒对组织的主要影响,而促进肺上皮细胞的凋亡与前期文献报道[9]一致,可能是肺机能障碍主要原因之一。分析结果还显示:MERS-CoV感染引起的表达下调的基因主要参与了支气管纤毛形成和运动、微管运动、糖酵解和多种物质的代谢。纤毛是细胞游离面伸出的能摆动的长的突起,其外部有一层质膜,内部是由微管组成的轴丝组成。纤毛的摆动与微管的滑动有关。呼吸道大部分的腔面为有纤毛的上皮,由于纤毛的定向摆动,呼吸道可以把颗粒物和外来微生物排出。呼吸道的粘液/纤毛清除功能是除物理屏障和非特异性免疫之外的呼吸系统三大防御机能之一[10]。上述分析的结果提示MERS-CoV病毒感染干扰了支气管上皮的防御功能,促进了继发感染对呼吸系统的损伤作用,另一方面无法排除的物质可阻塞了气道,抑制了气体交换加剧缺氧症状。在缺氧的条件下,细胞的能量供应需要借助糖酵解,而MERS-CoV又通过调控基因表达抑制了糖酵解的发生,阻断了细胞的能量供应,进一步加剧了细胞的损伤。
为了进一步探索起关键作用的hub分子,明确MERS-CoV致病的分子机制。我们分别分析了表达上调基因之间和下调基因之间的相互作用。结果提示差异基因之间存在复杂的相互作用。使用degree拓扑分析法对相互作用网络进行了评分,结果确定了相互作用网络中起关键作用的一些分子。这些分子包括干扰素调节因子IRF7,IRF9,IRF1,寡核苷酸合成酶1,2,L,人白细胞抗原HLA-A,B,E,F。周期蛋白依赖性激酶(CDK1),细胞周期素B(CCBB1, CCNB2)拓扑异构酶(TOP2A),核仁和纺锤体相关蛋白(NUSAP1)。这些分子对于细胞生存和免疫识别中等重要生理功能中起到了重要作用,MERS-CoV引起这些分子表达的改变在可能该病毒致病过程中起关键作用。
总之,MERS-CoV病毒感染宿主后会发生复杂的相互作用,一方面宿主细胞在病毒感染后启动基因表达以抑制病毒的复制,启动干扰素等抗病毒信号通路保护自身,另一方面病毒则通过促进宿主细胞凋亡,抑制支气管上皮纤毛的防御功能,促进继发感染,加剧缺氧,降低细胞能量供应等方式对抗宿主,引起宿主的病理改变甚至于导致宿主死亡。这些差异基因的分子表达及其参与细胞内的生物过程和信号通路可能在MERS-CoV与人体相互作用(包括机体抗病毒的作用和病毒致病)中起到了重要作用。这些新机制和分子的发现可能会为病毒感染后的病情诊断,新型靶标的筛选和新型治疗策略的制定提供帮助。
利益冲突:无
