金黄色葡萄球菌凝固酶coa基因的克隆、表达及其生物活性分析
2020-09-22郭海勇朱小雨赵研彤林依丹计银铎宋勤叶
郭海勇,赵 雪,朱小雨,赵研彤,林依丹,施 爽,李 铄,计银铎,宋勤叶
金黄色葡萄球菌(Staphylococcusaureus)是引起人及动物感染的重要致病菌之一,随着抗生素的广泛大量应用,金黄色葡萄球菌耐药菌株呈现多重耐药性,且具有持续进化的抗药性机制,其中耐甲氧西林金黄色葡萄球菌(Methicillin-resistantS.aureus,MRSA)的传播已超出医院感染的传播范围,成为社区获得性(community-acquired methicillin-resistantS.aureus,CA-MRSA)和家畜获得性(livestock-associated MRSA,LA-MRSA)病原菌,通常引起皮肤和软组织感染,也能引起严重的侵袭性疾病,如坏死性肺炎、脓毒血症、心内膜炎等[1]。MRSA还能引起奶牛、羊的乳腺炎及猪、禽、兔等其他动物的葡萄球菌病,给养殖业带来重大经济损失[2]。
凝固酶(coagulase,Coa)和血管性血友病因子结合蛋白(von Willebrand factor binding protein,vWbp)是金黄色葡萄球菌分泌的两种促进凝血的蛋白,能非酶解性地激活凝血酶原,在宿主感染过程中起到关键作用[3-4]。Coa是一种含有670个氨基酸左右的蛋白质,且在不同的菌株中长度不同[5],由N-末端部分的D1-D2结构域和C-末端部分的27个残基片段的R结构域串联重复组成。宿主凝血酶原的激活是通过Coa的N端高度可变的D1-D2结构域介导的,C端保守的R结构域通过将纤维蛋白原引导到金黄色葡萄球菌表面,产生抑制吞噬作用的纤维蛋白保护膜,从而高效地逃避固有免疫系统的识别和消除[6-7],同时也能应对抗生素的杀伤作用[8],引起严重的感染性疾病。
金黄色葡萄球菌感染和食物中毒事件已成为世界性的公共卫生问题,寻找对侵袭性金黄色葡萄球菌感染的保护性免疫一直是研究的主要目标,但目前还没有较理想的金黄色葡萄球菌疫苗成功[9]。研究显示,金黄色葡萄球菌凝固酶失活或被中和可预防葡萄球菌感染,说明以凝固酶制备的疫苗或凝固酶抑制剂可以作为治疗金黄色葡萄球菌感染的一种替代策略[3,10-11]。本研究首先构建了表达金黄色葡萄球菌USA300 CA-MRSA 923 的原核表达质粒pET-24b-coa,在IPTG诱导下体外表达了Coa重组蛋白,通过血浆凝固酶试验和动物试验,检测了表达的重组Coa(rCoa)的生物活性,旨在为研究开发以金黄色葡萄球菌Coa作为靶点的金黄色葡萄球菌疫苗和抗该菌感染的抑制剂奠定基础。
1 材料与方法
1.1菌株和载体 金黄色葡萄球菌 923(USA300 CA-MRSA)、E.coliDH10B 菌株由美国明尼苏达大学计银铎教授馈赠,E.coliBL21(DE3)菌株为吉林师范大学微生物研究室保存。pET-24b(+)表达载体为Novagen公司产品。
1.2主要试剂 Taq DNA聚合酶、限制性内切酶BamHI、XhoI为美国Thermo Scientific公司产品;基因组DNA提取试剂盒、Prestained Protein Marker Ⅲ购自天根生化科技(北京)有限公司;胶回收、质粒小提试剂盒购自宝生物工程(大连)有限公司;Ni-Agarose His 标签蛋白纯化试剂盒购自北京康为世纪生物科技有限公司;BCA蛋白浓度测定试剂盒购自biosharp生物科技公司;1 kb DNA Ladder、 Color Prestained Protein Standard购自NEB(北京)公司;硝酸纤维素膜为Pharmacia公司产品。兔抗His-tag抗体、HRP标记羊抗鼠IgG、羊抗兔IgG均购自北京索莱宝科技有限公司。金黄色葡萄球菌重组蛋白rSarZ,由本实验室制备并保存。
1.3实验动物 7周龄BALB/c雌性小鼠购自河北医科大学实验动物中心,小鼠饲养于温度为25 ℃的洁净动物室,12 h光照,自由采食和饮水。购入小鼠饲养7 d后开始进行动物实试验。
1.4引物设计与合成 根据GenBank报道的金黄色葡萄球菌coa基因序列(Accession No. AB488504)以及表达载体pET-24b(+)酶切位点设计特异性引物,F1:5′-TTTGGATCCATGAAAAAGCAAATAATTTC-3′,下划线序列为BamHⅠ酶切位点;R1: 5′-CCGCTCGAGTTTTGTTACTCTAGGCCCAT-3′,下划线序列为XhoI酶切位点,目的片段长度为1 989 bp。测序通用引物T7 promoter F:5′-TAATACGACTCACTATAGGG-3′,T7 Terminator R:5′-GCTAGTTATTGCTCAGCGG-3′。引物由上海生物工程技术有限公司合成。
1.5coa基因的PCR扩增 利用细菌基因组提取试剂盒提取金黄色葡萄球菌 923(USA300 CA-MRSA)基因组DNA,以其为模板进行PCR扩增。反应体系为50 μL:10× Ex Taq buffer 5 μL,dNTP mix 5 μL,2.5 mmol/L Mg2+5 μL,上、下游引物各1 μL(0.2 μmol/L),Ex Taq DNA聚合酶0.25 μL(1.25U),DNA模板2 μL,无菌水补至50 μL。反应条件:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 30 s,68 ℃ 2 min 30 s,30个循环;72 ℃ 5 min后终止反应。PCR产物经0.8 %琼脂糖凝胶电泳分析。
1.6重组质粒的构建及鉴定 PCR 产物经琼脂糖凝胶电泳后,用DNA纯化试剂盒回收PCR产物,用BamHⅠ和XhoⅠ双酶切。同时用BamHⅠ、XhoⅠ双酶切pET-24b(+)表达载体,纯化回收并在T4 DNA连接酶的作用下与coa基因连接,构建重组表达质粒pET-24b-coa。将5 μL重组质粒pET-24b-coa加入到50 μLE.coliDC10B感受态细胞中混匀,冰上放置20 min;将质粒与感受态细胞混合物转入电转化杯中,立即用电穿孔仪转化(BIO-RAD MicroPulser),输出电压为1 800 V,脉冲持续时间为5 ms。电转后感受态细胞经卡那霉素(50 μg/mL)抗性筛选,挑取阳性菌落提取重组表达质粒pET-24b-coa,经BamHⅠ和XhoⅠ双酶切及PCR鉴定后,将质粒送上海生物工程技术有限公司测序。
1.7重组蛋白的诱导表达 将阳性质粒转化至感受态细胞E.coliBL21(DE3),涂布于含卡那霉素(50 μg/mL)的LB平板,37 ℃培养过夜,挑转化后的单菌落接种于含卡那霉素(30 μg/mL)和氯霉素(34 μg/mL)的LB培养基中,30 ℃ 200 r/min 培养过夜,然后按照1∶100接种到含卡那霉素和氯霉素抗性的LB液体培养基中,30 ℃ 200 r/min 培养至OD600达到0.6 时加入终浓度为1 mmol/L的IPT G诱导,30 ℃ 200 r/min培养,于诱导0、1、2、3、4、6 h 分别取样1 mL制备蛋白上样,进行12% SDS-PAGE分析确定最佳诱导时间,以培养过夜的空载体 pET-24b(+)作为阴性对照。
1.8重组蛋白表达形式分析与纯化 在确定最佳诱导条件后,菌液培养至OD600=0.6时,加入终浓度为1 mmol/L的IPTG,30 ℃,200 r/min振摇诱导培养4 h,4 ℃ 8 000 r/min离心10 min收集菌体,每100 mg菌体加入2 mL细菌裂解液重悬,冰浴超声破碎(功率45 %,工作10 s,间隔10 s)直至清亮不粘稠,4℃ 10 000 r/min离心20 min,分离上清和沉淀。分别取上清和沉淀进行SDS-PAGE分析重组蛋白的表达形式。按照说明,用Ni-Agarose His 标签蛋白纯化试剂盒纯化目的蛋白和BCA蛋白浓度测定试剂盒测定目的蛋白含量,分装后-20 ℃保存备用。
1.9Western blot 检测 将纯化的重组蛋白rCoa进行SDS-PAGE分析,然后将蛋白质转移至NC膜上,以封闭液(TBST+5%脱脂乳)4 ℃ 封闭过夜,与兔抗His-tag抗体(1∶1 000)室温反应2 h;洗膜,加入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶2 000),室温反应2 h,洗膜后,以DAB显色试剂盒避光显色5 min,蒸馏水终止显色,观察结果、拍照。
1.10重组蛋白凝固活性检测 按照医学实验标准抽取健康成人的静脉血液,新鲜的人血液收集在肝素抗凝管中,立即进行血液凝固试验。将0.1 μg的纯化重组蛋白rCoa分别加入500 μL的新鲜血液和500 μL兔血浆中,37 ℃恒温培养6 h观察结果。同时设立不加重组蛋白rCoa的血液和兔血浆为空白对照以及分别加入空载体pET-24b(+)/BL21诱导表达蛋白和金黄色葡萄球菌重组蛋白rSarZ的兔血浆为阴性对照。
1.11重组蛋白的免疫原性分析
1.11.1小鼠免疫 选取8周龄BALB/c小鼠6只,随机分成2 组,即免疫组和对照组,每组3只。首次免疫用弗氏完全佐剂乳化的rCoa,第2次和第3次免疫用弗氏不完全佐剂乳化的rCoa。每次免疫间隔2周,每次每只小鼠经背部皮下多点接种50 μg rCoa。对照小鼠接种等量体积弗氏完全佐剂或不完全佐剂乳化的PBS。最后1次免疫后10 d采血分离血清,分装后-20 ℃冻存。
1.11.2血清抗体水平的间接ELISA测定 以浓度为1 μg /mL的纯化重组蛋白rCoa包被酶标板,4 ℃过夜;PBST洗涤4次,每次3 min,用5 %犊牛血清37 ℃封闭2 h;PBST洗涤,将重组蛋白rCoa三免10 d后获得的3只小鼠抗血清分别用5 %犊牛血清进行倍比稀释,分别加入对应蛋白孔,37℃孵育1 h,同时设阴性对照;PBST洗涤,加入用5%犊牛血清稀释(1∶1 000)的HRP标记羊抗鼠二抗,37 ℃孵育1 h;PBST洗涤,每孔加入50 μL TMB显色液,避光显色20 min,加入2 mol/L H2SO4终止反应,检测OD450值。
1.11.3重组蛋白rCoa免疫原性的Western blot分析 将纯化的重组蛋白rCoa进行SDS-PAGE分析,转膜、封闭后,与鼠抗Coa阳性血清(1∶100)室温反应2 h,充分洗膜后,加入HRP标记的羊抗鼠 IgG 二抗(1∶2 000),室温反应2 h,DAB显色,观察结果。
2 结 果
2.1重组质粒pET-24b-coa的构建与鉴定 金黄色葡萄球菌coa基因的PCR扩增产物经0.8%琼脂糖凝胶电泳鉴定,在1 500~2 000 bp之间可见单一扩增条带(图1),大小与预期1 989 bp相符。将经BamHI、XhoⅠ双酶切的PCR产物插入pET-24b(+)载体构建重组表达质粒。利用BamHI、XhoI双酶切及PCR对重组表达质粒鉴定,得到的条带与预期目的基因片段的大小相符(图2),表明coa基因已成功克隆至pET-24b(+)载体,且测序所得序列与S.aureus923株的coa基因序列一致,重组质粒pET-24b-coa构建成功。
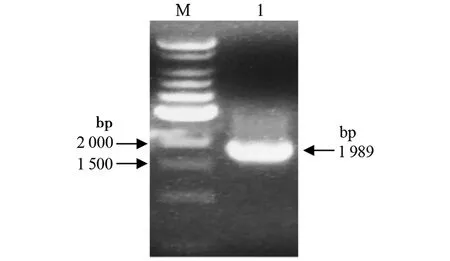
M:1kb DNA分子量标准;1:coa基因扩增产物图1 coa基因的PCR扩增Fig.1 Amplification of coa gene by PCR in S.aureus 923
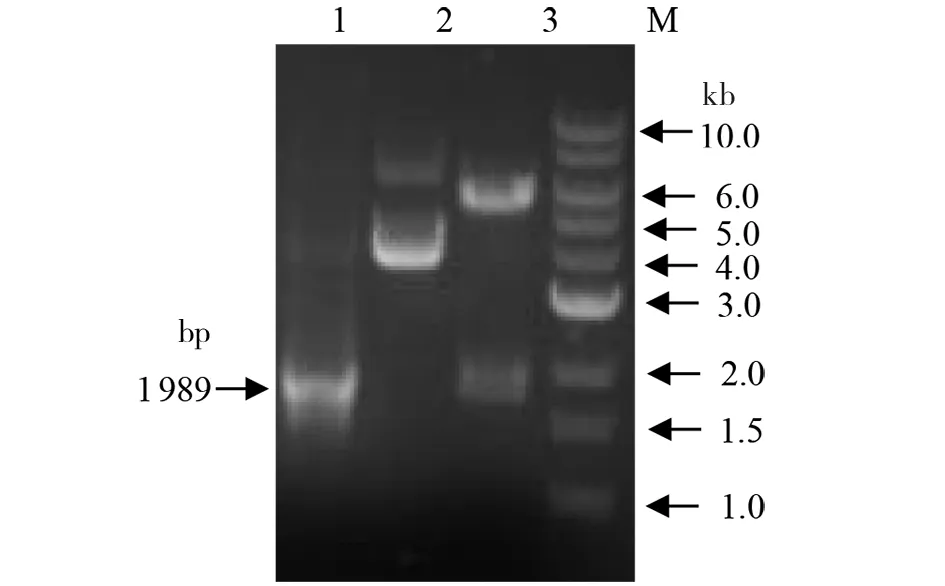
M:1kb DNA分子量标准;1:coa基因扩增产物;2:重组质粒pET-24b-coa;3:pET-24b-coa的BamHⅠand XhoⅠ酶切产物图2 coa基因的PCR扩增及重组质粒pET-24b-coa的酶切鉴定Fig.2 PCR amplification of coa gene and digestion identification of pET-24b-coa
2.2重组蛋白的诱导表达 表达菌E.coliBL21(DE3)经1 mmol/L IPTG诱导1、2、3、4、6 h 进行SDS-PAGE分析,在诱导1 h时,rCoa蛋白开始表达,在相对分子质量约为74.8 ku 处有明显的蛋白质表达条带,与目的蛋白基本一致,但表达量较低。当诱导4 h和6 h时rCoa蛋白表达量差不多,达到最高,因此在蛋白表达时选择诱导时间为4 h。阴性对照含空载体pET-24b(+)的工程菌和未诱导对照菌中未见有目的蛋白表达(图3)。

M:蛋白质分子量标准(NEB);1:诱导4 h后pET-24b-coa/BL21菌体超声裂解后上清;2:诱导4 h后pET-24b/ BL21菌体沉淀;3:未诱导的pET-24b-coa/BL21菌体沉淀;4~8:分别为诱导1 h、2 h、3 h、4 h和6 h后pET-24b-coa/BL21菌体沉淀图3 不同诱导时间重组蛋白表达的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the expression of rCoa by different induced time
2.3重组蛋白的表达形式 IPTG诱导表达4 h的菌液离心收集菌体,超声破碎后分离的沉淀和上清经SDS-PAGE分析,在沉淀中出现74.8 ku的目的蛋白条带,而在上清中未发现目的蛋白条带,表明rCoa以包涵体的形式表达(图4A)。目的蛋白经Ni-Agarose His标签蛋白纯化试剂盒纯化的SDS-PAGE结果见图4B,纯化蛋白经定量后,浓度为1.02 μg/μL。
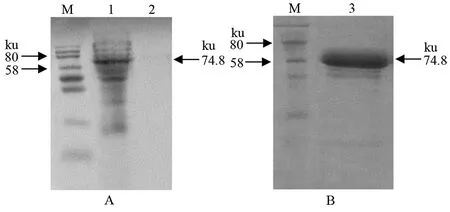
A:诱导后菌体超声裂解上清和沉淀的SDS-PAGE分析;B:纯化rCoa的SDS-PAGE分析;M:蛋白质分子量标准;1:重组菌超声裂解液沉淀;2:重组菌超声裂解液上清;3:纯化rCoa图4 重组蛋白rCoa的表达形式分析结果Fig.4 Analysis of the recombinant protein rCoa expression patterns
2.4重组蛋白的Western Blot分析 将纯化后的rCoa蛋白转移到NC膜上,一抗为兔抗His-tag抗体(1∶1 000),二抗为HRP-羊抗兔IgG(1∶2 000),经Western Blot分析显示在74.8 ku处出现一条很清晰的特异性反应条带(图5),表明纯化获得目的蛋白质能被抗His单克隆抗体特异性识别。
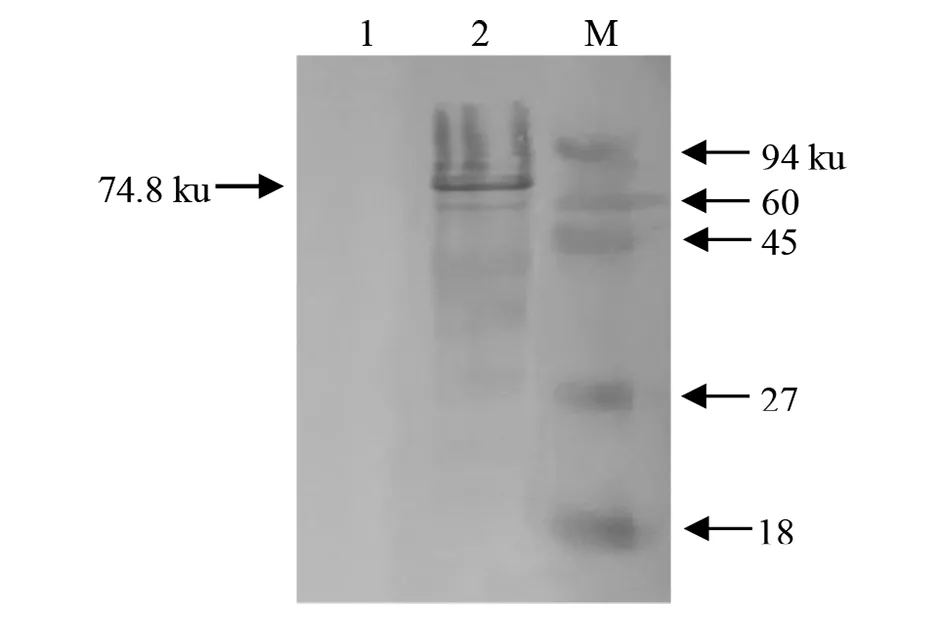
M:预染蛋白质Marker Ⅲ;1:pET-24b/BL21阴性对照 2:重组蛋白rCoa图5 重组蛋白的Western-blot 分析Fig.5 Western-blot analysis of recombinant protein rCoa
2.5重组纯化蛋白的凝固活性 当纯化的rCoa与新鲜人抗凝血或兔血浆在37 ℃恒温中共同孵育6 h后,重组蛋白rCoa能使人全血和兔血浆完全凝固,当倾斜试管时血液和兔血浆不流动。而未加rCoa的空白对照没有凝固现象出现,倾斜时血液及兔血浆沿管壁流动,含空载体pET-24b(+)大肠杆菌表达蛋白和金黄色葡萄球菌重组蛋白rSarZ的阴性对照组均不能使兔血浆凝固(图6),结果表明表达的rCoa具有良好的凝固人血液或兔血浆活性。

A:重组蛋白的凝血活性;B:重组蛋白凝固兔血浆活性;1:重组蛋白rCoa;2:未加重组蛋白rCoa空白对照;3:含空载体pET-24b/BL21阴性对照;4:金黄色葡萄球菌重组蛋白rSarZ阴性对照图6 重组蛋白对人血液和兔血浆的凝固活性Fig.6 Coagulation activity of the rCoa in human whole blood and rabbit plasma
2.6重组蛋白的免疫原性 第3次用rCoa免疫后10 d收集免疫组和对照组小鼠血清,将免疫组3只小鼠的血清分别进行倍比稀释,同时对照组3只小鼠血清混合做倍比稀释,以浓度为1 μg/mL的rCoa包被酶标板进行间接ELISA检测,结果显示在3只免疫小鼠的血清中都检测到了高效价的特异性抗体,抗体水平均在1∶6 400以上,而对照小鼠的血清中未检测到相应抗体(OD450<0.18)(图7)。该结果表明rCoa能刺激小鼠产生高效价的抗Coa特异性抗体,且具有良好的免疫原性。
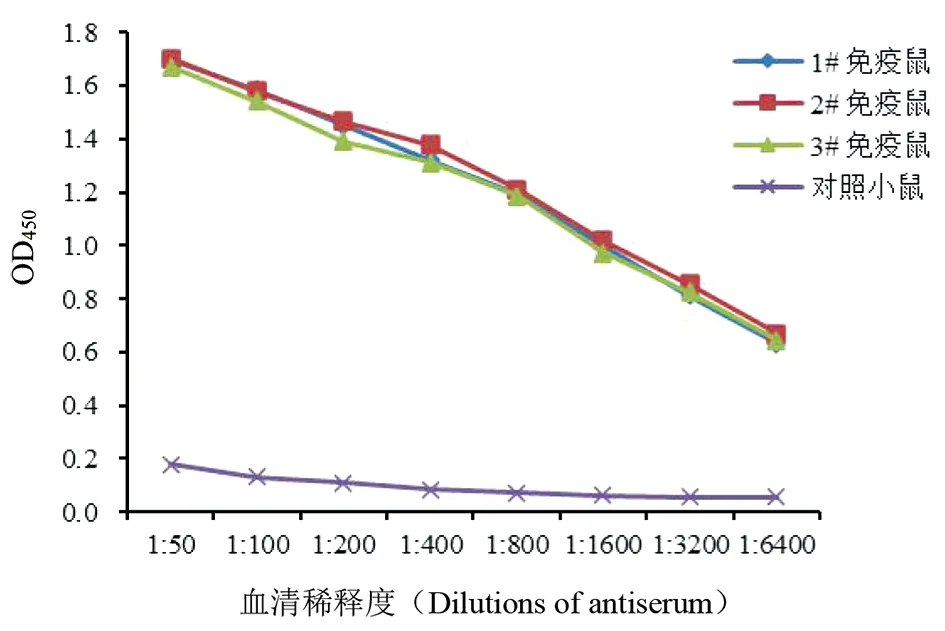
图7 重组蛋白rCoa抗血清的间接ELISA检测Fig.7 Determination of indirect ELISA assay for recombinant protein rCoa antibody
Western blot检测结果显示,免疫小鼠血清能够与转移到NC膜上的rCoa特异性结合,在74.8 ku处出现一条很清晰的特异性反应条带,表明rCoa能被小鼠抗Coa阳性血清所识别,具有良好的抗原结合活性(图8)。

M:预染蛋白质Marker Ⅲ; 1:pET-24b/BL21阴性对照 2:重组蛋白rCoa图8 重组蛋白免疫原性的 Western blot分析Fig.8 Western blot analysis of immunogenicity of rCoa
3 讨 论
金黄色葡萄球菌是引起人兽共患病重要的病原细菌之一,其强致病性依赖于多种毒素和侵袭性酶等毒力因子的产生,凝固酶是金黄色葡萄球菌SaeRS系统直接调控的重要毒力因子[12-13],凝固酶将宿主凝血酶原转化为葡萄球菌凝血酶,从而将纤维蛋白原转化为纤维蛋白,引起局部凝块保护细菌免受吞噬和免疫防御,介导Coa依赖型生物膜的形成,增强细菌耐药性[14-15]。凝固酶是金黄色葡萄球菌的表型决定簇,是鉴定金黄色葡萄球菌和区分凝固酶阳性和阴性葡萄球菌的重要因素[15]。Trivedi等[16]认为凝固酶的分泌是金黄色葡萄球菌在感染过程中适应的一个决定性特征。
金黄色葡萄球菌凝固酶Coa在皮肤脓肿、导管相关感染、心内膜炎和乳腺炎等疾病过程中发挥着关键作用,预示着Coa是预防或治疗金黄色葡萄球菌感染的重要靶点[17-18]。此外,针对葡萄球菌凝血酶活性的抑制剂可作为抗生素治疗的辅助手段[19]。Cheng等[3]研究表明针对Coa的特异性抗体对脓肿形成和致死性菌血症具有保护作用,提示凝固酶可作为葡萄球菌疫苗的保护性抗原诱导产生抗体,保护宿主免受金黄色葡萄球菌感染。Thomer等[20]研究表明针对Coa的R结构域的单克隆抗体降低了人血液中的细菌载量,证实Coa的保守R结构域可作为抗MRSA感染疫苗的新靶标。Qian等[21]构建了一个新的R结构域CoaR6,通过将CoaR6与破伤风神经毒素重链的C端片段Hc融合,提高 R 结构域免疫原性,融合蛋白 Hc-CoaR6成功地提高了免疫小鼠的抗 CoaR6 IgG 水平,为Coa的R结构域成为金黄色葡萄球菌候选疫苗靶标提供了强有力的科学依据。WANG 等[22]应用可以抑制Coa活性但不影响金黄色葡萄球菌活力的槲皮素治疗导管感染的大鼠,结果显示,通过槲皮素的治疗可以减少导管表面的细菌滞留,降低大鼠肾脏中的细菌负荷,并减轻了体内脓肿,表明以 Coa为靶点的天然化合物抗金黄色葡萄球菌感染是一种新策略,同时靶向Coa可降低产生耐药性的可能性。
pET系统是在大肠杆菌中克隆和表达重组蛋白的最强系统,本研究采用的pET-24b(+)表达载体能在大肠杆菌BL21(DE3)宿主菌中调节基础表达水平以优化coa基因的高效表达,通过优化表达条件获得了高表达量的重组蛋白rCoa,表达产物以包涵体的形式存在,这可能是在表达过程中目的蛋白形成了错配二硫键。包涵体经Ni-Agarose His 标签试剂盒纯化后不影响凝血活性和多克隆抗体的制备。纯化获得的重组蛋白rCoa对含抗凝剂的人全血和兔血浆有较好的凝集作用,这与张叶影等[23]研究报道相一致。用纯化的rCoa免疫小鼠,通过间接ELISA方法检测到3只免疫小鼠的血清抗体水平均在1∶6 400以上,结果说明表达的rCoa能够充分刺激小鼠产生特异性抗体,具有良好的免疫原性,下一步研究将侧重于探讨Coa蛋白对金黄色葡萄球菌感染的免疫保护效果及其在感染中的确切作用。此外本试验中建立的间接ELISA方法还可用于金黄色葡萄球菌凝固酶血清抗体水平的检测,可为金黄色葡萄球菌感染的血清学诊断和监测提供技术支持。
本试验以USA300 CA-MRSA 923 菌株基因组DNA为模板成功扩增出coa基因,将coa基因与pET-24b(+)表达载体连接,构建了重组pET-24b-coa/BL21的原核表达体系,获得了重组蛋白rCoa。rCoa具有良好的凝固酶活性和抗原活性,为进一步研究开发以Coa为靶点的抗金黄色葡萄球菌感染的抑制剂和疫苗奠定了重要基础。
利益冲突:无
