苦草群落重建中吲哚乙酸(IAA)的使用效果及限制因素
2020-08-24陈敏林品镕何宇清肖林叶长鹏
陈敏, 林品镕, 何宇清, 肖林, *, 叶长鹏
苦草群落重建中吲哚乙酸(IAA)的使用效果及限制因素
陈敏1, 2, 林品镕1, 何宇清1, 肖林1, *, 叶长鹏1
1. 暨南大学, 生命科学技术学院生态学系, 广州 510631 2. 中国科学院南海海洋研究所, 广州 510301
在富营养化水体修复中沉水植物种子萌发率低是常见问题, 植物生长素吲哚乙酸(IAA)可促进种子萌发。为探索吲哚乙酸在沉水植物苦草群落重建中使用的效果和限制因素, 实验设置了不同底泥-水质组合、季节温度和光照强度以及吲哚乙酸浓度梯度, 观察苦草种子萌发在不同环境因素下对吲哚乙酸的响应情况。结果表明, IAA的使用减弱了富营养湖泊底泥对苦草种子萌发的影响、降低了高光照对苦草种子萌发的抑制、扩大了苦草种子的最适萌发温度范围, 提高了苦草种子的累积萌发率和萌发速度; 但IAA的使用效果受到环境因素的影响, 一定温度范围内IAA的使用效果随温度的升高而增加, 随环境因素的增多对萌发的促进效果降低, 此外, 极端环境因素(冬季低温、富营养湖泊底泥-富营养湖泊湖水组合)也会降低IAA对萌发的促进效果; 而非极端的逆境中, IAA的使用能够取得较好的效果,如富营养湖泊底泥-纯水组合处理下苦草种子的萌发与IAA浓度显著正相关。实验结果可为IAA应用于苦草群落重建工程以提高苦草种子萌发率提供理论与实践指导。
沉水植被重建; 植物生长素吲哚乙酸(IAA); 苦草种子; 萌发; IAA浓度
0 引言
沉水植被是维持湖泊清水稳态的关键[1], 它的重建是水体富营养化修复的重要一环[2–3]。在我国富营养湖沉水植被重建实践中, 苦草() 的应用最为广泛[2–6]。苦草隶属于水鳖科苦草属, 在我国分布范围广[7], 但受人类活动和生态退化影响, 野外苦草资源下降[8], 从野外采集已无法满足沉水植被重建工程的需求。如何在沉水植被重建过程中减少苦草资源消耗, 增加重建效果, 是富营养化水体修复中一直努力解决的问题。在沉水植被重建中, 苦草营养体植株种植结合种子添加能提高效果, 而添加的苦草种子萌发率直接关系到沉水植被的重建效果[5–6]。
苦草种子萌发主要受温度、光照、基质以及水深和水质等的影响。1)温度: 有研究表明苦草种子萌发的最适温度在20℃左右[9-11], 但也有研究表明苦草种子的萌发速率随温度的增加而增大[9–10]; 2)基质: 苦草种子萌发率在底泥和纯水同时存在时比以纯水或底泥单独作为基质时要高[9–11], 但是在湖水中苦草种子的萌发率显著高于其它基质[12]; 而不同的基质间效果也存在差异, 黄土或湖泥中种子萌发情况好于河沙[10–12]; 与大粒径生物质炭和石英砂为基质的对照相比小粒径生物质炭为基质的苦草种子萌发率明显升高[13], 此外种子在底质中的埋深显著影响苦草种子的萌发率, 随埋深逐渐降低, 埋深为5 cm时苦草种子基本不萌发[6,14]; 3)水质: 富营养湖泊水中所含有的高营养盐[15]、高微囊藻毒素[16]对苦草的萌发起到一定的抑制作用; 4)光照: 苦草的种子萌发需要光照[6], 但高光照具有抑制效应, 低光照下苦草种子的萌发率显著高于高光照下[11]。
此外, 外源植物激素处理能够调节苦草种子萌发。植物激素主要有五大类: 生长素类、赤霉素类、细胞分裂素类、脱落酸类和乙烯, 而生长素类、赤霉素类、细胞分裂素类和脱落酸类植物激素都具有调节种子萌发的生理功能[17]。其中生长素类植物激素吲哚乙酸(IAA)在高等植物中分布较广, 也被广泛应用于调节种子萌发, 例如: 30 mg·L-1的浓度对玉米的种子萌发促进作用最为显著[18], 而番茄种子萌发的最佳促进浓度为100 mmol·L-1 [19], 在150 mg·L-1浓度时马槟榔种子的发芽率高达89.09%[20], 但IAA对种子萌发的作用具有低浓度促进高浓度抑制的功效[19,21]。目前关于吲哚乙酸(IAA)在苦草种子萌发中应用的报道不多, 主要研究结论为实验条件下150 mg·L-1的IAA浸种24 h[22–23]对苦草种子萌发的促进效果最好; 但高浓度IAA (300 mg·L-1)对苦草种子萌发有一定的抑制作用[23]。而在工程应用中吲哚乙酸(IAA)的使用效果如何、会受到何种因素的影响、如何影响等的研究内容则更少。
为探索富营养湖泊沉水植物苦草群落重建中IAA的使用效果和限制因素, 我们采用三温区培养箱模拟不同季节的温度和不同水深的光照, 研究了4种底质-水质组合下,不同浓度生长素(吲哚乙酸, IAA)处理的苦草种子萌发情况, 以期为植物生长素吲哚乙酸(IAA)在苦草群落重建工程中的使用提供理论指导, 从而提高工程中苦草种子的萌发率, 增加苦草群落重建的成功率。
1 材料与方法
1.1 实验设计
模拟施工时的4种底泥-水质组合:
M1: 富营养湖泊底泥(校内明湖)+其湖水;
M2: 黄泥+纯水;
M3: 富营养湖泊底泥(校内明湖)+纯水;
M4: 仅富营养湖泊湖水。
不同季节温度:
S1: 冬季, 参考广州2017年12月份和1月份平均日温和夜温, 白天为18℃, 夜间为12℃;
S2: 春季, 参考广州2017年4月份平均日温和夜温, 白天为25℃, 夜间为20℃;
S3: 夏季, 参考广州2017年8月份平均日温和夜温, 白天为35℃, 夜间为25℃。
不同施工深度下的光照:
L1: 光照培养箱的20%光照强度光照12 h, 无光照12 h;
L2: 光照培养箱的60%光照强度光照12 h, 无光照12 h;
L3: 光照培养箱的100%光照强度光照12 h, 无光照12 h。
IAA水平梯度(浓度设置参考徐恩兵, 等, 2016[12]):
CK: 0 mg·L-1, 为对照处理,即纯水;
I1: 50 mg·L-1; I2: 100 mg·L-1; I3: 150 mg·L-1; I4: 200 mg·L-1; I5: 250 mg·L-1。
实验时, 每个烧杯(250 mL烧杯216个)用对应的基质铺至烧杯50 mL刻度线附近(距离底部约2 cm)。每个烧杯放置饱满、大小较为一致苦草种子50粒(先用对应浓度的IAA溶液提前浸泡24 h), 浸泡后的种子均匀放入烧杯中, 再缓慢加入相应的纯水或富营养化的明湖水至烧杯200 mL刻度线附近(距离底部约6 cm)。每次计数后进行补充水分(补充相应的纯水或明湖水至200 mL), 并随机摆放烧杯位置。模拟实验于2018年3月4日至4月4日在实验室进行。
1.2 数据采集与计算方法
实验过程中每3 d对苦草种子萌发数进行记录, 种子萌发以新芽长度超过2 mm为准。苦草种子的萌发效果采用30 d后总的累积萌发率和萌发过程平均萌发速率两个指标。
累积萌发率=实验结束时累积萌发数/50×100%
平均萌发速率=已观察到萌发数/50/已观察天数×100%
1.3 数据处理
用SPSS软件对所得数据进行分析, 单个IAA浓度与对照之间的比较采用成对方差比较, 6个IAA处理浓度间的比较采用单因素方差分析(one-way ANOVA), 多个因子间的交互作用分析采用单因变量多因素一般线性模型分析(GLM-Univariate), 所有的比较和分析均用boostrap=1000增加样本量。
2 结果与分析
2.1 不同IAA浓度对苦草累积萌发率的影响
在0—250 mg·L-1IAA浓度中, 高浓度的IAA (250 mg·L-1)能显著提高苦草种子的萌发率(=0.001) (图1.A)。不同光照条件下各IAA处理间苦草种子的累积萌发率无明显差异(图1.D), 主要影响因素为温度(图1.C)和底泥-水质组合(图1.B)。
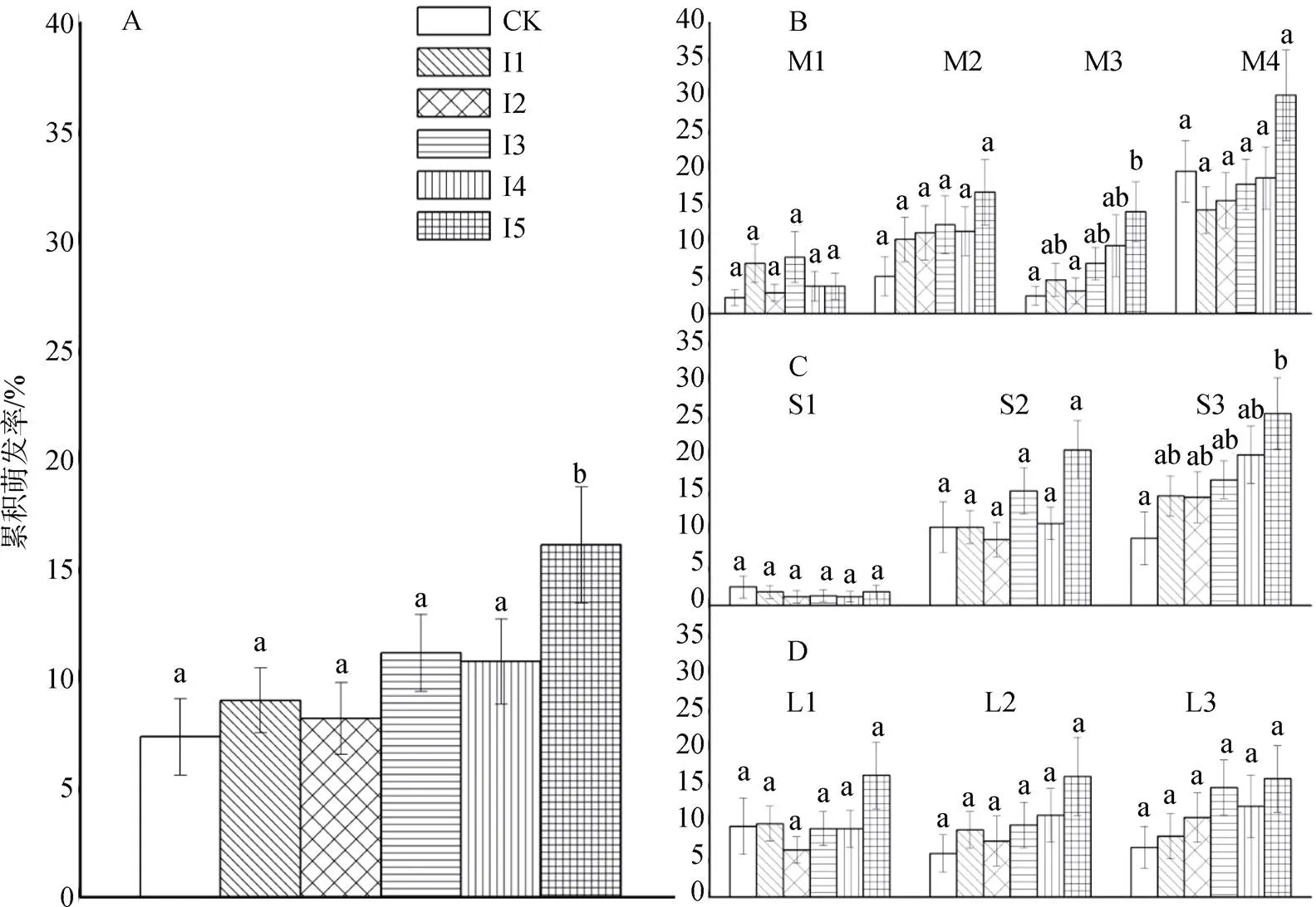
不同字母表示在0.05水平上差异显著。A: IAA的总体影响, B: 不同底泥-水质组合处理影响, C: 季节温度影响, D: 光照影响
Figure 1 Improvement of IAA concentrations on cumulative germination rate ofseeds
温度因素(图1.C)对苦草种子的累积萌发率影响最明显, 冬季低温条件(图1.C.S1)下苦草种子萌发率低, 即使采用IAA处理(50—250 mg·L-1)也不能提高其累积萌发率; 温度高于18℃时, 能够明显提高苦草种子的累积萌发率, 但春季(图1.C.S2) 时仅250 mg·L-1的IAA处理能够明显增加其累积萌发率, 而夏季高温(图1.C.S3)时苦草种子的萌发率对IAA浓度的响应呈显著正相关(=0.152,=0.001), 从50 mg·L-1到250 mg·L-1能明显增大其累积萌发率, 而到250 mg·L-1时增加显著(=0.002)。
富营养湖泊底泥-富营养湖泊湖水组合(图1.B. M1)和富营养湖泊底泥-纯水组合处理下(图1.B.M3)总体萌发率低, 但苦草的累积萌发率在富营养湖泊底泥-纯水组合处理下与IAA浓度存在显著正相关(R=0.165,=0.001), 当IAA浓度达到250 mg·L-1时, 该苦草种子累积萌发率已接近黄泥-纯水组合处理(图1.B.M2)。单独的富营养湖泊湖水(图1.B.M4)具有最优的种子累积萌发率, 但仅IAA浓度达到250 mg·L-1时才能明显提高种子累积萌发率。
2.2 不同浓度IAA对苦草种子萌发速率的影响
IAA处理后苦草种子平均萌发速率提高, 平均萌发速率最大为250 mg·L-1处理组, 平均萌发速率增长期主要在播种后的6—12 d(图2.A); 而对照的萌发速率增加缓慢, 只有在夏季温度时仅有富营养湖泊湖水中播种后的9—15 d才有迅速增长期(图2.A, B, C, D)。1)底泥-水质组合方式不同苦草种子平均萌发速率对IAA浓度的响应不同。除富营养湖泊底泥-富营养湖泊湖水组合的处理下IAA的使用效果不明显外(图2.B.M1), 其余三种处理中IAA的使用都能明显提高苦草种子的萌发速率, 迅速增长期一般在播种后的前12 d(图2.B.M2, M3, M4)。2)温度不同苦草种子平均萌发速率对IAA浓度的响应不同。冬季, 使用IAA处理对苦草种子平均萌发速率影响低(图2.C.S1); 春末温度下高浓度处理组平均萌发速率要高于对照组, 只有250 mg·L-1浓度的IAA处理组在9—15 d内有迅速增长期(图2.C.S2); 夏季较高温度影响下50—250 mg·L-1浓度的IAA处理能提升苦草种子的平均萌发速率, 平均萌发速率迅速增长期在6—12 d, 且浓度越大增加萌发速率的效果越好(图2.C.S3)。3)不同光照条件下IAA处理都能够增加苦草种子的平均萌发速率, 其效果随IAA浓度增加而增大, 萌发速率迅速增长期在播种后的6 d至12—15 d(图2.D)。
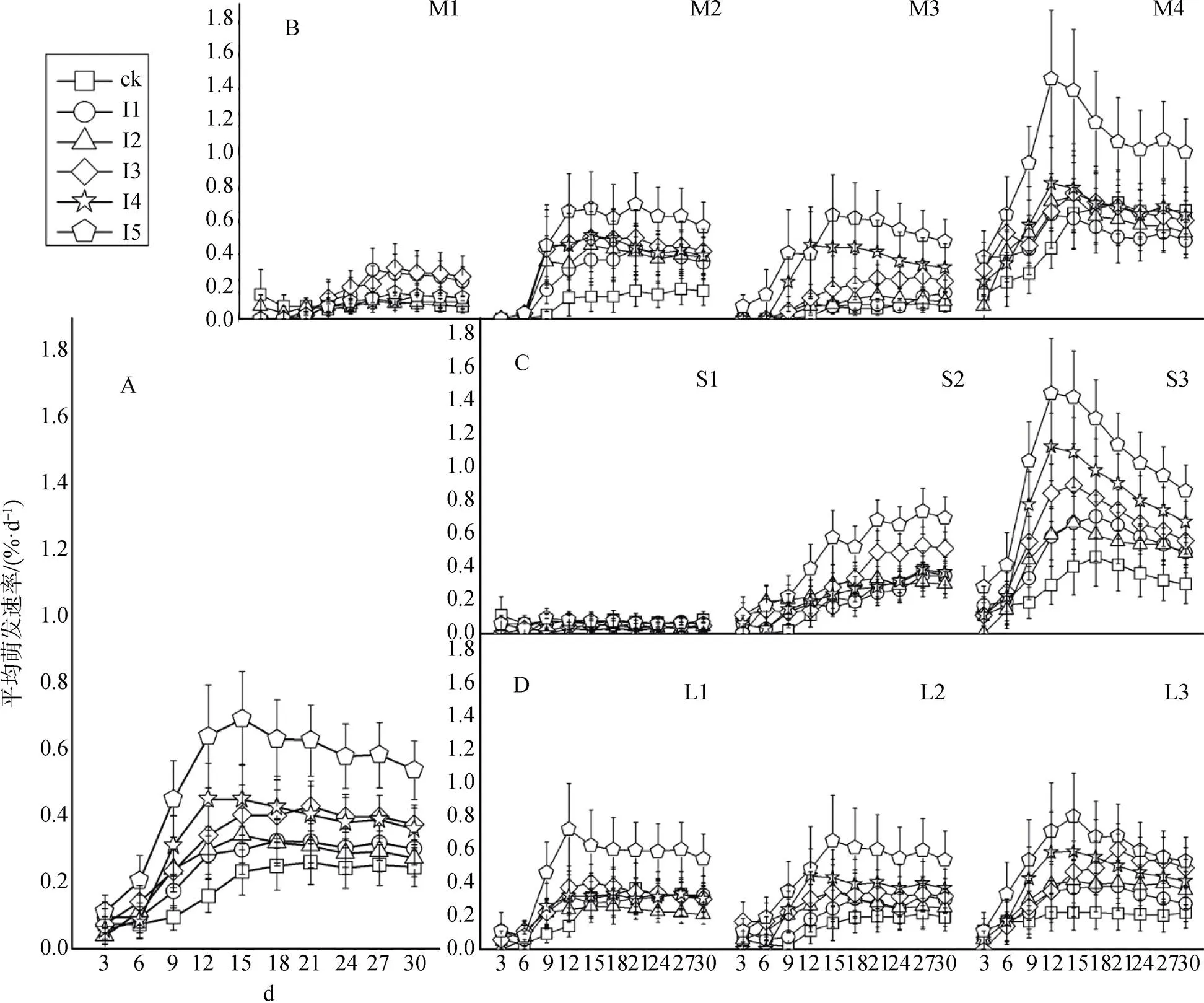
A: IAA的总体影响, B: 不同底泥-水质组合处理影响, C: 温度影响, D: 光照影响。
Figure 2 Improvement of IAA concentrations on average germination speed ofseeds
2.3 实验总体情况
实验结果表明不同处理的苦草种子萌发存在较大差异。苦草种子在萌发3—4周后萌发数基本不再增加。在冬季或富营养湖泊底泥-富营养湖泊湖水组合的处理下, 苦草种子萌发率最低为0, 而在黄泥-纯水组合处理下和单独的富营养湖泊湖水处理下, 苦草种子最早在第3 d萌发, 萌发率最高可达到50%。没有经过IAA浸泡处理的苦草种子萌发组表现出最适温度需求, 最适萌发温度为夜温20℃, 昼温25℃ (图1.C)和低光照需求高光照明显受抑制(图1.D)。多因素方差分析表明, IAA处理、季节温度和底泥-水质组合能够显著影响苦草种子萌发, 而光照强度影响不显著。IAA处理单独与季节温度、IAA处理单独与底泥-水质组合间的互作能够显著影响苦草种子的萌发(=3.382,=0.001;=2.205,= 0.009), 但IAA处理与季节温度和底质-水质组合三因素同时互作时对苦草种子的萌发影响不显著(= 1.451,=0.078)(表1)。
3 讨论
本实验的对照部分(0 mg·L-1浓度IAA处理)的结果对前人的研究结果进行了验证。实验中苦草种子萌发表现出了最适温度需求, 最适萌发温度为20—25℃左右[9–11]; 和低光照需求, 明显受高光照抑制[11], 与苦草的生长需求相似[26–27], 这些结果与前人研究结果基本一致。但不同基质对萌发的影响与部分与前人的研究不符, 即必须要同时有土和水萌发率才最大[9–11], 本实验中仅有富营养化明湖水的处理组萌发率最高, 但幼苗的生长不如有底泥的处理组好, 这可能是丰富的浮游植物的胞外化学物质对苦草种子萌发产生了促进作用[12,28]。
而处理组的结果表明在复杂的工程施工环境中, IAA的使用能够提高苦草种子的萌发效果, 从而促进沉水植物苦草群落的重建。IAA能够促进种子的胚根细胞伸长和分裂[17,24], 这一生理功能够在一定程度上改善不利因素对苦草种子萌发过程中胚根细胞伸长和分裂的抑制, 因此实验中能够观察到, IAA的使用降低了高光照对苦草种子萌发的抑制, 扩大了苦草种子萌发时对高温的耐受上限, IAA处理后苦草种子突破了最适萌发温度20—25℃的限制, 夏季高温能够获得更高的累积萌发率和平均萌发速度。逆境条件下IAA对种子萌发的促进效果在其它植物上已有报道, 例如, 宋科等[25]通过研究发现IAA能促进高盐胁迫下番茄()种子的萌发并提高番茄种子的发芽指数。

表1 IAA处理、季节温度和底泥-水质组合的互作对苦草种子萌发影响
但是, IAA的使用效果受到环境因素的影响。在一定范围内的环境因素条件下, IAA对苦草种子萌发的影响跟实验室条件下IAA单因素影响基本相似, 随浓度的升高而效果增加, 例如一定温度范围内IAA的使用效果随浓度的升高而增加, 随温度的升高而增加。但在一些极端逆境条件下, IAA对萌发的促进效果降低, 甚至是不起作用, 实验中, 冬季低温条件下IAA的使用无任何效用, 在富营养湖泊底泥-富营养湖泊湖水的组合中IAA的使用效果也不明显。而非极端逆境中, IAA的使用能够取得较好的效果如富营养湖泊底泥-纯水组合的处理下苦草种子的萌发与IAA浓度显著正相关。此外, 随影响IAA作用因素的增多, IAA对萌发的促进效果也会降低, 在生长素单因素、生长素与季节温度或者底泥-水质组合的双因素、生长素与季节温度和底泥-水质组合3因素组成的影响因素梯度中生长素的促进效果是逐渐降低的。以上结果表明, IAA应用于苦草群落重建工程中存在不少限制条件, 应尽量减少影响因素, 最好选择在生长素起作用的环境因素范围内使用, 注意使用时的季节温度、底泥-水质组合的影响, 替换掉富营养的底泥和水以及只替换富营养化的水后再使用吲哚乙酸效果会更好, 具体操作可根据施工成本进行选择。
之前的研究[22-23]仅考虑了IAA单因素的不同水平对苦草种子的萌发影响, 对于实际施工过程中存在的诸多因素都没有考虑在内, 因此难以指导IAA应用苦草群落重建工程中, 而我们的研究补充了这块内容, 能够为植物生长素吲哚乙酸(IAA)在苦草群落重建工程中的使用提供理论和实践指导。
致谢:论文在修改过程中得到了韩博平教授和张修峰研究员的帮助, 在此表示感谢!
[1] SCHEFFER M, CARPENTER S, FOLEY J A, et al. Catastrophic shifts in ecosystems[J]. Nature, 2001, (413): 591–596.
[2] 张萌, 曹特, 过龙根, 等. 武汉东湖水生植被重建及水质改善试验研究[J]. 环境科学与技术, 2010, 33(6): 154– 159.
[3] 马剑敏, 成水平, 贺锋, 等. 武汉月湖水生植被重建的实践与启示[J]. 水生生物学报, 2009, 33(2): 222–229.
[4] 黄峰, 李勇, 潘继征, 等. 冬春季富营养化滆湖中沉水植被重建及净化效果[J]. 环境科技, 2010, 23(4): 13–16.
[5] 马剑敏, 贺锋, 成水平, 等. 武汉莲花湖水生植被重建的实践与启示[J]. 武汉植物学研究, 2007, (5): 473–478.
[6] KE Xuesha, LI Wei. Germination requirement ofseeds: implications for restoration in Chinese lakes[J]. Hydrobiologia, 2006, 559: 357–362.
[7] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1992: 177.
[8] XIAO Lin, ZHANG Qun, WEI Guifeng, et al. Case study of Baiyun Lake and Caohai Lake implies how to implement wetland restoration/creation[J]. Open Access Library Journal, 2018, 5(10): 1–23.
[9] 由文辉, 宋永昌. 淀山湖3种沉水植物的种子萌发生态[J]. 应用生态报, 1995, 6(2): 196–200.
[10] 李亚东, 崔艳秋. 武汉东湖苦草种子和块茎发芽实验[J]. 水生生物学报, 2000, 24(3): 298–300.
[11] 陈开宁, 兰策介, 史龙新, 等. 苦草繁殖生态学研究[J]. 植物生态学报, 2006, 30(3): 487–495.
[12] 韩翠敏, 胡庚, 武涛. 不同水体条件和基质类型对苦草种子(V)萌发的影响[J]. 生态学杂志, 2014, 33(6): 1515–1519.
[13] 张瑄文, 李三姗, 甘琳, 等. 生物质炭对苦草(V)种子萌发与生长的影响[J]. 湖泊科学, 2018, 30(4): 1041–1051.
[14] ZUO Jincheng, LIU Linde, KONG Dongrui, et al. Effects of sediment burial on seed germination and seedling establishment of[J]. Journal of Freshwater Ecology, 2016, 31(2): 289–297.
[15] 袁龙义, 江林枝. 不同盐度对苦草、刺苦草和水车前种子萌发的影响研究[J]. 安徽农学通报, 2008, 14(17): 77–79.
[16] 尹黎燕, 黄家权, 李敦海, 等. 微囊藻毒素对沉水植物苦草生长发育的影响[J]. 水生生物学报, 2004, 28(2): 147– 150.
[17] 柯学莎, 李伟. 激素对水生植物生理生态的影响及其应用[J]. 生态学报, 2006, 26(5): 1542–1549.
[18] 郑艳冰, 党兰, 丛永柱, 等. 吲哚乙酸与赤霉素对玉米种子萌发和幼苗生长的影响[J]. 安徽农业科学, 2014, 42(13): 3836–3838.
[19] 刘拴成, 曹兴明, 穆俊祥, 等. 外源激素对盐胁迫下番茄种子萌发及幼苗生长的影响[J]. 种子, 2016, 35(12): 94– 98.
[20] 赵东兴, 李春, 李涛, 等. 4种植物生长调节剂对马槟榔种子萌发和幼苗生长的影响[J]. 南方农业学报, 2015, 46(10): 1834–1838.
[21] 呼凤兰. 5种植物激素对黑豆种子萌发的影响[J]. 种子, 2019, 38(6): 95–99.
[22] 左进城, 李秀玲, 张鹏, 等. 吲哚乙酸和激动素对苦草种子萌发和幼苗生长的影响[J]. 北方园艺, 2014, (23): 53– 56.
[23] 徐恩兵, 余平, 朱志强. 吲哚乙酸和矮壮素对苦草种子萌发和矮化特征的影响[J]. 安徽农业科学, 2016, 44(36): 41–43, 51.
[24] TILLBERG E. Indoleacetic Acid Levels in Phaseolus, Zea, and Pincus during Seed Germination[J]. Plant physiology, 1977, 60(2): 317–319.
[25] 宋科, 姚政, 徐四新, 等. 盐胁迫下番茄种子萌发和幼苗生长发育的调控研究[J]. 上海农业学报, 2013, 29(6): 64–68.
[26] 苏文华, 张光飞, 张云孙, 等. 5种沉水植物的光合特征[J].水生生物学报, 2004, 28(4): 391–395.
[27] 肖月娥, 陈开宁, 戴新宾, 等. 太湖中2种大型沉水被子植物适应低光能力的比较[J]. 植物生理学通讯, 2006, 42(3): 421–425.
[28] LI Zhongqiang, DAN Yu, TU Manghui. Seed germination of three species of Vallisneria ( Hydrocharitaceae) , and the effects of fresh-water microalgae[J]. Hydrobiologia, 2005, 544: 11–18.
Effect and limitation of indoleacetic acid (IAA) in community reconstruction of
CHEN Min1, 2, LIN Pinrong1, HE Yuqing1, XIAO Lin1,*, YE Changpeng
1. Department of Ecology, College of Life Science and Technology, Jinan University, Guangzhou 510631, China 2. South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China
Low seeds germination of submerged plant is a common problem in restoration of eutrophic shallow waters. However, indoleacetic acid (IAA) can affect the germination. In order to explore the effect and limitation of IAA incommunity reconstruction, we conducted an experiment exploring the seed germination ofresponding to IAA treatments under the multiple environmental conditions in reconstruction. The experiment was designed asseeds treated in 6 IAA concentrations with differentsediment-water quality combination, temperature and light intensity. Results showed that IAA weakened the negative influence of eutrophic sediments, reduced the inhibition ofseeds germination by high light intensity, and expanded the optimal germination temperature range. The effective role of IAA was affected by environmental factors, increased with the increase of temperature in a certain temperature range, and decreased with the environmental factors increasing. In addition, extreme environmental factors (low temperature in winter, eutrophic lake sediment-eutrophic lake water combination) also reduced the promotion effect of IAA on germination. However, except in extreme environments, the use of IAA could achieve better results. For example, the germination ofseeds in the treatment of eutrophic lake sediment-pure water combination was significantly positively correlated with the concentration of IAA. The results of the experiment can provide theoretical and practical guidance for IAA application in the reconstruction ofcommunity to improve the germination rate ofseeds.
submerged vegetation reconstruction; indoleacetic acid (IAA);seeds; germination; IAA concentration
10.14108/j.cnki.1008-8873.2020.04.014
陈敏, 林品镕, 何宇清, 等. 苦草群落重建中吲哚乙酸(IAA)的使用效果及限制因素[J]. 生态科学, 2020, 39(4): 106–112.
CHEN Min, LIN Pinrong, HE Yuqing, et al. Effect and limitation of indoleacetic acid (IAA) in community reconstruction of[J]. Ecological Science, 2020, 39(4): 106–112.
S157.2
A
1008-8873(2020)04-106-07
2020-03-24;
2020-06-11
广州市科技计划项目(201508020104)
陈敏(1996—), 女, 广东四会人, 中国科学院南海海洋研究所在读研究生
肖林, 男, 生态学博士, 暨南大学生态学系高级实验师, 从事植物生理生态学、植物群落生态学及以此为基础的修复生态学研究; Email: spray_80@foxmail.com
