EDDS对Cd胁迫下三叶鬼针草幼苗NO产生的影响
2020-08-24丁浚刚陈银萍杨波师小平颉海帆
丁浚刚, 陈银萍, 杨波, 师小平, 颉海帆
EDDS对Cd胁迫下三叶鬼针草幼苗NO产生的影响
丁浚刚, 陈银萍*, 杨波, 师小平, 颉海帆
兰州交通大学环境与市政工程学院, 兰州 730070
通过室内盆栽试验, 研究了40 mg·kg-1Cd(CdCl2·2.5 H2O)胁迫下, 不同浓度乙二胺二琥珀酸(EDDS)(0、0.5、1.5、2.5、5.0 mmol·L-1)单施及EDDS与一氧化氮(NO)供体硝普钠(SNP)(0、0.25、0.5、1.0 mmol·L-1)联合施加对三叶鬼针草(L)幼苗应激信号分子NO产生量和一氧化氮合酶(NOS)活性的影响。结果表明: 单施EDDS, 植株不同部位NO生成量随EDDS浓度的升高呈增加趋势, 5.0 mmol·L-1时达到最大; 0.5 mmol·L-1的EDDS可增强根、叶中NOS活性。在探究NO产生较多和NOS活性增强显著的EDDS处理浓度与SNP联合施加的研究中发现, 随SNP浓度的升高, 根中NO生成量先升高后降低, 茎和叶中持续升高; 适宜浓度的SNP可进一步增强植株体内NOS活性。EDDS诱导NO的生成会被硝酸还原酶(NR)抑制剂(NaN3)和NOS抑制剂(L-NAME)抑制, 对EDDS处理下NOS活性影响较小。NO清除剂(c-PTIO)能有效清除部分NO, 增强根和叶中NOS活性。因此, 在Cd胁迫下, 适宜浓度的EDDS单施及与SNP联合施加都会增加三叶鬼针草幼苗体内NO产生量。
EDDS; NO; 三叶鬼针草; Cd胁迫; NOS;
0 前言
植物修复是一种生态友好型原位绿色修复技术, 是重金属污染土壤修复研究的热点。但因普通植物生物量低、生长缓慢、对重金属的积累具有专一性等缺点, 很大程度上限制了植物修复技术在重金属污染土壤治理方面的推广应用[1]。近年来, 螯合剂诱导植物提取技术受到极大关注[2], 研究证实, Cd、铅(Pb)胁迫下, 适宜浓度的螯合剂可使土壤中水溶态重金属含量增加, 同时苎麻(L.)、紫花苜蓿(L.)等对土壤中重金属的吸收能力得到强化, 植物体内重金属含量明显提高, 土壤中重金属的去除效率得到了提高[3–4]。研究发现, 植物激素、菌根等与螯合剂联合施用, 不仅能够促进植物在重金属污染土壤中的正常生长, 提高植物抗性, 改善土质, 而且能够强化植物对重金属的吸收和富集, 大大提升了植物的修复效果[5]。
EDDS因其生物可降解, 对环境较友好, 且对植物和土壤微生物毒性较小, 作为一种可替代乙二胺四乙酸(EDTA)的螯合剂近年来广泛用于污染土壤修复的研究[6]。NO是一种广泛存在并参与植物应激反应的早期信号分子, 环境胁迫可导致植物细胞的NO爆发, 使植物细胞启动一系列反应或与其它信号分子协同, 防卫和保护植物体免受胁迫损伤[7]。在重金属胁迫条件下的研究表明, NO会参与抗逆生理过程, 诱导增强植物体内NO合成主要途径NOS活性, 提升植物的抗逆性, 降低副产物的积累, 提高植物对环境的适应能力[8]。但NO能否像激素和菌根等一样作为联合物质协同螯合剂强化植物对重金属的吸收和富集鲜有报道。
三叶鬼针草(L.)是种一年生草本植物, 由于其生物量大, 根系较发达, 对重金属表现出较强的抗逆性、优良的富集性和转移性, 近年来广泛用于Cd、Pb污染的土壤修复研究中[9–10]。本文通过盆栽试验研究不同浓度EDDS单施及与NO供体联合作用对Cd胁迫下三叶鬼针草不同部位NO生成及NOS活性的影响, 分析EDDS联合NO供体能否促进植物体内NO生成, 并浅探NO生成途径, 为进一步研究EDDS与联合物质是否可以通过促进植物体内NO的生成来提高植物抗性, 进而为强化植物对重金属的吸收和富集提供理论基础, 也可为促进三叶鬼针草在Cd污染土壤植物修复中的实际应用提供科学依据。
1 材料与方法
1.1 材料与试剂
三叶鬼针草种子购自泰山野菜种植基地; EDDS为麦卡希试剂, 现用现配; NR抑制剂NaN3、NOS抑制剂L-NAME、c-PTIO均购自Sigma公司; NOS和NO试剂盒均购自南京建成生物工程研究所; CdCl2·2.5 H2O、Na2[Fe(CN)5NO]·2H2O及其他药品均为国产分析纯。
1.2 试验设计
试验土壤基质采自甘肃省某县周边农田耕地(0—20 cm, Cd含量0.49 mg·kg-1), 自然风干后过2 mm筛备用。将2 kg备用土壤与设定污染物(以Cd Cl2·2.5H2O 模拟Cd胁迫, 浓度为40 mg·kg-1, 溶液形式加入到土壤中)充分混匀后装入花盆(口径20 cm、高度15 cm), 平衡21 d后, 于2016年3月20日选种播种, 盆栽置于温度、光照适宜的培养架上进行培养, 发芽后间苗至每盆10株植物, 待三叶鬼针草生长60 d左右、长出6片真叶后, 于2016年5月20日前后进行如下处理:
①EDDS单施试验设五个处理: 配制浓度为0、0.5、1.5、2.5、5.0 mmol·L-1的EDDS溶液(pH 7.0), 分别取各浓度溶液100 mL施入已长好植物的土壤中; ②选取NO产生量较多和NOS活性较强的EDDS处理浓度分别与不同浓度SNP(0、0.25、0.5、1.0 mmol·L-1)共同施加, 进行EDDS与SNP联合作用试验, 与0.1 mmol·L-1NaN3+0.25 mmol·L-1L-NAME共同施加, 进行NO主要合成途径以及对NOS活性影响试验, 与0.075 mmol·L-1c-PTIO共同施加, 进行EDDS诱导生成NO的清除及NOS活性影响试验; 各处理对照为同浓度Cd胁迫、相同生长条件下施加同剂量超纯水的处理(K(Cd))。上述处理各设置3个重复, 每个重复3个平行, 处理7 d后, 取现采鲜样进行各指标测定。
1.3 试验方法
使用南京建成NO试剂盒法测定NO含量: 称取根、茎、叶1 g洗净鲜样, 加入提取液冰浴研磨, 加入混合试剂37℃标准水浴1 h, 依次加入试剂三、四, 3500 rpm离心10 min, 取样加入显色剂, 10 min后550 nm波长下测定并计算NO含量。南京建成NOS试剂盒法测定NOS活性: 称取鲜样0.5 g加入提取液进行冰浴研磨, 4℃下3500 rpm离心10 min, 依次加入说明书要求试剂, 530 nm波长下测定并计算NOS活性。
1.4 数据统计与分析
采用Excel和SPSS 24软件进行数据处理和分析, 利用Origin 9软件绘图。采用单因素方差分析(One-way ANOVA)和Duncan法进行多重比较。
2 结果与分析
2.1 EDDS对Cd胁迫下三叶鬼针草幼苗NO产生的影响
40 mg·kg-1Cd胁迫下, 随着EDDS浓度增加不同部位NO生成量呈增加趋势; 根中NO生成量显著增加, 5.0 mmol·L-1时达到最大, 较K(Cd)增加了70.07%(P<0.05); EDDS浓度为2.5和5.0 mmol·L-1时茎中NO生成量增加显著, 较K(Cd)分别增加234.18%和268.00%(P<0.05); 叶中NO生成量在EDDS浓度为2.5 mmol·L-1时达到最大, 较K(Cd)增加155.14%(P<0.05), 虽在5.0 mmol·L-1时出现下降态势, 但仍高于K(Cd); EDDS浓度相同的条件下, 不同部位NO生成量根>茎>叶(图1)。
Cd胁迫下, 相同浓度SNP处理下, 三叶鬼针草幼苗根和茎在5.0 mmol·L-1EDDS处理下生成的NO量高于2.5 mmol·L-1, 但随SNP浓度的升高各部位总体变化趋势相似(图2)。根中NO生成量随SNP浓度的升高呈现先升高后降低的趋势, 在高浓度SNP与EDDS联合作用时NO生成量会被抑制, 2.5 mmol·L-1EDDS与0.25 mmol·L-1SNP联合作用时NO生成量达到最大, 较单施同浓度EDDS增加40.50%(P<0.05); 5.0 mmol·L-1EDDS与0.5 mmol·L-1SNP联合作用时NO生成量达到最大, 较单施同浓度EDDS增加118.39%(P<0.05)(图2A)。
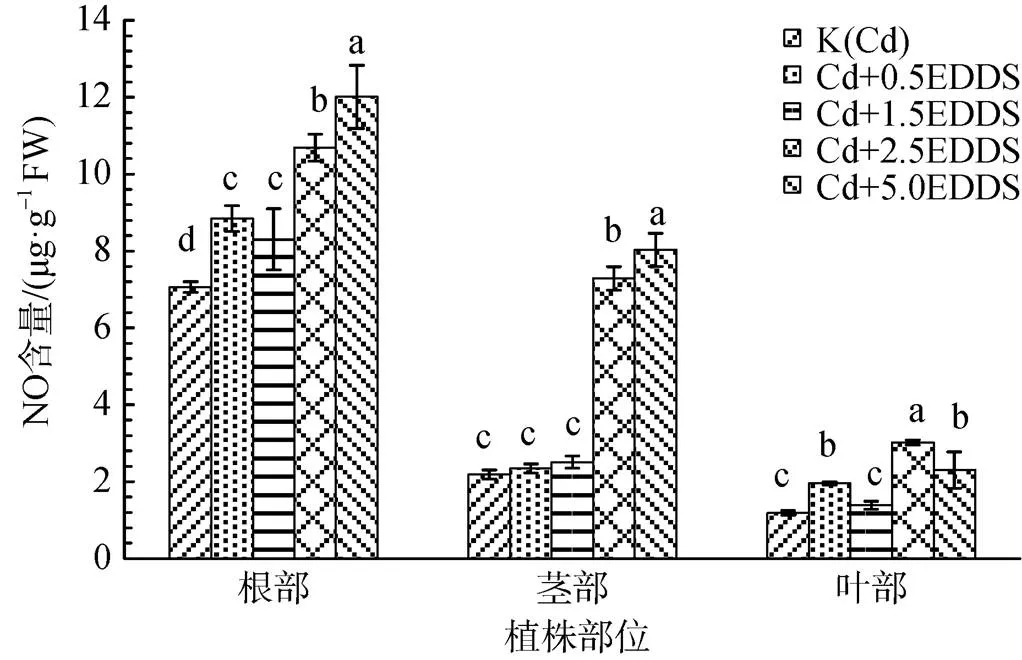
不同小写字母表示各处理间差异显著( P<0.05)。下同。
Figure 1 Effect of EDDS on NO production inseedlings
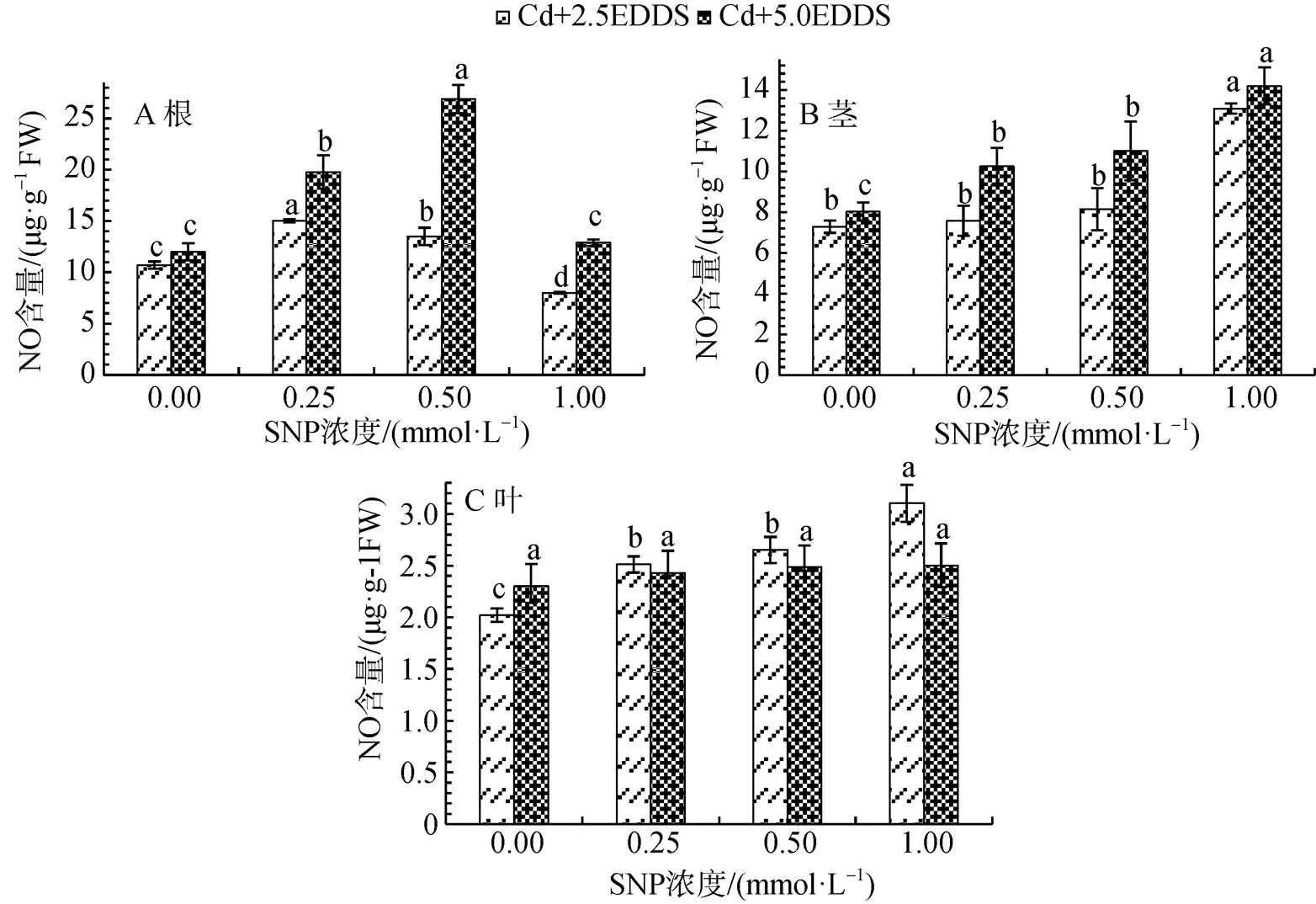
图 2 EDDS联合SNP对Cd胁迫下三叶鬼针草幼苗不同部位NO生成的影响
Figure 2 Effects of EDDS combined with SNP on NO production in different parts ofseedlings
茎部NO生成量随SNP浓度的升高呈现持续升高的趋势。当2.5和5.0 mmol·L-1EDDS分别与1.0 mmol·L-1SNP联合作用时NO生成量分别达到最大值, 较单施EDDS分别增加79.54%和76.82% (P<0.05)(图2B)。
叶部NO生成量随SNP浓度的升高呈现持续升高的趋势。2.5 mmol·L-1EDDS与1.0 mmol·L-1SNP联合作用NO生成量达到最大值, 较单施EDDS增加53.61%(P<0.05); 而5.0 mmol·L-1EDDS与不同浓度SNP联合作用时NO生成量虽有增加但不显著(图2C)。
对2.5 mmol·L-1EDDS处理组添加NaN3和L-NAME发现, 两种抑制剂能有效降低根和茎中由诱导产生的NO产生量; c-PTIO的施加能有效清除植株体内生成的部分NO, 根中NO生成量较K(Cd)显著降低(P<0.05), 茎中NO生成量较K(Cd)无显著变化(P>0.05)。两种抑制剂的添加对叶中诱导产生的NO生成量影响不显著, 而c-PTIO的添加可显著降低部分EDDS诱导产生的NO(图3)。
2.2 EDDS对三叶鬼针草不同部位NOS活性的影响
探究EDDS对三叶鬼针草幼苗NOS活性影响的研究发现: 0.5 mmol·L-1EDDS使得根和叶中NOS活性显著增强, 较K(Cd)分别提高14.88%和30.57% (P<0.05); 5.0 mmol·L-1EDDS处理显著增强茎中NOS活性, 较K(Cd)提高48.00%(P<0.05), 而对根中NOS活性产生明显的抑制作用(图4)。综合结果表明, 低浓度EDDS显著增强根和叶中NOS活性, 对茎影响较小; 高浓度EDDS抑制根中NOS活性, 增强茎中NOS活性, 对叶影响较小。
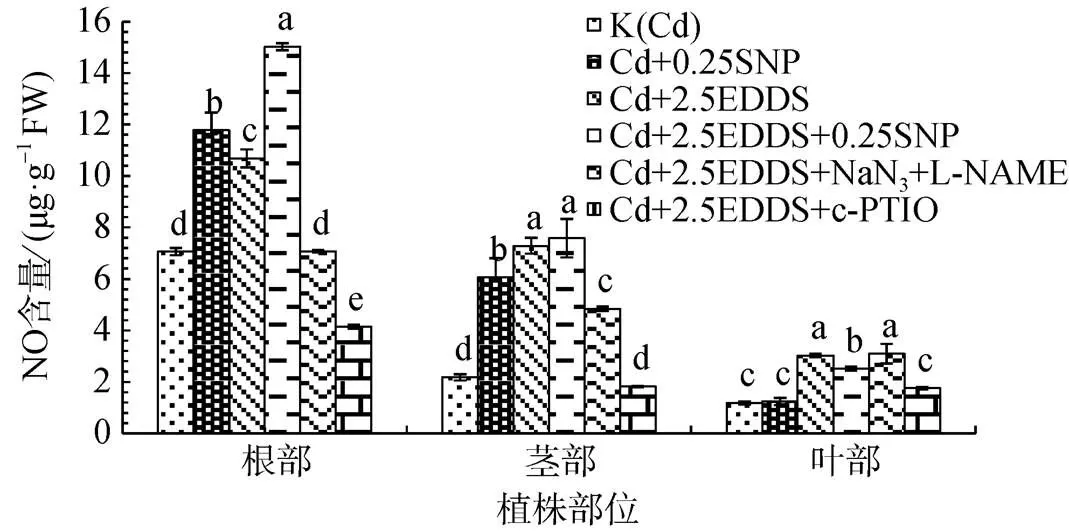
图3 EDDS与NO产生剂、抑制剂和清除剂联合作用对三叶鬼针草幼苗NO生成的影响
Figure 3 Effects of EDDS combined with NO producers, inhibitors and scavengers on NO production inseedlings
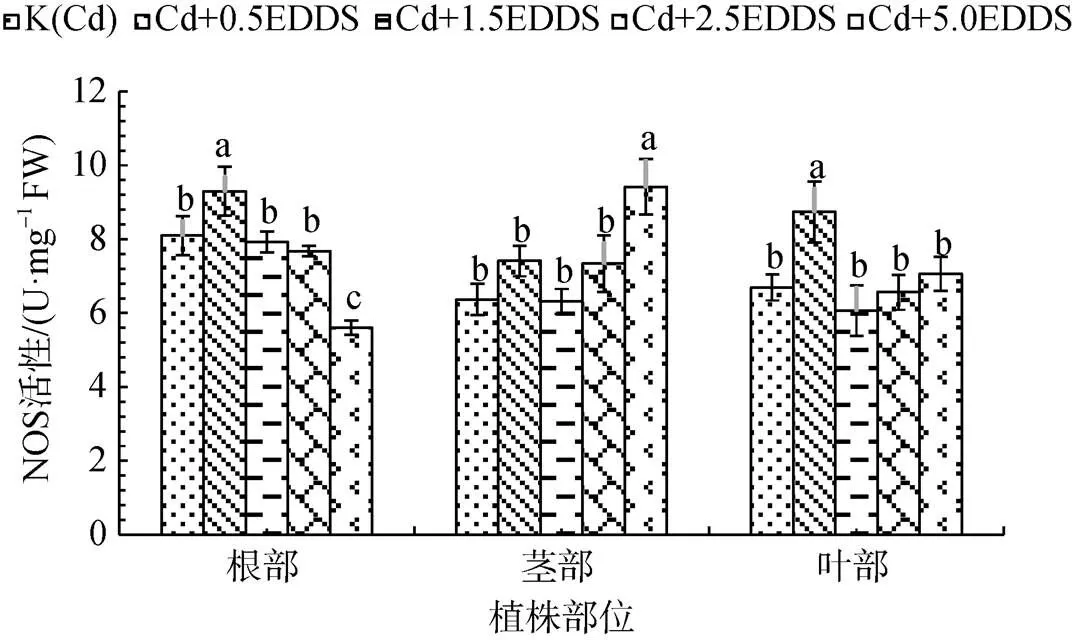
图4 不同浓度EDDS对三叶鬼针草幼苗NOS活性的影响
Figure 4 Effect of different concentrations of EDDS on NOS activities inseedlings
选取对三叶鬼针草幼苗不同部位NOS活性诱导作用较显著的0.5 mmol·L-1EDDS与不同浓度SNP联合处理幼苗发现: 三叶鬼针草不同部位NOS活性随着SNP浓度的增加, 呈现出先升高后降低的趋势, 且在0.25 mmol·L-1时各部位NOS活性均最强, 且显著高于K(Cd)(P<0.05)。高浓度SNP对根中NOS活性影响不显著; SNP浓度变化对茎部NOS活性影响较小; 0.25 mmol·L-1时, 叶中NOS活性较K(Cd)提高71.82%(P<0.05), 而施加1.0 mmol·L-1SNP处理时, NOS活性受到了显著抑制(P>0.05)(图5)。
在0.5 mmol·L-1EDDS作用下, NaN3和 L- NAME的添加对三叶鬼针草幼苗NOS活性影响较小, c-PTIO的添加可显著增强根中NOS活性(P<0.05), 对茎中NOS活性具有明显的抑制作用, 对叶中NOS活性影响甚微(图6)。
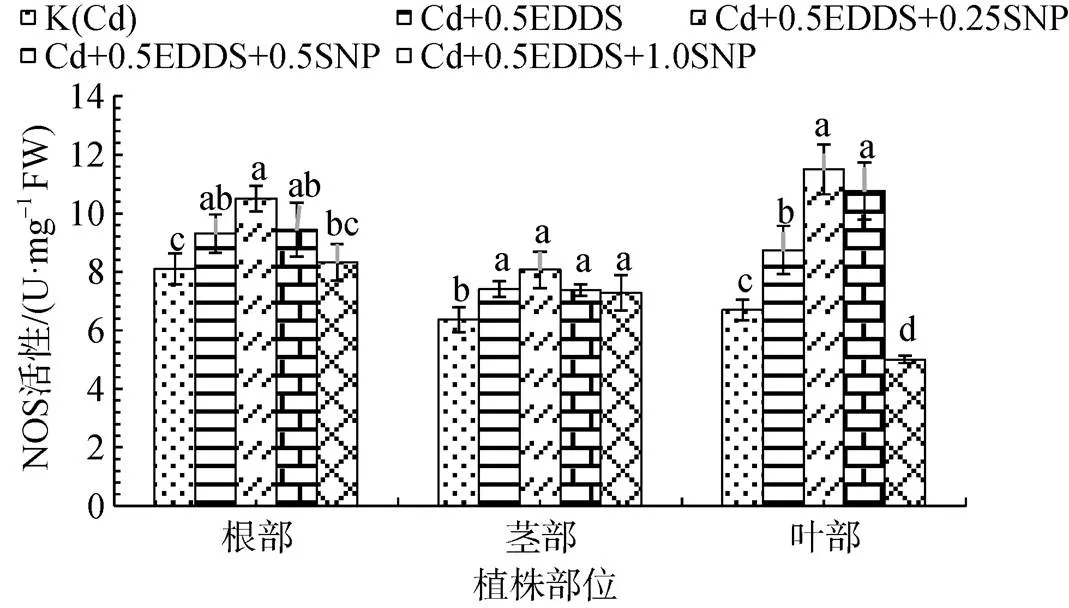
图5 不同浓度SNP与0.5 mmol·L-1EDDS共同施加对三叶鬼针草不同部位NOS活性的影响
Figure 5 Effect of different concentrations of SNP and 0.5 mmol·L-1EDDS on NOS activities in different parts ofseedlings
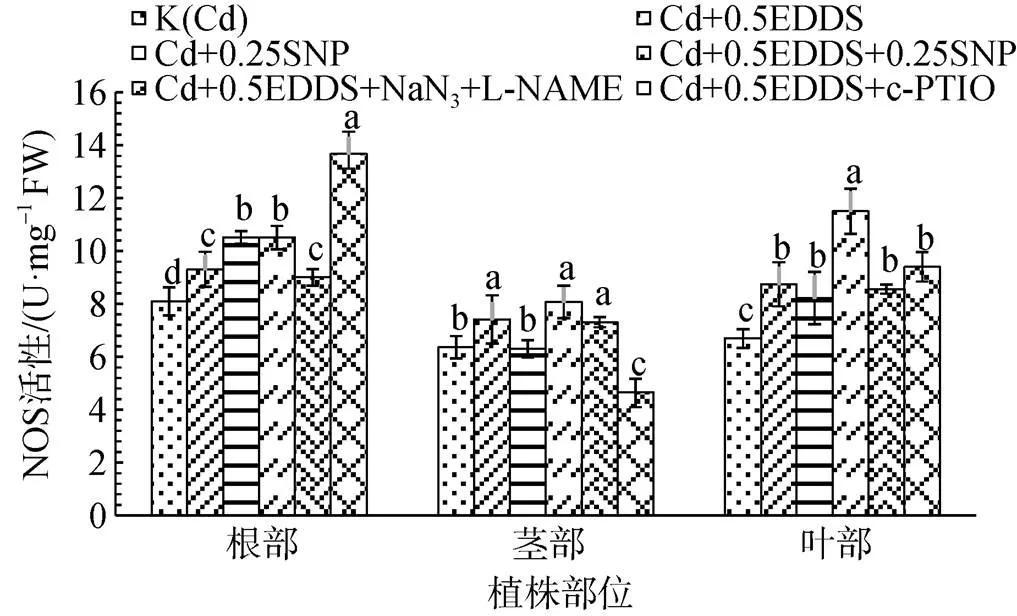
图6 EDDS与NO产生剂、抑制剂和清除剂联合作用对三叶鬼针草幼苗NOS活性的影响
Figure 6 Effect of EDDS combined with NO generator, inhibitor and scavenger on NOS activity ofseedlings
3 讨论
3.1 EDDS对三叶鬼针草不同部位NO含量的影响
螯合诱导植物修复是通过螯合剂活化并释放土壤中固相重金属, 提高土壤中液相重金属离子浓度, 解吸吸附在土壤颗粒表面的重金属, 从而提高植物修复效率[11]。适宜浓度的EDDS可以有效促进土壤中碳酸盐结合态、铁锰氧化物结合态等形态的金属离子向可交换态转化, 促进植物对金属离子的吸收[12], 并通过调整植物根系各化学成分、可溶性糖、可溶性蛋白质、丙二醛等的含量以及根系对矿物质元素的吸收和分配等来增强根系对重金属的耐受能力, 提升植物对重金属的吸收和富集能力[13]。研究证实, 植物体内NO主要通过改变重金属的分布和诱导抗性反应来参与植物对重金属胁迫的抗性[7]。紫花苜蓿和东南景天(Hance)在低浓度Cd胁迫下, 内源NO含量急剧上升, 而随着Cd浓度的升高, NO含量显著下降, 维持在略高或持平于空白对照, 在清除NO后植物的正常生长会受到明显的抑制, 并且活性氧(ROS)的积累会明显增加, 细胞损伤程度加重[14–15]。本研究结果表明, Cd胁迫下, 植物体内不同部位NO含量随着EDDS浓度的升高而升高, 一方面可能是随着EDDS浓度的增加使得土壤中可被植物利用的重金属形态含量增加, 促进了植物对重金属的吸收[16], 导致在一定重金属浓度范围下植物体内NO生成量增加, 以减轻重金属对植物的毒害作用[17]; 另一方面, 高浓度EDDS会对植物的正常生长产生抑制作用[18], 结合本试验室已有研究成果[10], EDDS浓度不超过2.5 mmol·L-1时, 三叶鬼针草能正常生长, 吸收富集转运重金属能力较强, 而超过2.5 mmol·L-1时, 植物正常生长受到抑制, 植物对Cd的吸收量减少, 土壤中Cd含量与对照组相比无显著差异, 说明高浓度EDDS对三叶鬼针草产生胁迫作用, 使得植物体内在NO含量积累升高, 而过多产生的NO与ROS反应产生毒性更强的氧化物如过氧化亚硝酸(ONOO-), 对细胞膜的损伤程度更大, 这与滕玉瑾等[19]的研究结果相似。
外源NO能够增强植物对重金属胁迫抗性, 一方面是通过增强植物细胞的抗氧化系统或直接清除ROS, 另一方面是通过影响植物对重金属的吸收以及重金属在植物细胞内的分布[20]。外源NO供体SNP的施加使植物体内NO生成增加, 一方面是由于植物吸收SNP后在植物体内本身释放NO[21], 另一方面, L-精氨酸作为植物体内通过NOS途径合成NO的主要前体物质, 其含量变化对植物体内NO含量影响较为明显[22], 而已有研究证实, 在铜(Cu)胁迫条件下, 施加SNP可以提高植物叶和根中L-精氨酸含量, 促进其向NO合成方向进行[23]。本研究表明, 在Cd胁迫条件下, 不同浓度的SNP与EDDS共同施加, 三叶鬼针草不同部位NO生成量会进一步增加, 随SNP浓度的增加, 茎和叶中NO生成量呈持续增加态势, 而根中NO生成量呈先增加后降低趋势, 其原因可能是在高浓度EDDS存在条件下, SNP浓度超过0.25 mmol·L-1时增强了重金属对植物根部生长的抑制作用, 且随着SNP浓度的升高, 抑制作用越明显[18,24]。
c-PTIO是NO的清除剂, 可有效清除植物内源NO[25], NaN3和L-NAME分别是NR和NOS的抑制剂[26]。研究表明, 植株体内NO释放量与NOS活性呈正相关, 添加适宜浓度SNP可以不同程度诱导植株体内NOS活性, 从而增加植株体内NO含量, NOS抑制剂L-NAME可以明显抑制NO的产生[23,27]; 本研究用EDDS联合NaN3和L-NAME处理Cd污染土壤中种植的三叶鬼针草幼苗, 发现三叶鬼针草不同部位NO含量相对于施加EDDS和SNP联合施加处理组都有所下降; 经c-PTIO处理后, 根部NO含量明显低于K(Cd)以及其他处理组, 叶和茎中NO生成量均有所降低, 说明在EDDS和SNP诱导作用下能够生成较多的NO, 而两种酶抑制剂能够在一定程度上抑制这种作用, c-PTIO则能够有效清除部分NO。杨建军等[28]的研究证实了盐胁迫条件能够使黄瓜(L.)幼苗体内NO生成量增加, NO清除剂c-PTIO以及NaN3和L-NAME都可以不同程度地降低NO含量, 这与本研究结果一致。
3.2 EDDS对三叶鬼针草不同部位NOS活性的影响
植物体内的内源NO主要由NOS和NR催化合成以及非酶促途径合成[29]。由NOS介导时以L-精氨酸为底物, 以NAD(P)H为电子供体生成NO[7,30]; 此外, 植物细胞质的NR和根部特有的质膜亚硝酸还原酶( Ni-NOR)也参与NO的生成, NR和Ni-NOR以NAD(P)H作为电子供体进行还原反应将亚硝酸盐(NO2-)还原生成NO[22]。研究证实, 在Cd胁迫下, 适宜浓度的SNP配合24-表油菜素内酯(EBR)可以刺激花生(L.)体内的NR和NOS, 提高酶的活性, 配合植物体内其他生理变化, 来减轻Cd在花生体内的负面效应[31]。本研究表明, 低浓度EDDS可以诱导三叶鬼针草根、茎、叶中NOS活性, NO含量也随之升高, 说明低浓度EDDS处理的三叶鬼针草在Cd胁迫下, NOS途径会对NO的生成产生影响, 而高浓度的EDDS对根部NOS活性产生了明显的抑制作用; 陈银萍等[8]的研究结果表明, 随着Pb胁迫浓度的增加, 三叶鬼针草不同部位NOS酶活性呈现先升高后降低的趋势。在高浓度EDDS处理时, 根中NOS活性虽然受到明显的抑制并低于K(Cd), 而NO含量持续升高, 说明此时, 三叶鬼针草根中NOS途径不是合成NO的唯一途径; Stöhr等[32]的研究发现, 烟草()根部存在特有的Ni-NOR, 参与NO的生成。在低浓度EDDS处理时, 施加SNP, 可以增强NOS活性, 但高浓度SNP对根和茎中NOS活性影响较小, 该结果与刘建新等[33]研究结果相似。低浓度的EDDS与L-NAME 和NaN3联合处理时根中NOS活性较SNP、EDDS及二者联合处理组有所降低, 茎和叶中也呈现出类似的变化趋势, 而在施加c-PTIO后根部NOS活性明显升高, 叶中较K(Cd)也有显著的升高, 这与c-PTIO导致盐处理小麦(L.)根中NOS类似蛋白活性增强[20]和c-PTIO使机械损伤下芦苇()愈伤组织NOS活性增强[34]的研究结果相似。而茎中呈现出明显的抑制状态, 原因可能是同种植物不同部位NOS对外界干扰的响应机理存在差异, 具体原因需进一步研究。
4 结论
Cd胁迫下, EDDS能诱导三叶鬼针草幼苗NO生成量的增加, 低浓度EDDS提升了根和叶中NOS活性, 且NO含量增加, 高浓度EDDS对根中NOS活性产生抑制, 但NO含量升高, 证明NOS途径不是根部NO合成的唯一途径; 低浓度EDDS与SNP联合作用可进一步提升根部NOS活性, 且在一定浓度范围内NO的生成量也会增加。两种抑制剂的添加进一步证实了EDDS对NO生成能产生积极的诱导作用。NO的清除能刺激NOS活性, 证实了在一定条件下, NOS途径是植物体内NO生成的途径之一, 但在不同部位表现出不同的响应, 出现这种现象的原因需进一步研究。
[1] 聂亚平, 王晓维, 万进荣, 等. 几种重金属(Pb、Zn、Cd、Cu)的超富集植物种类及增强植物修复措施研究进展[J]. 生态科学, 2016, 35(02): 174–182.
[2] 袁金玮, 陈笈, 陈芳, 等. 强化植物修复重金属污染土壤的策略及其机制[J]. 生物技术通报, 2019, 35(01): 126– 136.
[3] 刘金, 殷宪强, 孙慧敏, 等. EDDS与EDTA强化苎麻修复镉铅污染土壤[J]. 农业环境科学学报, 2015, 34(7): 1293–1300.
[4] 任丽娟, 柴琳琳, 郭昱, 等. 螯合剂对镉在土壤和紫花苜蓿中积累的影响研究[J]. 新疆大学学报(自然科学版), 2015, (3): 330–335.
[5] MOHD I, SAHI V. Promising role of plant hormones in translocation of lead inshoots[J]. Environmental Pollution, 2008, 153(1): 29–36.
[6] 刘晓娜, 赵中秋, 陈志霞, 等. 螯合剂、菌根联合植物修复重金属污染土壤研究进展[J]. 环境科学与技术, 2011, 34(12H): 127–133.
[7] 张玲玲, 吴丹, 赵子捷, 等. 植物一氧化氮信号分子的研究进展[J]. 植物学报, 2017, 52(3): 337–345.
[8] 陈银萍, 柯昀琪, 杨志娟, 等. 铅胁迫下三叶鬼针草内源一氧化氮的生成及其对氧化损伤的缓解效应[J]. 植物科学学报, 2018, 36(2): 264–272.
[9] 谌金吾, 孙一铭, 王凤英, 等. 三叶鬼针草毛状根的诱导及其对重金属Cd、Pb蓄积[J]. 环境科学学报, 2015, 35(5): 1596–1602.
[10] 杨波, 陈银萍, 柯昀琪, 等. EDDS对Cd胁迫下三叶鬼针草生长和抗氧化酶系统及Cd积累的影响[J]. 农业环境科学学报, 2018, 37(05): 41–48.
[11] 郑君健, 刘杰, 张学洪, 等. 重金属污染土壤植物修复及强化措施研究进展[J]. 广东农业科学, 2013, 40(18): 159– 164.
[12] 祝方, 商执峰, 陈雨, 等. 螯合剂-大白菜修复电子垃圾拆解场地土壤中锌与磷酸酶活性的研究[J]. 安全与环境工程, 2014, 21(3): 41–45.
[13] 袁菊红, 胡绵好. EDDS处理对硒胁迫下彩叶草根系FTIR-ATR、SEM-EDXS特征及生理特性的影响[J]. 植物科学学报, 2014, 32(6): 620–629.
[14] 蘧苗苗, 陈银萍, 苏向楠, 等. 镉胁迫下紫花苜蓿幼苗内源一氧化氮和活性氧的生成[J]. 广西植物, 2016, 36(12): 1483–1491.
[15] HU Yan, LU Lingli,TIAN Shengke,et al. Cadmium-induced nitric oxide burst enhances Cd tolerance at early stage in roots of a hyperaccumulatorpartially by altering glutathione metabolism[J]. Science of The Total Environment, 2019, 650: 2761–2770.
[16] 胡亚虎, 魏树和, 周启星, 等. 螯合剂在重金属污染土壤植物修复中的应用研究进展[J]. 农业环境科学学报, 2010, 29(11): 2055–2063.
[17] HUANG Meiyu, AI Honglian, XU Xiaoxiang, et al. Nitric oxide alleviates toxicity of hexavalent chromium on tall fescue and improves performance of photosystem II [J]. Ecotoxicology and environmental safety, 2018, 164: 32–40.
[18] 陈立, 王丹, 龙婵, 等. 三种螯合剂对芥菜修复铀镉复合污染土壤的影响[J]. 农业环境科学学报, 2018,37 (08): 146–153.
[19] 滕玉瑾, 李翠祥, 马婷, 等. 盐胁迫下小麦幼苗NO和胞间ROS的相互作用及其对元素含量的调节[J]. 植物生理学报, 2015, (11): 1837–1845.
[20] 夏海威, 施国新, 黄敏, 等. 一氧化氮对植物重金属胁迫抗性的影响研究进展[J]. 生态学报, 2015, 35(10): 3139– 3147.
[21] 张敏, 姜春辉, 李晓云, 等. 外源NO对铜胁迫下番茄幼苗根系构型及其超微结构的影响[J]. 植物生理学报, 2012, 48(11): 1105–1112.
[22] CANTÓN F R , SUÁREZ M F , CÁNOVAS F M. Molecular aspects of nitrogen mobilization and recycling in trees[J]. Photosynthesis Research, 2005, 83(2): 265–278.
[23] 王建, 窦巧惠, 于世欣, 等. 外源NO对Cu胁迫下番茄幼苗L-精氨酸代谢的影响[J]. 生态毒理学报, 2015, 10(3): 112–122.
[24] 武佳叶, 郝瑞芝, 曹媛, 等. NO对铅胁迫下玉米根尖细胞的影响[J]. 中国细胞生物学学报, 2013, (4): 469–475.
[25] 周万海, 师尚礼, 寇江涛. 一氧化氮对NaCl胁迫下苜蓿种子萌发的影响[J]. 核农学报, 2012, 26(4): 710–716.
[26] 王玮, 赵方贵, 侯丽霞, 等. NO参与AM真菌与烟草共生过程[J]. 生态学报, 2013, 33(23): 7583–7589.
[27] 张洪艳, 王文霞, 尹恒, 等. 壳寡糖诱导植物防御反应中一氧化氮信号的研究[J]. 中国生物工程杂志, 2011, 31(2): 18–22.
[28] 杨建军, 张国斌, 郁继华, 等. 盐胁迫下内源NO对黄瓜幼苗活性氧代谢和光合特性的影响[J]. 中国农业科学, 2017(19).
[29] WOJTASZEK P . Nitric oxide in plants - To NO or not to NO[J]. Phytochemistry, 2010, 31(33): 1–4.
[30] RíOLA DEL, F JAVIER C, BARROSO J B. Nitric oxide and nitric oxide synthase activity in plants[J]. Phytochemistry, 2004, 65(7): 783–792.
[31] DOBRIKOVA A G , VLADKOVA R S , RASHKOV G D , et al. Effects of exogenous 24-epibrassinolide on the photosynthetic membranes under non-stress conditions[J]. Plant Physiology and Biochemistry, 2014, 80: 75–82.
[32] STIHR C. Generation and possible roles of NO in plant roots and their apoplastic space[J]. Journal of Experimental Botany, 2003, 53(379): 2293–2303.
[33] 刘建新, 王金成, 刘秀丽. 镧胁迫下燕麦幼苗精氨酸代谢对外源NO的响应[J]. 中国稀土学报, 2018, 36(02): 236–246.
[34] ZHAO Mingui, CHEN Lei, ZHANG Lili, et al. Nitric reductase-dependent nitric oxide production is involved in cold acclimation and freezing tolerance in[J]. Plant Physiology, 2009, 151(2): 755–767.
Effects of EDDS on NO production in the seedlings ofLunder Cd stress
DING Jungang, CHEN Yinping*, YANG Bo, SHI Xiaoping, XIE Haifan
School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070
An indoor pot experiment was conducted to study the effects of EDDS (0, 0.5, 1.5, 2.5, 5.0 mmol.L-1) and EDDS combined with nitric oxide (NO) donor sodium nitroprusside (SNP) (0, 0.25, 0.5, 1.0 mmol.L-1) on stress signal molecule(NO) and nitric oxide synthase (NOS) activity production ofL. seedlings under 40 mg·kg-1Cd (CdCl2.2.5 H2O) stress. The results showed that NO production in different parts ofseedlings increased with the increase of EDDS concentration, and reached the maximum at 5.0 mmol·L-1; 0.5 mmol·L-1EDDS enhanced nitric oxide synthase (NOS) activity in roots and leaves. Selecting EDDS treatment concentration with more NO production and significant increase in NOS activity to combined with SNP to treatseedlings showed that NO production in roots increased first and then decreased, but increased continuously in stems and leaves with the increase of SNP concentration. The NOS activity in the plant could be further enhanced by appropriate concentration of SNP.The NO induced by EDDS was inhibited by nitrate reductase (NR) inhibitor (NaN3) and NOS inhibitor (L-NAME), and NaN3and L-NAME had little effect on NOS activity. The NO scavenger (c-PTIO) effectively removed some of the NO and enhanced NOS activity in roots and leaves.Therefore, under the stress of Cd, the NO production inL. seedlings could be increased by single application of EDDS and combined application of SNP with suitable concentration.
EDDS;NO;L.;Cd stress;NOS
10.14108/j.cnki.1008-8873.2020.04.003
丁浚刚, 陈银萍, 杨波, 等. EDDS对Cd胁迫下三叶鬼针草幼苗NO产生的影响[J]. 生态科学, 2020, 39(4): 19–25.
DING Jungang, CHEN Yinping, YANG Bo, et al. Effects of EDDS on NO production in the seedlings of Bidens pilosa L. under Cd stress[J]. Ecological Science, 2020, 39(4): 19–25.
Q494
A
1008-8873(2020)04-019-07
2019-10-07;
2019-12-27
国家自然科学基金项目(31560161;31260089;31640012)
丁浚刚(1992—), 男, 在读硕士, 主要从事环境生态学研究, E-mail: 1937657901@qq.com
陈银萍(1974—) , 女, 博士, 教授, 主要从事植物逆境生理生态学研究, E-mail: yinpch@mail.lzjtu.cn
