阿帕替尼联合化疗一线治疗小细胞肺癌的疗效观察△
2020-08-12李艳芳李倩朱梅吕姣姜海英陆娟
李艳芳,李倩,朱梅,吕姣,姜海英,陆娟
徐州市肿瘤医院1肿瘤内科,2呼吸科,江苏 徐州 221000
肺癌已成为全世界范围内导致肿瘤死亡的重要因素之一,且目前研究表明,肺癌的发病率呈现快速增长的趋势,其中,小细胞肺癌占所有肺癌的15%~20%,其特征为肿瘤恶化程度高、侵袭性强、倍增时间快、预后差[1]。大多数小细胞肺癌患者确诊时已出现远处转移或伴随淋巴结转移,无法行早期手术治疗,因此,化疗成为了临床治疗小细胞肺癌的常用方式[2-3]。顺铂联合依托泊苷是目前治疗小细胞肺癌的一线化疗方案,虽然具有促进肿瘤细胞凋亡的作用,但依托泊苷所作用的过程属于可逆过程,当顺铂联合依托泊苷化疗结束后,患者机体内的依托泊苷会逐渐消除,降低药物浓度,从而可能会导致肿瘤复发[4]。本研究观察了阿帕替尼联合一线化疗治疗小细胞肺癌的疗效,旨在寻找维持小细胞肺癌治疗的有效药物,以延长患者的生存期,现报道如下。
1 对象与方法
1.1 研究对象
选取2016年1月至2017年1月徐州市肿瘤医院收治的40例小细胞肺癌患者。纳入标准:患者均经组织病理学确诊为小细胞肺癌;既往未接受过放疗、化疗及其他抗肿瘤治疗。排除标准:存在活动性出血,包括咯血、消化道出血;合并严重心、肝、肾功能不全;合并严重的神经系统疾病,存在沟通障碍;合并其他肿瘤。按照随机数字表法将40例小细胞肺癌患者随机分为对照组和联合组,各20例。对照组中,男11例,女9例;年龄35~80岁,平均(58.5±2.5)岁;美国退伍军人肺癌研究协会(Veterans Administration Lung Study Group,VALG)分期:局限期5例,广泛期15例。联合组中,男10例,女10例;年龄35~85岁,平均(59.0±2.3)岁;VALG分期:局限期4例,广泛期16例。两组患者的性别、年龄、VALG分期比较,差异均无统计学意义(P>0.05),具有可比性。本研究经过医院医学伦理委员会审核批准,所有患者及其家属均对本研究知情并签署知情同意书。
1.2 方法
1.2.1 治疗方法 两组患者均行一线化疗方案治疗,采用顺铂联合依托泊苷(EP)一线化疗方案:依托泊苷100 mg/m2,第1至3天;顺铂总量为80 mg/m2,分2~3天使用,21天为1个周期。联合组加用阿帕替尼进行治疗,250 mg/d,口服,连服28天为1个周期。两组患者均至少化疗2个周期后评价疗效,若治疗有效则均化疗6个周期。联合组患者于一线化疗结束后继续口服阿帕替尼500 mg/d维持治疗至肿瘤进展,进展后给予二线方案化疗或放疗等局部治疗;单纯化疗组患者于一线化疗6个周期后观察肿瘤进展情况,若肿瘤进展,则给予二线方案化疗或放疗等局部治疗。两组患者后续接受二线化疗及放疗的情况平行,具有可比性。
1.2.2 血清样本采集 抽取两组患者治疗前1天和治疗结束后第1天清晨空腹静脉血5 ml,保存于抗凝管中,以3000 r/min的转速离心约20分钟,离心后分离出上层血清,置于-80℃环境中保存待用。
1.2.3 观察指标 ①采用罗氏Cobase601全自动电化学发光分析仪检测两组患者治疗前后神经元特异性烯醇化酶(neuron specific enolase,NSE)、胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)的表达水平。②采用酶联免疫吸附试验检测两组患者治疗前后血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的表达水平。③根据实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)[5]评估治疗效果,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),治疗总有效率=(CR+PR)例数/总例数×100%。④参照国际肿瘤化疗药物不良反应评价系统[6]对患者治疗相关不良反应进行评价,不良反应包括高胆红素血症、手足综合征、骨髓抑制、头痛、胃肠道反应(恶心、食欲减退)、高血压、蛋白尿。⑤对患者随访12~24个月,比较两组患者的1年、2年生存率。
1.3 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效的比较
联合组患者的治疗总有效率为80.0%(16/20),高于对照组的50.0%(10/20),差异有统计学意义(χ2=3.956,P<0.05)。(表1)

表1 两组患者的临床疗效[n(%)]
2.2 两组患者治疗前后血清NSE、ProGRP水平的比较
治疗前,两组患者的血清NSE、ProGRP水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的血清NSE、ProGRP水平均低于本组治疗前,差异均有统计学意义(P<0.05);治疗后,联合组患者的血清NSE、ProGRP水平均明显低于对照组,差异均有统计学意义(t=10.120、5.589,P<0.01)。(表2)
表2 两组患者治疗前后的血清NSE、ProGRP水平(±s)

表2 两组患者治疗前后的血清NSE、ProGRP水平(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标N S E(n g/m l)P r o G R P(p g/m l)治疗前治疗后治疗前治疗后7 3.2 4±1 1.1 0 1 6.1 4±1.1 2 a b 2 6 5 3.2 4±3 2 1.0 1 5 2 1.2 3±1 1 4.2 1 a b 7 3.2 5±1 1.0 2 3 1.2 4±6.5 8 a 2 6 5 8.9 6±3 2 6.3 5 8 5 9.3 5±2 4 5.2 4 a时间联合组(n=2 0)对照组(n=2 0)
2.3 两组患者治疗前后血清VEGF、VEGFR2水平的比较
治疗前,两组患者的血清VEGF、VEGFR2水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的血清VEGF、VEGFR2水平均低于本组治疗前,差异均有统计学意义(P<0.05);治疗后,联合组患者的血清VEGF、VEGFR2水平均明显低于对照组,差异均有统计学意义(t=7.198、14.090,P<0.01)。(表3)
表3 两组患者治疗前后血清VEGF、VEGFR2水平(pg/ml,±s)
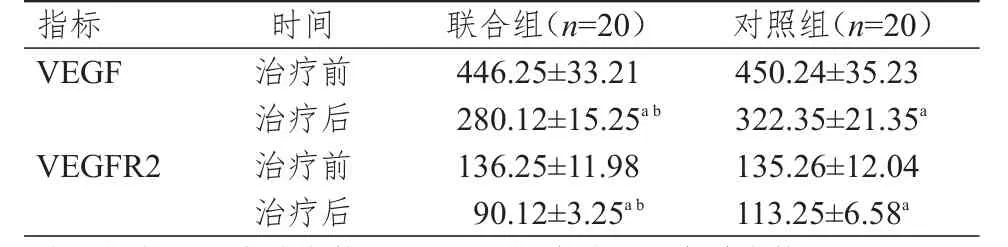
表3 两组患者治疗前后血清VEGF、VEGFR2水平(pg/ml,±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标V E G F V E G F R 2治疗前治疗后治疗前治疗后4 4 6.2 5±3 3.2 1 2 8 0.1 2±1 5.2 5 a b 1 3 6.2 5±1 1.9 8 9 0.1 2±3.2 5 a b 4 5 0.2 4±3 5.2 3 3 2 2.3 5±2 1.3 5 a 1 3 5.2 6±1 2.0 4 1 1 3.2 5±6.5 8 a时间联合组(n=2 0)对照组(n=2 0)
2.4 两组患者不良反应发生情况的比较
两组患者均发生了不同程度的不良反应,主要为1~2级不良反应。对照组中,高胆红素血症1例,手足综合征2例,骨髓抑制1例,胃肠道反应2例;联合组中,高胆红素血症1例,手足综合征1例,骨髓抑制2例,胃肠道反应1例,蛋白尿1例。仅对照组出现1例3级不良反应。两组患者各不良反应的发生情况比较,差异均无统计学意义(P>0.05)。
2.5 两组患者生存情况的比较
联合组患者的1年生存率、2年生存率分别90.00%(18/20)、80.00%(16/20),均高于对照组患者的 60.00%(12/20)、50.00%(10/20),差异均有统计学意义(χ2=4.800、3.956,P<0.05)。
3 讨论
顺铂联合依托泊苷是目前治疗小细胞肺癌的一线化疗方案,虽然近期疗效显著,但维持时间较短,大多数患者会在短期内复发或病情发生进展。因此,对于小细胞肺癌患者,寻找有效的维持治疗药物对抑制肿瘤复发、延长生存期尤为重要。
阿帕替尼属于一种新型口服小分子抗血管生成药物,是主要针对VEGFR2的小分子酪氨酸激酶抑制剂,高度选择性地与VEGFR2结合,并且会抑制VEGFR的磷酸化,进而阻断VEGF信号通路,最终起到抗肿瘤血管生成的作用[7]。VEGFR2主要表达于内皮细胞中,与肿瘤血管生成有关,当VEGF2被VEGF激活,VEGFR2羧基末尾、激酶插入区域均会发生自动磷酸化,最终促进肿瘤细胞的增殖、迁移以及内皮细胞的存活。有研究表明,阿帕替尼通过与VEGFR2结合从而竞争性抑制VEGFR2与VEGF的结合,抑制肿瘤血管生成、肿瘤细胞增殖,最终发挥抗肿瘤的作用[8]。研究发现,与其他同种类型的小分子酪氨酸酶激酶抑制剂比较,阿帕替尼选择性抑制VEGFR2的作用更强[9]。
目前,临床上已有多种研究证实阿帕替尼治疗多种晚期肿瘤安全有效[10-12]。郭秀梅等[13]发现,阿帕替尼二线治疗小细胞肺癌具有一定的临床疗效,可改善患者生活质量,且不良反应可控,能够作为二线治疗小细胞肺癌可选择的靶向药物。李芳芳和陶海涛[14]对阿帕替尼用于小细胞肺癌多线治疗后挽救治疗的效果进行探索,发现阿帕替尼可作为小细胞肺癌多线治疗后的选择。本研究结果显示,联合组患者的治疗总有效率高于对照组,差异有统计学意义(P<0.05),且联合组患者的1、2年生存率更高,血清中VEGF、VEGFR2水平更低,说明对小细胞肺癌行一线化疗联合阿帕替尼治疗的机制可能是通过抑制患者血清中VEGF、VEGFR2的表达抑制肿瘤细胞的增殖、转移,进而延长患者的生存周期,提高患者生存率。
临床上常使用NSE、ProGRP作为评价小细胞肺癌患者疗效的血清肿瘤标志物,根据患者治疗前后NSE、ProGRP水平的变化情况对治疗效果进行评估,二者均对小细胞肺癌的诊断具有较高的灵敏度和特异度[15]。NSE属于一种神经内分泌肿瘤标志物,主要表达于神经内分泌组织、神经组织。NSE在小细胞肺癌中呈异常高表达,可作为小细胞肺癌的诊断标志物[16]。GRP是一种类似蛙皮素的羧基末端的肽类物质,由小细胞肺癌细胞分泌,可在一定程度上促进小细胞肺癌细胞的增殖、分化、转移,但其在血液中的表达并不稳定,较易被分解酶降解,而GRP的前体片段ProGRP在血液中的表达较为稳定,且其表达与GRP呈正相关,在早期小细胞肺癌患者组织、血清中的表达水平均较高,且随着患者病情的发展进一步升高[17]。有研究表明,经化疗有效的小细胞肺癌患者血清中ProGRP水平明显低于化疗前,可作为小细胞肺癌临床诊断、疗效评估的敏感指标[18-20]。本研究结果显示,治疗后,两组患者血清中NSE、ProGRP水平均下降,但联合组患者血清中NSE、ProGRP水平更低,提示阿帕替尼联合一线化疗治疗小细胞肺癌的效果更优。
综上所述,阿帕替尼联合化疗一线治疗小细胞肺癌患者可在一定程度上抑制肿瘤因子的异常表达,提高患者的临床疗效和生存率,并可用于小细胞肺癌的维持治疗。但是,临床尚未有研究将一线化疗方案与阿帕替尼联合应用于小细胞肺癌的治疗中,因此,本研究的结果仍需后续研究进一步证实。
