牛无浆体和山羊无浆体双重PCR检测方法的建立
2020-07-13彭永帅张利卫王军李月勤王海燕
彭永帅,张利卫,王军,李月勤,王海燕
(河南牧业经济学院动物医药学院,河南 郑州 450046)
无浆体是一种专性血液寄生的可经硬蜱传播的病原体,世界范围内分布广泛[1]。我国报道的有关无浆体的病原包括牛无浆体(Anaplasmabovis)、山羊无浆体(A.capra)、绵羊无浆体(A.ovis)、嗜吞噬细胞无浆体(A.phagocytophilum)、边缘无浆体(A.marginale)、中央无浆体(A.centrale)和扁平无浆体(A.platys)共7个种。其中牛无浆体和绵羊无浆体流行最为广泛,在我国多地区的牛场和羊场均有报道,且感染率较高[1-2]。山羊无浆体是近年来新发现的一种人兽共患无浆体,最早在黑龙江省牡丹江市中心医院病人的血样品中检测到,并被正式命名[3]。后来又分别在绵羊、山羊、硬蜱和一些野生动物的样品中被检测到,可见山羊无浆体的宿主范围非常广泛[4-6]。
当前,PCR检测技术已被广泛应用于各种疾病的诊断,多重PCR方法是根据常规PCR方法衍生而来的技术,在同一个PCR反应体系中用2组或2组以上的引物同时扩增,结果发现能检测到相应的2种或2种以上的病原,比常规PCR的费用低且效率更高[7]。
本研究设计一种双重PCR方法,该方法操作简单快速且特异性和重复性良好,能够同时对牛无浆体和山羊无浆体2种病原进行快速检测,方便科研工作者和畜牧兽医相关人员对该病的诊断。
1 材料与方法
1.1 样品来源
采用2018年8月27日和9月28日采自陕西麟游羊全血DNA样品30份,-20 ℃冰箱保存备用。牛无浆体(A.bovis)、山羊无浆体(A.capra)、绵羊无浆体(A.ovis)、吕氏泰勒虫(T.luwenshuni)、牛巴贝斯虫(Babesiabovis)、尤氏泰勒虫(T.uilenbergi)、绵羊泰勒虫(T.ovis)、环形泰勒虫(T.annulata)、双芽巴贝斯虫(Babesiamotasi)和刚地弓形虫(T.gondii)阳性样品DNA由实验室保存。
1.2 DNA的提取
参考哺乳动物血液基因组DNA提取试剂盒(上海莱枫)说明书进行血液样品的提取,-20 ℃保存备用。
1.3 引物的设计
利用Clustal X 2.1序列分析软件,针对GenBank中登录牛无浆体gltA序列(登录号KP076365)与其他物种同源序列对比,用Premier 5.0软件设计1对特异性引物abgltAf1/abgltAr1,由上海生工生物工程公司合成。参考YANG等[4]合成山羊无浆体的msp4序列位点引物acmsp4f4/acmsp4r1,引物信息见表1。
表1 引物的设计
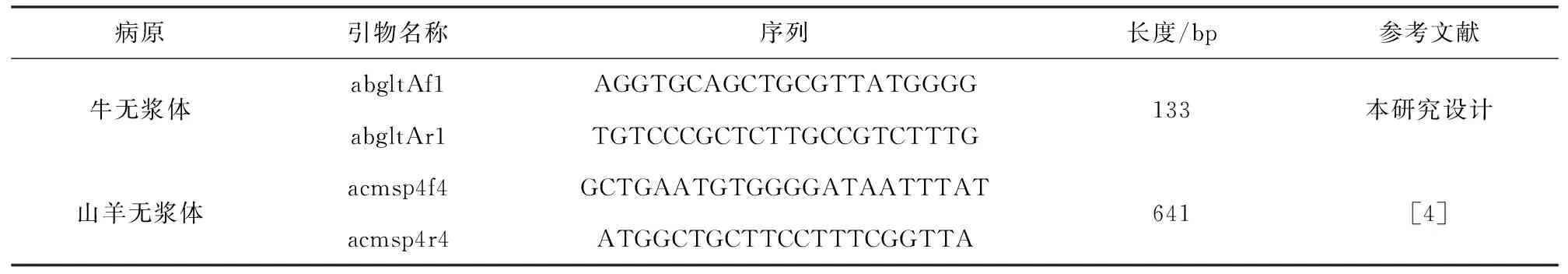
病原引物名称序列长度/bp参考文献牛无浆体abgltAf1AGGTGCAGCTGCGTTATGGGGabgltAr1TGTCCCGCTCTTGCCGTCTTTG133本研究设计山羊无浆体acmsp4f4GCTGAATGTGGGGATAATTTATacmsp4r4ATGGCTGCTTCCTTTCGGTTA641[4]
1.4 PCR扩增
1.4.1 单重PCR扩增
以羊全血基因组DNA为模板,分别用2种引物进行PCR扩增,将PCR产物用1.5%琼脂糖凝胶电泳后拍照成像。反应体系和反应条件分别见表2和表3。
表2 单对引物的PCR扩增反应体系

试剂体积/μL10×La Buffer2.5dNTP Mixture4上游引物0.4下游引物0.4La Taq酶 0.25DNA2ddH2O15.45
表3 单对引物的PCR扩增反应条件

预变性变性退火延伸循环次数延伸保存温度94℃94℃60℃72℃时间5min30s30s1min4072 ℃10 ℃10 min∞
1.4.2 双重PCR扩增
以羊全血基因组DNA为模板,将2对引物abgltAf1/abgltAr1、acmsp4f4/acmsp4r1加入到同一个PCR反应体系中,进行PCR扩增,将PCR产物进行1.5 %琼脂糖凝胶电泳,PCR反应体系和反应条件详情见表4和表5。
表4 双重PCR扩增反应体系

试剂体积/μL10×La Buffer2.5dNTP Mixture4LaTaq 酶0.25abgltAf1/acmsp4f4各0.4 abgltAr1/acmsp4r4各0.4 DNA2.0ddH2O14.65
表5 双重PCR扩增反应条件

预变性变性退火延伸循环次数延伸保存温度94 ℃94 ℃60 ℃72时间5 min30 s30 s1 min40次721010 min∞
1.5 双重PCR方法反应体系及反应条件的优化
对反应体系和反应条件中的循环次数、引物的剂量、LaTaq酶的剂量和退火温度进行调整优化。
1.5.1 PCR反应条件的优化
(1)最适循环次数的优化:25 μL PCR体系保持不变,即各成分的浓度及体积保持不变。配制共5组,每组中分别加入DNA模板2 μL,ddH2O作阴性对照。为减少误差将同时使用5台PCR仪进行PCR扩增。在其他PCR条件均不变的情况下,循环次数分别是25、30、35、40、45。
(2)最适引物剂量的优化:加入引物的剂量分别是 0.3、0.4、0.5、0.6和0.7 μL,采用25 μL PCR体系,条件及其他各成分不变进行PCR扩增。
1.5.2 PCR反应体系的优化
(1)LaTaq酶剂量的优化:在25 μL PCR体系中,保持其他各成分不变,只改变LaTaq酶的体积,加入LaTaq酶的剂量分别是0.2、0.25、0.3、0.35和0.4 μL。PCR反应条件采用优化后的反应条件进行扩增。
(2)退火温度的优化:在25 μL PCR体系中,保持反应条件和体系不变,只改变退火温度。使用梯度PCR仪将退火温度设置成55~65 ℃。
1.6 验证试验
1.6.1 序列测定
将所得PCR产物送至上海生工生物工程进行测序。将得到的基因序列在NCBI(https://www.ncbi.nlm.nih.gov/)网站上进行Blast比对。
1.6.2 特异性验证
用绵羊无浆体、吕氏泰勒虫、牛巴贝斯虫、尤氏泰勒虫、绵羊泰勒虫、环形泰勒虫、双芽巴贝斯虫和刚地弓形虫阳性DNA样品作为特异性试验的模板,按最佳反应体系及条件进行PCR扩增以检验所建立PCR方法的特异性。
1.6.3 重复性验证
以牛无浆体和山羊无浆体阳性样品为模板,用优化好的PCR反应体系及条件进行不同批次、批间的重复试验,并通过计算kappa系数检验结果的一致性。
1.6.4 临床样本检测
采用2018年9月28日和8月27日采自陕西麟游羊全血DNA样品30份,利用该研究所建立的最佳PCR体系进行检测。
2 结果与分析
2.1 PCR扩增
单独用牛无浆体引物(abgltAf1/abgltAr1)扩增羊全血基因组DNA,琼脂糖凝胶电泳结果显示在约133 bp处出现条带,与预期目的片段大小相符(图1)。
单独用山羊无浆体引物(acmsp4f4/acmsp4r4)扩增阳性山羊无浆体阳性样品,琼脂糖凝胶电泳结果显示在约641 bp处出现条带,大小与预期目的片段大小相符(图2)。
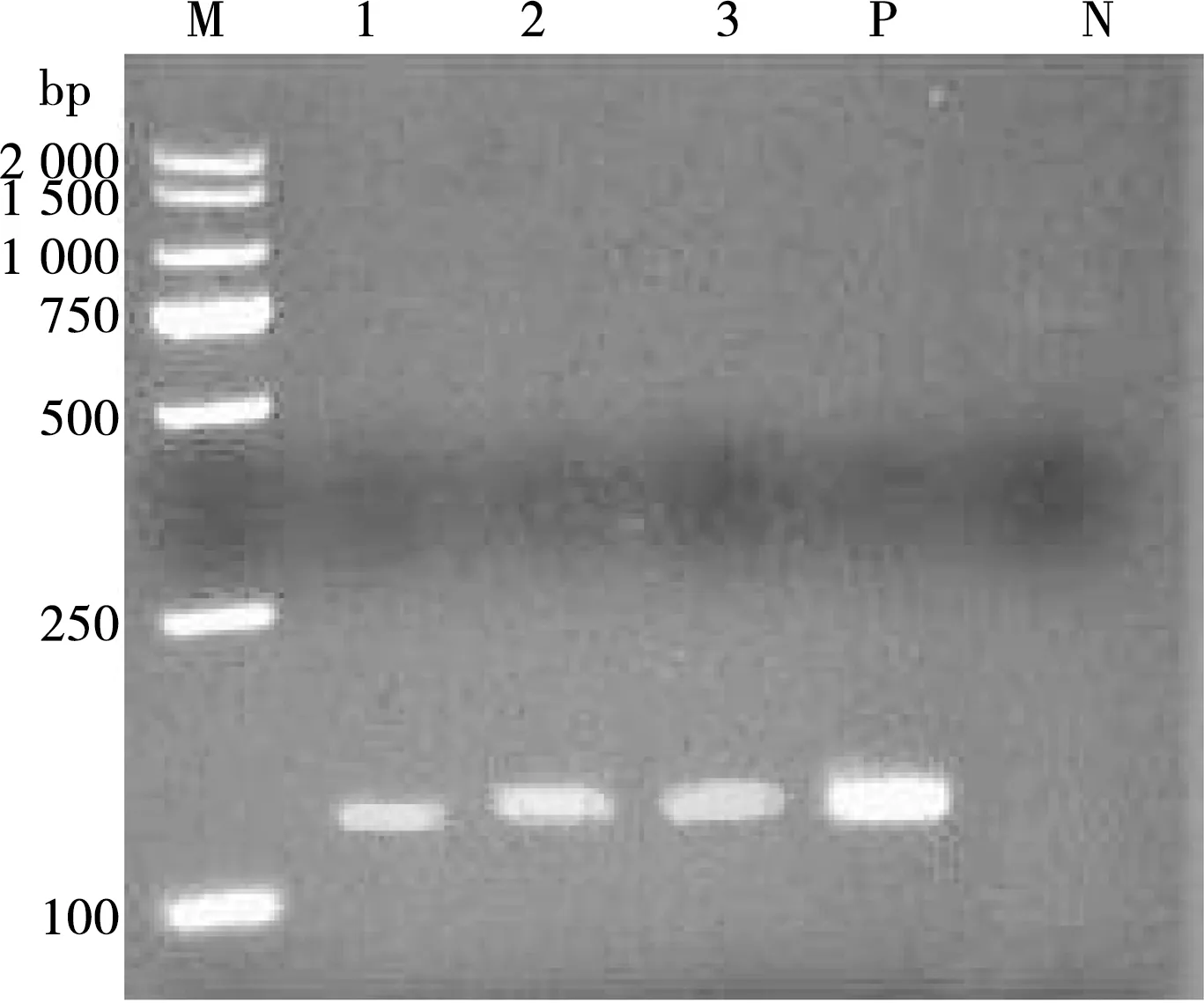
M. DL2000 DNA Marker;1~3. 样品编号;P. 阳性对照;N. 阴性对照
图1 PCR扩增结果
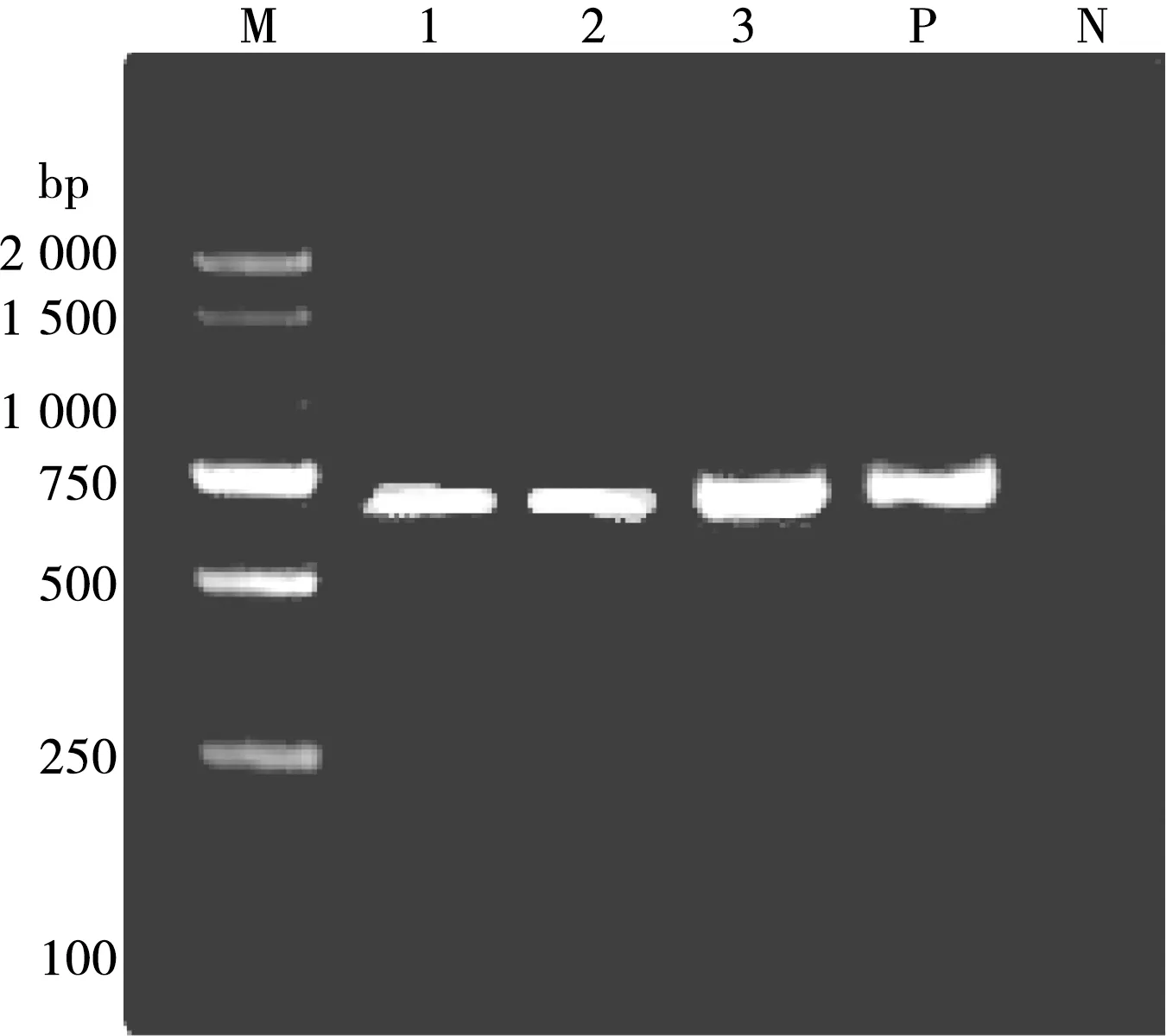
M. DL 2000 DNA Marker;1~3. 样品编号;P. 阳性对照;N. 阴性对照
图2 PCR扩增结果
同时采用牛无浆体引物abgltAf1/abgltAr1和山羊无浆体引物acmsp4f4/acmsp4r4两套引物进行PCR扩增,结果显示得到2条特异性条带,其中一条特异性条带约133 bp,另一条约641 bp,与预期目的片段大小相符(图3)。
2.2 双重PCR反应体系及反应条件的优化
2.2.1 最适退火温度的优化结果
退火温度在55~65 ℃区间内进行PCR扩增,结果显示当退火温度在61 ℃时条带最亮,故以61 ℃作为双重PCR的最适退火温度,见图4。
2.2.2 最适酶剂量的优化结果
通过使用不同剂量酶进行双重PCR反应,结果显示在当酶的剂量为0.3、0.35和0.4 μL时亮度变化不明显,故双重PCR体系酶的最适剂量为0.30 μL(见图5)。
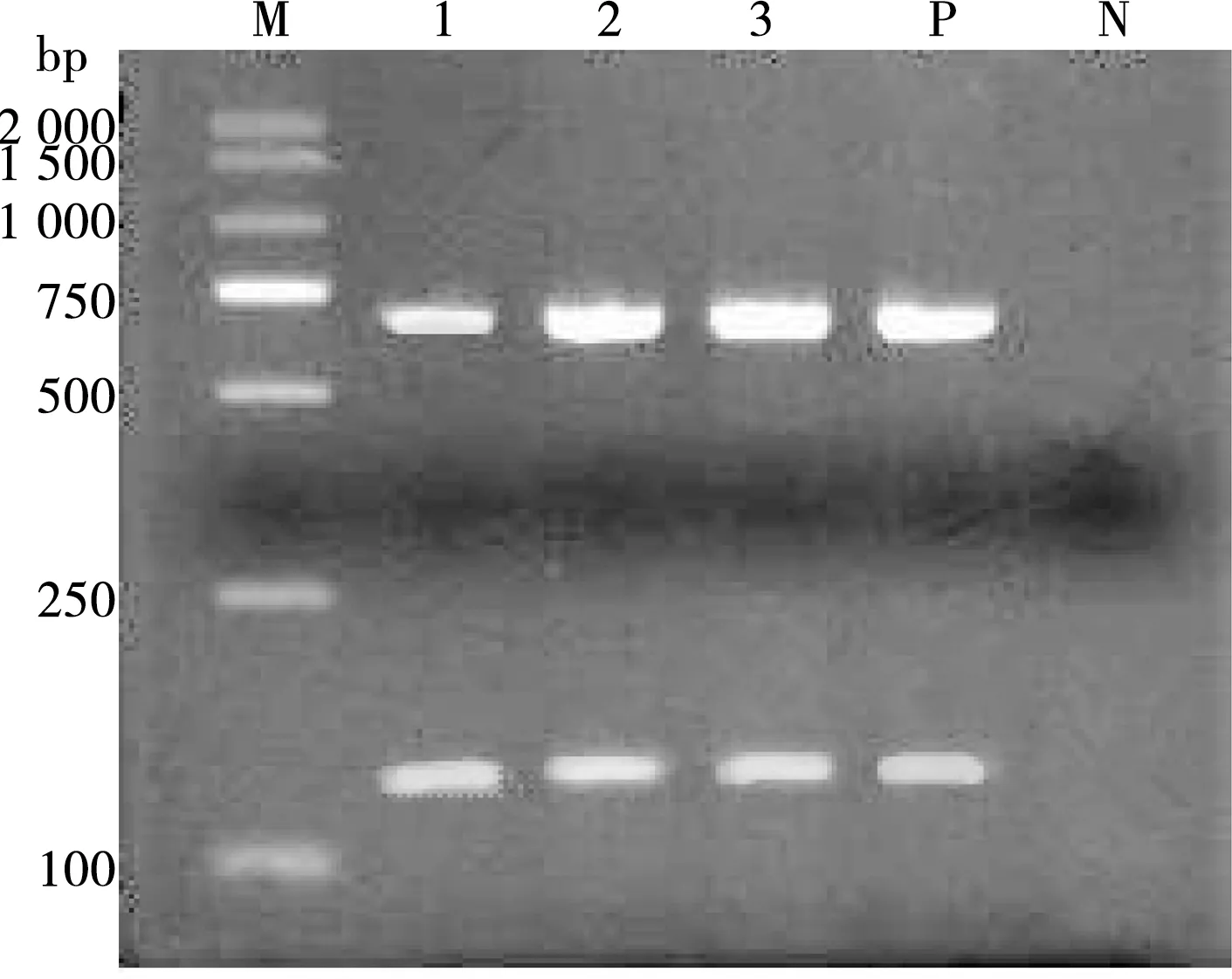
M. DL 2000 DNA Marker;1~3. 样品编号;P. 阳性对照;N. 阴性对照
图3 双引物的PCR扩增
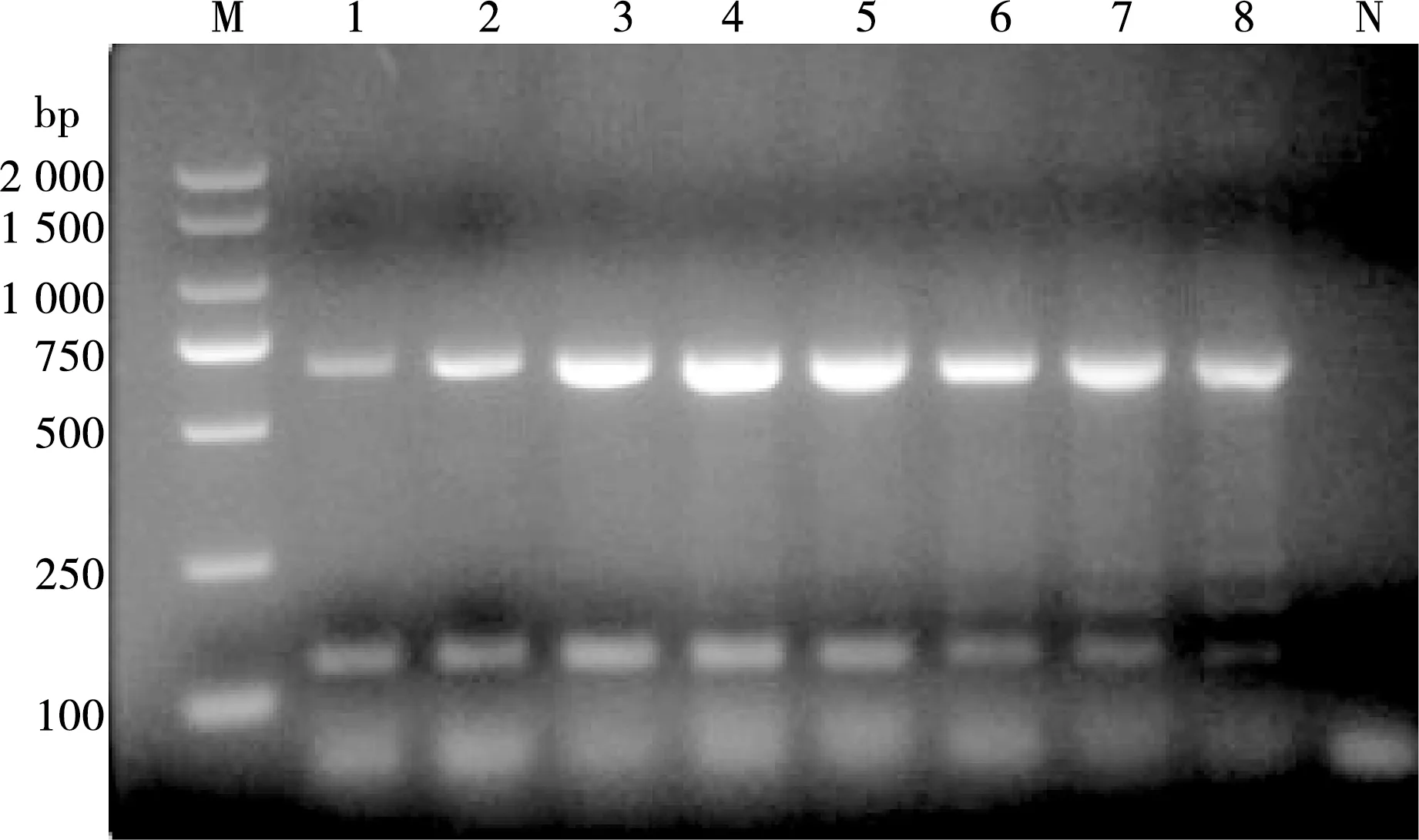
M. DL 2000 DNA Marker;1~8. 样品编号的温度分别是65 ℃、64 ℃、 63 ℃、 61 ℃、59 ℃、57 ℃、56 ℃、55 ℃;N. 阴性对照
图4 不同退火温度的PCR扩增
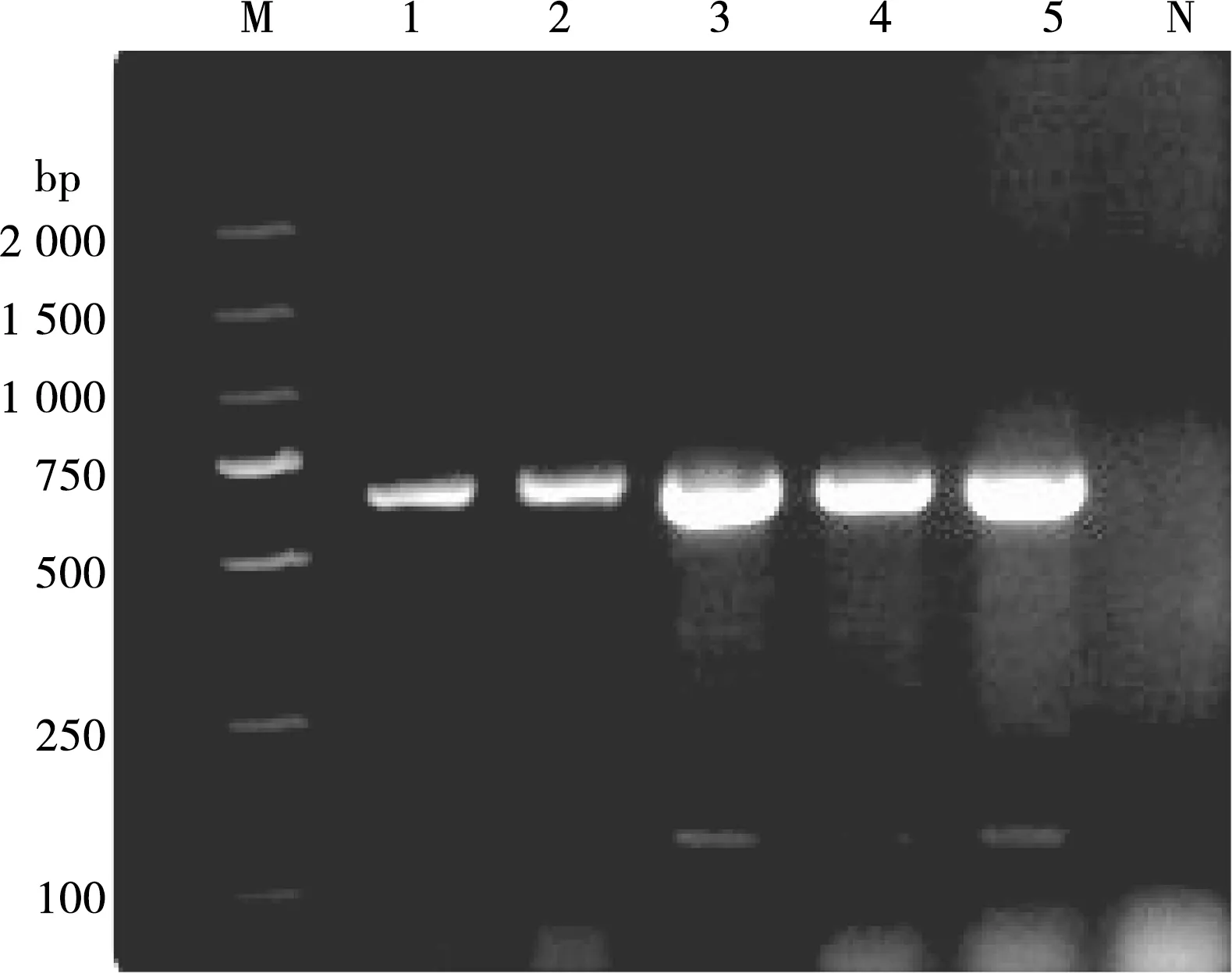
M. DL 2000 DNA Marker;1~5. 样品编号的酶剂量分别是:0.20、0.25、0.30、0.35和0.40 μL;N. 阴性对照
图5 不同酶剂量的PCR扩增
2.2.3 最适引物剂量的优化结果
通过采用不同的引物剂量进行双重PCR试验,结果显示当引物剂量为0.3、0.4、0.5和0.7 μL时133 bp目的条带亮度不及0.6 μL,故确定最佳引物浓度0.6 μL (图6)。
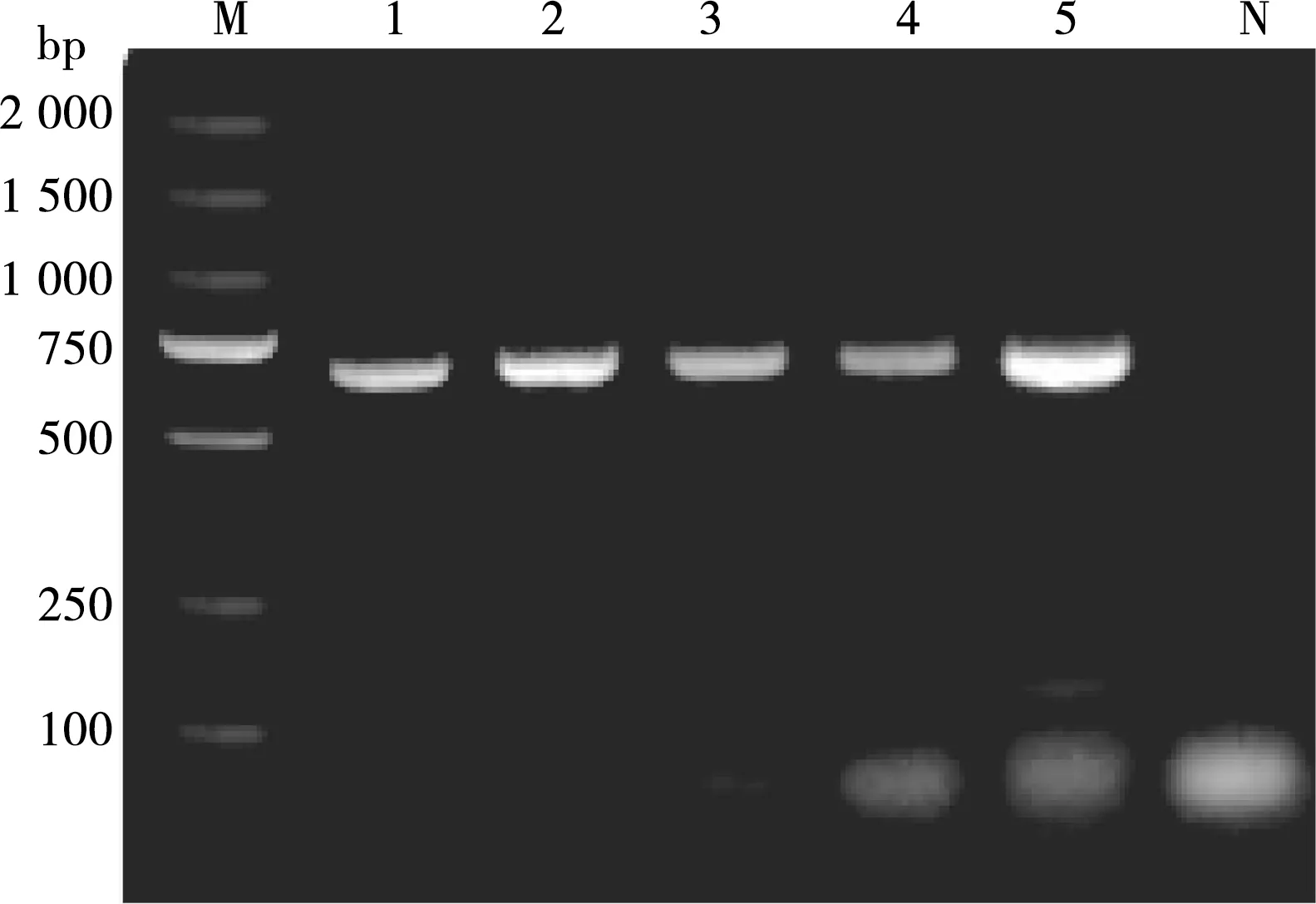
M. DL2000 DNA Marker;1~5. 样品编号的引物剂量分别是:0.3、0.4、0.5、0.6和0.7 μL;N. 阴性对照
图6 不同引物剂量的PCR扩增
2.2.4 最适循环次数的优化结果
根据不同循环次数观察出现条带的亮度,以确定最佳循环次数。通过调整发现,在循环次数为40的2条特异性条带比其他循环次数得到的条带要亮,所以本研究的最适循环次数为40(见图7)。
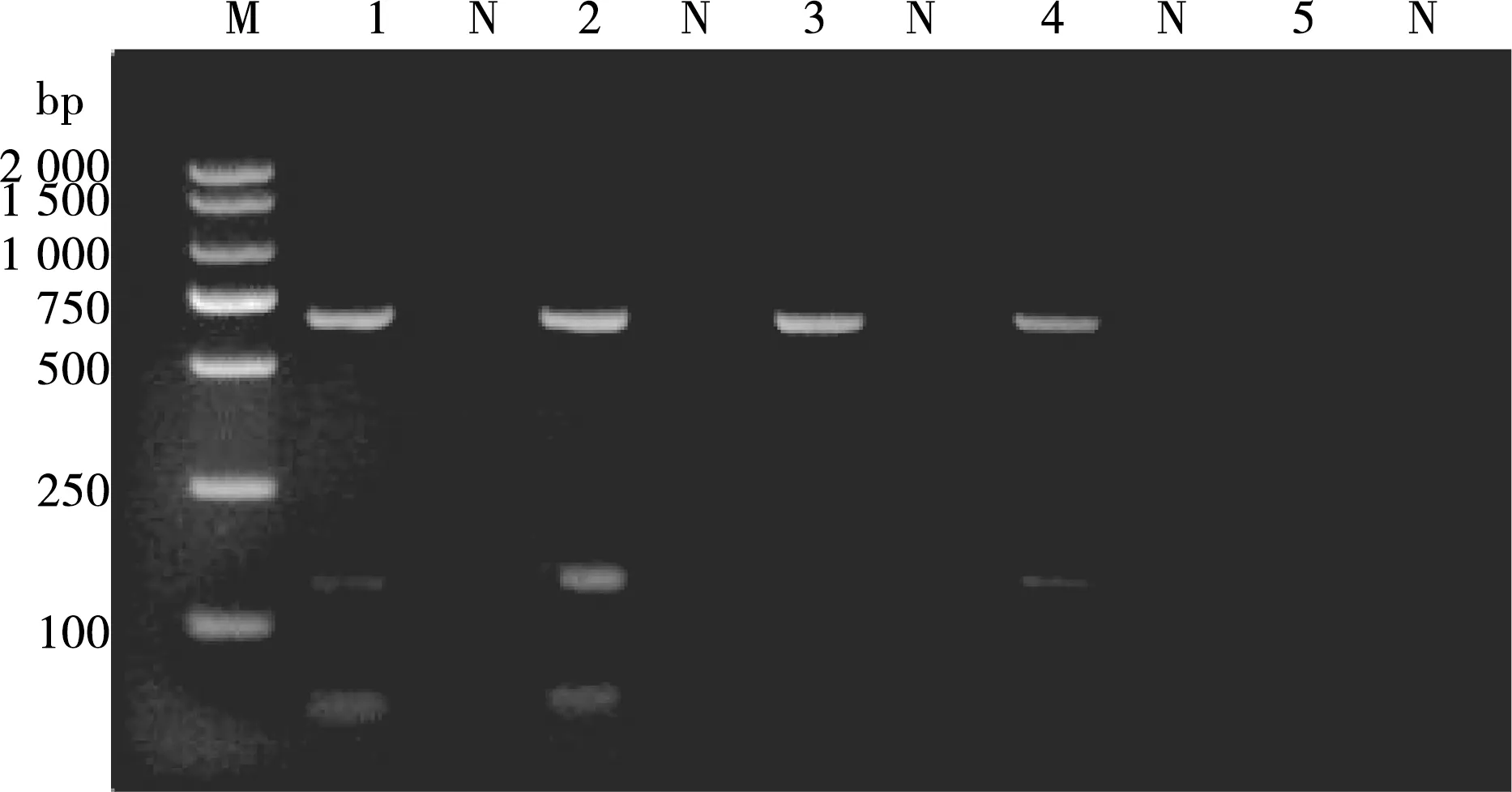
M. DL2000 DNA Marker;1~5. 样品编号的循环次数分别是:25、30、35、40、45;N. 阴性对照
图7 不同循环次数的PCR扩增
2.3 优化后的双重PCR反应体系及条件
通过对PCR反应体系中引物剂量、酶的剂量的优化及反应条件中退火温度、循环次数的优化后,确定的双重PCR的最适反应体系及条件分别见表6和表7。
2.4 序列分析
将测序结果利用NCBI(https://www.ncbi.nlm.nih.gov/)网站的BLAST比对功能进行分析,结果显示本研究所得到的牛无浆体和山羊无浆体序列分别与已报道的序列一致。
表6 PCR扩增体系

试剂体积/μL10×La Baffer2.5dNTP Mixture4abgltAf1/acmsp4f4各0.6abgltAr1/acmsp4r4各0.6La Taq酶0.3ddH2O15.2DNA2
表7 PCR扩增条件

预变性变性退火延伸循环次数再延伸保存温度94 ℃94 ℃61 ℃72 ℃时间5 min30 s30 s1 min40次72 ℃10 ℃10 min∞
2.5 特异性试验
采用本研究优化的双重PCR反应体系及条件,用引物acmsp4f4/acmsp4r4和引物abgltAf1/abgltAr1进行PCR扩增,发现混合阳性样品(牛无浆体、山羊无浆体)与分别感染牛无浆体、山羊无浆体的样品均出现相应条带,而绵羊无浆体、吕氏泰勒虫、牛巴贝斯虫、尤氏泰勒虫、绵羊泰勒虫、环形泰勒虫、双芽巴贝斯虫和刚地弓形虫血液样品则均未出现条带,表明本研究所建立的双重PCR特异性良好(见图8)。
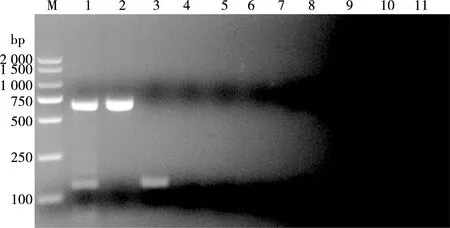
M. DL 2000 DNA Marker;1.牛无浆体+山羊无浆体;2.牛无浆体;3.山羊无浆体;4.绵羊无浆体;5.吕氏泰勒虫;6.牛巴贝斯虫;7.尤氏泰勒虫;8.绵羊泰勒虫;9.环形泰勒虫;10.双芽巴贝斯虫;11.刚地弓形虫
图8 PCR扩增特异性
2.6 重复性试验
用本研究的最佳PCR体系及条件,对3个批次的15份牛无浆体和山羊无浆体混合感染的阳性样品进行了3次重复试验,每次批间试验设置3个重复进行批内重复试验,发现重复性试验结果一致,kappa系数为1,表明本研究的双重PCR检测方法具有良好的重复性(见图9)。
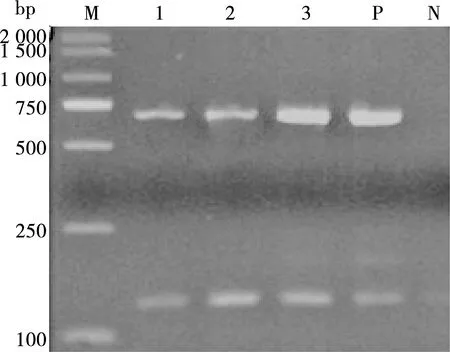
M. DL 2000 DNA Marker;1~3. 样品编号;P. 阳性对照;N. 阴性对照
图9 重复性PCR扩增结果
2.7 临床样本检测
分别用单重PCR法和本研究所建立的双重PCR法进行检测,结果显示双重PCR方法扩增牛无浆体的阳性率为60.0%(18/30),山羊无浆体的阳性率为66.7%(20/30),混合感染阳性率为66.7%(20/30)。单重PCR结果显示牛无浆体的阳性率为66.7%(20/30),山羊无浆体的阳性率为73.3%(22/30),牛无浆体和山羊无浆体混合感染率为73.3%(22/30),双重PCR与单重PCR检测阳性率差异不显著(见表8)。
表8 不同病原感染阳性率统计 %
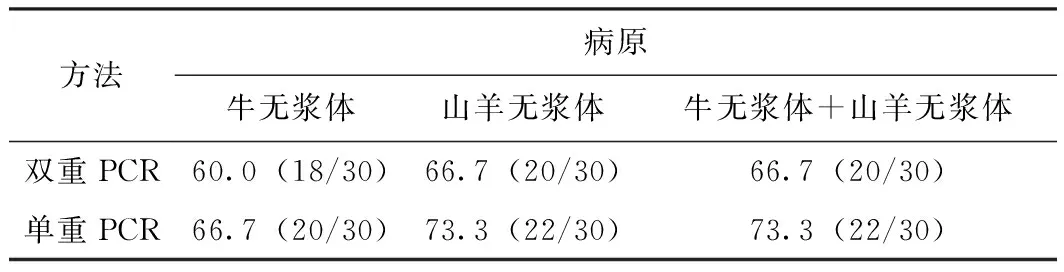
方法病原牛无浆体山羊无浆体牛无浆体+山羊无浆体双重PCR60.0(18/30)66.7(20/30)66.7(20/30)单重PCR66.7(20/30)73.3(22/30)73.3(22/30)
3 讨论
山羊无浆体和牛无浆体在小型反刍动物混合感染情况非常普遍,且感染率较高。YANG等[5]采用常规PCR技术对甘肃地区家养的小型反刍动物中无浆体的发生情况进行了研究,结果表明牛无浆体和山羊无浆体的平均感染率分别为24.4%和18.2%。SEO等[8]对1 219头牛进行多位点基因检测,分别检测到牛无浆体的16S rRNA基因和山羊无浆体的4个基因。PENG等[9]采用对我国山羊无浆体进行流行病学调查,结果表明山羊无浆体在我国分布广泛,尤其在河南、陕西等地区感染率较高。
已有研究者通过相关试验证明,msp4和gltA序列在无浆体属中高度保守,因此被广泛用于检测无浆体[10-11]。本研究通过对引物剂量增加和减少,分别产生“弱”和“强”的不同条带,结果表明在剂量为0.6 μL时为该研究的最佳引物剂量。所有引物的退火温度也需要进行优化,以获得特异性高的扩增产物,根据本研究结果发现,61 ℃为本研究的最适退火温度值。在优化反应体系和反应条件后,成功扩增出了预期大小的产物且2个引物组没有产生交叉双聚体,根据产物长度的差异可以识别该研究中的2种病原。与单重PCR相比,双重PCR对两种引物的特异性和重复性更好。本研究建立的双重PCR方法能够特异性检测出牛无浆体和山羊无浆体,扩增出133 bp和641 bp的目的条带,且不能检测出其他病原(绵羊无浆体、吕氏泰勒虫、牛巴贝斯虫、尤氏泰勒虫、绵羊泰勒虫、环形泰勒虫、双芽巴贝斯虫和刚地弓形虫),表现出良好的特异性;根据本研究的最佳反应体系和反应条件,对不同批次、批间的羊血液样品进行了3次重复试验,发现重复性试验结果一样,表明本研究的双重PCR检测方法具有良好的重复性。
目前用于检测无浆体的PCR方法有常规PCR、套式PCR、荧光定量PCR等,检测准确、特异性好,但每次PCR反应只能检测1种病原,而多重PCR技术能够同时检测2种或2种以上的不同病原,检测效率明显提高,因此建立一种双重PCR技术将为基层兽医工作人员和科研工作者提供一种非常有效的工具,将大大提高无浆体的检测效率。据报道,有研究者采用多重PCR技术进行检测边缘无浆体和中央无浆体[12];也有可同时检测泰勒虫属和无浆体属的二重PCR技术的相关报道[13],但能够能时检测山羊无浆体和牛无浆体的PCR技术除本研究外尚无相关报道。
综上,本研究建立了一种可同时检测山羊无浆体和牛无浆体的双重PCR方法,特异性、重复性良好,操作简便,省时省力,可用于两种无浆体感染的快速鉴别诊断和流行病学监测。
