G蛋白偶联雌激素受体在猪不同大小卵泡的分布与表达
2020-07-13苗懋东倪珺石凤垚李文慧蔡云栋芮荣
苗懋东,倪珺,石凤垚,李文慧,蔡云栋,芮荣
(南京农业大学动物医学院,江苏 南京 210095)
在雌性动物发情周期,卵母细胞随卵泡发育产生相应变化,只有卵泡内激素和其他细胞因子达到合适水平,卵母细胞才能重新获得成熟分裂的能力进而发育成熟,其中雌激素的调节至关重要。G蛋白偶联雌激素受体(GPER)是一种通过磷脂酰肌醇激酶(PI3K)作用的细胞内跨膜雌激素结合受体[1]。已有GPER在小鼠发情周期的卵巢分布和表达的相关报道,证实其分布和表达量变化与卵泡发育过程及发情周期中雌激素的变化规律基本一致[2]。在山羊卵巢的研究中,GPER广泛分布于发情周期中奶山羊各级卵泡,并不同程度地参与了卵泡成熟[3]。此外,也有研究表明GPER在小鼠下丘脑和猪垂体等部位均有表达,提示其可能参与了动物发情周期和腺垂体内分泌的调节[4-5];但迄今未见GPER在猪卵泡中表达与作用的报道。本试验旨在研究GPER在猪不同大小卵泡卵母细胞的分布与表达,以期为后续试验和相关研究提供参考。
1 材料与方法
1.1 猪不同大小卵泡COC与卵泡壁的采集
从南京元润食品有限公司下属屠宰场采集猪卵巢,置于37 ℃含1 000 U/mL青、链霉素无菌生理盐水中,2 h内送达实验室。将卵巢放入玻璃表面皿中,实体显微镜下分别剥离直径小于3 mm、3~5 mm及大于5 mm健康完整有腔卵泡,用无菌眼科剪与眼科镊撕开卵泡壁释放卵泡液及COC,轻刮卵泡内壁确保COC从卵泡壁分离。将各组卵泡壁保存于液氮中用于GPER蛋白表达分析;各组卵泡COC于无血清TCM 199培养液(GIBCO)洗2次后用作免疫荧光染色;另取部分母猪卵巢组织浸入4%多聚甲醛溶液中进行固定,以备免疫组织化学检测。
1.2 免疫组织化学检测
卵巢组织经过4%多聚甲醛固定后,按照表面卵泡直径小于3 mm、3~5 mm及大于5 mm的标准进行修块处理,取1 cm3大小组织块重新固定12 h后制作蜡块备用;常规组织切片,卵巢组织切为4 μm厚的连续切片,将切片脱蜡处理、水化、PBS洗涤、灭活,用0.01 mol/L柠檬酸盐抗原修复液对切片进行抗原热修复;接下来封闭、孵育一抗及二抗、DAB显色1 min,蒸馏水终止反应;切片置于苏木素染色缸中复染后脱色,然后梯度脱水,最后滴加中性树胶封片。封好的切片置于显微镜下,选取含不同大小卵泡的视野进行观察、拍照并进行图像分析。
1.3 蛋白免疫印迹
把收集到的卵泡壁分别剪碎,按照每20 μg组织添加200 μL裂解液的比例加入含1 μmol/L PMSF的RIPA裂解液,用超声破碎仪匀浆直至充分裂解后12 000 r/min离心10 min取上清;按照BCA蛋白定量试剂盒(康为世纪)说明书依次进行蛋白定量;在保证上样蛋白含量一致的前提下分别加入不同体积的5×loading buffer,吹打混匀后放在100 ℃沸水中煮10 min使蛋白变性。采用十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离样品总蛋白;经电转至聚偏二氟乙烯(PVDF)膜上后封闭。孵育抗体目的蛋白为兔源GPER多克隆抗体(Novus)、内参蛋白为兔α-tubulin多克隆抗体(Abcam),二抗为山羊抗兔IgG(H+L)-HRP(康为世纪)。将孵育二抗后的PVDF膜洗净置于TBST液中等待曝光显影。按照ECL化学发光底物(Biosharp)说明书1∶1配置工作液,使PVDF膜与其充分反应30 s,置于凝胶成像系统(Fujifilm LAS-4000)中曝光显色并拍照[6]。
1.4 间接免疫荧光染色与激光共聚焦显微镜观察
各组卵泡COC分别用4%多聚甲醛室温固定1 h后移入1% TritonX-100置于37 ℃湿盒中通透8~12 h,再用1%牛血清白蛋白(BSA)于37 ℃湿盒封闭1 h,之后取COC置于兔GPER多克隆抗体(1∶200)中在4 ℃湿盒避光孵育12 h,后用Alexa Fluor 488标记驴抗兔IgG(1∶1 000)室温避光孵育1 h;最后用0.01 g/L Hoechst 33342避光染核,于37 ℃湿盒孵育10 min后洗净封片。用激光共聚焦显微镜(Zeiss LSM700 META, Oberkochen, Germany)观察封片后的细胞并拍照保存,分析GPER在猪不同大小卵泡COC的分布与表达。
1.5 数据统计分析
每组试验至少设置3次重复。利用Image-Pro Plus 6.0软件进行免疫组化染色强度的平均光密度分析,Western blot结果通过Image J软件分析目的蛋白与内参蛋白表达强度的比率来统计猪不同大小卵泡中GPER蛋白表达水平。数据采用SPSS 18.0统计软件One-Way ANOVA LSD,以平均数±标准差(X±SE)表示,采用Duncan’s检验法检测不同组之间的差异显著性,P<0.05判为差异显著。
2 结果与分析
2.1 不同大小猪卵泡GPER的分布
GPER是一种膜受体,GPER阳性细胞呈现细胞核不着色的空泡状,细胞质着色较浅而胞膜着色较深。GPER免疫反应阳性产物呈黄棕色分布于猪不同发育阶段的卵泡中,不同大小卵泡的卵泡壁层颗粒细胞,卵泡膜细胞均有分布(图1A、B、C)。其中以大于5 mm卵泡的颗粒细胞分布最多、着色最深,其阳性物质着色于细胞的胞膜和胞质,胞核不着色;卵泡膜细胞呈现扁平的卵圆形,较颗粒细胞着色稍浅;卵巢间质中有极弱的GPER表达(图1C)。
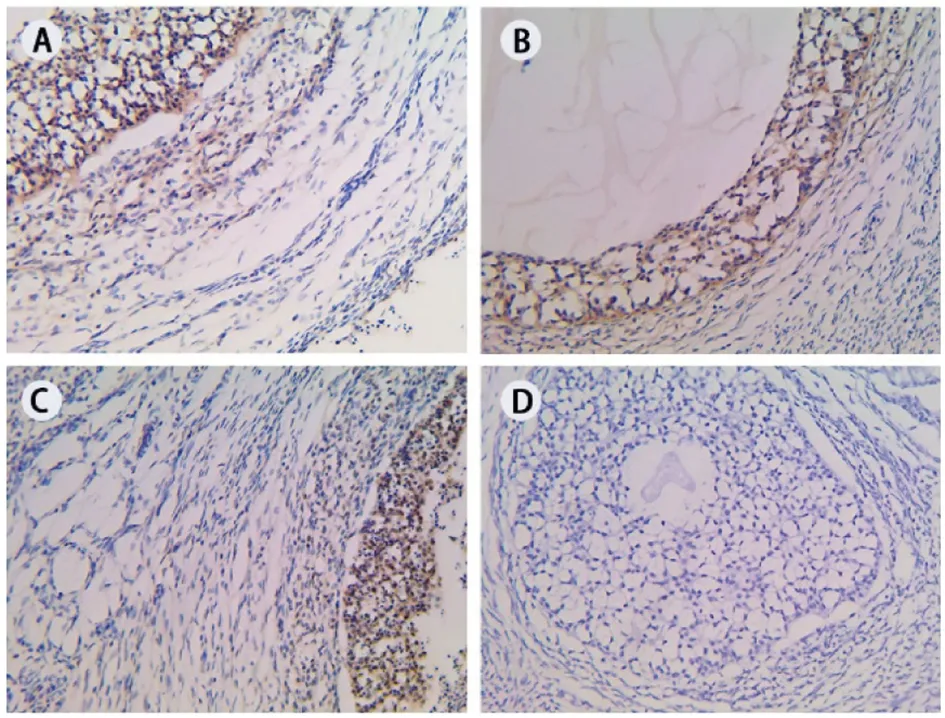
A. 直径小于3 mm卵泡;B. 直径3~5 mm卵泡;C. 直径大于5 mm卵泡;D. 阴性对照
图1 猪不同大小卵泡中GPER的分布(200×)
2.2 不同大小猪卵泡免疫组化染色的平均光密度变化
猪不同大小卵泡免疫组化染色的平均光密度变化如图2所示。从图中可以看出,GPER平均光密度值与卵泡直径呈正相关,直径3~5 mm卵泡GPER平均光密度值显著高于直径小于3 mm卵泡(P<0.05);直径大于5 mm卵泡GPER平均光密度值极显高于直径小于3 mm卵泡(P<0.01)。说明GPER的表达量随着卵泡发育呈现逐渐上升的趋势,卵泡直径越大,GPER表达量越高。
2.3 不同大小猪卵泡GPER蛋白的表达
从图3可以看出,与直径小于3 mm卵泡相比,直径3~5 mm卵泡和大于5 mm卵泡GPER蛋白相对表达量显著升高(P<0.05);猪卵泡直径越大,对应的GPER蛋白相对表达量越高。大于5 mm猪卵泡中GPER蛋白表达量最高,极显著高于小于3 mm卵泡和3~5 mm卵泡(P<0.01)。
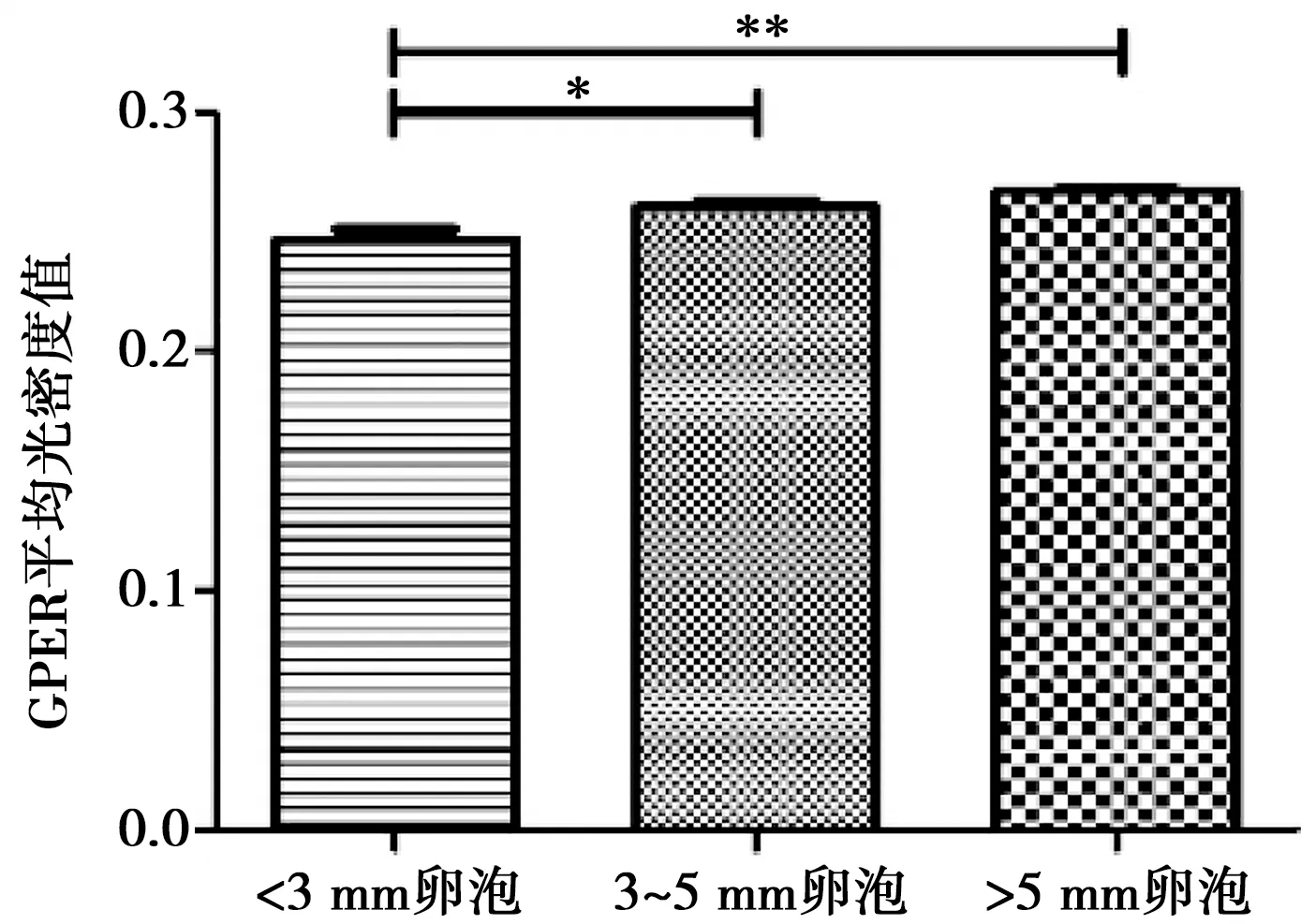
* P<0.05,** P<0.01。下同
图2 猪不同大小卵泡免疫组化染色的平均光密度变化
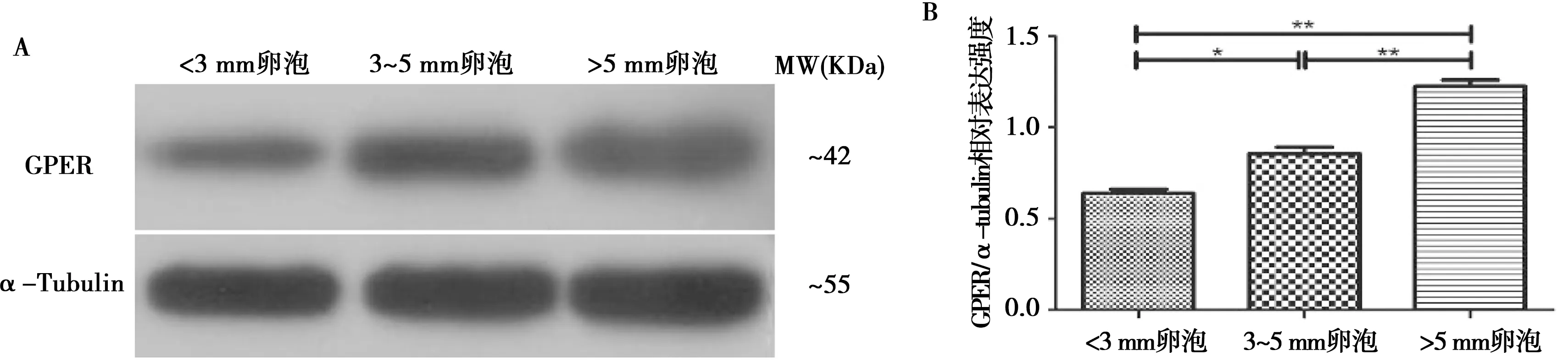
图3 猪不同大小卵泡中GPER蛋白的表达
2.4 猪卵泡COC的眼观形态特征
分别从直径小于3 mm、3~5 mm及大于5 mm卵泡液中采集COC。实体显微镜下可见卵母细胞均为圆形,周围有带状物,透明带外层包裹数层卵丘细胞。小于3 mm卵泡COC卵母细胞包被1-2层卵丘细胞(图4A、4a);3~5 mm卵泡COC卵母细胞包被3-4层卵丘细胞(图4B、4b);大于5 mm卵泡COC具有完整的卵丘结构(图4C、4c)。
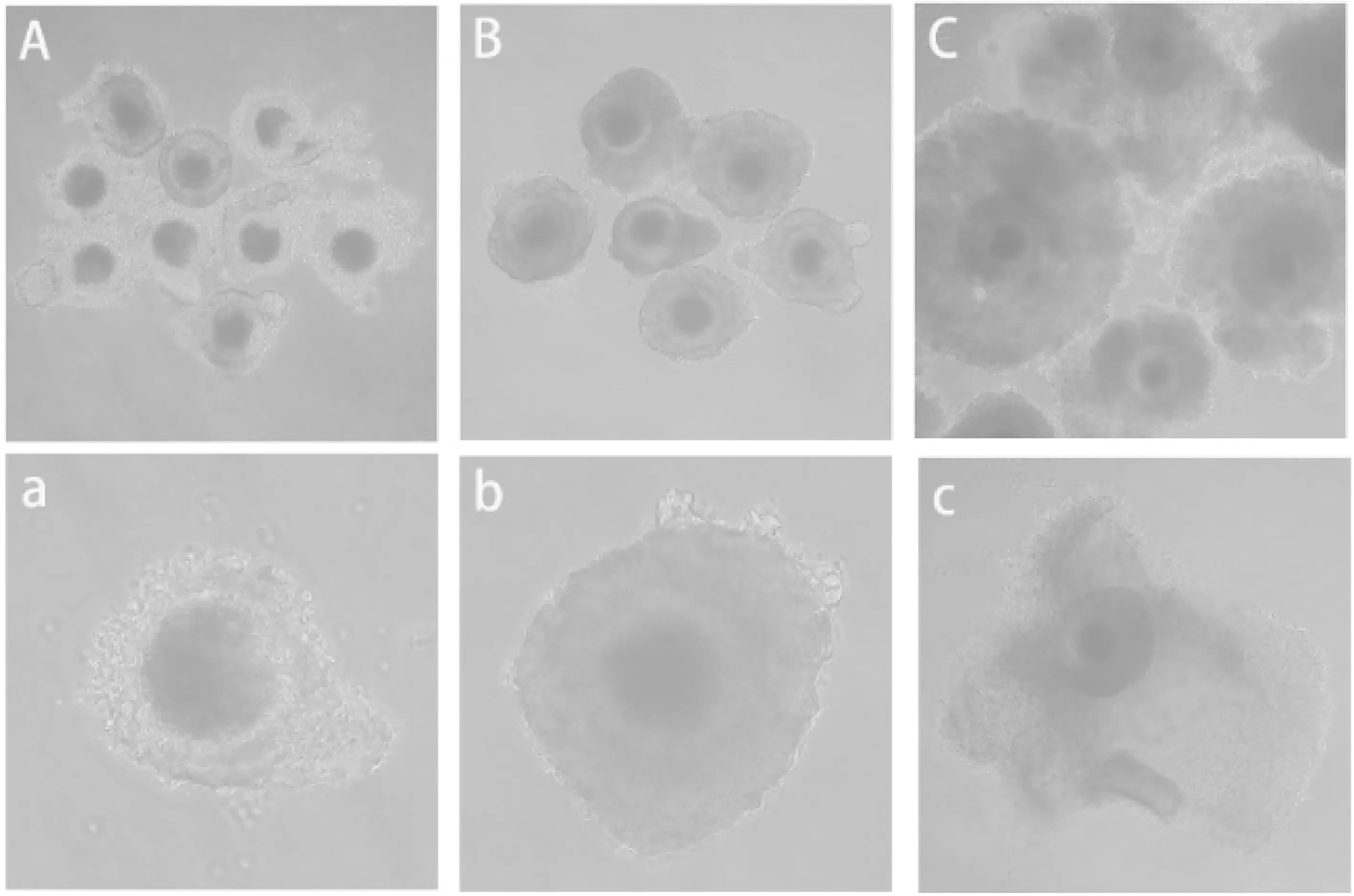
A和a. 直径小于3 mm卵泡COC;B和b. 直径3~5 mm卵泡COC;C和c. 直径大于5 mm卵泡COC;A、B、C(100×);a、b、c(400×)
图4 猪不同大小卵泡COC眼观形态特征
2.5 猪卵泡中GPER的定位
各组卵泡COC GPER的定位与表达如图5A所示,不同大小卵泡COC其卵丘细胞和卵母细胞都有GPER表达,GPER主要分布在卵丘细胞膜上,在卵母细胞中呈现全细胞着色但着色较浅。应用ImageJ对GPER荧光图片进行半定量分析发现,GPER在直径3~5 mm卵泡COC表达量最高,显著高于直径大于5 mm卵泡COC(P<0.05)(图5B)。
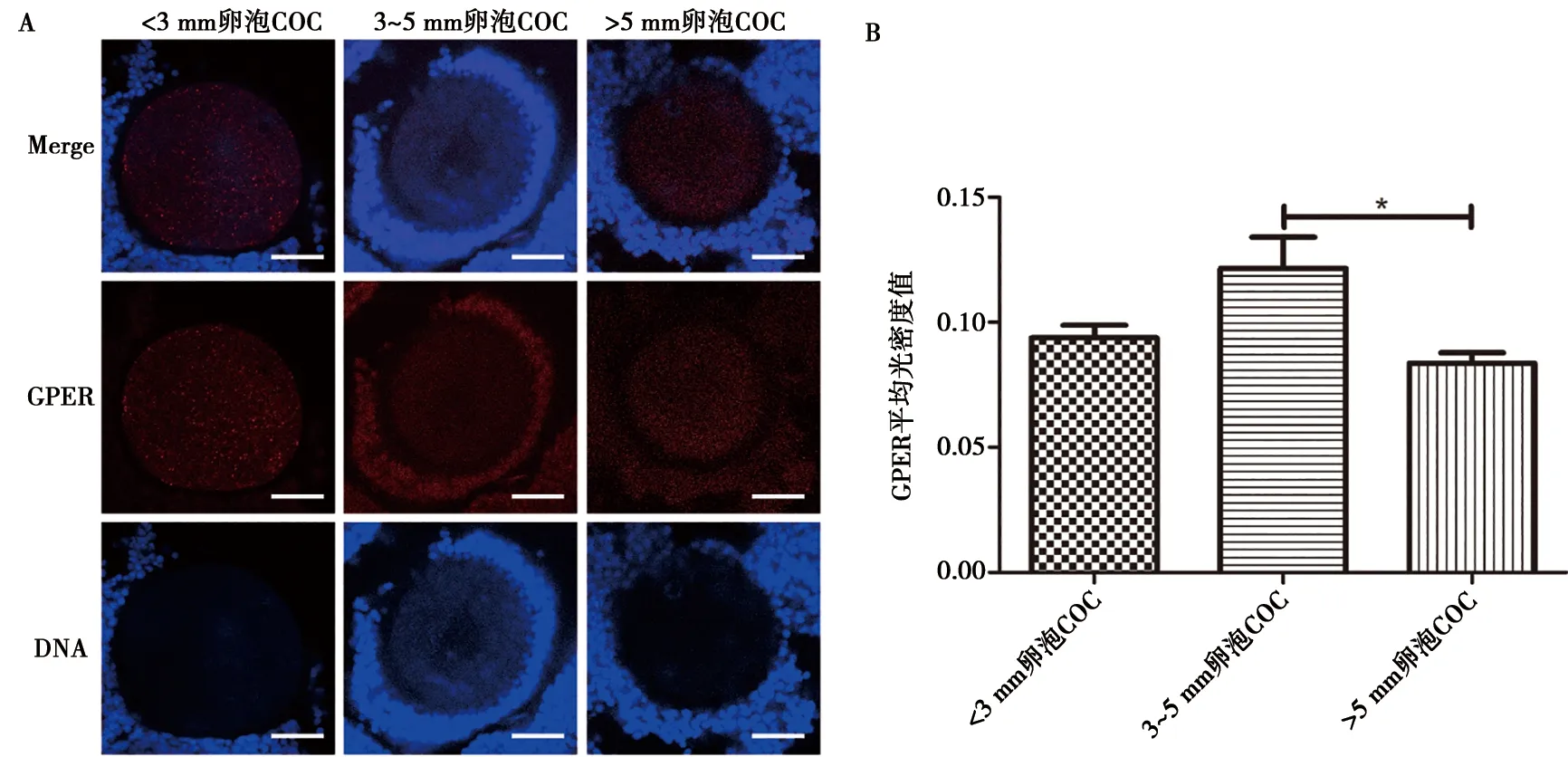
A. GPER和DNA在猪卵泡COC的定位,标尺为50 μm;B. 半定量分析GPER表达
图5 GPER在猪不同大小卵泡COC的定位
3 讨论
在雌性动物生殖周期中,随着卵泡发育、成熟,雌激素分泌增加。合成的雌激素不仅参与调控动物的发情与排卵,也参与调控卵母细胞成熟和卵丘细胞扩散。雌激素通过其核受体ERα和ERβ参与和调节哺乳动物卵巢的生理功能已被广泛证实,近年研究表明雌激素还可以通过GPER快速介导的非基因组途径影响生殖系统的功能[1]。
WANG等[7]通过免疫荧光对仓鼠卵巢进行研究发现GPER分布于卵泡颗粒细胞、膜细胞、黄体细胞和间质细胞、卵母细胞等处。耿阳雪等[2]和王文丽等[3]应用免疫组化分别在小鼠和山羊上也取得了类似的研究结果。本试验通过免疫组化和免疫荧光染色对猪不同大小卵泡卵母细胞上GPER的分布进行探究,结果表明猪不同大小卵泡的卵泡壁层颗粒细胞,卵泡膜细胞、卵丘细胞和卵母细胞均有GPER分布,其中以>5 mm卵泡的颗粒细胞分布最多、着色最深。卵巢间质中有极弱的GPER表达。GPER在体细胞和肿瘤细胞主要定位在质膜、内质网和高尔基体上[8-10]。本试验中,GPER阳性细胞呈现细胞核不着色的空泡状,细胞质着色较浅而胞膜着色较深,广泛存在于猪不同大小卵泡颗粒细胞、膜细胞和COC上。惠琦辉[11]在山羊卵巢研究中也得到类似的结果。另有研究发现,GPER在小鼠卵母细胞成熟分裂各时期,细胞膜表面的荧光信号明显[12],针对斑马鱼、美国石首鱼和金鱼的研究结果也验证了这一现象[13-14],不同的是,美国石首鱼和斑马鱼的卵泡细胞中不存在GPER的表达。这些研究结果表明GPER在哺乳动物卵泡的分布与表达具有一定的保守性。
进一步研究猪不同大小卵泡中GPER的表达变化发现,其表达量随卵泡发育呈现逐渐上升的趋势,卵泡直径越大,GPER表达量越高。这与惠琦辉[11]在山羊不同发育阶段卵泡中GPER相对表达量的研究结果相似。GPER这一具有发育阶段依赖性的表达特点提示其可能与卵泡发育和卵母细胞成熟作用有关,但仍需今后试验中进一步研究。
本研究结果表明,GPER在猪卵泡中的分布与表达和卵泡发育有密切关系,不同大小猪卵泡的颗粒细胞、膜细胞、卵丘细胞和卵母细胞均有GPER表达,其表达量随卵泡发育逐渐上升,这可能与GPER参与调节了猪卵泡发育和卵母细胞成熟有关。
