凤丹牡丹二氢黄酮醇-4-还原酶基因克隆及表达特性分析
2020-07-06甘林鑫李厚华李果刘鹏远韩美玲
甘林鑫 李厚华 李果 刘鹏远 韩美玲

摘要:以凤丹种皮为材料,克隆花青素生物合成中的关键基因DFR,并进行功能验证。结果表明,凤丹DFR基因含有长度为1 092 bp的开放阅读框(ORF),共编码364个氨基酸。其中,凤丹DFR蛋白的相对分子量为 40 796.17 u,理论等电点(PI)为5.76。实时荧光定量分析凤丹牡丹种子4个发育阶段的PoDFR基因表达水平,结果表明,在凤丹种子发育过程中,PoDFR基因的表达水平先增加后减少,在S2时期达到最高。构建PoDFR基因的原核表达载体并在大肠杆菌中表达以获得PoDFR的原核表达蛋白。体外酶促反应和高效液相色谱法表明,PoDFR蛋白可以催化二氢槲皮素合成无色花青素,通过与PoANS蛋白结合合成花青素,证明PoDFR基因具有相应的功能活性。
关键词:凤丹牡丹;DFR基因;二氢槲皮素;花青素;表达特性;功能
中图分类号: S685.110.1 文献标志码: A 文章编号:1002-1302(2020)10-0073-07
收稿日期:2019-05-06
基金项目:公益性行业(林业)科研重大专项(编号:201404701);国家自然科学基金(编号:31570697)。
作者简介:甘林鑫(1994—),女,云南昆明人,硕士,主要从事园林植物分子生物学研究。E-mail:597807188@qq.com。
通信作者:李厚華,博士,教授,主要从事园林植物研究。E-mail:lihouhua73@163.com。
凤丹牡丹,别称铜陵牡丹,栽培历史悠久,因其结实量大,栽培管理方便,已成为油用牡丹的主要品种[1]。然而,在实际生产榨油和使用过程中,由于成熟的牡丹种子外壳呈现黑色(图1),压榨后的原油会出现有异味的黑色物质,降低了牡丹原油的品质,而脱壳又会降低出油量。因此,研究黑色物质合成的相关基因,可以为下一步在基因工程层面上改善凤丹牡丹的种壳特性提供理论依据[2]。研究发现,类黄酮物质是牡丹种壳中的主要色素成分,包含花青素类、黄酮类和原花青素类[3],DFR基因作为类黄酮合成途径中的关键基因,还未在凤丹牡丹中被克隆。DFR(dihydroflavonol 4-reductase,二氢黄酮醇-4-还原酶)可以催化二氢黄酮醇合成无色的天竺葵素、飞燕草素或矢车菊素,再结合ANS(anthocyanidin synthase)催化合成有色花青素[4-6]。
为了解凤丹牡丹种皮中DFR基因的表达和调控,通过RT-PCR从凤丹牡丹种壳中克隆了类黄酮合成途径的重要基因DFR,并分析该基因的生物学信息。通过原核表达的方法获得该基因翻译的相应蛋白,再进行酶促反应,利用高效液相色谱法验证该基因的功能,分析了凤丹牡丹中类黄酮化合物代谢的分子机制。
1 试验材料与方法
1.1 植物材料与菌株
本试验以凤丹牡丹种子为材料,于西北农林科技大学牡丹种质资源圃中分别采集白色期、变色期、褐色期、黑色期的凤丹种子(图2),在液氮中快速冷冻后,将其储存在-80 ℃冰箱中用于基因克隆及表达分析。
1.2 凤丹总RNA提取与cDNA合成
使用OMEGA Plant Total RNA提取盒进行RNA提取,根据说明书操作。通过1%琼脂糖凝胶电泳检测,使用外分光光度计检测浓度。以每个时期总RNA为模板,使用PrimeScriptTM RT reagent Kit with gDNA Eraser,先消除基因组DNA后,反转录合成cDNA第一链,置于-80 ℃备用[7-8]。
1.3 基因克隆
基于NCBI上其他植物的DFR基因序列,使用软件Primer 5.0设计引物(表1)。以逆转录获得的cDNA为模板,用PrimeSTAR HS DNA聚合酶高保真酶扩增靶基因全长,琼脂糖凝胶电泳检测反应结果。
扩增条件为98 ℃预变性1 min;98 ℃变性10 s,58 ℃ 退火5 s,72 ℃延伸1 min(35个循环);将反应在 72 ℃ 延伸5 min,在4 ℃下储存。在1%琼脂糖凝胶上检测扩增产物,纯化并回收目标条带,把回收产物连接到pGEM-T载体上,通过热击法转化大肠杆菌E.coli DH5α感受态细胞,经蓝白斑筛选和菌落PCR验证后,将阳性菌液培养过夜,送至公司进行测序[9-11]。
1.4 生物信息学分析
使用NCBI BLAST进行氨基酸序列的同源分析,利用ExPASyProtParam Tool(http://web.expasy.org/protparam/),HNN SECONDARY STRUCTURE PREDICTION METHOD,Swiss-Model Workplace(http://swissmodel.expasy.org/)和TMGMM 2.0等软件进行蛋白质各级结构预测。编码蛋白的修饰位点检测在KinasePhos(http://kinasephos. mbc.nctu.edu.tw/)中完成[12-15]。
1.5 PoDFR基因的表达分析
用不同时期的种皮cDNA为模板,选用牡丹 β- 微管蛋白基因beta-Tubulin(登录号:EF608942)为实时定量反应的参考基因[2]。采用SYBR Green法在Applied Biosystems StepOne Plus实时定量PCR仪上按照仪器说明进行试验。每个样品重复3次,并使用2-ΔΔCT方法进行数据分析[16]。
1.6 PoDFR基因的原核表达分析
首先用EcoRI、HindⅢ双酶切线性化处理原核表达载体pET-28a[17]。基于载体切口两端的 15 bp 同源序列设计特异性引物nrDFRf和nrDFRr(表1)。使用cDNA作为模板,高保真酶扩增靶基因,并通过凝胶电泳检测回收产物和线性化载体,在重组酶的作用下进行连接。根据热激法连接产物转移至DH5α感受态细胞,并在过夜培养后挑斑用于PCR验证。将验证后的阳性细菌溶液送去测序以确保没有位点突变。在37 ℃下培养合格的阳性细菌溶液过夜后,提取质粒并转移到大肠杆菌BL21(DE3)感受态细胞中。在证实为正确且没有位点突变的重组载体菌液过夜培养后,将LB液体培养基稀释50倍并继续培养直至D600 nm约为0.6。通过加入终浓度为1.0 mmol/L的IPTG诱导外源基因的表达,并分别在0、2、4、6、8 h后收集细菌溶液,同时用PET-28a载体作为对照。确定了最佳诱导时间后,IPTG的终浓度分别设定为0、0.2、0.4、0.6、0.8、1.0 mmol/L,以确定最佳诱导浓度并收集诱导菌液。吸取上清液进行SDS-PAGE电泳。考马斯亮蓝染色后,再脱色并拍照保存[18-19]。
1.7 原核表达蛋白酶促反应
通过获得的最佳诱导方法诱导重组蛋白,并使用溶菌酶法提取蛋白质。诱导后,4 ℃收集菌液,4 000 r/min 离心5 min,去除上清液,用Buffer(100 mmol/L Tris-HCl,1 mmol/L EDTA,100 μg/mL 的溶菌酶,pH值8.0)重悬,室温条件下孵育15 min,超声15~20 s,12 000 r/min离心 15 min,取上清液[20]。根据DFR蛋白的特性,使用二氢槲皮素作为反应的底物,选择粗提蛋白作为催化剂进行酶促反应,并设定对照组PET-28a诱导提取蛋白。将单独DFR原核表达蛋白催化、DFR和ANS原核表达蛋白联合催化设置为2个试验组。反应条件为30 ℃、30 min,结束后保存于4 ℃。
1.8 高效液相色谱法检测
通过日立L-2000高效液相色谱仪检测酶促反应物,检测器为L-2455型二极管阵列检测器,检测波长为200~700 nm,C18柱(Hitachi,Japan,250 nm×4.6 mm,5 μm),柱温40 ℃,进样量为 10 μL,流速为0.5 mL/min。流动相参数A:0.04%甲酸水溶液,B:乙腈(色譜级)。采用梯度洗脱,洗脱程序为0~40 min,A为0~95%,B为5%~100%;40~60 min,A为0,B为100%。
2 结果与分析
2.1 PoDFR基因的序列与分析
以凤丹牡丹的cDNA为模板,通过RT-PCR扩增PoDFR基因全长,获得1 000 bp的基因序列(图3)。它包含1个完整的开放阅读框(open reading frame,ORF),共有1 095个碱基编码364个氨基酸残基(图4)。
2.2 PoDFR基因的生物信息学分析
用Blast比较凤丹牡丹的DFR基因序列与NCBI中其他植物的DFR基因序列,结果表明,凤丹牡丹DFR基因与芍药DFR基因(GenBank登录号:JQ070804.1)、枫香DFR基因(GenBank登录号:JX944785.1)、圆叶葡萄DFR基因(GenBank登录号:KC460268.1)的同源性分别为97%、83%、80%,与胡杨DFR基因(GenBank登录号:XM011009150.1)、欧洲草莓DFR基因(GenBank登录号:KC894052.1)、杂交月季DFR基因(GenBank登录号:AY780885.1)等的同源性也在70%以上。凤丹PoDFR蛋白相对分子质量为40 796.17 u,通过Expasy Protparam在线预测PoDFR蛋白氨基酸成分及比例如表2所示。
利用CELLO v.2.5在线软件预测PoDFR蛋白在真核生物中的亚细胞定位,发现它在细胞质中具有最高的定位概率,可靠性为4.063。其理化性质详见表3。
HNN用于预测凤丹PoDFR的二级结构。结果表明,PoDFR由35.44%的α-螺旋(α-helices),17.86%的延伸链(extended strands)和 46.79%的无规则卷曲(random coils)组成。PoDFR蛋白的三级结构预测如图5所示。分析了PoDFR蛋白的保守结构域(图6),PoDFR蛋白具有典型的PLN02650结构特征,其是DFR蛋白的特定位点,因此推测该蛋白是DFR。
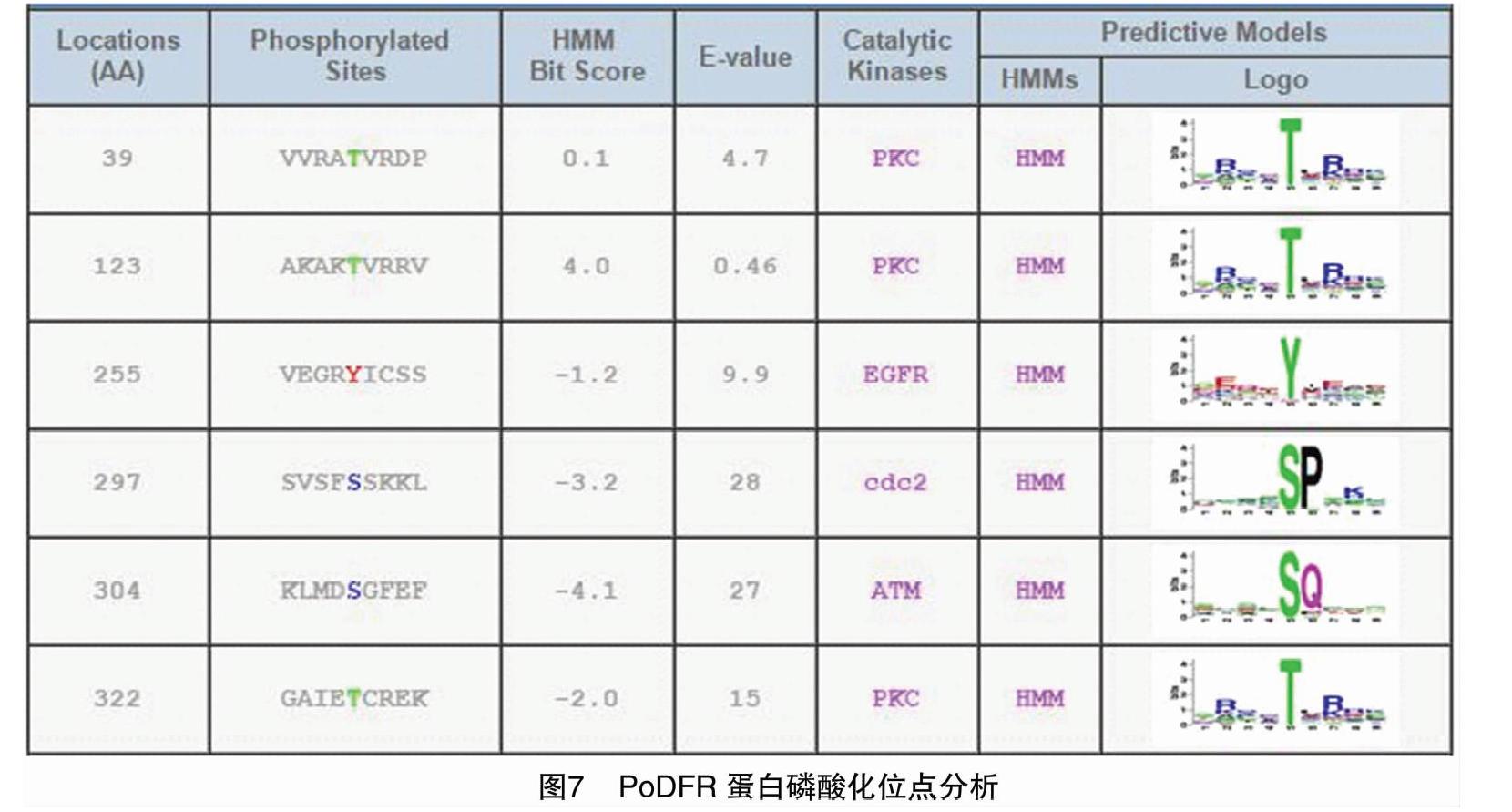
由激酶Phos预测PoDFR的蛋白磷酸化位点含有2个丝氨酸磷酸化位点(分别位于297、304氨基酸)和3个苏氨酸磷酸化位点(分别位于39、123、322氨基酸)和1个酪氨酸磷酸化位点(255氨基酸)(图7)。
2.3 PoDFR基因表达分析
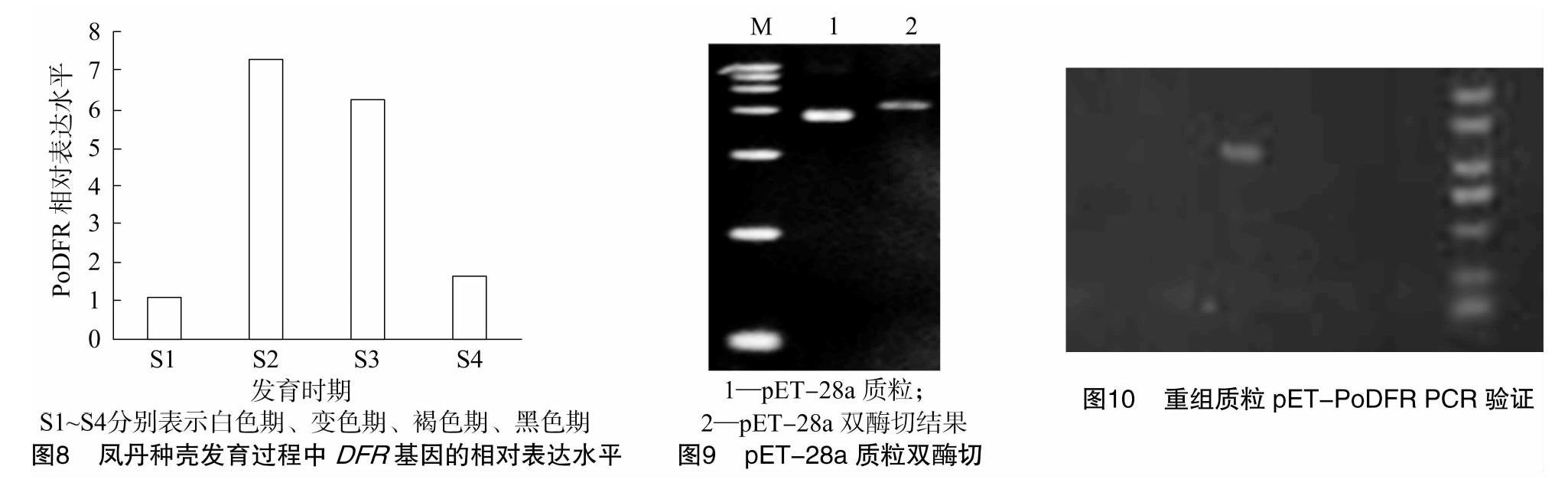
根据DFR基因序列,使用特异引物,通过实时定量方法(real-time PCR)对凤丹种壳发育过程中
DFR基因的表达量进行分析。结果(图8)显示,DFR基因在S2时期达到最高表达水平,是S1时期的7.31倍;S2时期后,DFR基因的表达量逐渐降低。
2.4 原核表达分析
2.4.1 重组载体pET-PoDFR 原核表达载体pET-28的双切线性化处理a质粒,如图9所示,由于各种形式,在载体被消化之前,存在多个电泳条带,并且消化后的载体和预期的大小基本相同。如图10、图11所示,有一个阳性转化体存在于重组载体pET-PoDFR中。在验证阳性转化体被摇动过夜并进行测序后,与第一次测序结果相比没有发现突变位点,因此表明成功构建了原核表达载体。
2.4.2 重组蛋白的诱导表达 诱导重组表达载体表达具有约45 000 u的相对分子量的特定蛋白质条带。PoDFR蛋白大小为40 796.17 u,加上原核表达载体pET-28a表达的约3 400 u的融合标签,与预期相符合(图11、图12)。此外,诱导约6 h后,PoDFR的表达水平最高。外源蛋白的表达水平明显高于载体pET-28a本身的表达水平,从中可以得出,这是诱导的最佳时间。而PoDFR表达量在02 mmol/L IPTG浓度诱导下外源蛋白表达量最高,结果表明这是最佳诱导浓度。
2.5 酶促反应
使用在前一步骤中获得的最佳条件诱导外源PoDFR在大肠杆菌中的表达,底物是二氢槲皮素。
在NADPH和粗蛋白提取物的作用下,仅用PoDFR蛋白的催化进行酶促反应,二氢槲皮素的颜色变暗;
PoANS蛋白质结合起来催化,颜色迅速变红(图13),可以发现B管反应的颜色明显比A管中PoDFR单独反应的颜色更红。PoANS的催化底物为无色花青素,可初步推断二氢槲皮素在PoDFR蛋白的催化下合成了无色花青素。对照组空载体 pET-28蛋白质提取物与二氢槲皮素反应,没有任何颜色变化。
2.6 高效液相色谱分析
将前一步获得的酶促反应物液体于520 nm波长下检测。结果显示,在空载体pET-28a中没有检测到吸收峰(图14),PoDFR和PoANS的联合反应物检测到吸收峰(图15),结合酶促反应的结果表明,PoDFR和PoANS联合催化出了花青素,两者都具有催化反应性。而ANS催化合成花青素的反應底物是无色花青素,证明了DFR基因能够将二氢槲皮素催化合成无色花青素。进一步说明了本试验克隆的DFR基因是与凤丹相对应的花青素催化合成的相关基因。
3 结论与讨论
在该研究中,通过RT-PCR技术获得PoDFR基因序列。凤丹DFR基因的生物信息学分析表明,
它与芍药DFR基因具有最高同源性,达到97%,证明了芍药与牡丹有着十分接近的亲缘关系,PoDFR蛋白也具有典型的DFR保守结构域。
DFR基因表达量与花青素合成密切相关。本试验实时定量结果表明,PoDFR基因的表达量在S2时期达到最高,然后表达水平逐渐下降。可能是在早期阶段,作为合成花青素的上游基因DFR蛋白,催化合成了大量的无色花青素,在后期,则需要ANS基因将无色花青素催化合成为花青素,DFR基因不参与花青素合成的后期反应。
本研究成功构建了pET-PoDFR原核表达载体,IPTG诱导了外源基因的原核表达蛋白。通过聚丙烯胺凝胶电泳确定6 h为原核表达载体最佳的表达时间。结果表明,常用的1 mmol/L IPTG诱导浓度不适用于该原核表达载体,可能因为高浓度的IPTG抑制了大肠杆菌细胞的正常生长活性,此浓度不利于外源基因在质粒载体上的表达。在确定 0.2 mmol/L IPTG作为原核表达载体的最佳浓度后,聚丙烯胺凝胶电泳还显示原核表达的蛋白与预测位置处的空载体明显不同。此外, 它在大肠杆菌中表达的蛋白中占比较高,这也表明IPTG的诱导促进了插入质粒载体pET-28a上的外源基因的表达。
牡丹中的花青素主要是矢车菊素和芍药素,二氢槲皮素是这2种花青素的上游前体,因此,用二氢槲皮素作为原核表达PoDFR的催化反应底物。结果显示,PoDFR原核表达的粗蛋白提物可以催化二氢槲皮素合成无色花青素,无色花青素不稳定,在自然条件下转化为红色花青素,而对照组空载体原核表达蛋白粗提物没有发生相应的颜色变化,证实获得的DFR基因具有相应的功能活性。同时,本研究还利用李果等获得的PoANS原核表达蛋白粗提物[21]与PoDFR蛋白联合催化,发现反应产物比PoDFR单独催化时更红。再用高效液相色谱法进行验证,在520 nm波长下,空载体没有检测到吸收峰,而PoANS与PoDFR联合催化的反应物检测到了吸收峰,这也进一步证明了DFR是凤丹牡丹花青素合成的相关基因。本研究旨在通过RNAi及病毒干扰技术干扰花青素合成途径的下游基因,调节花青素的合成与积累,为培育具有经济价值和观赏价值的凤丹新品种奠定一定的理论基础。
参考文献:
[1]覃逸明,聂刘旺,黄雨清,等. 凤丹(Paeonia ostii T.)自毒物质的检测及其作用机制[J]. 生态学报,2009,29(3):1153-1161.
[2]李育材. 中国油用牡丹工程的战略思考[J]. 中国工程科学,2014,16(10):58-63.
[3]魏新翠. 油用牡丹类黄酮合成酶基因的克隆及表达分析[D]. 杨凌:西北农林科技大学,2015.
[4]姚 红,周 平,范雨昕,等. 中国水仙DFR基因启动子的克隆及功能[J]. 应用与环境生物学报,2019,25(4):993-998.
[5]李亚丽,李 欣,肖 婕,等. 二氢黄酮醇-4-还原酶在花青素合成中的功能及调控研究进展[J]. 西北植物学报,2018,38(1):187-196.
[6]梁立军,杨祎辰,王二欢,等. 植物花青素生物合成与调控研究进展[J]. 安徽农业科学,2018,46(21):18-24.
[7]孟祥春,彭建宗,王小菁. 光和糖对非洲菊花色素苷积累及CHS、DFR基因表达的影响[J]. 园艺学报,2007,34(1):227-230.
[8]张 波,赵志常,高爱平,等. 芒果二氢黄酮醇4-还原酶(DFR)基因的克隆及其表达分析[J]. 分子植物育种,2015,13(4):816-821.
[9]焦淑珍,刘雅莉,娄 倩,等. 葡萄风信子二氢黄酮醇4-还原酶基因(DFR)的克隆与表达分析[J]. 农业生物技术学报,2014,22(5):529-540.
[10]黄兴琳,陆俊杏,廖冰楠,等. 油用牡丹PsFAD6基因的克隆与表达分析[J]. 分子植物育种,2017,15(12):4867-4871.
[11]李方殷. 葡萄风信子花色形成关键基因DFR原核表达及功能验证[D]. 杨凌:西北农林科技大学,2018.
[12]Gollop,R. Expression of the grape dihydroflavonol reductase gene and analysis of its promoter region[J]. Journal of Experimental Botany,2002,53(373):1397-1409.
[13]Marco B,Stefan B,Andrew W,et al. SWISS-MODEL:modelling protein tertiary and quaternary structure using evolutionary information[J]. Nucleic Acids Research,2014,42(W1):W252-W258.
[14]Li H,Qiu J,Chen F,et al. Molecular characterization and expression analysis of dihydroflavonol 4-reductase (DFR) gene in Saussurea medusa[J]. Molecular Biology Reports,2012,39(3):2991-2999.
[15]周 琳,王 雁. 我国油用牡丹开发利用现状及产业化发展对策[J]. 世界林业研究,2014,27(1):68-71.
[16]王亚杰,李厚华,付婉艺,等. 水母雪莲红色细胞系类黄酮含量和相关基因表达[J]. 生物工程学报,2014,30(8):1225-1234.
[17]田振东. 羽衣甘蓝粉色叶相关基因DFR的克隆及表达载体构建[D]. 沈阳:沈阳农业大学,2018.
[18]Yu C S,Lin C J,Hwang J K . Predicting subcellular localization of proteins for Gram-negative bacteria by support vector machines based on n-peptide compositions[J]. Protein Science,2004,13(5):1402-1406.
[19]袁玉辉,朱守晶,邹 杰,等. 芥菜型油菜BjuA09DFR基因及其启动子的克隆与转化和表达[J]. 西北植物学报,2019,39(1):24-31.
[20]许志茹,刘 通,崔国新,等. 芜菁二氢黄酮醇4-还原酶基因的克隆与功能鉴定[J]. 园艺学报,2014,41(4):687-700.
[21]李 果,李厚华,张延龙,等. 凤丹牡丹ANS(PoANS)基因克隆、特性及表达[J]. 东北林业大学学报,2016,44(7):64-69.
