胃癌三线阿帕替尼不同起始剂量和预后相关指标的临床研究
2020-06-19
(大连市第三人民医院肿瘤内科,辽宁 大连 116033)
胃癌是常见恶性肿瘤,致死率位居第三位[1]。手术是胃癌的根治方法,但大部分患者确诊时已失去手术机会。晚期胃癌化疗的5年生存率不足10%,中位总生存时间12个月左右,并且在三线及以上的治疗仍缺乏有效的方案[2-4]。甲磺酸阿帕替尼片是口服小分子抗血管生成抑制药,主要通过高度选择性地抑制血管内皮生长因子受体-2(VEGFR-2)酪氨酸激酶的活性,阻断血管内皮生长因子(VEGF)与其受体结合后的信号转导通路,从而强效抑制肿瘤血管生成,发挥抗肿瘤作用[5]。用于晚期胃癌或胃食管结合部腺癌三线及三线以上治疗。在临床中我们发现850 mg日1次的标准剂量常使患者因不良反应重而中断治疗,针对晚期胃癌患者尤其是经历过一、二线治疗的患者一般体力状态较差,通常临床中耐受的起始剂量为250 mg或500 mg。本文旨在探索阿帕替尼降低起始剂量强度对疗效的影响以及不良反应的监测,并通过血清VEGFR-2的浓度变化与PFS的关系找到可能的疗效预测指标。
1 资料与方法
1.1 一般资料:研究对象为2018年3月至2019年1月就诊于大连市三院肿瘤内科的晚期胃癌患者,共40例患者,其中男性23例,女性17例,年龄38~65岁,中位年龄53岁。病理类型:中分化腺癌9例,低分化腺癌24例,印戒细胞癌6例,黏液腺癌1例。治疗前均行血常规、生化系列、血清VEGFR-2、尿常规、心电图及增强CT等检查。所有患者均满足均经病理证实的晚期胃癌患者,既往接受二线化疗失败,且未接受过VEGFR-TKI治疗,有可测量病灶,ECOG 0~3分,基础血压正常或经降压药控制收缩压≤140 mm Hg、舒张压≤90 mm Hg。
1.2 治疗方法:入组40例患者随机分配至阿帕替尼250 mg剂量组和阿帕替尼500 mg剂量组中。阿帕替尼250 mg剂量组予阿帕替尼250 mg日1次口服,阿帕替尼500 mg剂量组予阿帕替尼500 mg日1次口服,4周后复查增强CT进行疗效评价,所有患者持续治疗直至疾病进展或出现不能耐受的严重不良反应。在应用阿帕替尼前抽取患者的外周血,留取尿液,检测外周血白细胞计数,粒细胞计数,血小板计数,生化系列、血浆VEGFR-2以及尿蛋白。口服阿帕替尼过程中,定期监测血压,血常规,肝肾功及尿常规。若出现1~2级不良反应可不减量仅对症治疗,出现3~4级不良反应时,应停药至不良反应降到1级以下后开始减量服药。
1.3 不良反应评价:本研究中患者出现的不良反应依据2009年美国国立癌症研究所(National Cancer Institute,NCI)常见不良反应事件评价标准4.0版分为Ⅰ~Ⅳ度。

表1 阿帕替尼250 mg组与500 mg组近期疗效的比较[n(%)]
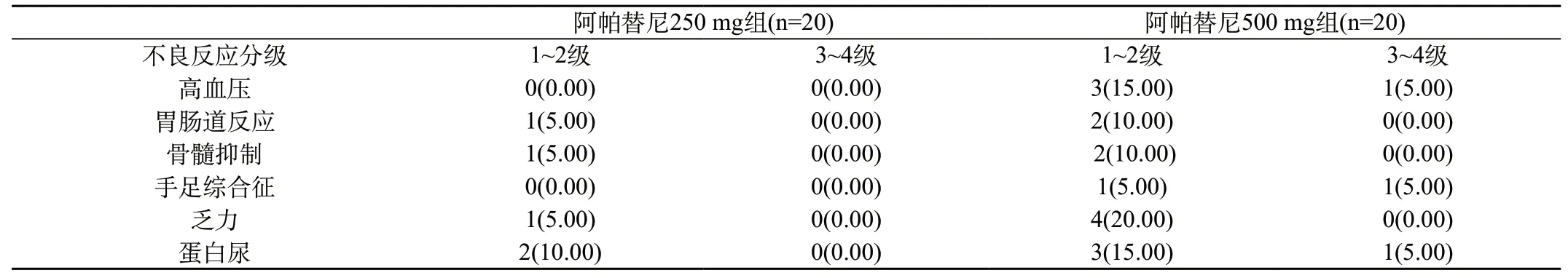
表2 阿帕替尼250 mg组与500 mg组不良反应一览表[n(%)]
1.4 疗效评价:患者用药4周后进行影像学及不良反应的评价。根据实体瘤的疗效评价标准(RECIST),疗效评价分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)、治疗有效(CR+PR)、疾病控制(CR+PR+SD)。观察患者不良反应发生率,按照WHO标准进行评价。
1.5 统计学分析:采用SPSS 21.0统计学软件进行统计学分析,组间基线特征、不良反应的比较、疗效的比较采用卡方(χ2)检验和Fisher确切概率法检验。用Kaplan-Meier生存分析拟合PFS曲线,比较PFS的差异。P<0.05视为差异具有统计学意义。
2 结果
2.1 阿帕替尼250 mg组和阿帕替尼500 mg组两组近期疗效的比较:在这40例患者中,阿帕替尼250 mg组20例,阿帕替尼500 mg组20例。阿帕替尼250 mg组疾病控制率(CR+PR+SD)10例(50.00%),阿帕替尼500 mg组疾病控制(CR+PR+SD)12例(60.00%)。两组疾病控制率无明显差异,P>0.05。两组疗效比较见表1。
2.2 阿帕替尼250 mg组和阿帕替尼500 mg组不良反应的比较:阿帕替尼常见的不良反应见表2,阿帕替尼的不良反应主要体现在乏力,血液学毒性,蛋白尿和高血压,但大多数均为Ⅰ~Ⅱ度,Ⅲ或Ⅳ不良反应发生率较低。其中阿帕替尼250 mg组不良反应发生率较阿帕替尼500 mg组发生率低,P<0.05。
2.3 血清VEGFR-2浓度变化与PFS的相关性:以用药前血清 VEGFR-2浓度为基线,服药4周后检测患者血清 VEGFR-2浓度,参考文献设定△VEGFR-2>+20%为疾病进展(PD),+20%<△VEGFR-2<-20%为疾病稳定(SD),△VEGFR-2<-20%为疾病缓解(PR)。4周后血清VEGFR-2浓度降低20%的患者PFS要比未降低或增长的患者PFS明显延长,PR、SD、PD患者PFS分别为6.58、4.35、3.26个月。P<0.05。结果表明血清VEGFR-2浓度变化提示患者PFS预后,VEGFR-2浓度降低幅度越大,预后越好。见图1。
3 讨 论
胃癌是全球常见的恶性肿瘤,其病死率在各种癌症中排第3位,仅次于肺癌和肝癌。由于早期症状不典型,近70%的胃癌患者在确诊时已是晚期,从而失去手术的机会,尽管已有多种化疗药物如氟尿嘧啶、铂类、紫杉醇、伊立替康等单药或联合治疗用于胃癌标准一线或二线治疗,但预后仍不容乐观。应用目前化疗方法治疗晚期胃癌5年生存率不足10%,中位总生存时间12个月左右,并且在三线及以上的治疗仍缺乏有效的方案,针对二线治疗失败后的患者迫切需要安全有效的治疗来改善其生活质量和延长带瘤生存时间。
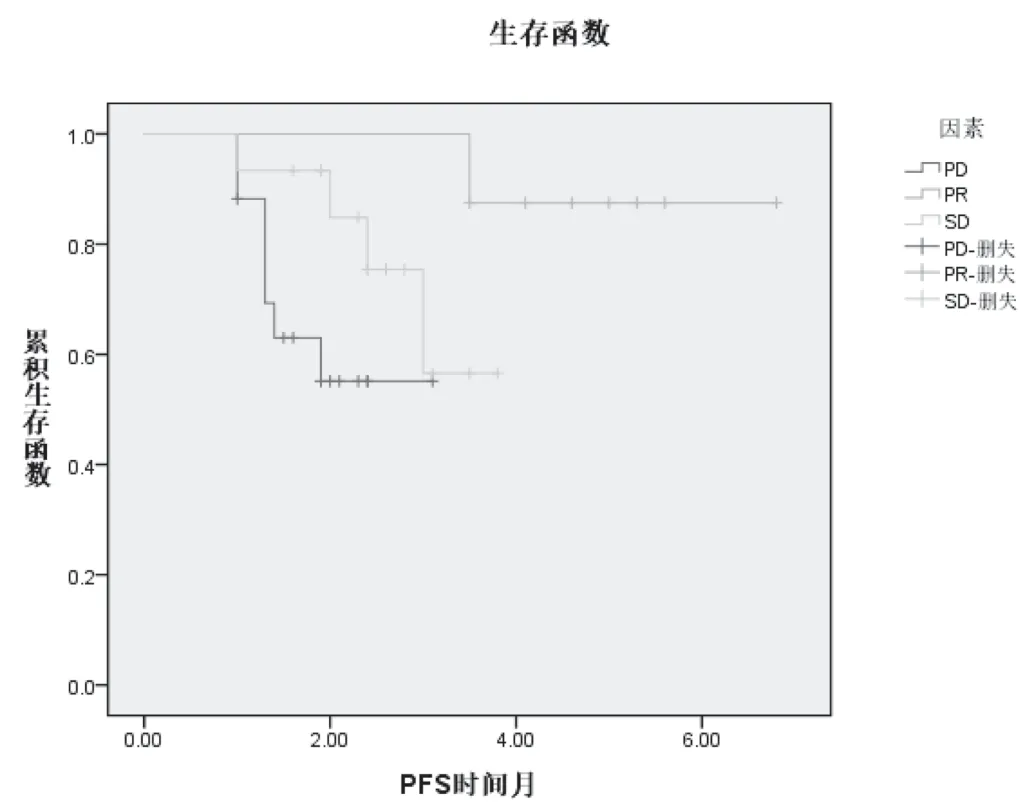
图1 血清VEGFR-2浓度变化与PFS的相关性
肿瘤血管不受控制及不规则的生成使肿瘤快速生长,同时也增加了转移的风险。血管内皮生长因子(VEGF)在血管生成过程中起到了重要的作用,而血管内皮细胞生长因子受体2(VEGFR-2)是VEGF-酪氨酸激酶发挥活性的关键调控点。VEGFR家族蛋白包括VEGFR-1、VEGFR-2和 VEGFR-3。在这些受体中,VEGFR-2与实体肿瘤瘤中的血管病态生成具有重要的关联[6]。肿瘤在发生、发展以及转移的过程中都离不开新生血管的生成,因此抗血管生成治疗已成为肿瘤治疗的关键。阿帕替尼是一种具有高度选择性地抑制VEGFR-2酪氨酸激酶活性的小分子抗血管生成药物。阿帕替尼与VEGFR-2结合后,阻断了VEGF与VEGFR-2相结合引起的VEGFR-2的自动磷酸化[7],从而可以抑制随后的相关信号转导,达到抑制血管生成的目的,发挥强大的抗肿瘤作用。
在阿帕替尼治疗晚期胃癌III期注册临床研究中,推荐的起始剂量是最大耐受剂量850 mg每日1次口服,3~4级不良反应发生率约为60%。在我们的临床实践中发现,850 mg每日一次的剂量常会在服药1~2周之内引起一系列不良反应,包括厌食,恶心,呕吐,黏膜炎,皮疹,腹泻,手足综合征,高血压和出血等,导致很多患者难以耐受,从而减量甚至停药,严重影响治疗的连续性,进而影响疗效;阿帕替尼Ⅲ期临床研究结果提示阿帕替尼可以为晚期胃癌患者带来生存获益,该研究中阿帕替尼组疾病控制率为42.05%,阿帕替尼中位PFS为2.60个月,本文结果显示阿帕替尼250 mg剂量组和500 mg剂量组疾病控制率分别是50.00%,60.00%,与既往研究结果基本相符。两组在近期疗效上无明显差异,所以针对晚期胃癌三线患者阿帕替尼可考虑250 mg日1次口服直至病情进展。本文分析了250 mg和500 mg两种起始剂量强度的药物不良反应,本研究中阿帕替尼组的主要不良反应体现在乏力,胃肠道反应,高血压和蛋白尿,且主要发生Ⅰ~Ⅱ度不良反应,Ⅲ~Ⅳ度不良反应少见,未出现因不良反应停药的患者,阿帕替尼250 mg组较500 mg组不良反应发生率低,患者耐受良好,也提高了患者的依从性。一个精确的生物学标志物对预测靶向药物的临床疗效具有重要意义。Fan M等报道了乳腺癌患者肿瘤组织高表达VEGFR-2预示着阿帕替尼治疗具有良好疗效[8]。在软组织肉瘤中也有多个报道中也均提到VEGFR-2高表达预示着阿帕替尼良好的抗肿瘤疗效[9-10]。
本研究中血清VEGFR-2浓度降低幅度越大,则PFS明显延长。或许VEGFR-2可成为预测阿帕替尼治疗胃癌疗效的生物学标志物。当然是否还存在更准确的预测阿帕替尼疗效的生物学标志物,这些都有待于我们在临床应用中进一步探索。
