猪繁殖与呼吸综合征的监测及其防控
2020-06-12李艳晖南平市延平区饲料工作办公室福建南平353000
李艳晖 南平市延平区饲料工作办公室 福建南平 353000
猪繁殖与呼吸障碍综合征(PRRS)又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种高度接触性传染性疾病。PRRSV的实验室诊断方法很多,最常用的是ELISA检测技术[1]。但目前猪的疫病十分复杂,在感染了PRRSV的猪群中容易发现沙门氏菌、链球菌、副猪嗜血杆菌等的继发感染以及与圆环病毒的共感染[2],因此,ELISA检测结果不能作为确诊的依据,此外ELISA方法不易检查患畜的早期感染,有时难以区分被动免疫和自然感染产生的抗体水平,容易漏诊或误诊[3-4]。RT-PCR检测技术在PRRSV诊断中,能够快速准确地对病原体进行定性[5-6],该法在发病初期即发病1周以内处于病毒血症期检出率最高,并且采样简单,可直接采血分离血清[7],对发病时间较长的猪则应采取脏器,其中肺脏和淋巴结检出率较高。因此,结合ELISA检测技术以及RT-PCR检测方法,在PRRS的诊断及跟踪监测方面具有重要意义。
1 材料与方法
1.1 材料 氯仿、异戊醇(24:1)、乙酸钠、异丙醇、75%乙醇、DEPC 水、5×MMLV Buffer、MMLV, 购于Promega 公 司 ;Trizol LS Reagent、25 mg MgCl2、RNase inhibitor、dNTP mixture均购于大连宝生物工程公司;Taq酶、10×PCR Buffer,购于北京天为时代公司;上游引物:5′-TGGCCAGCCAGTCAATC-3′,下游引物:5′-GCCCTAATTGAATAGGT-3′, 预扩增片段大小为427 bp,引物由TaKaRa公司合成;Herd-Chek猪蓝耳病抗体检测试剂盒。
1.2 方法
1.2.1 ELISA检测
1.2.1.1 样品采集与预处理 采集南平市延平区某猪场未进行猪繁殖与呼吸综合征疫苗免疫的仔猪血液样品115份,及时送检,将送检样品3 000 r/min离心5 min,取血清备用。
1.2.1.2 材料准备 所有试剂使用前置室温 (18~25℃)平衡0.5~1 h;将10×溶缩洗涤液用去离子水稀释至1×,现配现用;将3×样品稀释液用去离子水稀释至1×,现配现用。
1.2.1.3 判定标准 PRRS抗体的有无 (阳性/阴性)通过计算样品/阳性对照(S/P)的比值判定。S/P≥0.4判为阳性,表明抗体存在;S/P<0.4判为阴性,表明无抗体存在。
1.2.2 RT-PCR检测
1.2.2.1 样品采集与处理 无菌采集组织病料,取可疑猪的肺、淋巴结、肾等组织,按1:3加入TE Buffer研磨成组织悬液,于-20℃反复冻融3次,12 000 r/min离心10 min,备用。
1.2.2.2 RNA提取 取研磨病料上清150 μL,加入Trizol 750 μL,混匀,室温放置8 min;同时加入50 μL 乙酸钠和 200 μL 氯仿:异戊醇(24:1),混匀2 min,室温放置10 min后,于 4℃下 12 000 r/min离心10 min;慢慢吸取上清500 μL转入新管中,加入等量异丙醇,-20℃放置30 min;12 000 r/min离心15 min,吸弃上清,加入70%乙醇200 μL洗涤,12 000r/min离心15 min;弃上清,于生物安全条件下干燥,用DEPC水溶解沉淀,-20℃保存。
1.2.2.3 RT-PCR反应体系及条件 RT反应体系见表1。反应条件为:42 ℃、1 h,99 ℃、5 min,4℃保存。

表 1 10 μL RT 反应体系
PCR反应体系见表2。反应条件为:95℃、5 min,94 ℃、1 min,53.5~56 ℃、1 min,72 ℃、1 min,共35个循环;72℃、10 min后,4℃保存。

表 2 20 μL PCR反应体系
取 RT-PCR 产物 6 μL、6×Loading Buffer 2 μL、荧光燃料2 μL,于2.0%琼脂糖凝胶80 V电泳45~50 min。
1.2.3 疫情背景及现场调查 到场巡查公猪、母猪、哺乳仔猪、后备母猪及菜猪的健康状况,调查仔猪成活率,对病死猪进行剖检、记录。母猪群有少数已出现明显的临床症状,表现食欲不振(尤以怀孕后期为重)、发烧(39~41 ℃)、腹式呼吸。 少数母猪耳部、乳头、腹部发绀,尤其耳尖部。5%~35%妊娠后期母猪流产、早产,出现死胎、木乃伊胎。母猪返情率增加。仔猪出现严重的呼吸系统症状。
剖检患猪,病变表现为全身淋巴结肿胀,部分淋巴结出血,心肌心耳出血,心包及胸腔积液,肺脏水肿、间质性肺炎。
2 结果与分析
2.1 ELISA检测结果 猪场蓝耳病抗体检测结果见表3。猪场免疫经典毒株蓝耳病疫苗或没有免疫过蓝耳病疫苗,在猪场稳定的情况下,采用ELISA方法检测蓝耳病抗体,S/P值一般不会超过2.6,若出现S/P值过高的情况,则猪场有可能感染过蓝耳病病毒或当前猪场蓝耳病状况不稳定,呈现蓝耳病病毒活跃状态。检测结果显示,在115份仔猪血样中,检出蓝耳病抗体阳性数110份(S/P≥0.4),阳性率95.7%、阴性率4.3%。全部样品蓝耳病抗体S/P平均值为2.069,变异系数(离散度)51.36%,其中S/P值≥2.6的数量有35份,占检测数量的30.4%;并且S/P值≥3.0的个体占检测数的20.9%(24/115),比例较高。因仔猪的蓝耳病母源抗体可以维持到40日龄左右,所以从检测结果可以间接反映出该场母猪蓝耳病状况不稳定,初步推断该猪场已经有蓝耳病病毒流行。
2.2 RT-PCR检测结果 电泳结果显示,待检样品扩增得到一条与阳性对照相符、大小约427 bp的特异性条带(见图1),说明该猪场有蓝耳病毒存在。

图1 琼脂糖凝胶电泳
2.3 防控方案 生产母猪、公猪及后备公母猪选用勃林格公司PRRS活疫苗1.5头份普免,隔3周2头份加强免疫1次。仔猪7~15日龄时用哈尔滨维科公司PRRS活疫苗首免,每头接种活疫苗1头份,30~35日龄加强免疫1次。观察、记录猪群健康和仔猪成活率。
该场加强蓝耳病活疫苗免疫约3个月后,猪群发病率下降且仔猪存活率由48%提高到88%,母猪的生产性能也得到明显改善,该场蓝耳病的发病和流行得到了初步控制。
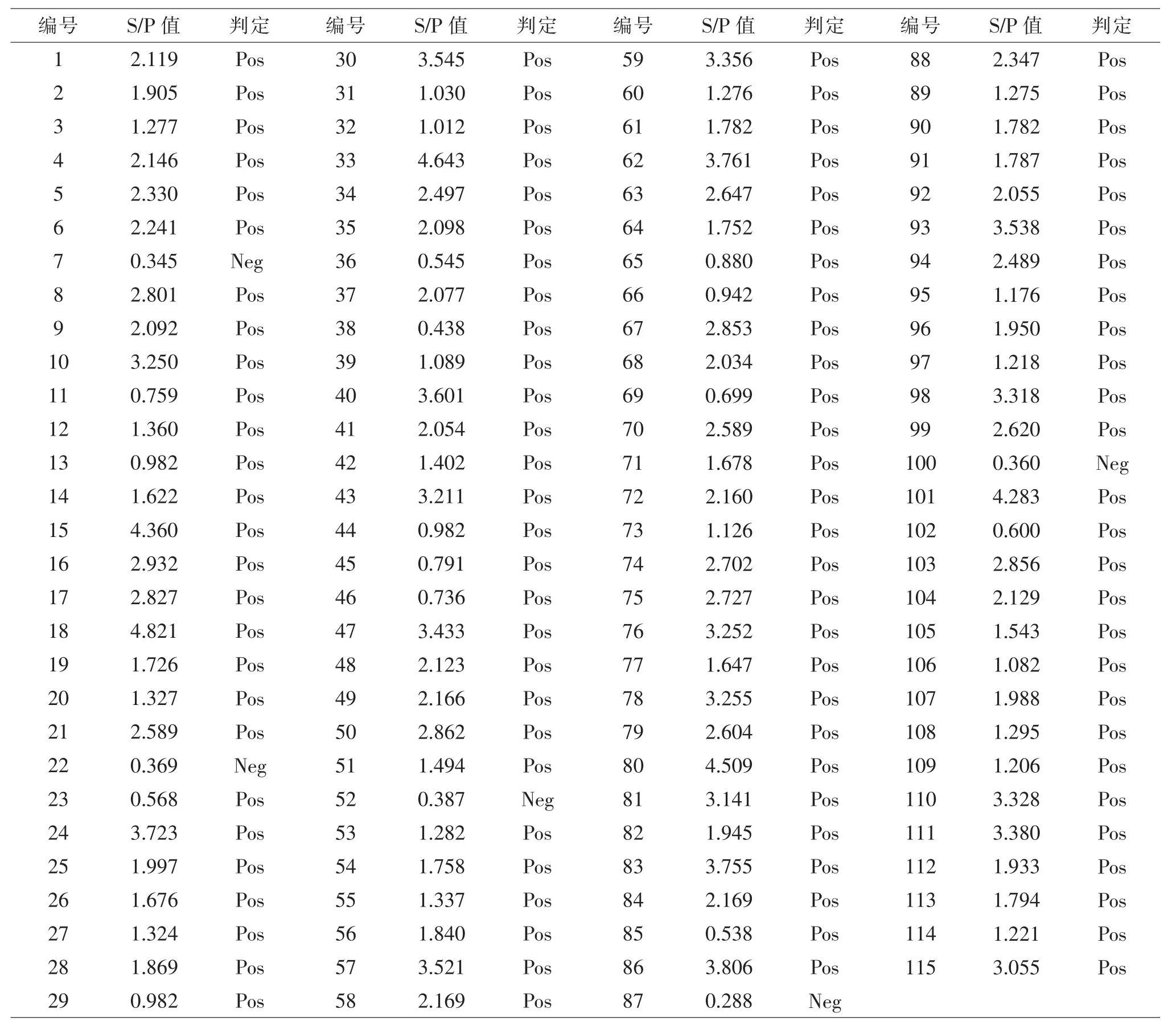
表3 延平区某猪场猪蓝耳病抗体ELISA检测数据
3 讨 论
1)猪蓝耳病靠传统的临床症状和流行病学资料已很难作出准确诊断,要想准确、快速地诊断PRRSV感染,必须采用实验室诊断。目前用于PRRSV实验室诊断方法有病原学检查、血清学检查等。血清学诊断用酶联免疫吸附试验,该方法具有灵敏、特异、简单、快速、稳定及易于自动化操作等特点,其检测的结果能比较客观地显示猪场蓝耳病抗体S/P值的整体水平。但血清学诊断方法也有些不足之处,对急性感染敏感性差,工作量大,且有时难以区分被动免疫和自然感染产生的抗体水平,容易漏诊或误诊。随着分子生物学研究的不断发展,分子生物学诊断技术如PCR诊断技术,以其敏感性、特异性强而广泛用于实验室和临床样品中病毒的检测。由于PCR技术具有快速、特异、敏感和易于操作等优点,在PRRSV感染的临床诊断中已得到广泛的推广应用。
2)对从延平区某猪场采集的115份血清样本用ELISA方法进行猪蓝耳病抗体检测,结果95.7%的样本为阳性,抗体水平高低不均匀,S/P值≥2.6的个体比例偏高,怀疑该场有猪蓝耳病病毒隐性感染。再结合RT-PCR检测方法从采集的病料组织中扩增出PRRSV特异基因片段,确诊该猪场存在猪蓝耳病病毒感染。确诊后采取相应的防控方案,即注射疫苗加强免疫,使猪群抗体水平达到一个稳定的水平,使猪场内无易感猪存在。通过跟踪调查,约3个月后可见猪群临床症状明显减轻或消失,仔猪存活率由48%提高到88%,该病的发病和流行得到了很好的控制,猪群整体生产性能得到显著提高,证明以蓝耳病活疫苗免疫为主的防控方案的可行性。
