红果树种子萌发与幼苗生长特性研究
2020-06-10王雪鳗曾琬晴谭利平彭培好
王雪鳗,曾琬晴,谭利平,庞 鑫,彭培好
(成都理工大学 生态资源与景观研究所,四川 成都 610051)
红果树(Stranvaesiadavidiana)是蔷薇科(Rosaceae)红果树属(Stranvaesia)的常绿灌木或小乔木,主要分布于四川、云南等海拔在1000~3000 m的沟谷、河谷两侧坡地灌木丛中。其冠型饱满;树叶具有明显的季相变化,红叶期持久;花白,复伞房花序,密具多花,花期5~6月;梨果近球形,桔红色[1],果期9~10月,是花果叶观赏价值极佳的野生观赏植物资源,对其引种驯化能够弥补城市色叶及观果树种的稀缺。同时红果树果实营养价值较高,富含钾,镁、β-胡萝卜素、VC等,适宜食用和加工[3];枝条柔韧,是做树桩盆景的优良材料[2]。通过实地调查发现,在红果树种源采集地几无幼苗植株,且成熟植株分布稀疏,种群数量较少,自然更新较差。但是目前针对红果树属的研究主要为红果树(国外引进)的无根试管苗研究[4],以及其变种波叶红果树的种子萌发特性研究[5]、扦插研究[6]、组织培养研究和试管苗移栽研究[7],而对原变种红果树的种子萌发方面的研究尚无报道。本文研究了不同赤霉素3(GA3)浓度、高锰酸钾(KMnO4)浓度及不同基质条件下红果树种子萌发和幼苗生长的差异,旨在探明红果树最适宜的萌发条件,进而对其萌发特性进行研究,不仅能够为红果树的引种驯化及规模化生产提供理论参考,也利于红果树种质资源的保存。
1 材料与方法
1.1 试验材料
红果树果实在2017年12月采集于四川省唐家河自然保护区。收集的果实先用蒸馏水冲洗、浸泡,并搓洗、漂净分离出种子,待自然风干后储藏备用。
1.2 试验地概况
试验地点位于四川省成都市成华区成都理工大学园林实习基地(E104°08′20.49″,N30°40′43.74″),试验时间为2018年4月19日~2018年5月10日,温度区间为16~26℃,萌发试验持续20 d,幼苗生长数据采用萌发第30 d的数据。
1.3 试验方法
1.3.1 溶剂配制
GA3溶液浓度设置为:50 mg/L(G1)、100 mg/L(G2)、150 mg/L(G3)、200 mg/L(G4);KMnO4溶液浓度设置为:1 g/L(K1)、2 g/L(K2)、3 g/L(K3)、4 g/L(K4)、5 g/L(K5),对照组为蒸馏水(CK)。将种子分别放入溶液浸泡2 h。
1.3.2 基质处理
试验基质由河沙和黄壤配比组成。所有基质首先喷洒5 g/L的KMnO4溶液消毒后,于日光下晾晒3 d。然后分别按照河沙∶黄壤=1∶1(S1)、河沙∶黄壤=2∶1(S2)、河沙∶黄壤=1∶2(S3)三种比例配制。
1.3.3 播种与观测
将浸泡后的种子分别播种于基质中,每处理6个重复,每重复8粒种子。将其置于温室内萌发,每日浇水保持基质湿润,每2 d观测一次,视种子胚根露出土壤为发芽[12],并选用发芽率、发芽势两个发芽指标对种子萌发特性进行研究。发芽率(%)=(发芽结束时发芽的种子/种子总数)×100%,发芽势(%)=(发芽开始到高峰时段正常发芽种子数/种子总数)×100%(发芽势是衡量种子品质的重要指标,发芽率相同的种子, 发芽势高的处理效果好[12])。同时选用萌发第30 d的真叶数量、株高作为幼苗生长的研究依据。测量采用精度为0.01 mm的数显游标卡尺。
1.4 数据统计与分析
试验数据采用SPSS 19.0软件分析,运用单因素方差分析、双因素方差分析和多重比较的方法。
2 结果与分析
2.1 不同基质和GA3浓度对红果树种子萌发和幼苗生长的影响
由表1可见,通过单因素方差分析,GA3浓度对种子发芽率和发芽势有显著影响,同时对红果树幼苗真叶数量和株高有极显著影响,而基质未呈现显著性。通过双因素方差分析,基质和GA3的交互作用对红果树种子萌发及幼苗真叶数量没有显著影响,但是对株高有显著影响。
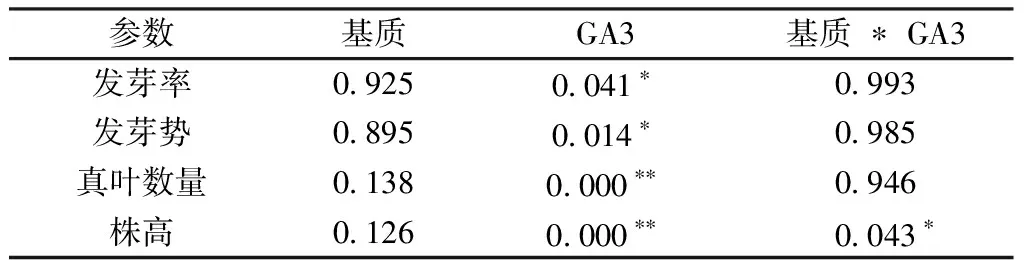
表1 不同基质和GA3浓度对红果树种子萌发和幼苗生长的影响的方差分析
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同。
2.1.1 不同基质和GA3浓度对种子萌发的影响
由表2可见,同一基质条件下,与对照组CK相比,GA3显著提高了红果树种子的发芽率和发芽势,在0~200 mg/L范围内,随着GA3浓度增加,种子的发芽率和发芽势呈现增高趋势。S1条件下,用200 mg/L的GA3处理种子,红果树的发芽率最高(50.00%),发芽势也最高(45.83%);S2条件下,用200 mg/L的GA3处理种子,红果树的发芽率最高(50.00%),发芽势最高(45.83%);S3条件下,用200 mg/L的GA3处理种子,红果树的发芽率最高(41.67%),发芽势最高(37.50%)。在同一GA3浓度中,S3基质中在5个试验组中发芽率与发芽势最高值最多,占比80%,浓度条件为CK、G1、G2、G3,整体效果较好。但是在G4浓度条件下,S1基质发芽率最高(50.02%),发芽势最高(45.89%)。
2.1.2 不同基质和GA3浓度对红果树幼苗生长的影响
由表2可见,同一基质条件下,与CK相比,GA3显著提高了幼苗的株高和真叶数量,随着GA3浓度的增加,株高和真叶数量呈现增高趋势。S1条件下,用200 mg/LGA3处理种子,红果树幼苗的真叶数量最多(4.25片),株高最高(4.67 cm);S2条件下,用200 mg/LGA3处理种子,红果树幼苗的真叶数量最多(3.8片),株高最高(3.83 cm);S3条件下,用200 mg/LGA3处理种子,红果树幼苗的真叶数量最多(4.33片),株高最高(4.75 cm)。同一GA3浓度条件下,对照组中S2基质的真叶数量最多(3片),株高最高(3.13 cm);G1处理条件下,S1基质的真叶数量最多(3.6片),株高最高(3.70 cm);G2处理条件下,S1基质的真叶数量最多(3.83片),株高最高(4.42 cm);G3处理条件下,S1基质的真叶数量最多(4片),株高最高(4.50 cm);G4处理条件下,S3基质的真叶数量最多(4.33片),株高最高(4.75 cm)。

表2 不同基质和GA3浓度对种子萌发和幼苗生长的影响
2.2 不同基质和KMnO4浓度对红果树种子萌发和幼苗生长的影响
由表3可见,通过单因素方差,KMnO4浓度对种子发芽势有显著影响, 且对红果树幼苗的真叶数量和株高有极显著影响,但对发芽率没有显著影响;而基质对种子发芽率和发芽势及株高均无显著影响,但对红果树幼苗的真叶数量呈现显著影响。通过双因素方差分析,基质和KMnO4的交互作用对红果树种子萌发与幼苗生长均无显著影响。

表3 不同基质和KMnO4浓度对红果树种子萌发和幼苗生长的影响的方差分析
2.2.1 不同基质和KMnO4浓度对种子萌发的影响
由表4可见,同一基质条件下,与CK相比,随着KMnO4浓度的增加,发芽率和发芽势呈现先增加后降低的趋势,用5 g/LKMnO4处理种子,发芽率和发芽势都最低,且低于CK。S1条件下,用4 g/L的KMnO4处理种子,发芽率最高(42.50%),发芽势最高(35.00%);S2条件下,用4 g/L的KMnO4处理种子,发芽率最高(42.50%),发芽势最高(35.00%);S3条件下,用3 g/L的KMnO4处理种子,发芽率最高(45.83%),发芽势最高(41.67%)。而在同一KMnO4浓度下,对照组中,S3基质的发芽率最高(32.5%),发芽势为27.5%;K1处理条件下,S3基质的发芽率最高(33.33%),发芽势最高(29.17%);K2处理条件下,S3基质的发芽率最高(34.38%),发芽势最高(31.25%);K3处理条件下,S3基质的发芽率最高(45.83%),发芽势最高(41.67%);K4处理条件下,S1和S2基质的发芽率最高(42.50%),发芽势最高(35.00%);K5处理条件下,S3基质的发芽率最高(29.17%),发芽势为25.00%。
2.2.2 不同基质和KMnO4浓度对幼苗生长的影响
由表4可见,同一基质条件下,随着KMnO4浓度增加,株高和真叶数量呈现先增高后降低的趋势。S1基质下,用4 g/LKMnO4处理种子,真叶数量最多(3.80片),株高最高(5.26 cm);S2基质下,用4 g/LKMnO4处理种子,真叶数量最多(3.67片),株高最高(3.83 cm);S3基质下,用4 g/LKMnO4处理种子,真叶数量最多(3.25片),用3 g/LKMnO4处理种子,株高最高(3.88 cm)。而在同一浓度KMnO4处理的对照组中,S2基质的株高最高(3.13 cm),真叶数量最多(3片);K1处理条件下,S2基质的株高最高(3.30 cm),真叶数量为3片;K2处理条件下,S1基质的株高最高(3.84 cm),S2基质的真叶数量最多(3.25片);K3处理条件下,S1基质的株高最高(4.33 cm),真叶数量最多(3.60片);K4处理条件下,S1基质的株高最高(5.26 cm),真叶数量最多(3.80片);K5处理条件下,S2基质的株高最高(3.10 cm),真叶数量最多(3.80片)。
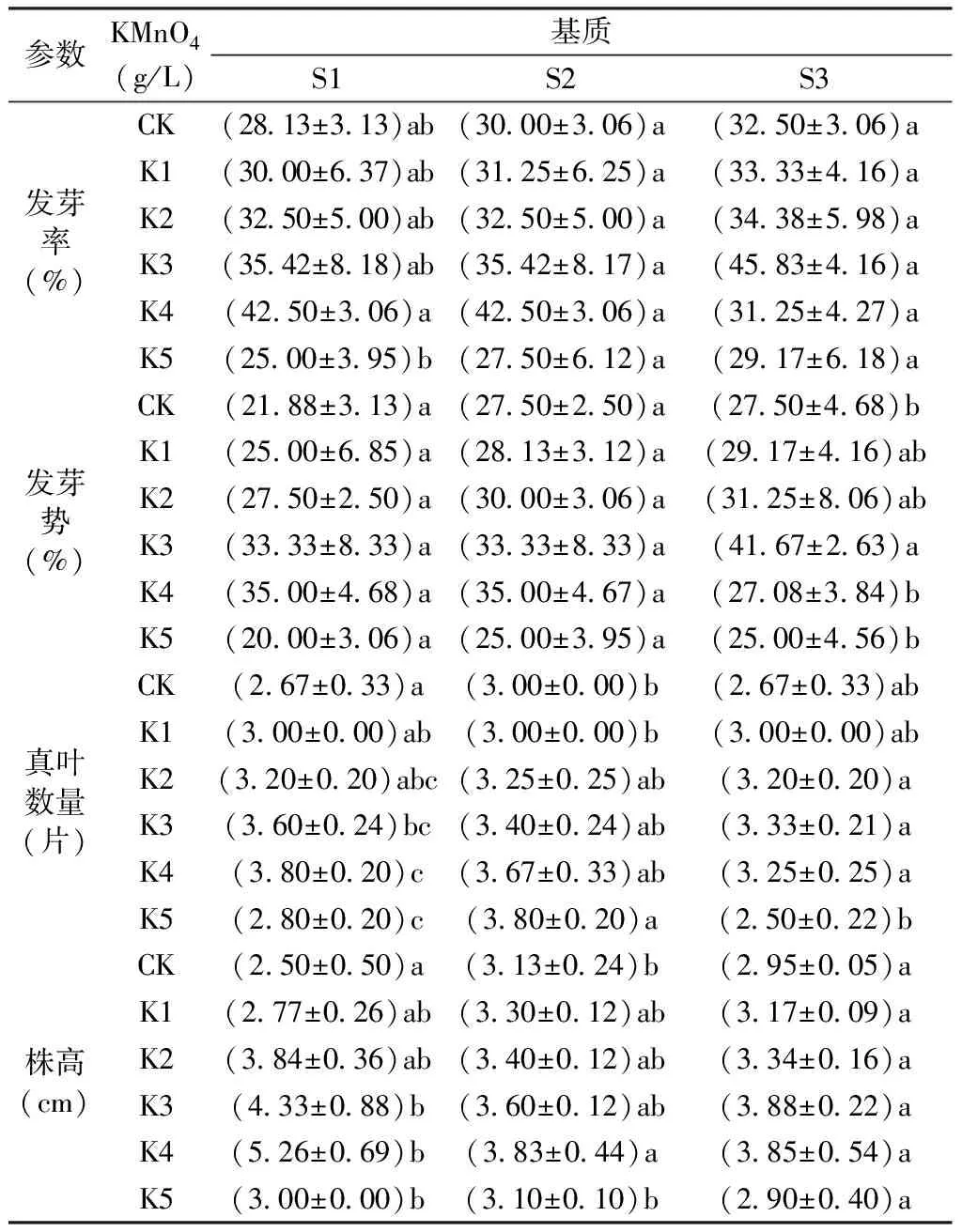
表4 不同基质和KMnO4浓度对种子萌发和幼苗生长的影响
3 结论与讨论
3.1 不同基质与激素对红果树种子萌发的影响
种子萌发受多重因素的影响,包括自身生理因素和外界环境因素。红果树种子成熟于10月,此时雨季刚好结束,逐渐进入低温季节。因唐家河自然保护区内冬季平均温度为-1.2~11℃,因此种子难以萌发而进入低温休眠。打破种子休眠的方法主要为物理与化学两种方式,蒋挺等人在研究波叶红果树萌发特性时,采用低温层积打破种子休眠,在室外自然低温条件下砂藏60 d后,种子萌发率为41.3%[5]。而通过GA3作为生长激素处理红果树种子时,无论哪种基质条件下,随着GA3浓度增加,种子的发芽率和发芽势均呈现增高趋势,这与孙鹏[16]、陆玉建[17]和刘延文[19]等的研究结果一致。当GA3浓度为200 mg/L时,红果树的发芽率可达50%。GA3作为一种常用的生长调节剂,能够在解除休眠中起到关键作用[17],能激活水解酶的活性,使种子内部发生生理变化,促进种子胚的发育和种子发芽[19-20],并且耗时短,萌发率更高,更适用于人工繁育。
从对比试验来看,CK组也存在一定的发芽率,这与实际调查所发现的几无幼苗植株相背,推测主要受当地环境影响。唐家河自然保护区冬长夏短,最热7月平均温度仅为19.7℃,而试验温度为16~26℃,高于种源地温度,猜测低温是制约野外萌发的关键因素。另外,对试验后未发芽的种子进行解剖发现,存在少量发育不完整的胚,可能是由于母株生长环境差所致。种源地的红果树主要分布在游步道旁,溪谷两侧的崖壁上,养分不足,同时容易受到来往游人车辆的影响及上下饮水的野生动物的踩踏及啃食。或是由于花期降雨多,持续时间长,造成对孢粉等空气颗粒物的冲刷,导致花的败育。而具有完整胚却未萌发的种子,推测是受生长激素的影响,合适的生长激素浓度更能提高种子的萌发率。本试验所采用的GA3处理在0~200 mg/L范围内能够有效提高种子的发芽率和发芽势,当浓度高于200 mg/L时,能否进一步提高种子萌发率有待进一步研究。 KMnO4处理在一定浓度范围内具有同样的促进效果,但随着KMnO4浓度的增加,发芽率呈现先增加后降低的趋势,说明KMnO4溶液对种子的萌发有一定促进作用。但KMnO4浓度不易控制,因其氧化性太强,稍有不慎容易破坏种子的内部结构使种子丧失了活性[10]。
3.2 不同基质与激素对红果树幼苗生长的影响
土壤是种植的基础,土壤的理化性质能够影响土壤中水肥气等的运作进而影响植物的生长发育[21]。在土壤中掺入河沙可以改善土壤理化性质和土壤透水透气性,增加植物品质和产量[22-23]。所以采用不同比例的黄壤和河沙作为基质能影响幼苗的株高和真叶数量,但基质理化性质具体如何改变还有待进一步研究。
KMnO4作为一种氧化剂,具有药肥兼用的功能,能对种子消毒也能提高发芽率、促进幼苗生长[13,15-16]。本研究结果表明,KMnO4对红果树幼苗的真叶数量和株高有极显著影响;三种基质条件下,随着KMnO4浓度的增加,株高和真叶数量呈现先增高后降低的趋势。这可能由于高锰酸钾溶于水后能够释放氧、锰和钾离子等植物生长不可或缺的元素,同时这些微量元素能提高种子内酶的活性,参与激素的合成,提高种子活力,促进种子早期的萌发和生长,但当钾离子浓度过高时,胞内水势降低导致种子生理缺水,从而抑制种苗的生长[14-15]。
GA3浓度对红果树幼苗真叶数量和株高有极显著影响,双因素方差分析表明,基质和GA3的交互作用对幼苗的株高有显著影响。随着GA3浓度增加,幼苗的真叶数量和株高均呈增高趋势。这可能是GA3能激活水解酶的活性,使种子内部发生生理变化,促进种子胚的发育和种子发芽[19-20]。本试验所采用的GA3处理在0~200 mg/L范围内能够促进幼苗初期真叶数量和株高的生长,当浓度高于200 mg/L时,幼苗的株高和真叶数量能否进一步增加有待下一步研究。
此外,幼苗生长过程中采用第30 d的试验数据,株高和真叶数量差异显著,可能是发育早期幼苗吸收利用KMnO4分解的离子或幼苗受到GA3的促进作用;生长后期(30 d后)幼苗的株高和真叶数量无显著差异,可能是30 d后幼苗营养根、茎、叶逐渐发育,自我生产能力趋于成熟[24]。
