miR-451a和MMP-2蛋白在结直肠癌组织中的表达及对肿瘤细胞增殖的影响
2020-06-03倪浩亮韩越俊金晰函杜金林
倪浩亮 韩越俊 金晰函 杜金林
[摘要] 目的 探讨miR-451a和MMP-2蛋白在结直肠癌组织中的表达情况及两者对肿瘤细胞增殖的影响。方法 采用逆转录聚合酶链反应(RT-PCR)和免疫印迹分别检测结直肠癌组织与癌旁组织(来自2018年金华市中心医院手术切除的标本),多个肿瘤细胞系中miR-451a的表达和MMP-2蛋白的表达;在HCT116细胞系中过表达miR-451a(miR-451a-mimic)检测MMP-2蛋白表达;miR-451a-mimic或沉默MMP-2表达检测细胞增殖情况。结果 在结直肠癌组织中miR-451a表达明显下降,MMP-2蛋白的表达显著升高,这种结果同时出现在各个结直肠癌细胞株中,以HCT116细胞株最为明显;在HCT116细胞系中miR-451a-mimic显著减少MMP-2蛋白表达量,miR-451a-mimic或沉默MMP-2均会抑制肿瘤细胞的增殖。 结论 miR-451a在结直肠癌组织中表达明显降低,其本身可能通过抑制MMP-2蛋白的表达来抑制肿瘤细胞的增殖。
[关键词] miR-451a;MMP-2;结直肠癌;增殖
[中图分类号] R735.3 [文献标识码] A [文章编号] 1673-9701(2020)09-0015-05
[Abstract] Objective To investigate the expression of miR-451a and MMP-2 proteins in colorectal cancer tissues and their effects on tumor cell proliferation. Methods Reverse transcriptase polymerase chain reaction (RT-PCR) and immunoblotting were used to detect the expression of miR-451a and MMP-2 proteins in multiple tumor cell lines in colorectal cancer tissues and paracancerous tissues (from the specimens surgically resected by Jinhua Central Hospital in 2018), respectively. The expression of MMP-2 protein was detected by over-expression of miR-451a(miR-451a-mimic) in HCT116 cell lines; cell proliferation was detected by miR-451a-mimic or by silencing MMP-2 expression. Results The expression of miR-451a in colorectal cancer tissues significantly decreased, while the expression of MMP-2 protein significantly increased; this result was found in all colorectal cancer cell lines simultaneously, with the HCT116 cell line being the most obvious; miR-451a-mimic significantly reduced the expression of MMP-2 protein in HCT116 cell lines, and miR-451a-mimic or silencing MMP-2 inhibited the proliferation of tumor cells. Conclusion The expression of miR-451a in colorectal cancer tissues is significantly reduced, which itself may inhibit the proliferation of tumor cells by inhibiting the expression of MMP-2 protein.
[Key words] miR-451a; MMP-2; Colorectal cancer; Proliferation
结直肠癌(colorectal cancer,CRC)是世界上第三大最常见的恶性肿瘤,也是癌症相关死亡的第四大原因[1]。全世界约有50%的CRC患者死于远处转移[2-3]。尽管CRC的诊断和治疗有所改善,但每年有超过60万例患者死于CRC。近年来由于饮食结构和生活水平的改变,该病在我国发病率呈逐年上升趋势[4]。miR-451最早是由Altuvia等[5]在2005年从人脑垂体RNA中提取并命名,位于17q11.2染色体上。基质金属蛋白酶-2(matrix metal proteinase 2,MMP-2)参与肿瘤基底膜和细胞外基质的降解,与肿瘤关系密切,其高表达可促进肿瘤细胞的侵袭和转移。文献报道显示miR-451能够抑制乳腺癌、神经胶质瘤和非小细胞肺癌中的细胞生长、增殖、侵袭和迁移[6-8],但其在结直肠癌中表達及对结直肠癌细胞侵袭机制的研究不够充分。本研究将采用逆转录聚合酶链反应(reverse transcriptase polymerase chain reaction,RT-PCR)分析结肠癌组织和癌旁组织中miR-451的表达差异,免疫组织化学法和Western blot检测结肠癌组织中MMP-2的蛋白表达情况,并探讨两者与结肠癌的相关性,以及共同参与细胞增殖抑制的具体机制。
1 材料与方法
1.1 材料来源
12例结肠癌组织和癌旁组织取自2018年金华市中心医院手术切除的标本。所有患者术前均未接受过放化疗,术后病理诊断证实均为结肠癌Ⅱ期中分化腺癌。标本:男6例,女6例,本研究获得金华市中心医院伦理委员会批准,组织标本的收集均征得患者本人的知情同意。人结直肠癌细胞株HT29、HCT116、SW480购自中国科学院上海细胞资源中心,人结肠正常黏膜上皮细胞株NCM60本实验室保存;过表达pcDNA-miR451a(pcDNA-miR-451a-mimic)、pcDNA-NC、psilencer-MMP-2pcDNA-MMP-2及对照质粒psilencer-Scr由上海吉凯生物公司构建,miR-451a RT PCR引物购自北京擎科有限责任公司;Lipofectamine TM 3000转染试剂盒购自Invitrogen公司;MMP-2抗体购自CST公司;GAPDH抗体、辣根酶过氧化物标记山羊抗小鼠、山羊抗兔二抗购自北京百奥莱博科技有限公司。
1.2 方法
1.2.1 Realtime-PCR检测组织及各细胞系中miR-451a的表达 采用Trizol法提取癌组织、癌旁组织以及各细胞系的总RNA,首先加一定量Trizol,然后以5:1的比例加入氯仿,充分混匀,静置5 min,然后3000 rpm 4℃离心10 min,取上清加入异丙醇(根据Trizol量按2:1加)混匀静置10 min,3000 rpm 4℃离心5 min,去上清,加入75%乙醇洗涤,7500 r/min 4℃离心5 min,去上清,加入DEPC水溶解沉淀。根据OD260/OD280比值判断提取RNA的纯度,根据TAKARA逆转录试剂盒要求以5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAACA-3'引 物合成cDNA。按VazymemiRNA Universal SYBR qPCR Master Mix试剂盒说明,配制PCR反应体系,在定量PCR仪器上进行Realtime-PCR,最后用2-△△CT公式计算miR-451a表达量,并且采用内参基因u6作为内对照。
1.2.2 Western blot检测组织和各细胞系中MMP-2蛋白水平表达情况 取100 mg组织置入EP管中,并加入1 mL RIPA蛋白裂解液(已经加入蛋白酶抑制剂)。用电动匀浆器置于冰上匀浆,至肉眼不见块状组织为止,冰上充分裂解1 h,收集液体;取适量RIPA蛋白裂解液(加入蛋白酶抑制剂)加入6孔板中,机械破碎细胞,冰上充分裂解30 min提取液体。收集好的液体在3000 rpm 4℃条件下离心15 min,去沉淀,BCA法测浓度后置入-80℃储存备用。取稀释好的样品进行SDS-PAGE电泳(分离胶12%,浓缩胶5%),转膜,4℃封闭过夜。一抗4℃孵育过夜,TBST洗涤后,再与HRP标记的二抗于室温孵育1 h,ECL显色,照相。
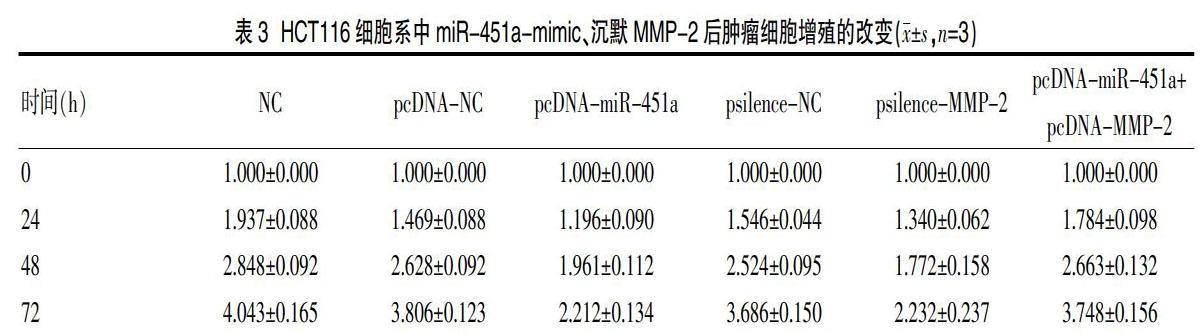
1.2.3细胞系中miR-451a-mimic检测MMP-2表达情况 细胞均用含10%胎牛血清、1%青链霉素的DEME培养基在5%CO2、37℃细胞培养箱中进行培养。消化细胞收集到12孔板上,分别转染pcDNA-miR 451a、pcDNA-NC转染0 h、24 h、48 h、72 h、96 h后,免疫印迹法检测MMP-2的蛋白含量,每组重复3次。
1.2.4 miR-451a-mimic或沉默MMP-2或同时miR-451a-mimic和MMP-2之后MTT法检测感染细胞的生存状况 消化适量细胞收集到96孔板上,每组设三个重复孔,待24 h后分别转染pcDNA-miR451a、psilencer-MMP-2、pcDNA-NC、psilencer-Scr以及同时转染pcDNA-miR451a和pcDNA-MMP-2,在0 h、24 h、48 h、72 h、96 h后在待测孔每孔加入适量MTT溶液,继续培养4 h后,弃培养液。每孔加入DMSO150 μL,避光震荡10 min,使结晶物充分溶解。测定570 nm处检测各孔吸光值(optical density,OD)。绘制对应时间的生长曲线。
1.3统计学处理
采用SPSS19.0统计学软件进行数据分析,计量资料以(x±s)表示,采用t检验,双变量数据采用双因素变量方差分析,P<0.05为差异有统计学意义。
2 结果
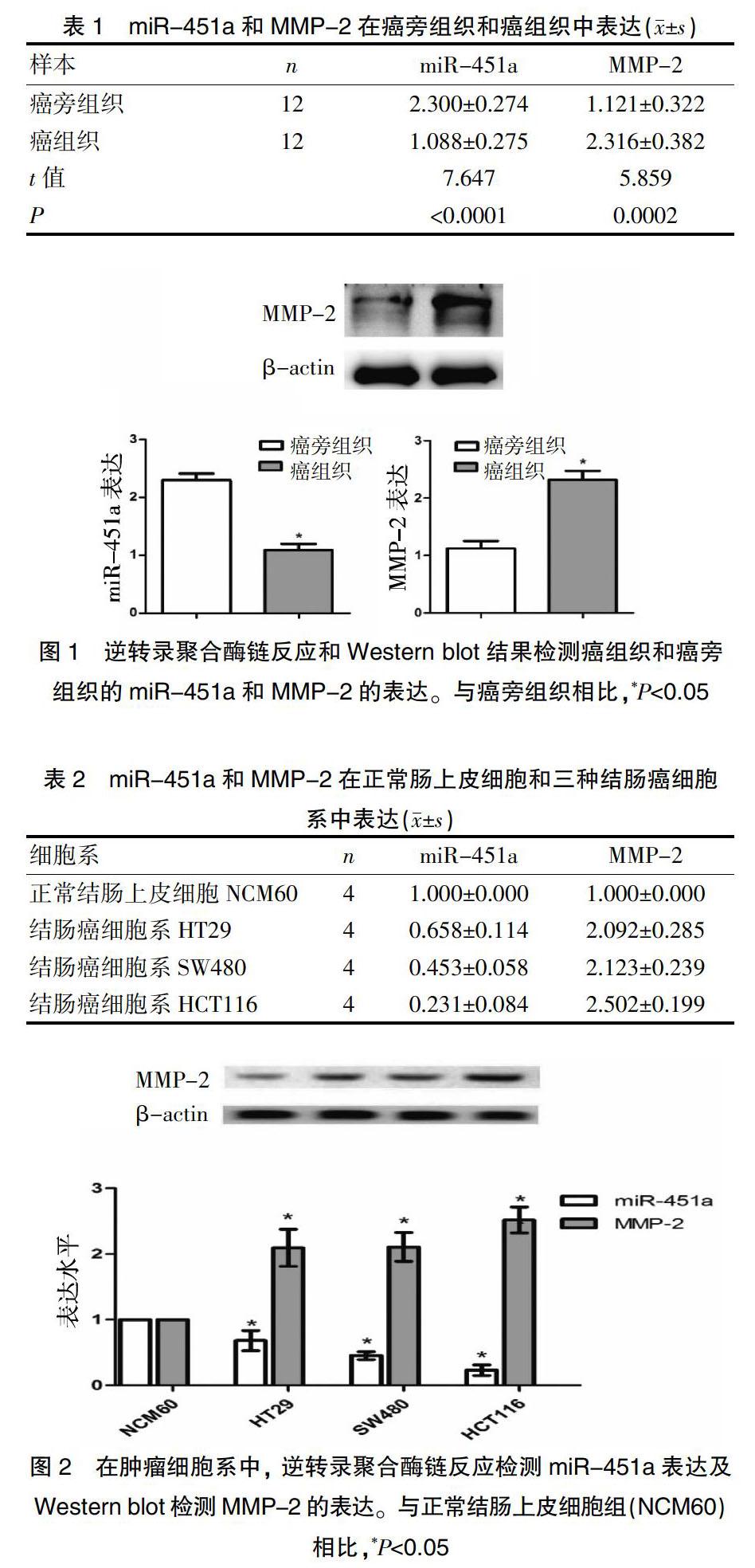
2.1 结直肠癌中miR-451a和MMP-2的表达水平
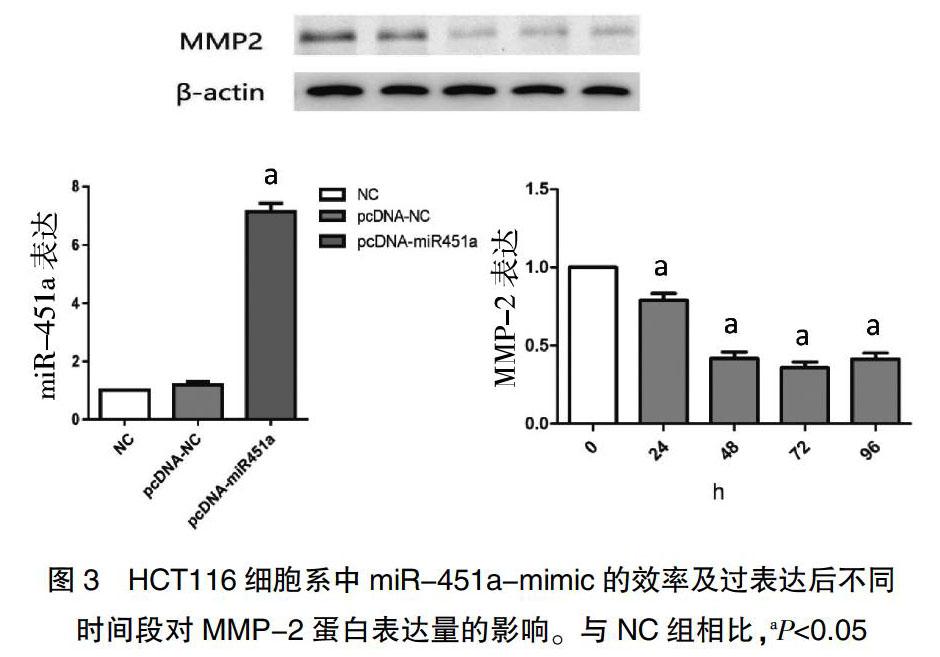
RT-PCR的结果显示,与癌旁组织相比,癌组织中的miR-451a表达水平显著下降,Western blot显示MMP-2蛋白表达量显著升高(图1、表1),在三个人结直肠癌细胞株中,miR-451a表达水平均显著下降,MMP-2蛋白表达量均显著升高,因此为了更好的研究其中机制,选取三种结直肠癌细胞系分别为HT29、SW480和HCT116来验证miR-451a和MMP-2在体外的表达。结果显示在三种结直肠癌细胞系中,miR-451a表达水平均下降,而MMP-2蛋白表达量均升高,尤其在HCT116细胞系中miR-451a表达水平下降最为明显,而MMP-2蛋白表达量则升高最为明显,差异均有统计学意义(P<0.05)(图2、表2)。进而我们选取HCT116细胞系来进行体外机制的验证。
2.3结直肠癌细胞系中miR-451a-mimic、沉默MMP-2对肿瘤细胞增殖的影響
在转染miR-451a-mimic质粒、沉默MMP-2质粒后,HCT116细胞在48 h后出现对细胞增殖的明显抑制作用,达到72 h时,抑制效果最为明显。HCT116细胞系中miR-451a-mimic其48 h和72 h抑制率分别为18.25%和37.23%,沉默MMP2基因后,48 h和72 h抑制率分别为29.54%和43.42%(图4、表3)。
3討论
miRNA以干扰mRNA翻译的方式负向调控基因的表达,能够与靶基因的3′端非转录区域特异性结合而导致靶mRNA降解或抑制其翻译,从而对基因进行转录后调控。其中miR-451a被发现与肿瘤的发生、发展有密切关系。Bandres E等[9]研究显示在胃癌和结直肠癌细胞株中,miR-451a-mimic可以有效降低巨噬细胞迁移抑制因子的mRNA和蛋白量,从而抑制肿瘤细胞的增殖、分化、浸润、转移和促进细胞的凋亡,从而达到抑制肿瘤发生、发展。除此之外,有文献指出[10]AMP活化蛋白激酶也是miR-451a的潜在作用因子,miR-451a-mimic能够抑制AMP活化蛋白激酶对雷帕霉素靶蛋白复合体1的激活作用,从而达到调节肿瘤生长的目的。
MMP-2是基质金属蛋白酶的一种,能对细胞外基质成分进行降解,这种作用是肿瘤侵袭、转移的重要条件[11-13]。MMP-2具有明胶酶的特性,可以在肿瘤浸润时,分解细胞外基质的通路,可以使细胞外基质重新排列,加速肿瘤的浸润及转移[14,15]。MMP-2的过度表达加强了恶性肿瘤的局部侵袭能力和远端转移能力,使病情进一步的恶化[16,17]。有研究显示在结直肠癌病变组织中MMP-2表达升高,明显异于正常的结直肠组织[18]。
有研究显示在胃癌细胞中MMP-2蛋白表达量受到miR-451a表达的影响,但在结直肠癌中尚未有足够的研究揭示这两者的关系[19,20],本实验发现,在结直肠癌中miR-451a-mimic后发现MMP-2蛋白表达量相应的减少,证明MMP-2的表达确实受到miR-451a的影响,分别转染miR-451a-mimic以及抑制MMP-2的表达均会抑制肿瘤细胞的增殖,同时还发现,将miR-451a-mimic和MMP-2同时转染后,细胞增殖没有抑制,说明MMP-2蛋白恢复表达时,miR-451a-mimic并不能抑制癌细胞的增殖,可知miR-451a抑制结直肠癌细胞生长依赖于MMP-2的表达。
总而言之,miR-451a和MMP-2在结直肠癌发生发展中均分别扮演了关键角色,但其中MMP-2和miR-451a两者之间的相互关系及共同对肿瘤细胞的影响还未充分研究。本研究旨在探讨miR-451a和MMP-2两者在结直肠癌中共同发挥作用的联系,以阐明miR-451a作为抑癌因子具体的功能机制,为肿瘤个体化治疗提供帮助。本实验只能证实miR-451a表达可以抑制MMP-2表达,其中具体的机制还需要进一步探索。
[参考文献]
[1] Lancet T. Toward better control of colorectal cancer[J]. Lancet,2014,383(9927):1437.
[2] Liu J,Li H,Sun L,et al. Epigenetic alternations of microRNAs and DNA methylation contribute to liver metastasis of colorectal cancer[J]. Dig Dis Sci,2019,64(6):1523-1534.
[3] Zhang T,Guo J,Gu J,et al. Identifying the key genes and microRNAs in colorectal cancer liver metastasis by bioinformatics analysis and in vitro experiments[J]. Oncol Rep,2019,41(1):279-291.
[4] Shen Y,Gong JM,Zhou LL,et al. MiR-451 as a new tumor marker for gastric cancer[J]. Oncotarget,2017,8(34):56542-56545.
[5] Altuvia Y,Landgraf P,Lithwick G,et al. Clustering and conservation patterns of human microRNAs[J]. Nucleic Acids Res,2005,33(8):2697-2706.
[6] Gits CM,van Kuijk PF,Jonkers MB,et al. MicroRNA expression profiles distinguish liposarcoma subtypes and implicate miR-145 and miR-451 as tumor suppressors[J].Int J Cancer,2014,135(2):348-361.
[7] Tian Y,Nan Y,Han L,et al. MicroRNA miR-451 downregulates the PI3K/AKT pathway through CAB39 in human glioma[J]. Int J Oncol,2012,40(4):1105-1112.
[8] Lopotová T,Zá■ková M,Klamová H,et al. MicroRNA-451 in chronic myeloid leukemia:miR-451-BCR-ABL regulatory loop?[J]. Leuk Res,2011,35(7):974-977.
[9] Bandres E,Bitarte N,Arias F,et al. microRNA-451 regulates macrophage migration inhibitory factor produ-ction and proliferation of gastrointestinal cancer cells[J]. Clin Cancer Res,2009,15(7):2281-2290.
[10] Sun X,Lou L,Zhong K,et al. MicroRNA-451 regulates chemoresistance in renal cell carcinoma by targeting ATF-2 gene[J]. Exp Biol Med (Maywood),2017,242(12):1299-1305.
[11] Li Z,Shan F,Ying X,et al. Laparoscopic versus open gastrectomy for elderly local advanced gastric cancer patients:Study protocol of a phase II randomized controll-ed trial[J]. BMC Cancer,2018,18(1):1118.
[12] Agraval H,Ucs Y. MMP-2 and MMP-9 mediate cigarette smoke extract-induced epithelial-mesenchymal transition in airway epithelial cells via EGFR/Akt/GSK3β/β-catenin pathway:Amelioration by fisetin[J]. Chem Biol Interact,2019,314:108846.
[13] Santiago-Ruiz L,Buendía-Roldán I,Pérez-Rubio G,et al. MMP2 polymorphism affects plasma matrix metall-oproteinase(MMP)-2 levels,and correlates with the decline in lung function in hypersensitivity pneumonitis positive to autoantibodies patients[J]. Biomolecules,2019,9(10):574.
[14] Lee KS,Shin S,Cho E,et al. nc886,A non-coding RNA,inhibits UVB-induced MMP-9 and COX-2 expression via the PKR pathway in human keratinocytes[J]. Biochem Biophys Res Commun,2019,512(4):647-652.
[15] Tsai MH,Wu CH,Lin WN,et al. Infection with staphylococcus aureus elicits COX-2/PGE2/IL-6/MMP-9-dependent aorta inflammation via the inhibition of intracellular ROS production[J]. Biomed Pharmacother,2018, 107:889-900.
[16] Shashni B,Nagasaki Y.Nitroxide radical-containing na-noparticles attenuate tumorigenic potential of triple negative breast cancer[J]. Biomaterials,2018,178:48-62.
[17] Xu H,Ren YJ,Liu K,et al. Correlations of serum VEGF and MMP-2 levels with CLM in CRC patients and effects of TACE on their expressions[J]. Eur Rev Med Pharmacol Sci,2018,22(11):3394-3401.
[18] Ling L,Li Y,Li H,et al. MMP-2 and MMP-9 gene polymorphisms act as biological indicators for ulinastatin efficacy in patients with severe acute pancreatitis[J]. Me-dicine (Baltimore),2019,98(24):e15831.
[19] Mashhadiabbas F,Neamatzadeh H,Foroughi E,et al. Association of MMP-2-753C>T and MMP-9-1562C>T polymorphisms with chronic/aggressive periodontitis risk:A systematic review and meta-analysis[J]. Iran J Public Health,2019,48(7):1227-1238.
[20] Peyronnet B,Richard C,Bendavid C,et al. Urinary TIMP-2 and MMP-2 are significantly associated with poor bladder compliance in adult patients with spina bifida[J]. Neurourol Urodyn,2019,38(8):2151-2158.
(收稿日期:2019-12-19)
