肠润方对功能性便秘大鼠结肠Cajal间质细胞及c-kit/SCF信号通路的影响※
2020-05-31肖秋平洪燕秋耿学斯
●肖秋平 洪燕秋 耿学斯▲ 文 磊
功能性便秘(function constipation,FC)是消化系统常见病、难治病,全球发病率逐渐上升。FC的发生与多种因素相关,但发病机制尚未完全阐明。研究显示,伴有结肠动力障碍的FC患者占相当比例[1]。目前普遍认为Cajal 间质细胞(interstitial cells of Cajal,ICC)的异常是导致胃肠道动力障碍性疾病的一个重要原因,ICC 特异性表达的酪氨酸蛋白激酶生长因子受体(Tyrosine kinase growth factor receptor,c-kit)及其配体干细胞因子(stem cell factor,SCF)结合所启动的信号通路对ICC 生长发育及功能的维持至关重要。中医认为便秘的反复发生主要由于阴血不足,肠道失润,或气虚气滞,推动无力,或两者兼并。基于“运脾滋阴”治法的肠润方在前期临床研究中取得确切疗效[2-3]。本研究旨在探讨肠润方对FC 大鼠结肠ICC 及c-kit/SCF信号系统的影响,揭示滋阴行气法治疗FC、改善结肠动力的可能作用机制。
1 资料与方法
1.1 动物健康SD大鼠72只,雌雄各半,体重(220±20)g,由厦门大学实验动物中心采购提供,许可证号:SYXK(闽)2013-0006。饲料、垫料来源同上,饲养室温度20℃~25℃,湿度45%~55%。
1.2 药物与试剂肠润方(炒白术20g,玄参15g,麦冬15g,火麻仁15g,枳实15g,槟榔15g),肠润方水煎剂:将95g 生药饮片浸泡于蒸馏水中(蒸馏水略没过饮片即可)1h后回流煮沸30min,滤出药液,再加入蒸馏水(蒸馏水略没过饮片即可),同法煮沸30min,过滤。将两次得到的滤液混合,在3500rpm 离心滤液10min,药液旋蒸浓缩至47.5mL,得到200%肠润方水煎液。实验前配制含生药量分别为0.5g/ml、1g/ml 和2g/ml的肠润方水煎液。
麻仁丸:福州海王金象中药制药有限公司(批号:1805042);复方地芬诺酯:新乡市常乐制药有限公司(批号:17040952);PBS 磷酸缓冲液(索莱宝公司,批号:P1010);BCA 蛋白浓度测定试剂盒(碧云天公司,批号:P0010S);PVDF 膜(迈博瑞公司,批号:R7EA3809G);c-kit 抗体(Thermo Fisher 公司,批号:34-8800);SCF 抗体(Abcama 公司,批号:ab64677);IgG抗体(Abcama公司,批号:ab150077),RNA提取试剂盒(Promega 公司,批号:LS1040);逆转录试剂盒(Promega 公司,批号:A5001);RT-PCR 试剂(全式金公司,批号:AQ101-03);免疫组化染色试剂盒(索莱宝公司,批号:SP0041)。
1.3 分组与造模72 只健康SD 大鼠正常喂养和观察1周,随机分为空白组、模型组、麻仁丸组以及肠润方高、中、低剂量组,共6 组,每组12 只。根据课题组前期实验造模方法造模[4],空白组予蒸馏水2.2 ml/次,2次/天灌胃,模型组、麻仁丸组、肠润方组予复方地芬诺脂10mg/kg/d 灌胃,连续灌胃14 天。各组均于末次给药30min 后以0.2mL/20g 的墨汁灌胃,记录大鼠首粒黑便排出时间、6h 内的排便粒数和大便性状,通过SPSS 22.0 统计软件进行分析,验证便秘模型成功制备。
1.4 药物干预造模成功后,空白组、模型组均予蒸馏水1ml/100g/天,2 次/天灌胃;麻仁丸组予规格为0.6g/粒的麻仁丸按成人(60kg)日服计量2.4g 换算成SD大鼠剂量0.3g/kg/d,2次/d灌胃;肠润方高、中、低剂量组根据《中药药理实验方法学》计算出中药人鼠等效剂量,按成人(60kg)日服剂量95g换算成SD大鼠服用剂量为低剂量组5.5g/kg/d,中剂量组11g/kg/d,高剂量组22g/kg/d,2次/d灌胃,各组连续灌胃14天后进行取材。
1.5 标本采集末次给药结束后,禁食不禁水12h,颈椎脱臼处死动物,打开大鼠腹腔取2cm结肠肠管共2份,1份经生理盐水清洗后用OTC保鲜剂固定,液氮保存待western blot 及RT-PCR 测定,1 份固定于中性福尔马林中,以待免疫组化测定。
1.6 免疫组织化学法检测取放于4%多聚甲醛固定的组织,经脱水、包埋制成连续切片。石蜡切片脱蜡后进行抗原修复。用组化笔画圈围住组织,滴加3%过氧化氢灭活内源酶活性。加山羊血清封闭液封闭非特异性位点,室温10min。甩掉封闭液,圈内滴加一抗(1:1000稀释的兔抗鼠c-kit或1:1000稀释的兔抗鼠SCF)盖住组织,放入湿盒内4℃过夜。二抗(1:3000稀释的羊抗兔IgG)室温孵育10min。链霉菌抗生物素-过氧化物酶溶液在室温下孵育10min,DAB 显色。苏木素复染细胞核,自来水冲洗反蓝,1%盐酸酒精分化3秒,自来水冲洗三分钟,脱水,中性树胶封片。用Definiens Tissue StudioTM 图象分析系统,测定各组ckit、SCF 阳性细胞的平均光密度值(average optical den-sity,AOD)。
1.7 Western Blot 检测取大鼠结肠组织样品,加入蛋白裂解液混匀,冰上静置10~15min,12000rpm离心10min,取上清液,重复离心,BCA 蛋白测定试剂盒测得待测样品的蛋白浓度。进行SDS-PAGE电泳,转膜,PVDF膜取出置于含5%奶粉的TBST中,室温慢摇封闭1h,一抗(1:1000 稀释的兔抗鼠c-kit 或1:1000稀释的兔抗鼠SCF)放置低速摇床上4℃过夜。TBST漂洗3次,10min/次,室温孵育辣根过氧化物酶标记山羊抗兔二抗(1:3000 稀释的羊抗兔IgG)低速孵育1h,TBST漂洗3次,10min/次。ECL工作液浸润PVDF膜,避光显影,Tubulin作为内参照。
1.8 RT-PCR 检测取液氮冻存新鲜结肠组织,提取总RNA,测定RNA 浓度,RNA 电泳测定其完整性。经promega 反转录试剂盒操作,所得cDNA 进行RTPCR 检测。反应体系共10μL。经ABI Primer Express10 软件设计荧光定量PCR 引物,由大连宝生物工程有限公司合成。各检测指标引物序列见表1。热循环参数如下:95℃30s 为第一阶段,1 个循环;95℃5s,60℃30s 为第二阶段,45 个循环。以β-actin基因为内参照。CFX96Manager软件分析结果。
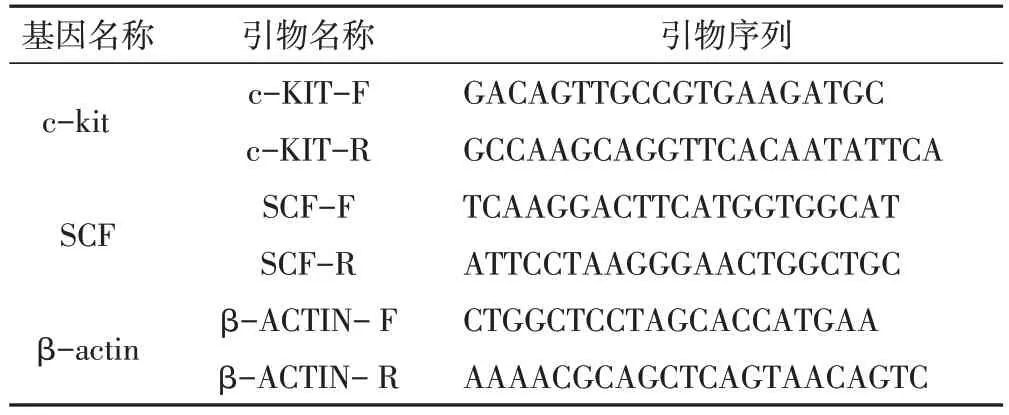
表1 c-kit、SCF、β-actin引物序列
1.9 统计学方法数据采用SPSS 22.0 软件进行统计学处理。数据以均数±标准差()表示,组间比较若满足正态性且方差齐时采用单因素方差分析LSD法和SNK法,若方差不齐,采用DunnettT3法进行方差检验和两两比较,若数据非正态分布采用秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 便秘模型建立情况实验过程中,无大鼠死亡,表明复方地芬诺酯法制备FC 模型具有安全性、稳定性。模型组、麻仁丸组及肠润方高中低各剂量组在大鼠首粒黑便排出时间、6h内粪便排出颗粒数量以及粪便重量与空白组比较均有统计学差异(P<0.05),表明FC大鼠模型成功复制。见表2。
表2 6组大鼠排便情况比较()
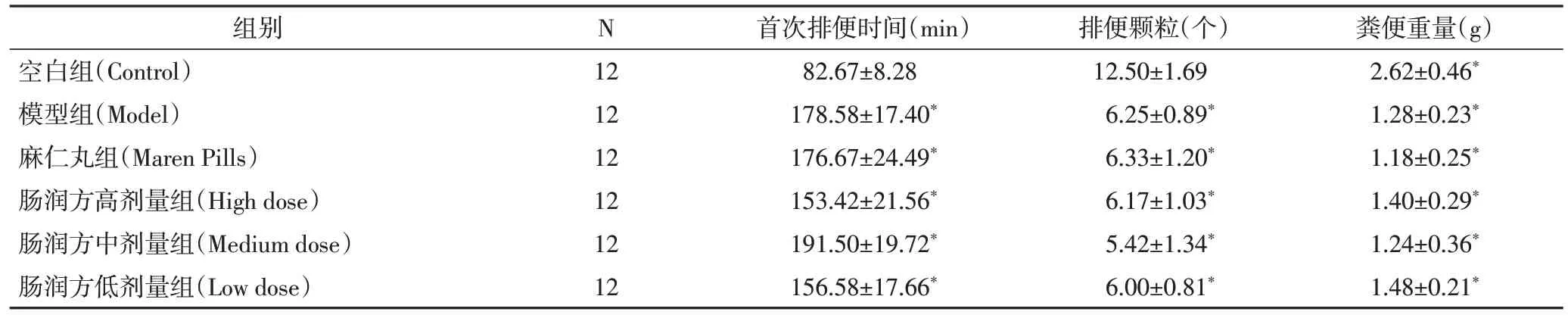
表2 6组大鼠排便情况比较()
注:与空白组比较,*P<0.05
2.2 免疫组化检测大鼠结肠组织中c-kit、SCF 的分布与表达c-kit、SCF均分布于结肠组织和间隙。从c-kit的表达情况分析,结果显示:与空白组比较,模型组和肠润方低剂量组的c-kit表达量均显著降低(P<0.01或P<0.05),肠润方高剂量组和中剂量组与空白组比较无显著差异(P>0.05),而麻仁丸组的c-kit表达量显著升高(P<0.01);与模型组比较,麻仁丸组、肠润方高剂量组和中剂量组的c-kit 表达量均显著升高(P<0.01或P<0.05),而肠润方低剂量组与模型组比较无显著差异(P>0.05)。其中,肠润方高、中、低剂量组的c-kit表达量呈逐渐下降的趋势。见图1。
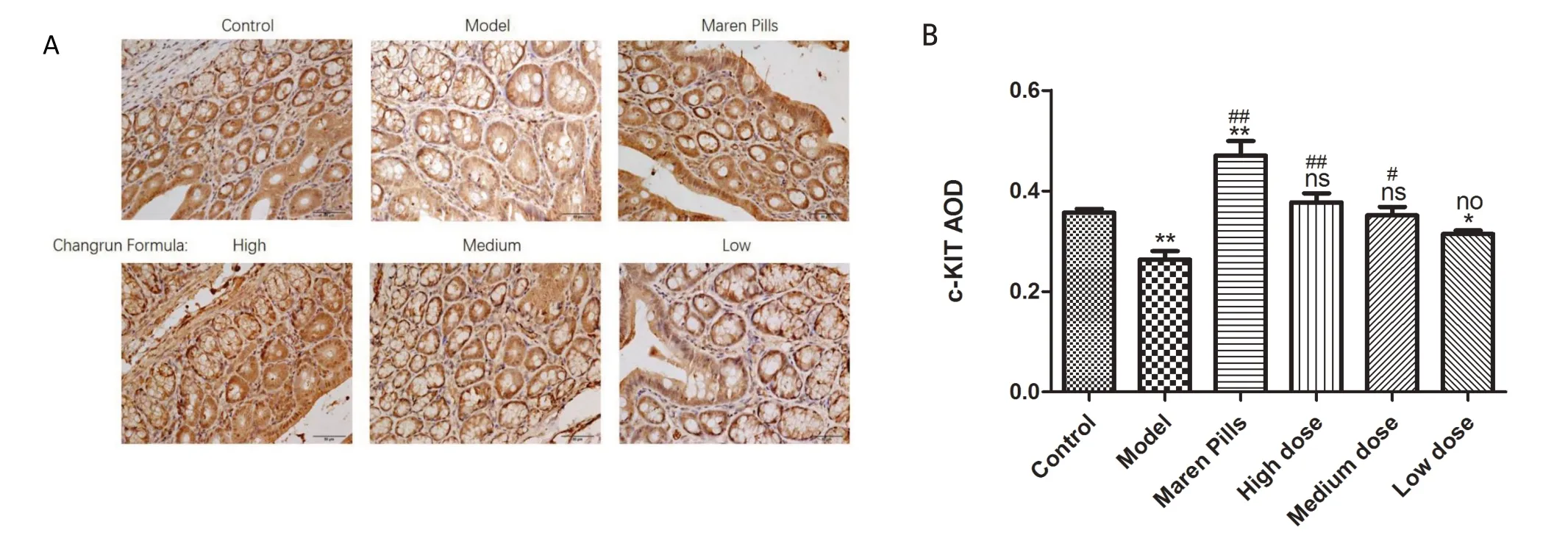
图1 免疫组化检测各组大鼠结肠中c-kit分布与表达情况(SP×400)
从SCF 的表达情况分析,结果显示:与空白组比较,模型组和肠润方中剂量组和低剂量组的SCF表达量均显著降低(P<0.001 或P<0.01),而麻仁丸组和肠润方高剂量组与空白组比较无显著差异(P>0.05);与模型组比较,麻仁丸组、肠润方高剂量组和中剂量组的SCF表达量均显著升高(P<0.01或P<0.05),而肠润方低剂量组与模型组比较无显著差异(P>0.05)。其中,肠润方高、中、低剂量组的SCF表达量呈逐渐下降的趋势。见图2。
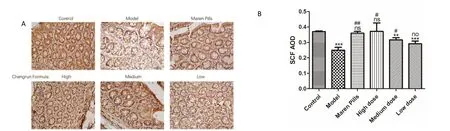
图2 免疫组化检测各组大鼠结肠中SCF分布与表达情况(SP×400)
2.3 Western Blot 检测各组大鼠结肠组织中c-kit、SCF蛋白的表达与空白组比,模型组、麻仁丸组、肠润方低剂量组c-kit 表达显著降低(P<0.001 或P<0.01),中、高剂量组无显著差异(P>0.05);与模型组比,麻仁丸组及肠润方高、中剂量组c-kit表达显著升高(P<0.001),肠润方低剂量组无显著差异(P>0.05)。见图3A、3B。
与空白组比,模型组、麻仁丸组、肠润方中、低剂量组SCF 表达显著降低(P<0.001 或P<0.01),高剂量组无显著差异(P>0.05);与模型组比,麻仁丸组、肠润方高、中剂量组SCF 表达显著升高(P<0.001),低剂量组无显著差异(P>0.05)。见图3A、3C。
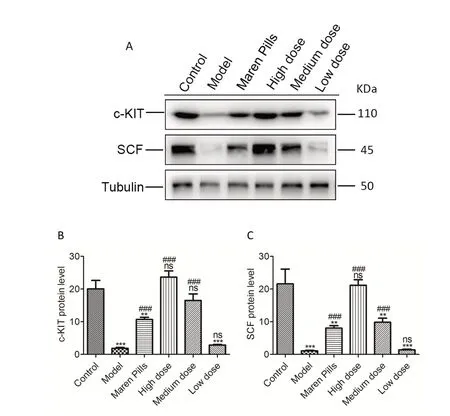
图3 western blot检测大鼠结肠组织c-kit、SCF的蛋白水平
2.4 RT-PCR 检测各组大鼠结肠组织中c-kit、SCF mRNA的表达与空白组比,模型组、麻仁丸组、肠润方中、低剂量组c-kit mRNA 表达显著降低(P<0.001或P<0.01 或P<0.05),高剂量组无明显差异(P>0.05);与模型组相比,麻仁丸组、肠润方高剂量组、中剂量组中c-kit 表达显著升高(P<0.001 或P<0.05),低剂量组无显著差异(P>0.05)。见图4。
与空白组相比,模型组、麻仁丸组、肠润方低剂量组中SCF mRNA 表达均显著降低(P<0.001 或P<0.01),高、中剂量组无明显差异(P>0.05);与模型组相比,麻仁丸组、肠润方高、中、低剂量组均显著升高(P<0.001或P<0.01或P<0.05)。见图4。
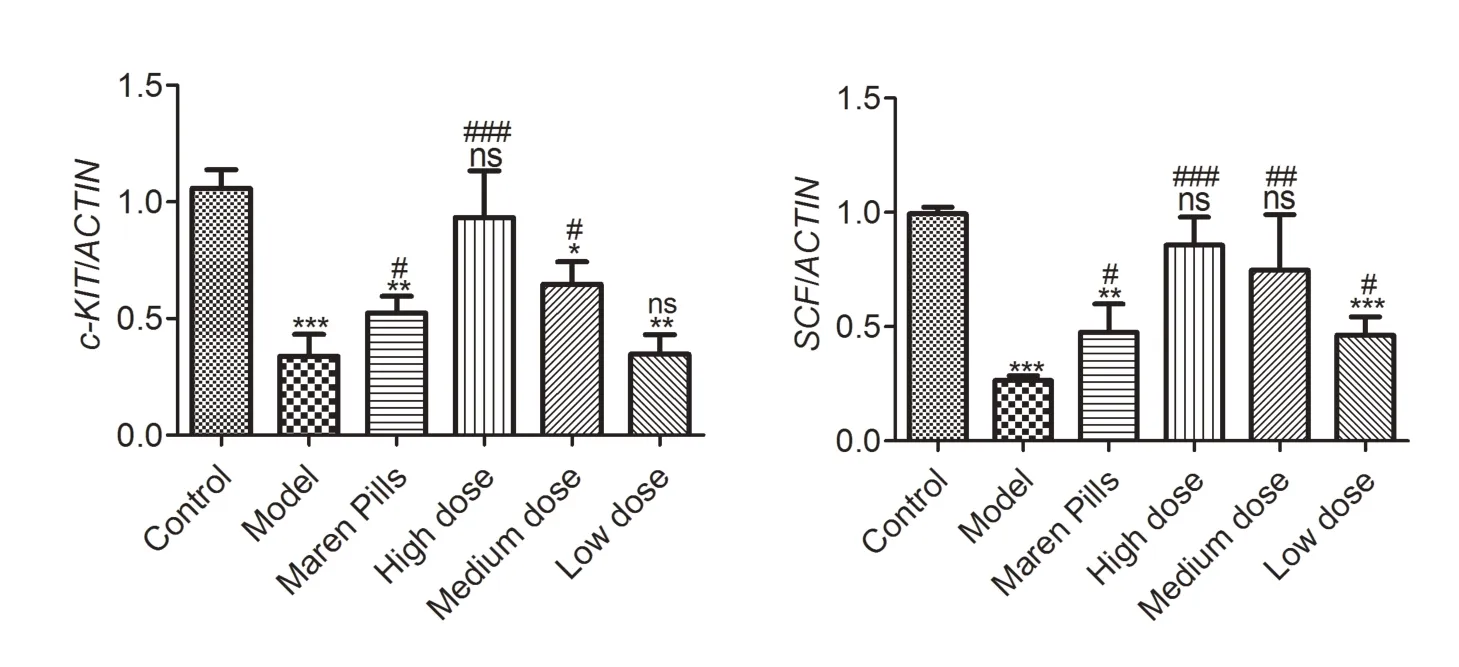
图4 RT-PCR检测大鼠结肠组织c-kit、SCF mRNA表达水平
3 讨论
肠道平滑肌与心脏相同,也表现其自主的电节律性,它起源于肌间神经丛周围的起搏细胞,称为Cajal间质细胞。ICC通过自发产生的节律性慢波控制肠道收缩的节点、频次与方向,慢波由肠神经-ICC-平滑肌细胞网络间的缝隙连接传播,最终引发平滑肌的周期收缩[5]。ICC介导胃肠道肌电活动的起搏,同时也是肠内神经元向胃肠道平滑肌细胞传递信号的必要条件[6],因此它被认为对胃肠运动的调控至关重要。ICC的缺失和功能受损直接影响了胃肠道的正常运动,可引起便秘、糖尿病胃轻瘫、功能性消化不良等胃肠动力障碍性疾病。在FC患者中相当一部分人表现为结肠排空迟缓,而结肠动力减弱是造成这些患者排空迟缓的原因。充分的证据显示[7-9],FC的发生与ICC的改变密切相关。研究表明[10-11],慢传输型便秘(STC)患者结肠组织中ICC 数量与体积较正常人明显降低。一项对20例重度便秘患者结肠次全切除术的病理研究显示,有60%的患者出现ICC 发育不全[12]。本研究采用复方地芬诺脂制备FC 大鼠肠动力障碍模型,通过免疫组化法对大鼠结肠组织进行观察,模型组c-kit、SCF 的表达明显降低,证实ICC 参与了FC 的发病机制。
在ICC 的发育、分化及表型的维持中c-kit、SCF及其组成的c-kit/SCF 信号通路扮演了重要的角色。c-kit 是由人染色体4q11~12 的原癌基因c-kit 编码的跨膜蛋白,由于其特异性表达于ICC,ICC可以通过标记c-kit抗体来识别。c-kit在胞外配体结合区与神经元表达的配体干细胞因子SCF 结合,SCF 发生二聚化后c-kit单体结构发生改变,产生均聚,导致细胞膜上氨基残基的自动磷酸化,启动SCF/c-kit 信号通路,介导各种第二信号分子调节ICC的细胞功能[13]。研究表明[14],ICC与平滑肌细胞都来源于Kit阳性的前体细胞群,接受Kit 信号转导的Kit 阳性前体细胞保留Kit 的表达并发展为功能性ICC,而未经该途径转导的Kit阳性前体细胞则成为平滑肌细胞,提示Kit信号在对ICC种群的发育和维持至关重要。Tong W等[15]研究发现,对小鼠注射抗c-kit 单克隆抗体阻断c-kit 后,小鼠肠内ICC 几乎消失,监测电节律变化显示慢波活动丢失,局部应用SCF后发现经c-kit信号阻断的ICC数量和空肠电节律恢复,提示SCF激活的c-kit信号通路是调控ICC存活和增殖的关键途径。在本研究中,与空白组相比,模型组c-kit、SCF 在结肠组织的表达明显降低,c-kit、SCF 蛋白及其基因表达水平下降。免疫组化结果显示c-kit、SCF的表达与肠润方剂量呈正相关,经肠润方(高、中剂量组)治疗,大鼠结肠组织ckit、SCF 蛋白及c-kit mRNA、SCF mRNA 表达明显升高,说明FC 的发生及ICC 的改变与c-kit、SCF 表达异常、c-kit/SCF 信号通路受阻相关,实验进一步表明肠润方治疗FC是通过介导c-kit、SCF mRNA 的表达,提高c-kit、SCF 蛋白的表达,从而修复c-kit/SCF 信号通路,提高ICC的数量和功能,促使ICC恢复对胃肠道节律的正常调控。
中医认为正虚邪恋,缠绵不愈,正气不足是导致慢性便秘的根本原因。FC 病机在于阴血不足,肠道失润,亦或是气虚气滞,推动无力,或两者兼有。治疗便秘时不应局限于通便,而应从患者自身整体状况出发,发挥中医整体把握、病症兼顾、平衡阴阳及调和气血的优势,改善便秘症状的同时减少其并发症,从而提高患者生存质量。基于上述认识,笔者提出“以补通秘”的治疗原则,其目的是通便不用泻药,通过健脾行气、滋阴润肠,促进肠道蠕动而达到标本兼治。肠润方是以“滋阴行气”为基本治法,具有滋阴益气、行气润肠的功效。肠润方治疗FC 临床疗效显著,有效提高患者生存质量,近期有效率达90.0%,随访3个月有效率67.5%[2-3]。方中君药白术甘温补虚,归脾、胃经,既可补气又兼健脾,脾气健运则胃得以行其津液,胃肠分泌旺盛,蠕动增强,津行肠润而运肠,则肠枯便停之势得缓。玄参苦、咸、微寒,壮水之主,启肾水而能治肠燥舟停之液干;麦冬甘、寒,益阴生津,在《药品化义》尚有“治虚人元气不运,胸腹虚气痞满”的补气之说,玄参、麦冬配伍,增液益气而水流舟行,与方中其他药物相伍,泻而不峻,润而不腻,二者共为臣药。火麻仁甘、平,归脾、胃、大肠经,质润多脂,滋阴养血,润肠通便,善于治疗津血亏虚之肠燥便秘;枳实苦、辛、微寒,具有行气导滞,通导肠腑积滞的功效;槟榔辛温,行气布津,归胃与大肠二经,与方中诸味滋阴药物配伍开辛润之用,三者共为臣使之药。火麻仁配伍白术可益气养阴润肠;枳实配伍白术,取枳术丸之意,益气行津濡润肠道,起到消补兼施的作用;槟榔破气消积,配伍枳实,行胃肠之积滞通调肠道。诸药相合,共奏健脾行气、滋阴润肠之功,具有补重于消,寓消于补,以补为通的特点。
本研究表明,肠润方可明显提高c-kit、SCF 蛋白表达及c-kit、SCF mRNA 的表达水平,通过修复c-kit/SCF 信号系统恢复ICC 对胃肠道电节律的正常调控,达到促进肠道蠕动,恢复胃肠道动力的作用。前期研究表明[4],肠润方亦可通过激活P38MAPK信号通路调控AQP3、AQP9 的表达,起到促进黏膜分泌黏液润滑肠道作用。肠润方治疗便秘具有多靶点的优势,通过整体调控而达到行气润肠的效果,进一步阐明基于滋阴行气法的中医药治疗FC的现代医学机制。
