铽(III)离子及其复合物:从发光特性到传感应用
2020-05-13柳苏月田晶晶田洪涛许文涛1
柳苏月 田晶晶 田洪涛 许文涛1,
(1. 河北农业大学食品科技学院,保定 071001;2. 北京食品营养与人类健康高精尖创新中心 中国农业大学,北京 100083;3. 农业农村部农业转基因生物安全评价(食用)重点实验室 中国农业大学,北京 100083;4. 国家北方山区农业工程技术研究中心,保定 071001)
稀土元素(Rare earth element,REE)也称镧系元素(Lanthanide element,Ln),在周期表中包含镧(Lanthanum,La)到镥(Lutetium,Lu)15 种金属元素,它们具有相似的外层电子结构,彼此之间化学性质相似。在4f 轨道上,电子的运动状态和能级特征赋予了稀土配合物特殊的发光性质。被屏蔽的4f 轨道发生f-f 禁阻跃迁时,Ln 能保持其特有的发光颜色,并且具有光谱特性—可见光区产生的线性谱带窄,激发态寿命达毫秒级。但是,由f-f 禁阻跃迁产生的镧系离子(Ln3+)在紫外可见光区域摩尔吸光系数小,对激发光的吸收能力弱。为了增强其发光性能,部分有机化合物能与Ln3+形成特殊发光配合物,并且镧系发光配合物得到了广泛的研究。
1942 年3 月,魏斯曼[1]提出了天线效应,也称光敏化作用,即Ln3+作为能量受体,当有机配体(能量供体)捕获激发光的能量后经能量转移过程将能量转移至Ln3+,Ln3+因此达到激发态,之后经辐射跃迁能够发光。这种供体与受体之间的相互作用,涉及多种能量转移机制,如Förster 共振能量转移(Förster resonance energy,FRET)[2],德克斯特能量转移(Dexter excitation transfer,DET)[3]等。天线效应为提高Ln3+的发光性能提供了有效途径,使得镧系发光配合物具有独特的光学性质—斯托克(Stokes)位移大,发射带尖锐,发光寿命长,光化学稳定性高等[4]。
相比于其它Ln3+,更多研究集中在铕离子(Eu3+)发光配合物和铽离子(Tb3+)发光配合物[5]。它们具有高量子产率,长寿命和多个光谱分辨的发射带。但是相比于铕,铽的发射带能更好分离[2]。基于此,对铽离子与不同配体形成的发光铽离子配合物的研究状况及其应用展开评述,特别是其优异的发光性质在生物技术领域的应用,如荧光探针、生物传感、细胞成像、药物递送及癌症的诊断和治疗等方面。
1 铽离子及铽离子配合物的基本性质
铽(Terbium)在稀土元素中排列第14 位,为银灰色金属,有延展性,质地软。三价铽离子(Tb3+)具有一定细胞毒性,在体内Tb3+靶器官为肝、肺和脾,当与合适的配体进行配合之后形成的铽离子配合物能后适度地降低其毒性[6]。Tb3+具有独特的光、电、磁等性质[7-8],其中Tb3+的发光性质引起了科研工作者的研究兴趣。基于天线效应改善其发光特性能进一步拓宽其应用范围,如在光功能材料方面,可以用于照明,激光等;其构建的发光探针还可以应用于生物传感器、生物成像等;在医学方面如免疫检测、药物递送、癌症的诊断和治疗[5]。
1.1 铽离子的发光性质
Tb3+的发光机制属于光致发光,即通过紫外可见或红外辐射,用电磁辐射照射激发Tb3+。因为Tb3+具有较低的摩尔消光系数,当用紫外灯对其直接辐射时,或者不发光或者发出微弱的绿色荧光,且水溶液中游离的Tb3+吸光截面低,其周围介质如配位水分子中的氢氧键的高频振动造成非辐射失活,引起能量损失,对其发光有一定的淬灭作用[2,9-10]。
1.2 铽离子配合物的发光特性
基于配位化学的原理,配体的选择对于铽离子配合物的发光性质有很大的影响。综合多年的研究工作来看,大多数工作致力于提高其发光性能从而扩展其应用。
单齿配体,是指一个配体只具有一个配位原子。多齿配体,是指一个配体中含有两个或两个以上的配位原子。Tb3+可以部分多齿配体形成较为稳定的发光复合物,尤其是与含有带负电荷的供体基团的配体。一般用紫外灯激发该配合物的水溶液能得到Tb3+独特且强烈的绿色荧光。此外,溶剂也会对铽离子的发光性能造成影响,与水这种常用的溶剂相比,如DNA/Tb 的配合物在二甲基酰胺(DMF)和二甲基亚砜(DMSO)中发生发光率更强[11]。有机溶剂能促进静电相互作用,使得Tb3+配位范围发生改变。此外,Tb3+还可以与具有环状结构的配合物形成铽离子螯合物,通过两个或者多个配位体与Tb3+形成螯合环。从软硬酸理论的角度来看,铽(III)离子属于硬酸,倾向于与氧,氮类硬碱相互作用[12]。选择符合要求且高效的配体或者敏化剂螯合铽离子,一方面能减少周围环境介质造成的发光淬灭影响;另一方面基于天线效应显著提高铽离子发光性能。
1.3 常见的铽离子配体
常见的铽离子配体例如含N 杂环有机配体:联吡啶、2,6-吡啶二羧酸;含多羧基有机多齿配体:乙二胺四乙酸(EDTA)、二乙烯三胺五乙酸(DTPA)等聚氨基多羧酸盐,是常见的螯合剂[12]。此外,还有含α-羰基羧酸构型的第3 代喹诺酮类抗菌药物例如恩诺沙星、氟罗沙星、普卢利沙星和达氟沙星,都可与铽离子形成二元配合物。生物大分子类如核酸、蛋白质芳香残基的三重态与铽的共振能级几乎重叠。核酸、肽用作天线配体,也可以与铽离子形成复合物[13]。不同配体彼此能协同配合,还能形成三元发光配合物。譬如联吡啶与Tb3+形成的配合物还能有效结合DNA。不仅如此,Tb3+及其配合物还能结合大多数纳米材料,所得复合材料能进一步提高其发光性能等。常用的纳米材料有碳量子点、二氧化硅、金属-有机骨架、层状双氢氧化物等,并且有专门对于稀土层状稀土氢氧化物纳米材料的研究。一般而言,核酸、蛋白质、纳米颗粒等结构不仅能够敏化Tb3+发光,还能螯合Tb3+从而减少周围介质对其发光的淬灭作用[14]。
1.4 铽离子配合物的发光机理及影响发光性能的因素
铽离子配合物的发光机理建立在紫外可见或红外辐射的光致发光原理的基础上。光致发光的过程即是用电磁辐射照射激发铽离子配合物,其将经历吸收能量,能量传递,能量发射3 个阶段。配体敏化铽离子发光过程机制可以用图1 来解释。高效配体(供体)吸收能量后从基态(S0)变成激发单重态(S1),通过系间窜跃能进入激发三重态(T1),当配体的激发三重态与铽离子的5D4发射态能量水平重叠时,能够发生能量转移的过程,能量转移到位于较低能级的Tb3+,该过程属非辐射跃迁。处于最低激发态能级的Tb3+随之发生辐射跃迁,可发出绿色荧光[15]。其特征发射光谱对应于从5D4能级到7Fj(j= 3,4,5,6)的电子跃迁。并且由5D4到7F5的能级跃迁发出的荧光最强,在荧光光谱上表现出尖锐的发射峰。此外,配体从不同多重态的激发态(单重激发态或三重激发态)向基态(S0)辐射过程中也会产生相应的荧光或磷光[12]。
因此,高效的配体或敏化剂,除了应具有较高的吸收系数、高热力学和动力学的稳定性等特点外,其还需具有较小的单线态与三线态之间的能隙,如此才能进行有效的系间窜跃,并且其最低三重态与铽离子的最低激发态匹配程度应相当或者重叠。此外,有机配体连接的基团、配位环境以及多种配体的参与导致的协同发光效应也能影响铽离子配合物的发光性能[5]。
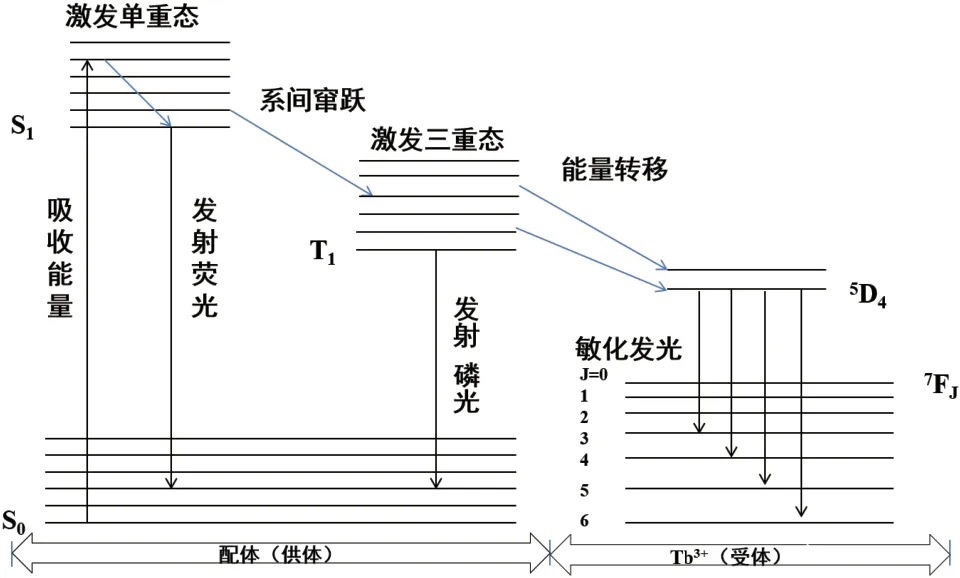
图1 敏化铽离子发光能量转移机制
1.5 铽离子与核酸
能量转移试验中,寡核苷酸和Tb3+形成的配合物最具代表性[16]。如DNA,是与磷酸基团相关的核苷酸碱基(A、T、G 和C)的带负电荷的聚合物,并且其组成和构象具有可编程性,易化学合成,易购置,具有稳定性,纯度高,成本低[17]。
核碱基(嘌呤或嘧啶碱基)为DNA 组成部分之一,是良好的发色团,可作为能量转移过程中的供体,因而核酸及其片段在一定波长范围内对紫外辐射有较强的吸收,并且特定碱基对应特定的吸收波长。其中鸟嘌呤(Guanine,G)在波长约285 nm 处有最大紫外光吸光值,并且具有合适的三重态能量[18],能将能量传递至Tb3+,即鸟嘌呤能够敏化Tb3+发光,是有效的敏化剂。从其结构来看(图2-A),G 的六元环上,O6 和N7 是Tb3+的合适配位位点。此外,还有胞嘧啶(Cytosine,C),其通过O2 和N3 能与Tb3+配位。G 和C 均可增强水溶液中Tb3+发光,二者发光增强效果的差异可能源于三重态能量形成的量子产率的差异或是结合稳定性以及动力学的差异。另外,腺嘌呤(Adenine,A)和胸腺嘧啶(Thymine,T)因为不具有相邻的高电子密度区域,其氧原子仅用于键合作用[9]。Tb3+作为具有高电荷密度的硬路易斯酸,对DNA 的磷酸骨架也具有高亲和力,可以与磷酸基团结合。Tb3+能与所有核苷酸单磷酸的磷酸盐配位,即与磷酸基团上的氧进行配位,但是能进行有效的能量转移的配体主要来自碱基[9,16]。
在此基础之上,核苷类别中的 鸟嘌呤核苷(Guanosine),由鸟嘌呤和核糖环组成,作为一种在紫外区具有高消光系数的配体,能产生天线效应。鸟苷经磷酸化后可形成鸟苷一磷酸(GMP),与其二磷酸盐和三磷酸盐类似物相比(图2-B),是一种更好的能量转移供体。致敏效率:鸟苷一磷酸(GMP)>鸟苷二磷酸(GDP)>鸟苷三磷酸(GTP)[9]。此外还有四磷酸鸟苷(ppGpp),为高度磷酸化的鸟苷酸分子,其结构与鸟嘌呤核苷酸具有高度相似性,在G 的5'位点和3'位点附着两个磷酸基团[19]。4个呈钳型分布的磷酸基团能更好的螯合Tb3+。
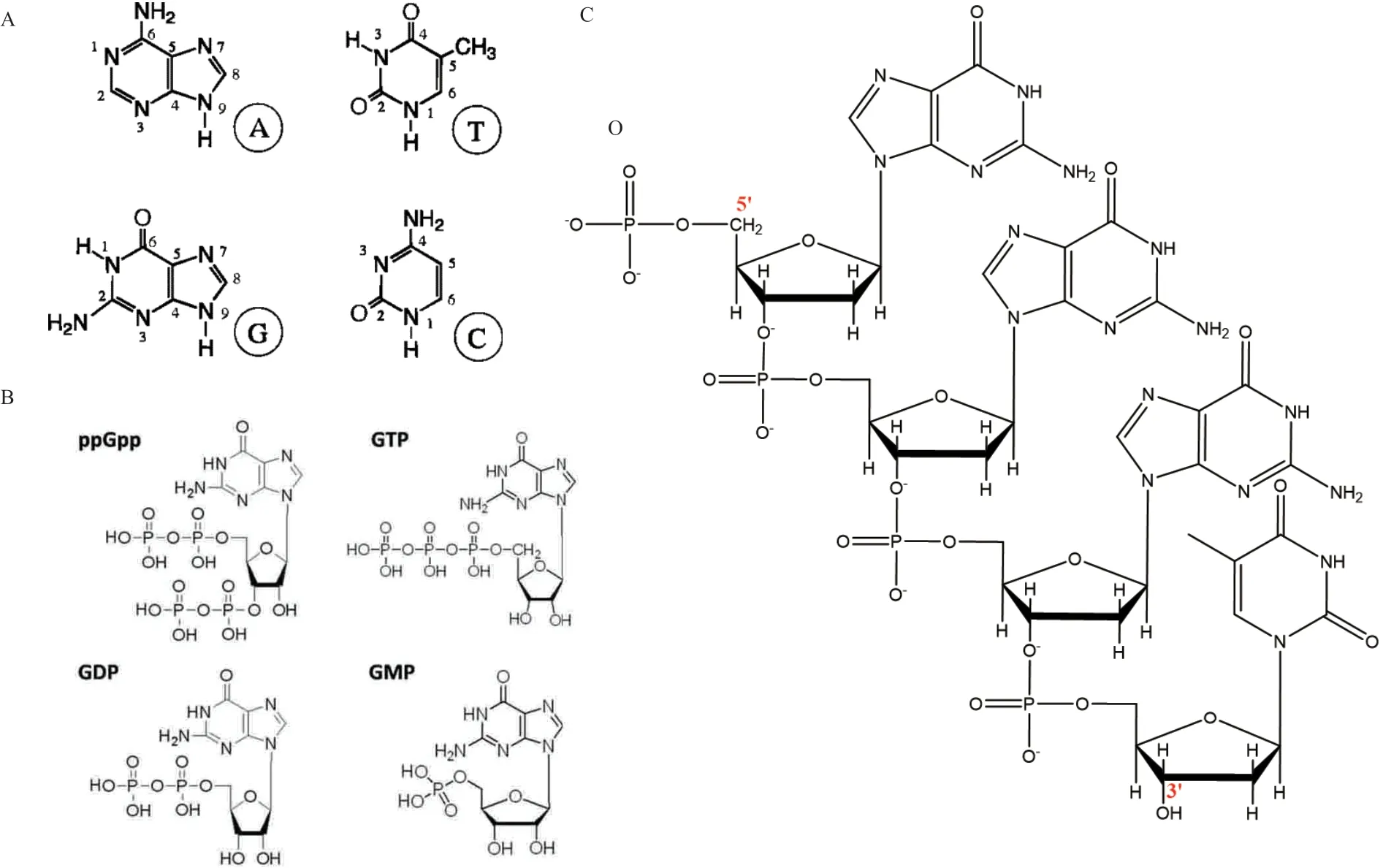
图2 结构示意图
1.5.1 Tb3+与单链DNA 对于具有特异性序列的单链DNA,如富含G 或富含GT 的单链DNA 等,都能增强Tb3+的发光强度。特别是富含G 的ssDNA 能显著增强水溶液中Tb3+的发光强度[4],如[G3T]5序列被广泛应用于敏化Tb3+发光[20-22]。[G3T]单元(图2-C),包含3 个鸟嘌呤碱基和1 个胸腺嘧啶。因为3 个G 在和Tb3+配位的情况下仍缺乏1 个与Tb3+配位的位点,而1 个T 的磷酸集团上的氧恰好能够提供1 个金属配位位点,从而能够和Tb3+配位以达到充分敏化Tb3+发光的目的。与传统的有机天线配体相比,单链DNA 不仅具有良好的水溶性,其还有着结构多样,生物相容性良好,重现性优异等特点。此外,Tb3+还可以促进具有富G 序列的ssDNA 折叠成紧凑的G-四链体,G-四链体(G-quadruplexes,G4)是由DNA 单链形成的特殊结构[23]。和钾离子(K+)、钠离子(Na+)一样,Tb3+也能稳定G4 的结构,位于G4 的中心,可形成(G4/Tb)结构,G4 也能敏化Tb3+发光。
1.5.2 Tb3+与双链DNA 包括铽在内的镧系元素对双链DNA 几乎没有稳定作用,还会使双链不稳定,双链解离之后,能暴露更多的碱基,在一定条件下有利于敏化发光过程的发生[16]。另外,双链DNA的简单检测方法通常和铽离子配合物在静态淬灭的机制下得以实现,这些配合物往往是与具有特殊结构和性质的纳米材料复合成的,如接下来将要介绍的碳点,MOFs 材料等[13,24]。此外,双链序列中如果存在单个碱基错配的碱基对,Tb3+的发光也会 增强[9-10]。
1.6 铽离子与肽
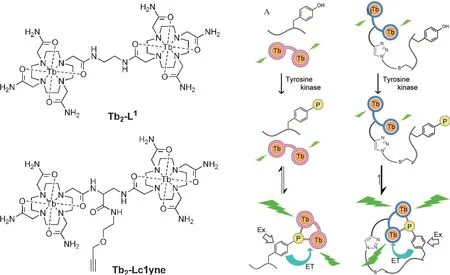
图3 两种双核铽(III)复合物结构以及两种策略(A)和(B)[25]
肽由氨基酸缩合而成,多肽可进一步折叠成蛋白质。肽可以与铽离子配合物形成发光配合物。如图3 所示,Akiba 等[25]介绍了两种双核铽(III)离子复合物。当铽(III)离子配合物与肽底物结合后,底物肽磷酸化时配位铽离子的肽被利用,铽(III)离子配合物发光信号因而改变。有两种策略,第一种策略(A),构建非共轭铽(III)复合物Tb2-L1,利用磷酸酪氨酸(phosphotyrosine,pTyr)的苯酚作为天线配体。当pTyr 的磷酸盐与Tb2-L1结合时,该酚位于Tb3+离子附近。在用紫外光照射时,苯酚吸收光的能量,并将能量转移至发射中心的Tb3+。不发生磷酸化时,该结合不会发生,因为酚基团离Tb3+距离太远无法进行有效的能量转移。第2 种策略(B),Tb3+复合物(Tb2-Lc1yne)与肽底物偶联。具体为Tb2-Lc1yne 通过点击反应与带有叠氮化合物的底物肽中半胱氨酸残基的硫醇基团实现共价偶联,这是一种更有效的分子内的反应,能够很好地克服静电排斥作用。
1.7 铽离子的复合材料
大量研究表明,利用铽(III)离子及其配合物与纳米材料复合形成的新型稀土纳米复合材料,可以充分利用彼此的功能优势,如利于纳米材料本身的发光性质加上稀土元素Tb3+优异的发光性能,经掺杂体系或表面的共价修饰、配位、包覆、吸附等不同作用方式,结合两种发光材料的优势,能提高复合物材料的发光性能,从而应用在荧光分析、生物传感的领域。稀土纳米粒子的制备方法很多:热分解法、醇盐法、沉淀法、溶胶法、溶胶-凝胶法和水热法等。所涉纳米材料包括层状材料、金属有机骨架、碳量子点、二氧化硅等。
1.7.1 与层状材料 阴离子型层状材料的层状双氢氧化物 阴离子型层状材料的层状双氢氧化物(Layered double hydroxide,LDHs)是一类层柱状化合物,具有带正电荷的金属氢氧化物层,且层间填充可交换阴离子。其具有良好的生物相容性,并且细胞毒性低,可以作为生物活性分子的载体,生物分子通过附着于表面,共沉淀或阴离子交换反应嵌入LDHs 材料中。其中层状稀土氢氧化物(Layered rare-earth hydroxide,LRHs)可以剥落成单层或若干层厚的纳米片以进一步构成各种纳米结构而被广泛研究,其通式为[RE2(OH)5(H2O)n][Am-]1/m(RE:稀土阳离子,A:阴离子)[8,26-27]。
1.7.2 与金属有机骨架 金属有机骨架(Metalorganic frameworks,MOFs),是一种有机-无机杂化材料,也称多孔配位聚合物,由金属阳离子或簇和有机配体组成[28]。其特征为兼具无机材料的刚性和有机材料的柔性,具有新颖的拓扑结构[29]。其中镧系金属有机骨架(Lanthanide metal-organic frameworks,Ln-MOFs)近年来被广泛研究[30]。以Tb-MOFs 为代表,具有发光性质并且其结构具有很强的延展性、可调节性和设计性,可设计为荧光探针,用作传感材料,且大多数基于荧光淬灭的传感机制。
1.7.3 与碳量子点 碳点(Carbon dots,CDs)是一种新兴的碳纳米材料,具有优良的光学性质、较好的生物相容性和低的细胞毒性,且容易制备。荧光碳点作为一种良好的发光材料,在生物成像、疾病诊断、化学传感和光催化等领域具有广阔的应用前景[24]。将Tb3+掺入碳点或者对碳点表面进行修饰,基于天线效应能改善其荧光特性,可扩大碳点在荧光分析和生物传感中的应用范围。
1.7.4 与二氧化硅 二氧化硅(SiO2)是一种生物相容性强、稳定性好的纳米材料,其表面易于修饰以附着生物分子。将发光体系中掺杂二氧化硅纳米粒子能够制备光稳定性更好、寿命更长、亲水性更好、尺寸更小的探针[31]。例如,通过共价交联将铽 (III)离子配合物包封到无机主体中,所获得的SiO2包覆纳米颗粒和游离的铽(III)离子相比,抗光漂白能力也更强。可以应用生物标记[32]、设计发光传感器[33]等。
1.8 铽离子及铽离子复合物相关的研究技术
利用铽(III)离子配合物独特发光性质建立有由Evangelista 等于1991 年应用的酶放大镧系发光(Enzyme-amplified lanthanide luminescence,EALL)的技术[2]。它是以酶作为标记物或者目标分析物,通过酶促反应将底物转化成的产物可以与镧系元素形成发光螯合物,并结合时间分辨或者常规的荧光方法检测产物螯合物,可用于DNA 杂交测定[34]。其中,时间分辨荧光分析法也叫时间分辨荧光免疫分 析(Time-resolved fluoroimmunoassay,TRFIA),于1979 年创建[35],是一种非放射性微量分析技术,也是一种特殊的荧光分析[2]。它是以铽粒子螯合物作为标记物,利用其较长的衰减寿命可以减少来自样品自然荧光的干扰,消除非特异性散射光。其较高的信噪比,极大提高了检测分析灵敏度,在生物分析领域应用十分广泛[31]。也有学者将时间分辨发光技术称为时间门控发光技术(Time-gated luminescence,TGL)[17-18,36],其核心在于通过设置一定的延迟时间,排除了短寿命的背景荧光造成的信号干扰之后再采集来自长寿命的荧光信号,依此将长寿命荧光与短寿命荧光区分开来。此外,还有由时间分辨荧光技术和荧光共振能量转移技术相结合的均相时间分辨荧光技术(Homogeneous timeresolved fluorescence,HTRF)[37-38],具有不需多次孵育、洗涤和分离等步骤的优势。
2 铽离子及铽离子复合物介导的生物传感器
2.1 铽离子介导的核酸生物传感器
生物传感器能在复杂样品基质中能够检测到广谱的分析物质,其高度的特异性和敏感性对于检测而言十分重要[39]。按检测靶标物质的不同,基于铽离子构建的生物传感器也具有多样性。从信号转换器的角度来看,大多数为发光生物传感器。因为铽离子的特殊发光性质,根据其发光的变化建立的传感器主要类型有“turn-on”型、“turn-off”型等。“turn-on”型即是根据靶标物质诱导的发光信号增强的原理来实施检测,“turn-off”型则是基于靶标物质引起发光信号的减弱甚至淬灭的机理。
2.1.1 铽离子介导的DNA 生物传感器 2007 年,Chen 等[32]通过反相微乳液法制备含有铽配合物的二氧化硅纳米粒子,用二氧化硅包覆的纳米铽配合物的发光强度相当于340 个游离的的铽配合物的发光强度,并且荧光寿命达到1.5 ms,可用于时间分辨荧光分析。如图4-A 所示,铽离子配合物由作为光吸收天线的基于喹诺酮的染料分子(Cs124)和基于聚氨基羧酸盐(DTPA)的螯合剂,以及镧系元素铽离子组成。其中,染料分子用于捕获激发光并通过荧光能量转移使镧系离子发光敏化,发光增强约175 000 倍(4-B)。而聚氨基羧酸盐溶解性好且与镧系元素有较高的结合常数。通过简单的偶联反应避免了传统方法合成配体的复杂环节。其后,该配合物可用于标记DNA 和另一捕获探针DNA 固定在磁性微球上,目标DNA 可以与二者互补配对从而进行DNA 夹心杂交实验,不同浓度的目标DNA 对该铽复合物具有良好的荧光响应,检测限达到 8× 10-11
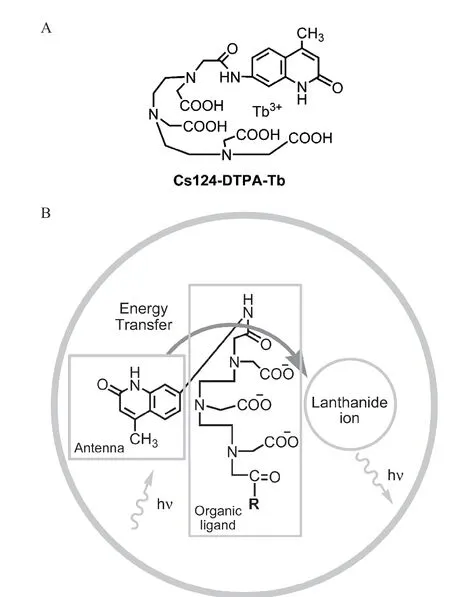
图4 Tb3 +与喹诺酮、DTPA 形成的复合以及能量转移机制原理图[32]
mol/L。从检测的灵敏度来看,该方法比荧光素染料异硫氰酸酯(FITC)溶液光谱测量提高至少100 倍。
2012 年,Wu 等[40]利用普利沙星(Prulifloxacin,PUFX)与Tb3+形成的络合物PUFX-Tb3+设计了检测鲱鱼精子DNA(hsDNA)的发光传感器,检测范围3.0×10-9- 1.0×10-6g/mL,检测限低至 2.1× 10-9g/mL。其中每个Tb3+的8 个配位点可以被PUFX的O 和溶剂中的H2O 分子的O 饱和。加入DNA 以后,PUFX-Tb3+能够嵌入堆叠的DNA 碱基对中,形成三元复合物PUFX-Tb3+-DNA,增加了复合物的刚性,并减少因为周围介质水分子的O-H 振动造成的无辐射能量损失。基于鸟嘌呤的敏化作用及分子间能量转移机制,铽离子的发光强度约10 倍。
2016 年,Soltani 等[41]构建了基于铽-达氟沙星(Tb3+-Dano)复合物的荧光探针,用以测定小牛胸腺DNA(Calf thymus DNA,ctDNA),检测限为8 ng/mL。Tb3+-Dano 具有良好的水溶性和稳定性。当加入ctDNA 时,Tb3+-Dano 系统的荧光强度大大增强。该荧光探针用于测定纳克级的ctDNA。
2018 年,Liu 等[24]通过水热法制备掺杂有铽(III)的碳点(Tb-CD)(图5)。所得Tb-CD 的粒径小(3 nm)而均匀,荧光性能良好,能够光致发光并且具有优异的水分散性。Tb-CD 具有许多功能性极性基团,主要是-COOH、-OH 和-NH2,因而可以使Tb-CD 在水溶液中保持稳定。其官能团与双链ctDNA 具有强烈的相互作用,能导致荧光淬灭。通过计算结合常数和热力学常数证明了该淬灭机制为静态淬灭。基于该系统荧光信号的相对变化,建立了一种测定双链ctDNA 的荧光淬灭方法,检测限为53 ng/mL。
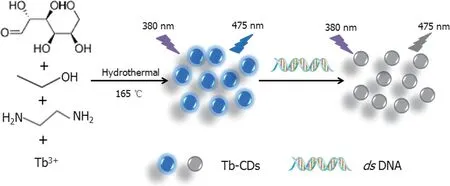
图5 Tb-CDS 检测双链ctDNA 的原理图[24]
2015 年,Jiang 等[20]基于最优天线配体[G3T]5敏化Tb3+发光的原理设计了一种检测目标DNA 的传感器(图6)。通过识别信号放大和降低背景两种方式来提高DNA/ Tb3+生物体系的检测灵敏度。其中核酸信号放大策略为自催化多循环放大技术,它包括核酸外切酶(III)和Zn2+依赖性8-17 型DNAzyme(DNA 切割核酶)辅助的目标循环放大过程,而信号背景的降低是通过引入Fe3O4磁纳米粒子,经磁分离步骤能成功地将信号分子从复杂样品溶液中分离出来,最终获得纯[G3T]5序列,避免了非特异性敏化从而降低背景值,并且还提高了该实验的重复性和稳定性。
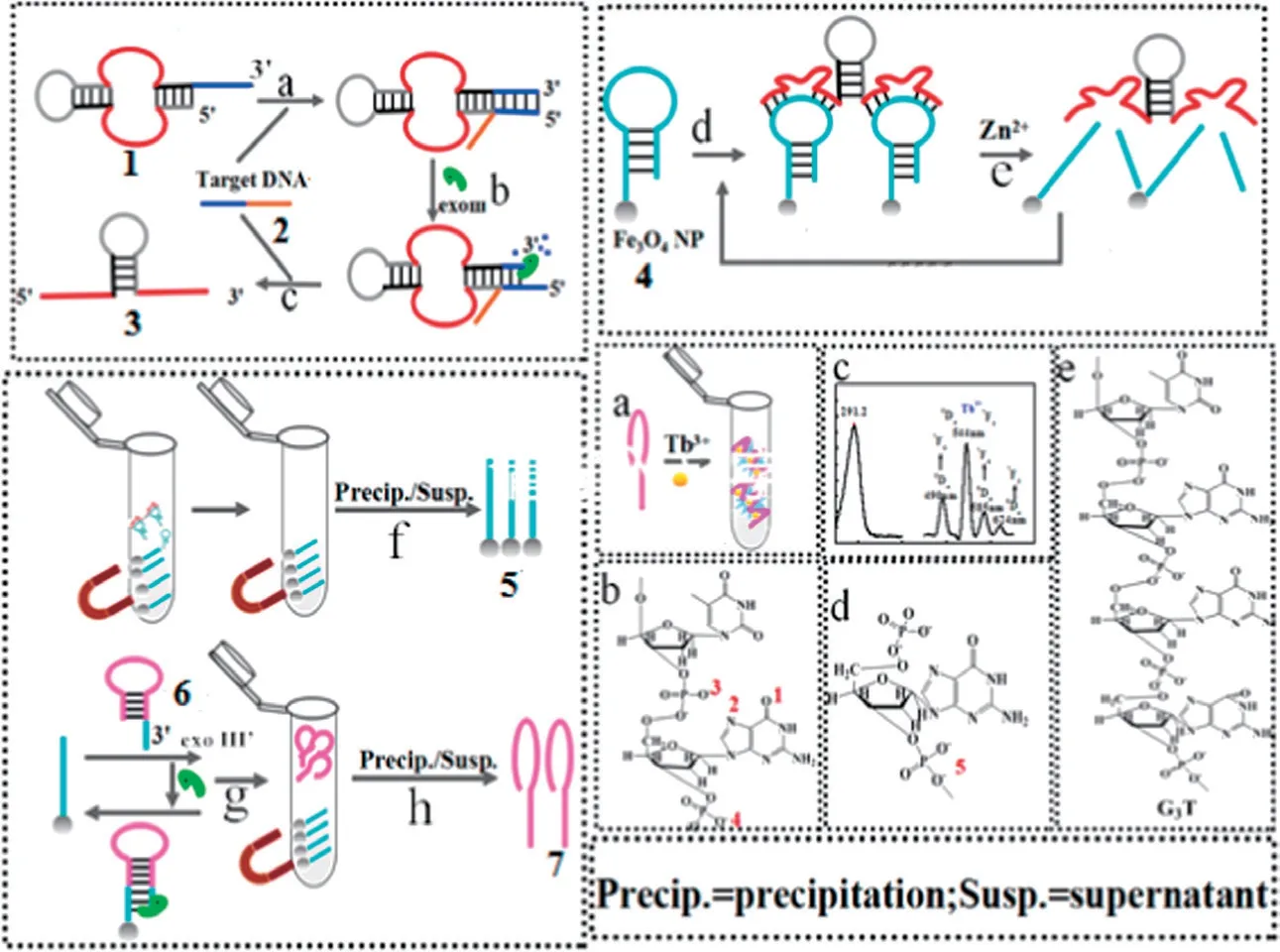
图6 [G3T]5 敏化Tb3+发光检测目标DNA 原理图[20]
2.1.2 铽离子介导的microRNA 传感器 2015 年,Zhang 等[42]利用了单链致敏的Tb3+的独特荧光特性,基于双特异性核酸酶辅助(Duplex-specific nuclease,DSN)靶循环可无标记检测肿瘤标志物microRNA-21,检测限低至8 fM。如图7-A 所示,设计的捕获探针由两部分组成,一部分是可与microRNA-21 结合的部分固定在磁珠上,能够形成DNA-RNA 异源双链;另一部分则为信号放大部分。DSN 能够对DNA-RNA 杂交体中的DNA 进行切割,能水解捕获探针上与靶结合的部分,从而释放microRNA-21,其后与新的捕获探针杂交,进入循环过程。通过磁分离得到捕获探针的信号输出部分,放大由发光增强的Tb3+产生的荧光信号。
2018 年,Chi 等[14]构建了基于G-四链体敏化发光Tb3+的发光探针,用于microRNA-21 的发光传感检测,检测限低至0.108 pM。该方法能区分microRNA 其他的家族成员,且在癌细胞提取物中也能发挥作用。此外,通过改变相应的DNA 探针还可以应用于其他microRNA 或适配体的检测。其原理如图7-B 所示,microRNA 存在时,其作为引发聚合反应的触发子,借助末端脱氧核苷酸转移酶的核苷酸底物特异性,催化鸟嘌呤形成富含G 的核苷酸序列。在核苷酸底物的组合为60%的dGTP 和40%的dATP 时,Tb3+促进富含G 的核苷酸序列进一步形成G-四链体,并且Tb3+被包封在四链体核的中心腔中,鸟嘌呤通过能量转移增强Tb3+的发光。
2.2 铽离子介导的金属离子传感器
2015 年,Chen 等[43]建立了一种由硫磺素T(Thioflavin T,ThT)和铽离子介导的检测Tb3+的荧光生物传感器(图8)。水溶性ThT 是一种G-四链体的特异性染料,对G-四链体结构有明显的选择性,能诱导G-四链体产生稳定的发光。在ThT 和钾离子存在的体系中,DNA 折叠形成平行G-四链体,能够稳定G-四链体结构,彼此之间具有强相互作用,使得荧光强度增强。在引入铽离子后,铽离子竞争结合G-四链体导致其构象的改变,释放了G-四链体上的ThT,从而引起ThT 发射荧光强度的减弱,根据荧光信号的变化从而超痕量检测Tb3+,Tb3+浓度与荧光强度呈现良好的线性关系,检测范围在1.0 pmol/L-10.0 μmol/L,检测限为0.55 pmol/L。
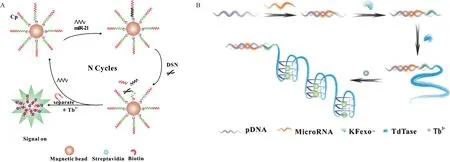
图7 两种铽介导的microRNA-21 传感器原理图[14,42]
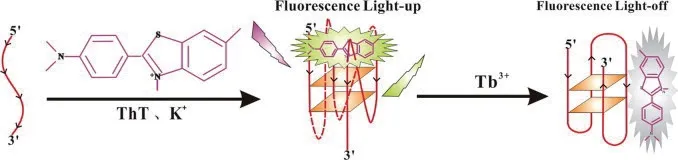
图8 ThT 和Tb3+介导的检测Tb3+传感器原理图[43]
2016 年,Pal 等[44]设计了一种新的基于Tb3+的3D多孔MOF(Porous metal organic frameworks,PMOF),通过在紫外光下观察到的荧光猝灭,选择性地和可逆地感测二甲基甲酰胺(Dimethilformamide,DMF)悬浮液中的 Fe3+。检测原理基于激发能量的竞争吸收机制。2018 年,Wang 等[29]提出的新型发光Tb-MOF,通过将三唑单元锚定在其骨架上,改善了其发光传感特性,提高传感性能,能同时检测Fe3+、Cr2O72-、CrO42-和MnO4-等重金属离子。2018 年,Xue 等[17]利用DNA 致敏的Tb(DNA/Tb)作为无标记、多功能的“化学鼻/舌”,结合时间门控发光检测技术,开发了基于发光寿命的传感器。该团队筛选出一系列富含鸟嘌呤/胸腺嘧啶(G/T)的DNA 配体,最终得到3 种DNA/Tb 传感器,来检测49 种金属离子包括碱金属离子,碱土金属离子,过渡/后过渡金属离子和镧系元素离子。简言之,3种配体能够调节天线效应,对广泛的金属离子产生强烈不同的铽发光响应。利用时域来区分长寿命发光和短寿命发光。
2.3 铽离子介导的蛋白质传感器
Tb3+配合物与肽结合能检测特定的蛋白质,如细胞周期蛋白A。1、4、7 和10-四氮杂环十二烷-1,4,7,10-四羧酸(简称DOTA)是一种有机多齿配体,其与铽离子的配合物如图9-A 所示。Pazos 等[45]设计了一种能够与细胞周期蛋白A 特异性结合的肽,将掺入的铽离子螯合大环DOTA(DOTA[Tb3+]复合物)引入肽支架中(图9-B)。铽螯合八肽与细胞周期蛋白A 的结合沟(Cyclin binding groove,CBG)相互作用,使得掺入细胞周期蛋白结合态的铽离子距离色氨酸(Tryptophan,Trp)不超过15-20Å,Trp(217)能够用作天线,能够敏化铽离子,通过分子间敏化引起能量转移,因此能够构建检测细胞周期蛋白A 的荧光传感器,检出限约为30 μg/mL。
2.4 铽离子介导的酶活性传感器
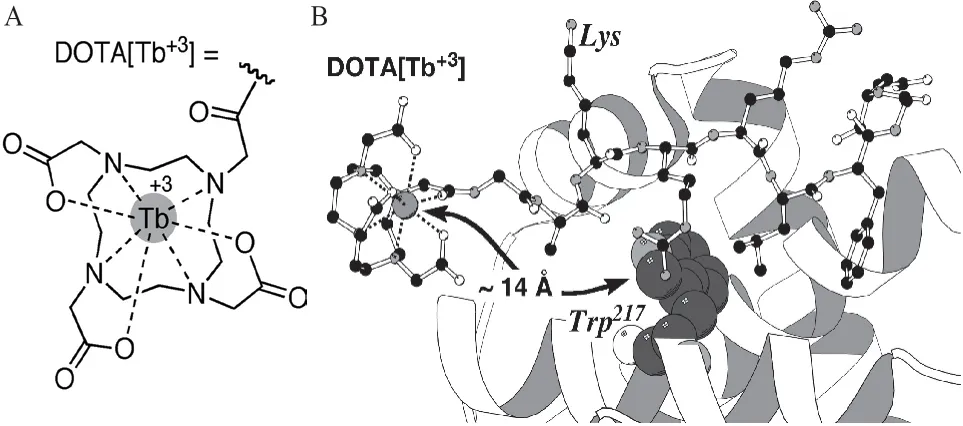
图9 铽离子介导的蛋白质传感器[45]
2014 年,Akiba 等[25]基于铽(III)配合物能与肽底物结合,底物肽发生磷酸化时,即将一个磷酸基团加到蛋白质时,与铽离子发生配位作用,肽与铽离子配合物形成发光配合物作为信号输出基团会因此发生改变。利用这一机制,可实时监测酪氨酸磷酸化。蛋白质磷酸化与去磷酸化是生物体中重要的调节机制,能够介导细胞内信号转导,其与许多疾病密切相关。
前面所提的第一种策略非共轭铽(III)复合物Tb2-L1虽能确保了最小的背景信号,但是Tb2-L1与底物肽之间的作用属于静电吸引作用而不是配位作用。当底物肽带正电荷时,该分子间的缔合无法进行,检测信号非常弱。而第2 种策略Tb3+复合物(Tb2-Lc1yne)与肽底物偶联,这作为一种更有效的分子内的反应,能够很好地克服静电排斥作用。在实时监测酪氨酸磷酸化时,基于时间分辨光谱法,能够进行详细的定量分析,灵敏度和信噪比更高。
2018 年,Han 等[46]基于时间分辨发光技术(TRL)开发了一种无标记生物传感器,用于乙酰化介导的肽/DNA 相互作用和Tb3+/DNA 发光探针分别连续检测组蛋白乙酰转移酶(HAT)和组蛋白去乙酰化酶(HDAC)的酶活性。其原理为富含鸟嘌呤(G)的ssDNA 敏化的Tb3+发光作为输出信号,聚阳离子底物肽以高亲和力与DNA 相互作用,随后取代Tb3+消除发光信号,以此反映HAT 或者HDAC 的酶活性。检测HAT 的线性范围为0.2-100 nmol/L,检测限为0.05 nmol/L;连续监测HDAC 催化的脱乙酰化,线性范围为0.5-500 nmol/L,检测限为0.5nmol/L。
2.5 铽离子介导的其他小分子传感器
2.5.1 铽离子与碳量子点相结合介导的传感器
2.5.1.1 铽离子与碳量子点相结合介导ATP 传感器 2016 年,Xu 等[47]先以含多羧基的葡萄糖为碳源,与钝化颗粒合成的碳点(CDs)。再用微波的方法,将氯化铽水溶液中的三价铽离子通过与羧基配合化学组装到碳点上形成Tb-CDs,形成具有强荧光强度的铽离子能官能化碳点,并结合金纳米粒子(Gold nanoparticles,AuNP),随之构建了AuNP-Tb-CD 荧光适配体平台以用于测定靶ATP(图10-A)。其检测基本原理为,当不存在ATP 时,即便有ATP 适配体存在的情况下,金纳米颗粒倾向于在高盐状态下聚集,而在该体系中引入靶ATP 时,ATP 和适配体形成适配体-ATP 复合物抑制了金纳米粒子的聚集,分散的金纳米粒子通过荧光共振能量转移(FRET)能有效淬灭荧光信号,从而构建一种基于荧光淬灭机制的检测方法。

图10 铽离子与碳量子点相结合介导的传感器
2.5.1.2 铽离子与碳量子点相结合介导ppGpp 传感器 ppGpp 为高度磷酸化的鸟苷酸分子,在基因表达中发挥着重要作用。2018 年,Chen 等[19]通过两个步骤来制备铽修饰的荧光CD(CDs-Tb),首先通过水热法制备发蓝光的CDs,然后在CDs 的表面铽离子与羧基和氨基基团配合形成CDs-Tb(图10-B)。ppGpp 存在时,ppGpp 含有4 个磷酸基团,能提供与铽离子配位位点,并且其类似于钳状的结构能够螯合铽离子,产生天线效应,从而提高了铽离子的发光强度。并且一般的核苷酸如GDP、GMP 等对CDs-Tb 的荧光发射几乎没有影响,在复杂样品中具有高选择性。Tb-CDs 因为在水溶液中的荧光发射峰保持不变可作 内置参考信号,Tb3+结合ppGpp 后表现出的增强的荧光发射信号作为荧光响应信号。该团队利用Tb3+的天线效应和CD 的特异识别能力的协同效应,构建了一种铽修饰碳点(CDs-Tb)的荧光比率探针,高灵敏度、高选择性检测ppGpp,检测限低至50 nmol/L。这种比率型荧光探针的优势体现在既可以保留CDs 的固有荧光还能保持CDs 自身与Tb3+配位的能力,避免了背景荧光的干扰,提高了检测灵敏度。该团队还因此构建了基于CDs-Tb 的纸张传感器用于ppGpp 的可视化检测。
2.5.2 铽离子与SiO2相结合介导的葡萄糖传感器 2018 年,Yu 等[33]利用溶胶-凝胶方法合成表面改性的SiO2纳米粒子,制备了以铽为中心的杂化-有机无机材料,纳米晶体的平均直径为40 nm,进而建立了基于镧系杂化网络的葡萄糖传感器,葡萄糖的检测限为3.4 μmol/L。在溶胶-凝胶基质中将戊二酸酐引入获得羧酸酯基团,能与中心金属离子Tb3+配位,和2-羧基苯基硼酸(配位配体)均被包封,建立了新的混合结构。其光致发光的结果表明了该材料能够提高Tb3+在水溶液中的发光性能,有强烈的绿色发光。而且提高了该复合材料热稳定性,Si-O 共价相互作用的强大联系可以增强纳米结构,分解温度提高,还具有传感可重用性。
2.5.3 铽离子与吡啶二羧酸配合介导的传感器 吡啶二羧酸(Dipicolinic acid,DPA)又称喹啉酸,大量存在于细菌的芽孢中[48]。吡啶二羧酸阴离子作为通用成分,能敏化Tb3+,形成强烈的发光螯合物[49]。而且吡啶二羧酸阴离子与Tb3+形成的螯合物比与Eu3+形成的螯合物更稳定,发出的信号更强[12]。
1997 年,Rosen 等[50]发现Tb3+和孢子壳中的吡啶二羧酸钙反应形成哌啶甲酸铽(III)螯合物。基于Tb3+光致发光的原理,该复合物产生强烈且独特的光致发光光谱,提高了Tb3+单独存在时的光致发光强度,初步构建了一种检测细菌孢子的方法。
2017 年,Wang 等[51]在时间分辨荧光检测技术的基础上,建立了一种新型双镧系元素(铽和铕)时间分辨的荧光比率型探针。将构建好的Tb/DPA@SiO2封装到自组装Eu/GMP 配位聚合物(CPs)的网络结构中,形成Tb/DPA@SiO2-Eu/GMP 配合物用以检测炭疽中DPA 的浓度。如图11 所示,其原理为Tb/DPA@SiO2基于DPA 的敏化作用可以发出强烈绿色荧光,在DPA 存在下,通过排除Eu/GMP CPs 中的水,形成Tb/DPA@SiO2-Eu/GMP/DPA 能显著增强Eu 的红色荧光。其中Tb/DPA@SiO2用作稳定的参考信号,Eu/GMP CPs 用作敏感响应信号。除了检测DPA,Tb3+与DPA 形成的络合物还可以应用于常规分析某些化合物,例如多巴胺,它在中枢和外周神经系统中起重要作用。2012年,Wabaidur 等[52]使用二元铽络合物Tb3+-DPA 的荧光增强实现了多巴胺的荧光测定,检测限和定量限分别为1.2×10-8mol/L 和4.1×10-8mol/L。此外,2,6-吡啶二羧酸及其衍生物还可以结合EALL 和时间分辩荧光分析技术用于评价酯酶的选择性和灵敏 检测[53]。
2.5.4 铽离子与银离子介导的发光传感器 通过引入金属离子例如银离子(Ag+),与Tb3+竞争结合G-四链体,以一种竞争结合机制,根据靶标诱导G4/Tb 复合物的发光变化,可用于可视化传感检测。Ag+通过与G 的O6 和N7 配位破坏G-四链体结构,抑制Tb/G4-血红素DNA 酶的过氧化物酶样活性。2016 年,Tang 等[54]开发了一种检测硫化氢(H2S)的比色传感器。H2S 存在时,能够竞争性结合Ag+,生成更稳定的Ag2S 沉淀,Tb/G4-血红素DNA 酶的过氧化物酶样活性得以恢复。而由Tb3+促进的Tb/G4-血红素DNA 酶的活性,比常用钾离子(K+)和钠离子(Na+)促进的G4-血红素DNA 酶活性更高,可以催化H2O2氧化,使ABTS 生成有色产物ABTS·+。同样由Ag+介导的破坏G4/Tb 结构,Ag+与Tb3+竞争结合G-四链体上的G,Ag+通过与G 的O6 和N7 配位增加了鸟嘌呤碱基的刚性,改变了鸟嘌呤的激发态,引起能量从核碱基到Tb3+更有效的转移[10],银离子的加入起到了荧光增强的效应。
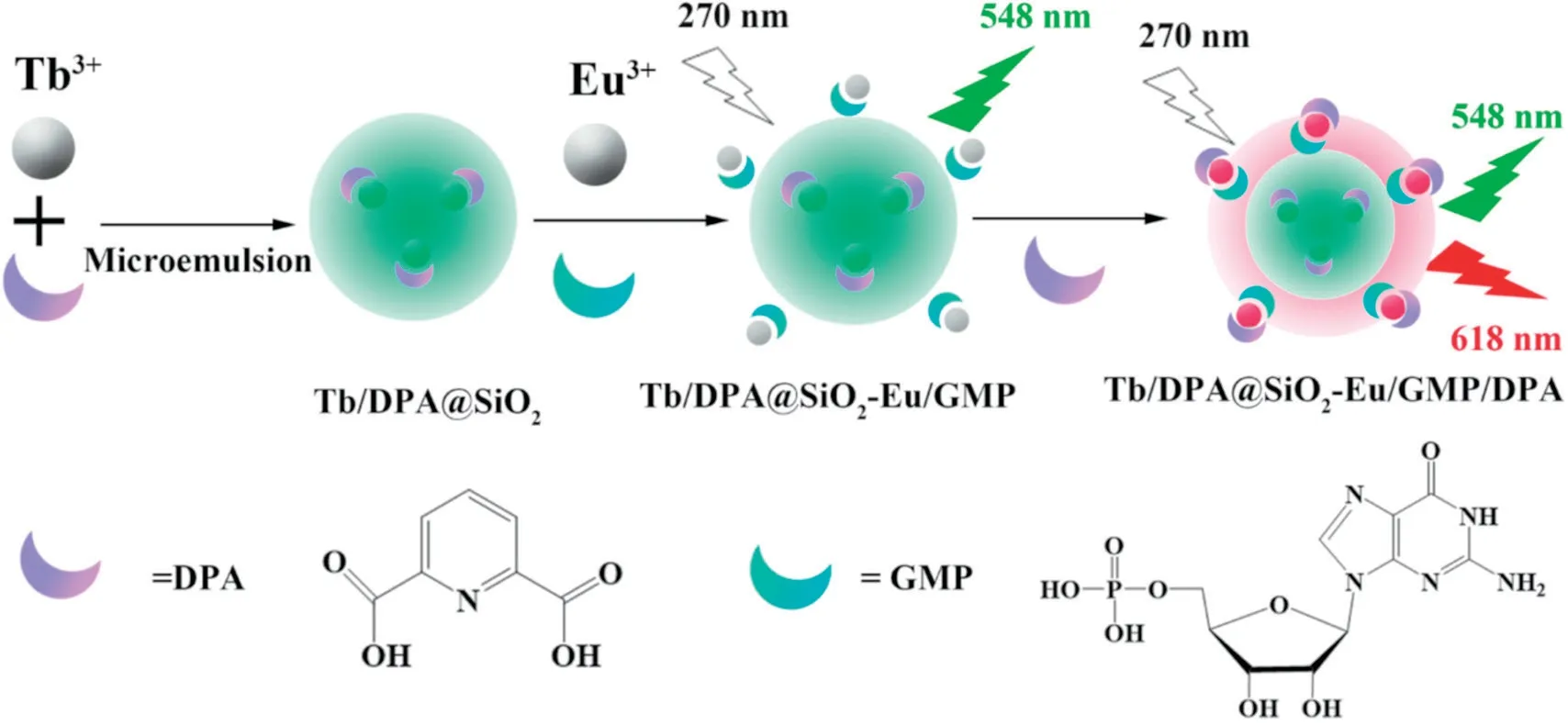
图11 基于Tb/DPA@SiO2-Eu/GMP 复合物的DPA 检测荧光探针的示意图[51]
2014 年,Zhang 等[21]利用最优单链[G3T]5序列作为Tb3+的天线配体,使Tb3+的发光效率提高3 个数量级。如图12 所示,通过Ag+和Cys 介导其可逆发光变化设计了一种逻辑门和过氧化氢的传感器。c[G3T]5序列是一条与[G3T]5序列互补配对的富C 序列,二者形成杂交链。银离子因为能够形成更为稳定的C-Ag+-C 的复合结构将双链[G3T]5/c[G3T]5打开,使得[G3T]5序列释放从而敏化Tb3+发光,而Cys 的加入则能竞争结合Ag+从而破坏C-Ag+-C,使得c[G3T]5重新与[G3T]5杂交,发光系统则恢复“关闭”状态。又因为过氧化氢能将半胱氨酸氧化成胱氨酸,从而逆转了半胱氨酸介导的发光降低现象。基于Tb3+-DNA 的发光探针以及Tb3+、Ag+、[G3T]5/ c[G3T]5的传感系统,设计了一种“turn-on”型的过氧化氢发光传感器。
综上所述,基于天线效应的基本原理和靶标诱导发光信号值的变化,由铽离子及其复合物介导的生物传感器涵盖从生物大分子核酸、蛋白质到各种小分子靶标物质的检测,涉及领域从食品安全到环境监测。与镧系元素独有的时间分辨荧光的检测手段相结合,其检测不仅具有高选择性,和传统的方法相比,在灵敏度方面也有很大的提升,检测限可低至皮摩级别。但是其大多数属于基于液相以及体外的检测方法,对于需要在生物体内进行检测的靶标物质还有极大研究空间,尤其是对其毒性的研究。此外,由于检测时需要依靠固定仪器设备的使用,在实际应用方面有一定的局限性。其具体产品的开发方面还有很大的发展空间。例如,便携式检测仪,商业化的试剂盒以及试纸条等对于实现对目标物质的快速、灵敏、原位检测具有十分重要的意义
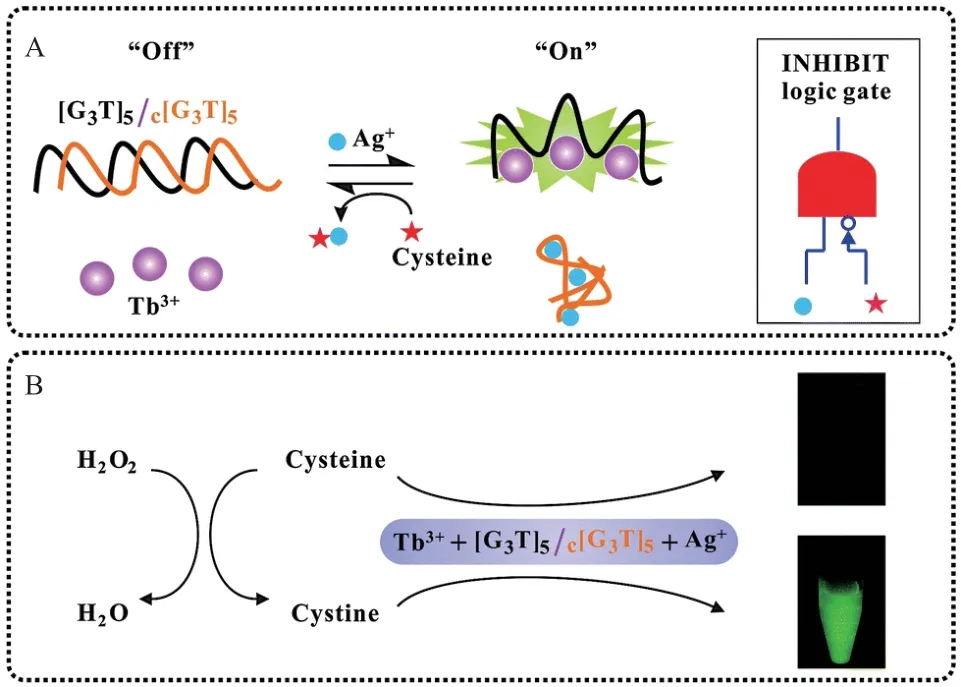
图12 由Ag+和半胱氨酸调节的Tb3+发光传感器原理图[21]
3 在药物递送、细胞成像、癌症诊断及治疗方面的应用
3.1 在药物递送过程中的潜在应用
游离的Ln3+在pH 约为9 时,容易形成氢氧化物,在生物系统中显示出一定的毒性。镧系元素在和合适的配体进行配合之后形成的镧系复合物能够适当地降低毒性。2017 年,Ju 等[6]通过水热法合成NO3
-型LTbH(NO3-LTbH),通过阴离子交换法将阿司匹林(缩写ASA)插入层状氢氧化铽(LTbH)中,形成一种新型的复合材料,显著增强了Tb3+的发光。因为ASA 阴离子和Tb3+中心之间能进行有效的能量转移。该复合材料用来检测ASA,复合材料的热稳定性高。用磺酰罗丹明B(Sulforhodamine B,SRB)比色法观察到细胞毒性低,还能在一定的缓冲体系中进行ASA 药物持续释放,对药物有明显的缓释作用,可维持约36 h。对于半衰期短的阿司匹林而言,有利于延长该治疗剂的持续时间。因而在生物系统检测和药物递送领域都有着潜在的应用。
3.2 在细胞成像方面的应用
细胞成像技术对于医学研究具有重要意义,细胞内微小的变化便能引起细胞功能障碍。用高量子产率的荧光团制备荧光探针,能够实现对细胞内活性物质如核酸、蛋白质、阴阳离子、小分子物质的实时原位监测,在细胞成像技术中具有重要地位[55]。基于镧系络合物优异的光谱特征,镧系元素络合物还可用来研究多重成像和多光子显微镜的生物探针的制备。Tb3+构建的探针可长期用于细胞过程的多光子成像,细胞摄取能力良好,能消除细胞培养基中光散射的干扰和生物分子的自发荧光,容易储存,并且可以光降解。这些特点使得其特别适用于信号转导,癌细胞分裂过程中的胞质分裂,抗体缀合和光漂白后荧光恢复的研究[56]。
3.2.1 Tb 构建的探针用于生物硫醇的分子成像 Zhou 等[57]设计并合成了一种新型的基于铽发光杂化无机/有机探针,用于生物硫醇的分子成像。分散在水中的介孔二氧化硅纳米球用作共价连接的含镧系元素有机结构的合适主体。镧系元素结构与磺酸酯单元连接,该磺酸酯单元在生物硫醇存在下被裂解以产生铽发射。不仅如此,该智能探针可渗透细胞膜,在人胚肾细胞和人肺腺癌细胞中存在半胱氨酸和谷胱甘肽时选择性地发光,并且能定量检测,得到生物硫醇的检测限。其中半胱氨酸为36.8 nmol/L,谷胱甘肽为32.5 nmol/L,同型半胱氨酸为
34.7 nmol/L。
3.2.2 Tb 构建的探针用于癌细胞成像及治疗 Bui 等[58]使用时间采样寿命成像显微镜技术固定T24癌细胞,能观察在单光子或双光子激发下镧系元素离子的毫秒级发光寿命成像,以检测细胞内黏度的空间和时间变化。该团队通过设计对黏度敏感的发光铽配合物用以探测胞内环境。该方法独创性在于依靠黏度引起发光寿命的变化,构建了直接测量细胞内黏度的荧光探针,可在所研究的复合物的黏性介质中观察到量子产率和发光寿命均增加4 倍,黏度在较宽范围(0.6-1 200 cP)内的寿命为0.23-0.89 ms,达豪秒级,与迄今为止其他已知分子相比具有明显优势。大量研究表明DTPA 或DOTA 的水溶性Eu(III)和Tb(III)双镧系螯合物制作的生物探针具有高灵敏度,还有高抗氧化活性。例如,与小牛胸腺DNA 相互作用,可以作为癌症细胞的细胞成像探针[5]。2016 年,Dasari 等[59]利用双光敏化的稳定的Eu(III)和Tb(III)复合物,用以生物成像和光响应性治疗剂。光响应治疗剂在癌症的治疗过程中,能够实现对药物的输送和时间控制。该团队使用共聚焦荧光显微技术观察癌细胞HeLa,MCR-7 和H460 癌细胞,发现该复合探针可定位细胞质和细胞核。并且在光照射下产生活性氧导致光细胞毒性使得细胞凋亡。这种有效的光致DNA 裂解十分适合于癌细胞的诊断光疗,有着成为治疗癌症药物分子的可能性。
一般而言,许多药物分子与DNA 的相互作用可能存在沟槽结合和嵌插两种作用方式。并且部分嵌入剂可以针对性地应用于治疗乳腺癌或血癌等癌症[5]。镧系金属离子、镧系金属离子配合物其与DNA 发生作用可能属于嵌插作用,能够选择性地嵌入到核碱基对中。而有的研究通过研究DNA 黏度表明其与DNA 的作用模式并非嵌插作用而是沟槽结合[13]。因此,如果镧系配合物作为药物分子裂解DNA 以诱导肿瘤细胞的凋亡,其具体结合机制有待进一步研究,但毫无疑问其成为抗肿瘤新药物的潜在性。
4 总结与展望
近些年研究者们对于铽(III)离子配合物的研究工作多基于光致发光的原理,充分利用其优良的光学特性,构建发光探针及发光传感器,可以检测包括核酸、蛋白质、金属离子、小分子等各种靶标物质,在生物传感器的领域应用广阔。但是关于其能量转移的机制以及供体与受体的相互作用十分复杂,有待进一步研究。铽(III)离子及其配合物与各种纳米材料的结合形成的复合物具有多样化的合成及表征形式,可获得出色的复合材料。充分结合二者的优势往往可以改善其性质,特别是其发光性质,可应用在染料、发光材料以及光功能材料、光学传感等领域。例如,铽(III)离子、荧光碳量子点的相结合形成的新型发光材料,可应用于活细胞的多色成像,并且细胞毒性低;还有铽金属有机凝胶,这种新型凝胶纳米材料应用于电化学发光领域,可作为电化学发射极的潜在材料。相比于基于光致发光的研究,其在电化学发光领域的研究还处于起步阶段,具有一定的研究潜力与应用价值。
铽(III)离子配合物的研究还有利于医学和生物学的发展。铽(III)离子与层状材料形成的层状氢氧化铽可用于药物递送,并且氢氧化铽纳米颗粒还有促血管生成的特性,能增强伤口的愈合,对于心血管疾病的治疗策略有待进一步研发。但值得注意的是,虽然目前的研究表明层状氢氧化铽是可以逐渐降解的,但单独的铽(III)离子暴露在消化道中,具有一定细胞毒性。铽(III)离子在体内靶器官为肝、肺和脾。对其在药物载体的应用方面需要进行更详细的安全性评估。此外,虽然研究多集中在LRHs的阴离子交换方面,但是其还能将中性络合物原位插入LRHs 结构中,再将铽离子配合物接枝在剥落的纳米薄片上,如构建高灵敏度、实时的光学温度传感器[8],揭示了铽离子复合物在光学传感方面的更加广阔的发展前途。在生物成像方面,在荧光染料选择上,相比于传统的有机荧光染料,有机镧系元素材料不仅光稳定性高,水溶性良好,还具有在纳秒范围内的短寿命激发态的特点。这种经修饰后的复合物具有高三光子截面和低细胞毒性,在体外活细胞成像中显示出多光子诱导的f-f 发射,可多重成像。这对于细胞的多重成像和多光子显微镜探针的制备具有一定的指导意义。
在癌症治疗及诊断方面,由于DNA 作为大多数抗癌治疗的靶分子,包含铽(III)离子在内的镧系配合物与DNA 的结合,其作为抗肿瘤药物的潜在试剂,对于肿瘤细胞的选择性,其疗效、以及是否有副作用,是开发新型药物分子的基础,对于靶向抗癌药物的开发具有十分重要的研究意义,同时对于在生物体治疗疾病的本质也有着深远意义。
