快速蒸馏-离子色谱法测定干红葡萄酒中的亚硫酸盐含量
2020-05-12郭晓艳苏远科王志宏
郭晓艳,罗 晓,苏远科,王志宏*
(中华人民共和国龙口海关,山东 龙口 265700)
干红葡萄酒是一种以葡萄为原料的发酵酒,因其特有的功效和营养价值,深受消费者的喜爱。存在于葡萄酒中的亚硫酸盐主要分为两类:天然的和人工添加的。葡萄酒在发酵过程中会自然产生亚硫酸盐,这种自然形成的亚硫酸盐含量不足以起到保鲜的作用。为了防止葡萄酒被氧化,很多酿酒师会在酒中添加二氧化硫以起到杀菌、促进发酵的作用。因此,葡萄酒中都会有不同含量水平的二氧化硫残留[1](二氧化硫残留量是亚硫酸盐在食品中存在的计量形式)。国家标准GB2760—2014《食品安全国家标准食品添加剂使用标准》[2]中规定了二氧化硫在葡萄酒中的最大使用量为0.25 g/L(甜型葡萄酒系列产品最大使用量为0.4 g/L,最大使用量以二氧化硫残留量计),残留量过高时就会对人体健康造成严重威胁[3-4]。因此,测定二氧化硫残留量成为检验葡萄酒安全性的一项重要内容[5]。
检测葡萄酒中二氧化硫残留量常用方法有:盐酸副玫瑰苯胺比色法[6]、直接滴定法[7]、蒸馏-碘量滴定法[8]。对于本身有红色等深颜色样品来说,盐酸副玫瑰苯胺比色法会产生无法扣除的干扰,而且实验过程中要使用四氯汞钠和苯胺等有毒试剂,会危害到实验人员的健康,造成环境污染[9]。目前,国家标准中已将该法取消,只保留了蒸馏-碘量滴定法。直接滴定法操作简单,但也因干红葡萄酒的深红色影响了滴定终点的判断导致测定结果不准确[10]。蒸馏-碘量滴定法以蒸馏作为前处理手段,可以消除颜色的干扰,但是该方法蒸馏时间较长,不适合大量样品的快速检测。近几年来,离子色谱法因其快速、灵敏、稳定等优点被广泛应用于食品中二氧化硫残留量的测定[11-14]。其中,行业标准SN/T 2918—2011《出口食品中亚硫酸盐的检测方法离子色谱法》[15]使用离子色谱法测定啤酒中的亚硫酸盐含量,但该标准并未涉及到干红葡萄酒中亚硫酸盐的测定。
综上,本研究将蒸馏的前处理技术和离子色谱法相结合,采用微量蒸馏仪进行快速蒸馏后上机检测,既消除了杂质的干扰,又提高了日常检测效率。
1 材料与方法
1.1 材料与试剂
实验用干红葡萄酒:市售。无水亚硫酸钠、无水碳酸氢钠(优级纯):天津市光复精细化工研究所;无水碳酸钠(基准试剂):天津市科密欧化学试剂开发中心;氢氧化钠(优级纯):山海工学团实验二厂(进口分装);乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(分析纯):天津市天河化学试剂厂;碘标准溶液(0.100 4 mol/L):坛墨质检标准物质中心;硫代硫酸钠(分析纯):天津市鑫铂特化工有限公司;淀粉(分析纯):天津市风船化学试剂科技有限公司;水中亚硫酸根标准溶液(1 000 mg/L):坛墨质检标准物质中心;甲醛(37%~40%):国药集团化学试剂有限公司;浓盐酸、浓硫酸(优级纯):天津东方化工厂;超纯水:由MILLIPORE超纯水系统制得。
1.2 仪器与设备
881CompactICpro离子色谱仪(配备858型自动进样器、色谱工作站、电导检测器、保护柱Metrosep RP 2 Guard):瑞士万通有限公司;SH-AC-18型阴离子色谱柱(250 mm×4.6 mm):青岛盛翰色谱技术有限公司;XP205DR电子分析天平:瑞士梅特勒公司;K-355微量蒸馏仪:瑞士步琦有限公司。
1.3 方法
1.3.1 样品前处理
准确吸取干红葡萄酒10.0 mL于蒸馏管中,加入50 mL水,10 mL盐酸(1∶1,V/V),连接微量蒸馏仪,微量蒸馏仪接收管插入预先装有20 mL浓度为1.0 mol/L NaOH溶液的200 mL容量瓶中,开启微量蒸馏仪15 min后,取下容量瓶,用超纯水定容至刻度。吸取一定量的吸收液经0.45 μm水系滤膜过滤后,由离子色谱仪测定,外标法定量。
1.3.2 标准溶液的制备标准曲线的绘制
按照SN/T 2918—2011《出口食品中亚硫酸盐的检测方法离子色谱法》[15]附录A中方法测定亚硫酸钠的纯度。称取一定量亚硫酸钠(经纯度计算亚硫酸钠实际含量为0.196 9 g),置于50 mL烧杯中溶解,并吸取2.0 mL甲醛于容量瓶中,将溶解后的亚硫酸钠溶液转移至100 mL容量瓶中并用纯水定容至刻度,此溶液即为质量浓度1 000 mg/L(以二氧化硫计)的标准储备液。准确吸取该储备液10.0 mL,加入2.0mL甲醛,用纯水定容至100 mL,此溶液即为100mg/L(以二氧化硫计)的中间液。准确吸取该中间液1.00 mL、2.00 mL、5.00 mL、10.0 mL、20.0 mL及储备液5.00 mL、10.0 mL至不同的100 mL容量瓶中,加入2 mL甲醛,用纯水定容,摇匀,配制成1.0 mg/L、2.0 mg/L、5.0 mg/L、10 mg/L、20 mg/L、50 mg/L、100 mg/L的标准系列溶液。
1.3.3 离子色谱条件
SH-AC-18型阴离子交换柱(250 mm×4.6 mm);保护柱Metrosep RP 2 Guard(3.5 mm);淋洗液:碳酸钠(2.4 mmol/L)/碳酸氢钠(6.0 mmol/L);流速:1.0 mL/min;抑制系统溶液:1%硫酸溶液、超纯水,柱温:35 ℃;进样量:20 μL。
2 结果与分析
2.1 分离效果
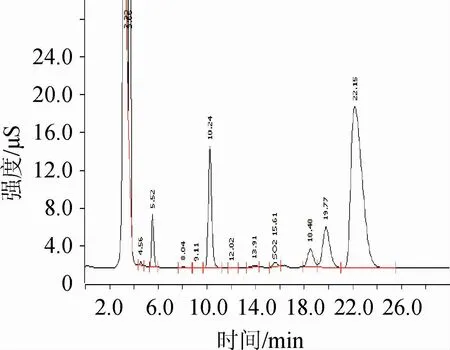
图1 行业标准方法前处理后的干红葡萄酒的离子色谱图Fig.1 Ion chromatogram of dry red wine after pretreatment by the industry standard
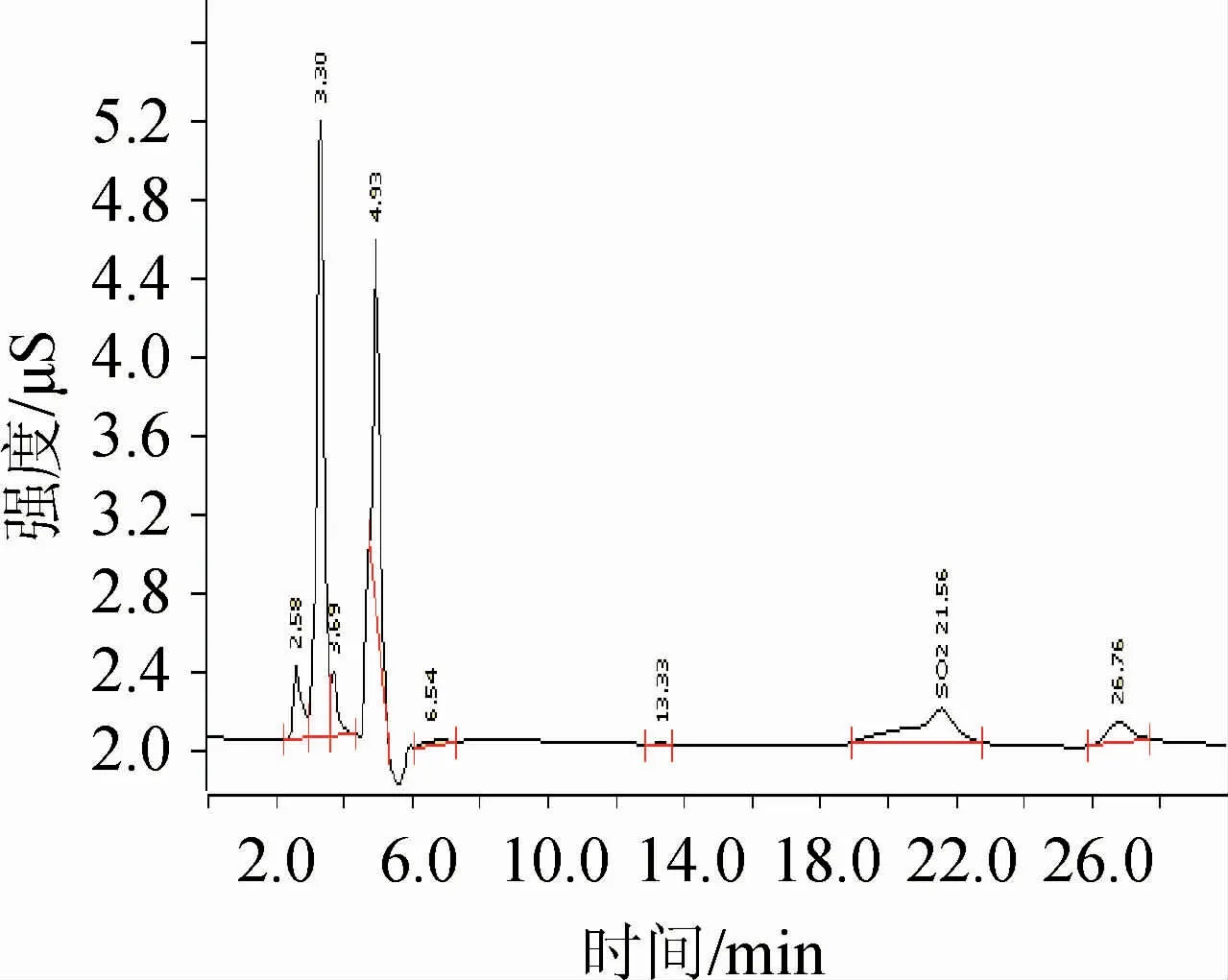
图2 快速蒸馏后干红葡萄酒的离子色谱图Fig.2 Ion chromatogram of dry red wine after rapid distillation
从图1和图2可以看出,该蒸馏前处理方法可以有效去除干红葡萄酒中的杂质,使色谱图更为纯净。并且通过回收试验,证明此蒸馏的处理方法对亚硫酸盐无保留,可满足检测需求。标准溶液和处理后的样品采用1.3.3所述色谱条件分离后,亚硫酸根色谱峰清晰,峰形良好,与前后峰的分离度R>1。
2.2 方法的检出限及线性关系
在质量浓度范围1.0~100 mg/L内,设置标准系列为1.0 mg/L、2.0 mg/L、5.0 mg/L、10 mg/L、20 mg/L、50 mg/L、100 mg/L,以亚硫酸根标准溶液的浓度为横坐标,峰面积为纵坐标,制作标准曲线,线性方程为A=-0.128 767+3.965 19E-3×Q,相关系数为0.999 5,说明方法的线性关系良好。本方法在质量浓度低于0.3 mg/L时检测不到信号,用质量浓度为0.3 mg/L的亚硫酸根标准溶液重复7次进样,测定结果的平均值为0.358 mg/L,标准偏差为0.015 2 mg/L,3倍的标准偏差乘以稀释倍数20即为方法检出限,计算得10 mL干红葡萄酒,定容体积为200 mL时的检出限约为1 mg/L。
2.3 方法的精密度和回收率
在同一干红葡萄酒样品中,先取7个平行样进行检测,以7次本底含量检测结果的平均值作为本底值,另取3个平行样,依次向3个平行样中添加质量浓度分别为30mg/L(1#)、60 mg/L(2#)、120 mg/L(3#)的亚硫酸钠标准溶液,每个浓度水平进行7次平行测定实验,验证方法的回收率和精密度。方法回收率和相对标准偏差(relative standard deviation,RSD)见表1。
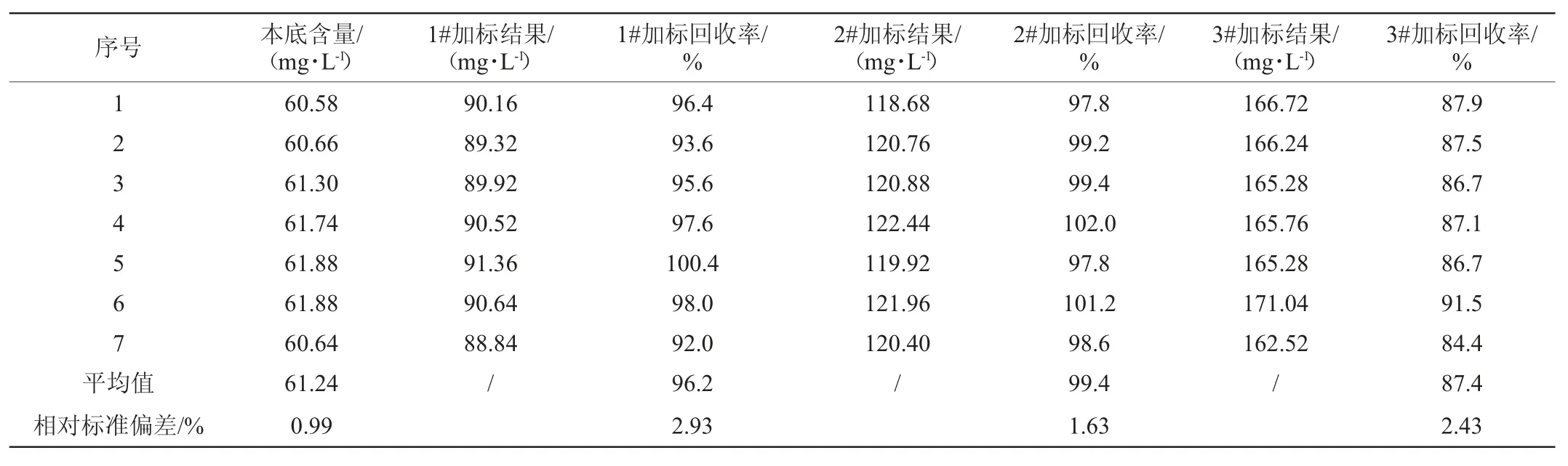
表1 干红葡萄酒的加标回收率与精密度实验结果Table 1 Results of adding recovery rates and precision experiments of dry red wine
由表1可知,干红葡萄酒样品在30mg/L、60mg/L、90mg/L的添加水平下,回收率在87.4%~99.4%范围内,回收率实验结果相对标准偏差在1.63%~2.93%之间,能够满足分析要求。
2.4 不同方法测定结果对比
本方法的测定结果分别与国标GB 5009.34—2016《食品安全国家标准食品中二氧化硫的测定》中的蒸馏-碘滴定法、GB 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法、SN/T 2918—2011《出口食品中亚硫酸盐的检测方法离子色谱法》中的离子色谱法的测定结果进行了比对,以确保该方法的准确性。比对结果见表2。

表2 不同方法的比对结果Table 2 Comparison results of different methods
通过比对结果可以看出,本方法的结果与其他3种方法结果的RSD均小于5%,测定结果具有很好的一致性。
2.5 样品前处理的选择
食品样品的基体复杂,一般含有较多的蛋白质、油脂、色素、纤维素等有机大分子组分[16],干红葡萄酒则含有更多的色素、纤维素,这些组分不仅影响分离效果还会降低色谱柱的性能和寿命。本实验尝试了使用活性炭和C18小柱来除去色素,其回收结果见表3。结果表明,样品溶液色素减少的同时,亚硫酸根也被吸附[17],回收率最高仅为10%。水蒸气蒸馏能有效防止大分子杂质进入到吸收液中,使干扰物质与目标物分离,有效消除样品中有色物质的基体干扰,降低对色谱柱的影响,本实验就是利用与蒸馏法原理相似的微量蒸馏仪对干红葡萄酒进行快速蒸馏,氢氧化钠溶液进行吸收,离子色谱仪检测吸收液中的亚硫酸根含量,取得了较好的回收率试验结果。
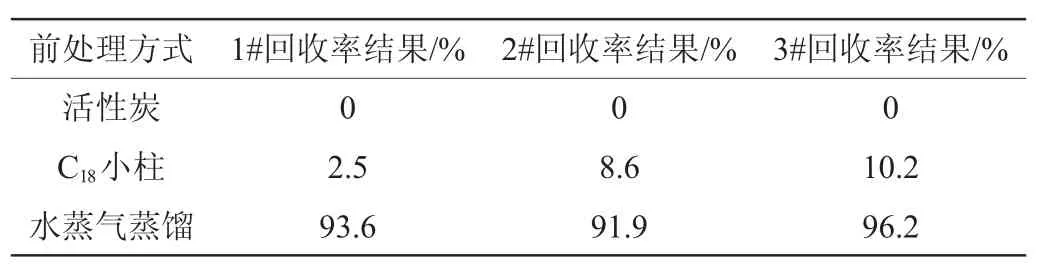
表3 不同前处理方法的加标回收率结果Table 3 Results of adding standard recovery rates of different pretreatments
2.6 吸收液的选择
为防止亚硫酸盐被氧化,考虑吸收液中加入稳定剂,根据文献[18-19],甲醛效果最好。但甲醛用量过多杂峰就多,从而导致检测结果不准确[20],此外,二氧化硫为酸性气体,碱性的氢氧化钠溶液是吸收液的选择之一。由表4可知,蒸馏出来的样品分别用1 mol/L的氢氧化钠和甲醛/氢氧化钠(1∶1,V/V)溶液吸收,通过回收率试验表明,当使用甲醛/氢氧化钠(1∶1,V/V)溶液进行吸收时,回收率为0;而仅用氢氧化钠溶液作吸收液时回收率达90%以上,符合检测要求。氢氧化钠溶液的使用不仅可以与蒸馏气体带出的二氧化硫充分反应生成亚硫酸根,而且能提供亚硫酸根稳定存在的碱性环境。

表4 不同吸收液的加标回收率结果Table 4 Results of adding standard recovery rates of different absorption liquid
3 结论
近年来,食品安全问题日益凸显,超量使用及滥用亚硫酸盐的现象非常严重,加强对食品中二氧化硫及亚硫酸盐的监督已成为急需解决的问题,在采样数量大并且种类繁多的情况下,操作简单、分析成本低、检测快速且灵敏度高的分析方法才能适应检测要求。本实验建立了一种快速蒸馏-离子色谱法测定干红葡萄酒中亚硫酸盐的分析方法,实验表明,该方法蒸馏样品操作简单,通过程序设置,蒸馏时间可实现全自动快速蒸馏,安全可靠,杂质干扰大大减少,相比于国标法,大大缩短了蒸馏时间,可用于检测大批样品;用氢氧化钠吸收液将二氧化硫转化为亚硫酸根,碳酸钠/碳酸氢钠作为淋洗液等度洗脱,分离效果很好;离子色谱法解决了滴定法无法准确判断终点的困扰,使检测结果更加准确;方法加标回收率平均值在87.4%~99.4%范围内,相对标准偏差(RSD)为1.63%~2.93%,可以准确测定干红中的亚硫酸盐含量。
