CADASIL患者脑微出血分布特征及临床意义
2020-05-08姚明周立新朱以诚彭斌倪俊
姚明,周立新,朱以诚,彭斌,倪俊
颞极和外囊白质高信号是伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(cerebral autosomal dominant angiopathy with subcortical infarct and leukoencephalopathy,CADASIL)的特征性影像学表现[1]。然而,中国CADASIL患者具有上述典型白质高信号的比例远低于高加索人群[2]。对于这些缺乏颞极或外囊特征性白质高信号的CADASIL患者,临床鉴别诊断困难,因此探索其他影像学标志物特征无疑有助于更好的鉴别诊断。
脑微出血(cerebral microbleeds,CMBs)是脑小血管病的重要影像学标志之一[3]。大量研究显示,CMBs与年龄、性别、高血压、脑淀粉样血管病(cerebral amyloid angiopathy,CAA)密切相关[4],其中最常见病因是高血压脑小血管病(深部和脑干分布为主)和淀粉样脑血管病(脑叶分布为主)[4-8]。国外研究显示,31%~69%的CADASIL患者可发现CMBs[9-14]。Dichgans等[9]发现CADASIL患者82%的CMBs位于长T2信号以外的区域,且尸检证实CMBs位于缺血灶之外,这些都提示CMBs是CADASIL患者独立于腔隙和白质高信号的特征性影像学表现。国外研究提出CADASIL患者CMBs也以丘脑、基底节、脑干等深部多见[9,13]。国内关于CADASIL相关CMBs的研究较少,且缺乏CADASIL与其他原因CMBs分布特征差异的研究。本研究旨在探讨中国CADASIL患者CMBs的分布特征,并与高血压脑小血管病患者进行比较,进一步探索其可能的临床意义。
1 研究对象与方法
1.1 研究对象 北京协和医院牵头的“十三五”国家重点研发计划“精准医学专项”脑小血管病队列是一项全国多中心、前瞻性队列研究。该研究经过北京协和医院伦理委员会批准,所有患者均已签署知情同意书。研究入组标准:年龄≥18岁,符合以下一个或多个临床表现:①1个月内新发腔隙性脑梗死患者;②1个月内新发非外伤性脑实质出血患者;③头颅MRI显示血管源性脑白质高信号患者(Fazekas评分≥2分);④头颅MRI显示腔隙病灶≥1个;⑤头颅MRI GRE或SWI序列显示微出血病灶≥2个。排除标准:①新发腔隙性脑梗死患者,病灶同侧颈内动脉、大脑中动脉或其他可能供血该病灶的大动脉狭窄>50%;②新发腔隙性脑梗死患者,有重要的心源性栓塞证据;③本次卒中是由于外伤直接导致;④非血管源性的脑白质病变。
“酒店里发生了什么,你可以继续向酒店了解。我们的公民没有违反瑞典法律,为什么被瑞典警察这样粗暴对待,扔到荒郊野外的坟场?瑞典警方为什么不通知我们使馆,迄今也不回应我们使馆的见面要求?如果你要采访瑞典警方,请你代向瑞典警方提出我的问题。”桂从友连续质问道。
本研究从北京协和医院该研究的亚组人群中,选取2017年6月-2019年12月,基因确诊的有完整临床、影像和遗传学资料的18岁以上CADASIL患者21例(CADASIL组);同时随机纳入性别匹配,且符合下述要求的高血压动脉硬化性脑小血管病患者21例(高血压脑小血管病组):①符合脑小血管病影像诊断;②明确原发性高血压病史;③年龄>60岁;④完整的影像学资料;⑤临床或基因检查除外CAA、CADASIL或其他基因明确诊断的遗传性脑小血管病患者、免疫病相关脑小血管病。
1.2 研究方法 收集患者的年龄、高血压、高脂血症及糖尿病史。所有患者在北京协和医院神经科首诊时均进行头颅常规MRI T1WI、T2WI、FLAIR、DWI以及T2*或SWI扫描。盲法读片并记录患者的CMBs的数量和部位。CMBs部位分为脑叶(包括皮层/皮层下白质),深部区域(包括丘脑、丘脑以外基底节区域、脑干),以及小脑。
CMBs诊断标准:根据Greenberg等[4]推荐的诊断标准,在MRI T2*序列或SWI序列观察到:①低信号的边界清晰的圆形或者椭圆形(非线型)病灶;②直径2~5 mm,最大不超过10 mm;③病灶至少一半以上被脑实质包绕;④在T1WI和T2WI一般不可见;⑤除外伪影,如血管流空影、钙/铁沉积及弥漫性轴索损伤等。
1.3 统计学方法 本研究应用SPSS 22.0软件进行数据分析。计数资料用构成比(%)表示,符合正态分布的计量资料用表示;通过χ2检验或独立样本t检验比较CADASIL组和高血压性脑小血管病组间基线特征的差异,通过χ2检验比较该两组间CMBs分布的差异。当P<0.05时差异具有统计学意义。
2 结果
2.1 一般情况 CADASIL组患者平均年龄低于高血压性脑小血管病组(47.28±12.24岁vs65.38±4.27岁,P<0.001),高脂血症比例低于后者(9.5%vs52.48%,P=0.003),差异均具有统计学意义。CADASIL组糖尿病比例低于高血压性脑小血管病组(14.3%vs38.1%,P=0.080),但差异无统计学意义。CADASIL组3例(14.3%)合并高血压。
2.2 两组CMBs分布区域比较 CADASIL组10例(47.6%)存在CMBs,共计115个CMBs,伴有CMBs的CADASIL患者中5例(50%)存在5个以上的CMBs。高血压性脑小血管病组除1例外,其余20例(95.2%)均存在CMBs,共计218个CMBs。CADASIL患者和高血压性脑小血管病患者典型CMBs分布如图1、图2所示。
CADASIL组CMBs以丘脑最常受累(52/115,45.2%),其次是脑叶(皮层/皮层下,41/115,35.7%)、基底节(13/115,11.3%)、脑干(5/115,4.4%)及小脑(4/115,3.5%)。值得注意的是,存在脑干CMBs的4例CADASIL患者中,3例合并高血压。高血压脑小血管病组以基底节CMBs最多见(77/218,35.3%),其次脑叶(58/218,26.6%)、丘脑(42/218,19.2%)、脑干(35/218,16.10%)及小脑(6/218,2.8%)。CADASIL患者丘脑CMBs/总CMBs比例、丘脑CMBs/(基底节CMBs+脑干CMBs)比例均高于高血压性脑小血管病组,差异均具有统计学意义(P<0.001)(表1)。
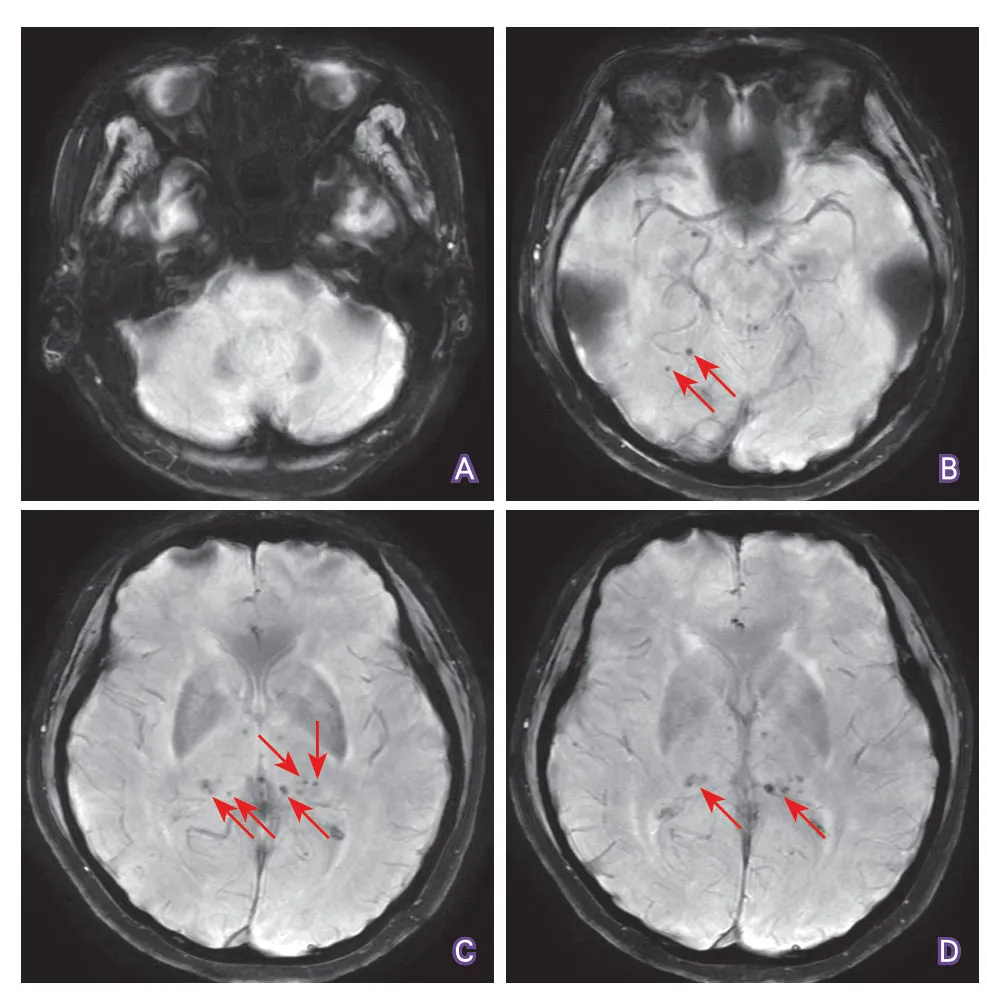
图1 CADASIL患者SWI
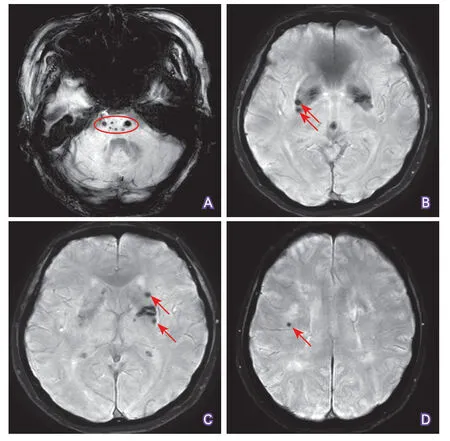
图2 高血压性脑小血管病患者SWI
3 讨论
本研究结果显示,与高血压动脉硬化性脑小血管病相比,CADASIL患者CMBs以丘脑受累最常见,而前者则以丘脑以外的基底节区和脑干更常见。这一显著差异对于临床鉴别表现为不典型白质高信号的脑小血管病病因有重要提示意义。
国外研究中关于CADASIL患者CMBs发生率报道不一[9-11,13-14],但随着病程延长而增加[12-13]。Lesnik等[10]发现CMBs见于31%的症状性CADASIL患者,Viswanathan等[11]也发现35%的CADASIL患者可存在CMBs。本研究显示47.6%的CADASIL患者存在CMBs。这一CMBs检出率显著高于上述两项研究,但明显低于国内张杰文等[15]研究所见。上述差异可能与种族、样本数及研究人群年龄、MR检测序列有关。张杰文等采用SWI进行CMBs判读,而Lesnik和Viswanathan等采用T2*。然而,Diehgans等[9]报道了16例进行T2*序列检查的CADASIL患者,其平均年龄与本研究相仿,但高达69%的患者存在CMBs。这提示除了年龄、MR检测技术之外,还有其他因素影响CADASIL患者CMBs的发生。已有研究显示NOTCH3基因型与临床影像表型相关。Rutten等[16]研究发现与携带编码第7-34表皮生长因子样重复序列(epidermal growth factor-like repeat,EGFr)突变的患者相比,携带编码第1-6 EGFr突变的CADASIL患者卒中发病更早、影像上白质高信号负荷更重,临床预后更差。非经典半胱氨酸残基突变者颞极白质高信号出现率低[17]。在高加索人群中,R153C基因型与CMBs独立相关[10],而亚裔CADASIL患者中,R544C基因型患者具有较高的出血风险[18-19]。因此,进一步针对遗传因素在CADASIL患者CMBs发生中的作用的研究值得期待。
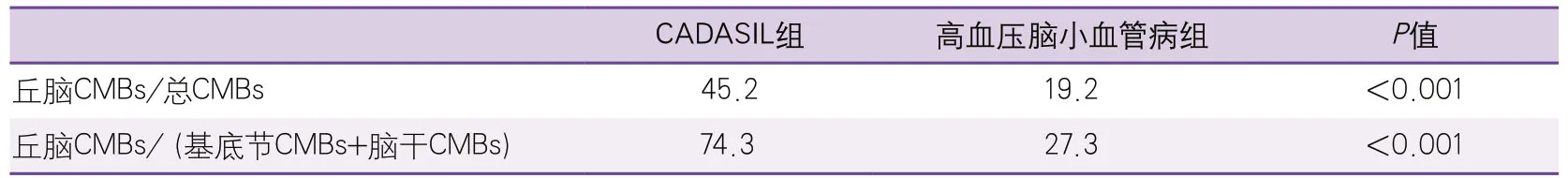
表1 CADASIL组和高血压脑小血管病组深部CMBs特征比较(单位:%)
本研究显示CADASIL患者CMBs以丘脑最常受累,其次是皮层/皮层下、基底节,脑干和小脑少见,与既往国外文献报道类似[9-11,13];但与高血压小动脉病变相关脑小血管病显著不同,提示两种疾病的CMBs发生机制存在差异。高血压相关CMBs以深部/幕下多见[5,20]。本研究发现尽管CADASIL患者和高血压性脑小血管病患者50%以上的CMBs位于深部(丘脑、基底节及脑干),但是两组深部CMBs的分布亦存在显著差异。CADASIL患者的深部CMBs以丘脑为主,而高血压性脑小血管病组则主要累及丘脑以外基底节和脑干。豆纹动脉、脑干深穿支为高血压性小动脉病变的好发部位。高血压可造成上述部位脑内小动脉的玻璃样变、微动脉瘤和动脉中层退变,导致血管破裂出血,从而形成CMBs病灶。CADASIL患者由于NOTCH3基因突变导致嗜铬颗粒沉积于小血管壁,进而出现小血管管壁增厚、管腔狭窄、血管平滑肌细胞退行性变以及血管壁通透性改变等,都可能参与CADASIL患者CMBs的形成[1];但是CADASIL患者深部CMBs以丘脑受累为主的原因目前尚不清楚,不除外与NOTCH3基因突变有关。CAA是CMBs的另一常见病因。大量研究表明CAA与皮层/皮层下CMBs密切相关,CMBs是CAA病变进展的影像标志之一[4,20]。APOE基因型与CAA患者CMBs形成相关[5],并影响其在颅内的分布。目前尚缺乏大样本的关于CADASIL基因型与CMBs分布部位的相关研究,但是有个例报道大量脑桥融合性CMBs见于P1008S突变的CADASIL患者[21],而全脑大量弥漫分布的CMBs见于R558C纯合突变患者[22]。因此,我们推测NOTCH3基因突变可能影响CMBs在CADASIL的分布,有待于进一步大样本的基因型-影像表型分析。
本研究也存在以下不足。首先,本研究数据来自单中心,存在一定的偏移,但是所有CADASIL患者为连续入组,并随机选择性别匹配的高血压小动脉硬化患者,降低了可能的偏移。其次,患者接受T2*或者SWI检查,SWI对于CMBs的检出率高于T2*,但是两组不同MR序列的比例相同,减少了可能的误差。最后,本研究未进行NOTCH3基因型与CMBs分布特征的关联分析。未来研究将系统进行两者的关联性分析,探索CADASIL患者发生脑CMBs可能的遗传机制。