矾根‘莓果’不定芽诱导与快速繁殖
2020-05-06邵雅东殷丽青张永春李青竹
邵雅东,殷丽青,张永春,孙 翊,李青竹,成 鑫,3,高 健
(1.上海市农业科学院,上海 201403;2.长江大学园艺园林学院,湖北 荆州 434025;3.安顺学院,贵州 安顺 561000;4.上海强绿花卉专业合作社,上海 202154)
矾根Heucheraspp.为原产于北美洲的虎耳草科Saxifragaceae矾根属Heuchera多年生草本花卉园艺类群,是欧美园林中常见的一种彩叶观赏植物,具有观赏期长、耐寒、耐阴的优良品质[1-2]。随着中国城市建设和园林造景的发展,矾根逐渐被应用于我国的花坛、花境和花带的景观配置中,已成为一种流行的园艺植物[3]。此外,矾根还可以吸收土壤中的重金属元素,并富集于地上部分,随着地上部生物量的增加,矾根吸收重金属的能力也逐渐增强[4],在土壤生态环境改良中的应用前景良好。
然而,矾根品种繁多,大部分品种不育或结实困难,种子育苗还存在难以保持品种原有特性的问题[2];分株繁殖又存在繁殖效率低、周期长 的问题,不利于新品种的推广;扦插繁殖对母株需求量较大,且对温、湿度等环境条件的要求较高[5]。植物组织培养是一种可以克服有性繁殖效率低、品种高度不育和保持品种优良特性的技术,且高效稳定的再生体系还是基因工程育种的基础[6-7]。不定芽培养作为植物组培中常用途径之一,具有周期短、变异率低等特点,已逐渐成为矾根组织培养研究的重点[8-9]。组织培养是在短期内获得大量整齐、均匀的矾根健壮种苗的最适繁育方式[10-12]。前人已经开展了有关矾根组织培养方面的研究,大部分的研究集中于以顶芽或腋芽为外植体诱导丛生芽从而建立矾根的离体快繁体系方面[11-13]。近几年,也有少量的研究者利用叶片或叶柄等为外植体诱导不定芽从而建立矾根的再生体系[2,14]。然而,由于基因型之间的差异,对不同品种在离体再生培养过程中的最适植物生长调节剂的种类和浓度的探索尚需深入。矾根‘莓果’H.‘Mei Guo’是一种红叶粉花矾根新品种,是少数叶色为亮红色的品种之一,其观赏价值高且适生性较好,然而在其组培繁育过程中存在增殖系数低且生根困难的问题,其繁育效率明显低于其他品种。因此,本研究分别以矾根‘莓果’的叶片和叶柄为外植体进行不定芽诱导试验,并进一步开展不定芽增殖和生根培养试验,以筛选获得最佳培养基配方,从而建立其高效的离体培养体系,以加速矾根品种的繁殖与推广,并为其种质保存和分子育种提供技术支撑。
1 材料与方法
1.1 供试材料
以上海市农业科学院植物组培平台提供的矾根‘莓果’为试材,取其长势良好的无菌苗叶片和叶柄作为外植体。以MS或1/2MS为基本培养基,添加3%的蔗糖、0.6%的琼脂粉,将pH值调整至5.8。将不同处理的培养基置于121 ℃、0.11 MPa的条件下高压灭菌20 min后以备用。
1.2 不定芽的诱导
以MS为基本培养基,添加不同浓度的TDZ(噻重氮苯基脲)或6-BA(6-苄氨基嘌呤)和0.1 mg/L 的NAA(萘乙酸)。TDZ的处理浓度分别设为0.00、0.05、0.10、0.20、0.50 mg/L,其处理编号依次为T0(CK)、T1、T2、T3、T4;6-BA的处理浓度分别设为0.0、0.2、0.5、1.0、2.0 mg/L,其处理编号依次为B0(CK)、B1、B2、B3、B4。分别以切取的试管苗叶片下方0.5 cm左右的叶柄和切割成0.5 cm×0.5 cm的正方形叶片作为外植体,将其分别接种于不同培养基上,每个处理接种9个外植体,重复8次。
1.3 丛生芽的增殖培养
将叶片诱导的丛生芽置于无生长调节剂的MS培养基上继代培养30 d,然后切割单芽,分别置于添加了不同浓度6-BA的MS培养基上进行增殖培养,6-BA的处理浓度分别设为0.00、0.05、0.10、0.20、0.50、1.00 mg/L,处理编号依次为S0(CK)、S1、S2、S3、S4、S5。每个处理接种4个丛生芽,重复8次。
1.4 丛生芽的生根培养
将以最适增殖培养基培养出的丛生芽分割为单芽,再将其分别接种于含有不同浓度的NAA和IBA的1/2 MS生根培养基上。NAA的处理浓度分别设为0.0、0.2、0.5、1.0、2.0 mg/L,处理编号依次为N0(CK)、N1、N2、N3、N4;IBA的处理浓度分别设为0.0、0.2、0.5、1.0、2.0 mg/L,处理编号依次为I0(CK)、I1、I2、I3、I4。每个处理接种7个单芽,重复10次。
1.5 培养条件
先将以叶片和叶柄诱导的不定芽均置于黑暗条件下培养20 d,然后将其移入光照条件下培养55 d,在光照条件下完成丛生芽增殖和试管苗生根培养。培养室温度设为(24±2)℃,光照强度设为(32±2)μmol·m-2s-1,光照时间设为12 h/d。
1.6 数据统计
将不定芽置于光照条件下诱导55 d后,统计不定芽的诱导率和平均出芽数;增殖培养30 d后,统计丛生芽的增殖系数;诱导培养30 d后,统计生根率和生根数,并测定根长。
诱导率=分化有效不定芽的外植体数/接种的外植体数×100%;
平均出芽数=总芽数/出芽的外植体数;
增殖系数=新增殖的芽数/接种芽数;
生根率=生根植株数/接种植株数×100%;
单株平均根数=总根数/生根苗数量;
单株平均根长=试管苗基部至最长根的根尖长度之平均值。
采用SAS 8.1软件中的方差分析(ANOVA)对各处理的结果数据分别作差异性显著性检验和 Duncan 的多重比较分析,显著水平P<0.05。
2 结果与分析
2.1 不同浓度的TDZ和6-BA对矾根叶片和叶柄不定芽诱导的影响
不同浓度的TDZ对矾根‘莓果’丛生芽诱导的影响情况见表1。在含有浓度为0.1 mg/L的NAA的培养基(不添加TDZ)上,矾根‘莓果’叶片和叶柄均不能诱导出不定芽;而在含有不同浓度的TDZ的培养基中,外植体在暗培养9 d后其切口处开始膨大,光培养33 d后其切口两侧都开始产生不定芽并伴有少量愈伤组织的产生,光培养55 d时不定芽的诱导到达高峰且不定芽的状态较好;在不同浓度的TDZ处理间,矾根‘莓果’叶片和叶柄的不定芽诱导率均呈显著差异,不定芽诱导率随着TDZ处理浓度的提高均呈先升后降的趋势。当TDZ的浓度为0.05 mg/L时,叶片不定芽的诱导率最高,为91.67%;然而,在添加了浓度为0.2 mg/L的TDZ的培养基上,叶柄不定芽的诱导率达到最高值,为80.56%。叶片和叶柄的平均出芽数,随着TDZ浓度的提高也均呈先增后降的趋势;叶片的平均出芽数,在TDZ的浓度为0.1 mg/L时最高,为1.80个,而当TDZ的浓度增加到0.5 mg/L时,其平均出芽数却降至0个;叶柄的平均出芽数,在TDZ的浓度为0.2 mg/L时达到最高,为2.05个,随着TDZ浓度的继续上升,其平均出芽数开始下降。由此说明,与叶柄相比,叶片对TDZ的浓度更加敏感,较低浓度的TDZ就能有效诱导叶片产生不定芽;而较高浓度的TDZ对叶片和叶柄不定芽的诱导均有一定的抑制作用,其对叶片不定芽诱导的抑制作用更为明显。用于叶片不定芽诱导的TDZ的最适浓度为0.05 mg/L,用于叶柄不定芽诱导的TDZ的最适浓度为 0.2 mg/L,在含有最适浓度的TDZ的培养基上不定芽的诱导效果,叶片好于叶柄。矾根‘莓果’在适宜培养基上诱导产生的不定芽如图1所示。
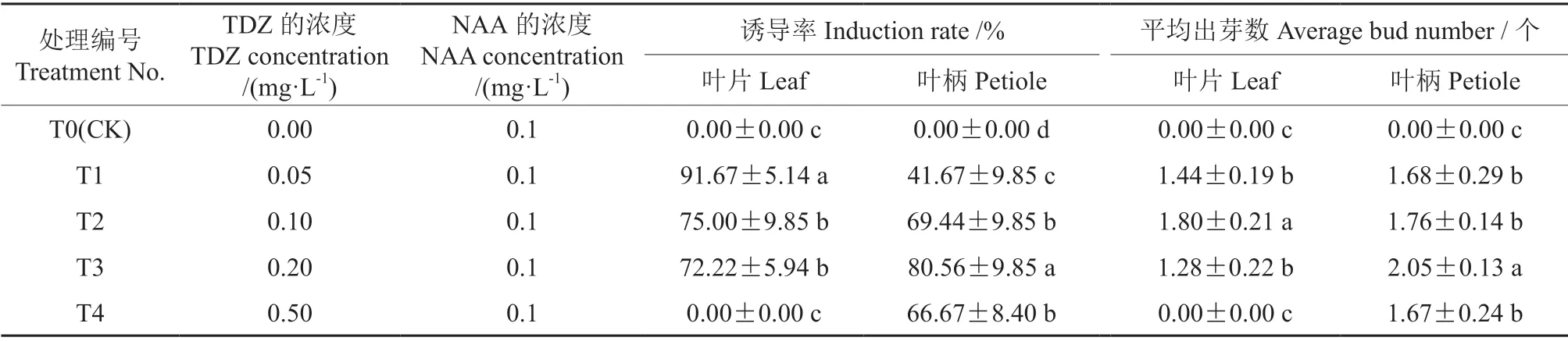
表1 不同浓度的TDZ对矾根‘莓果’叶片和叶柄不定芽诱导的影响†Table 1 Effects of different concentrations of TDZ on induction of adventitious buds from leaves and petioles in H.‘Mei Guo’
将矾根‘莓果’叶片和叶柄分别置于含有 0.1 mg/L的NAA、并添加了不同浓度的6-BA的诱导培养基上暗培养7 d后,其外植体切口处均开始膨大,光培养30 d后其切口两侧均开始形成少量的不定芽,并伴有极少量愈伤组织的产生;光培养55 d后其不定芽诱导率均达到峰值。不同浓度的6-BA对矾根‘莓果’丛生芽诱导的影响情况见表2。由表2可知,光培养55 d后,矾根叶片和叶柄的不定芽诱导率和平均出芽数随着6-BA浓度的增加均先升高后降低。当6-BA的浓度从 0.0 mg/L提高至1.0 mg/L时,叶片的不定芽诱导率和平均出芽数均达到最高值,分别为86.11%和3.20个;叶柄的不定芽诱导率和平均出芽数也均达到最高值,分别为91.67%和2.73个。当6-BA的浓度由 1.0 mg/L提高至2.0 mg/L时,叶片和叶柄的不定芽诱导率和平均出芽数都下降。这一结果表明:在添加了适宜浓度的6-BA和NAA的培养基上,叶片与叶柄均能够诱导产生不定芽,且叶片和叶柄的最适培养基均为B3处理,即6-BA的浓度为1.0 mg/L。在此条件下,不定芽的诱导率,叶柄高于叶片;而平均出芽数,叶柄却低于叶片(图1)。
以叶片为外植体进行矾根‘莓果’不定芽诱导时,获得最大诱导率的培养基分别为T1和B3处理的,且其差异不大,然而,在T1处理的培养基上,不定芽的出芽数远低于B3处理的。而以叶柄为外植体进行不定芽诱导时,以不同培养基培养获得的不定芽诱导率,T3处理的培养基远低于B3处理的培养基。综上所述,矾根叶片和叶柄不定芽诱导的最适培养基均为B3处理的培养基,即MS+1.0 mg/L的6-BA+0.1 mg/L的NAA。

图1 矾根‘莓果’在适宜培养基上诱导产生的不定芽Fig.1 Induced adventitious buds from H.‘Mei Guo’ in optimum media

表2 不同浓度的6-BA对矾根‘莓果’叶片和叶柄不定芽诱导的影响Table 2 Effects of different concentrations of 6-BA on induction of adventitious buds from leaves and petioles in H.‘Mei Guo’
2.2 不同浓度的6-BA对矾根丛生芽增殖培养的影响
在矾根‘莓果’试管苗丛生芽的增殖培养基中添加不同浓度的6-BA,对其增殖生长的促进效果明显不同,试验结果如图2所示。图2显示,增殖培养基中6-BA的浓度不同,其对矾根‘莓果’丛生芽增殖系数的影响差异显著,试验结果见表3。当6-BA的浓度为0.0~0.5 mg/L时,矾根‘莓果’丛生芽的增殖系数随着6-BA浓度的增加而提高;当6-BA的浓度增加到0.5 mg/L时,其增殖系数最高,为3.97,植株生长快,长势健壮;当6-BA的浓度超过0.5 mg/L之后,其增殖系数开始下降;当6-BA的浓度由0.5 mg/L提高到1.0 mg/L时,其增殖系数由3.97降低至2.94,且有玻璃苗出现,说明浓度过高的6-BA不利于丛生芽的增殖且容易导致玻璃化现象的发生。试验结果表明:适宜浓度的6-BA可以显著提高矾根丛生芽的增殖系数,最适合矾根丛生芽增殖的培养基是MS+0.5 mg/L的6-BA。

图2 不同浓度的6-BA对矾根丛生芽增殖培养的影响Fig.2 Effects of different concentrations of 6-BA on proliferation culture of cluster buds in H.‘Mei Guo’
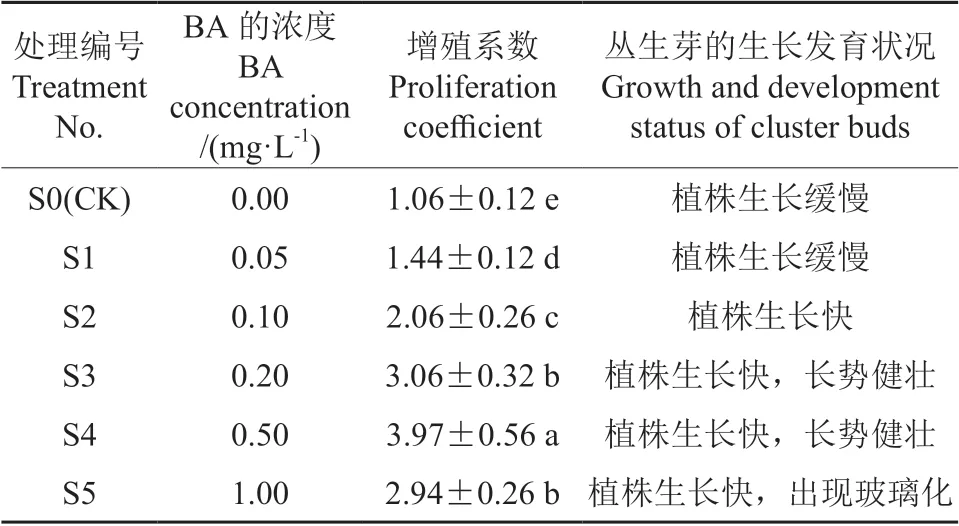
表3 不同浓度的6-BA对矾根‘莓果’丛生芽增殖的影响Table 3 Effects of different concentrations of 6-BA on proliferation of cluster buds in H.‘Mei Guo’
2.3 不同浓度的NAA和IBA对矾根试管苗生根的影响
矾根‘莓果’试管苗诱导生根结果显示,添加不同浓度的NAA和IBA对生根的促进效果明显不同(图3)。在1/2MS培养基上,随着NAA浓度由0.0 mg/L上升到2.0 mg/L,其生根率逐渐升高,即由58.3%增加到100%(表4)。与此同时,单株平均根长却显著下降,由3.28 cm降低至 1.93 cm。此外,随着NAA浓度的上升,单株平均生根数呈现先升后降的趋势,在NAA浓度为 1.0 mg/L时达到最高值,为47.6条,当NAA的浓度为2.0 mg/L时,单株平均生根数为34.5条。
适当添加IBA可以有效提高矾根的生根率和单株生根数,单株平均根长也会显著降低,试验结果见表5。在1/2MS培养基上,当IBA的浓度由0.0 mg/L上升至2.0 mg/L时,生根率由58.3%上升到95.0%,单株平均根长却由3.28 cm下降至1.73 cm,而单株平均根数则呈先增后降趋势。当IBA的浓度由0.0 mg/L增加至1.0 mg/L时,单株平均根数由5.5条上升至19.2条;当IBA浓度为 2.0 mg/L时,单株平均根数下降至14.2条。
矾根‘莓果’试管苗诱导生根的试验结果见表4~5。表4~5表明,适当添加NAA或IBA均可有效提高矾根生根率和单株根数,显著降低单株平均根长。在分别添加了1.0、2.0 mg/L的NAA和2.0 mg/L的IBA的培养基中,其生根率均较高,但其单株平均生根数的差异较大,适宜浓度的NAA可以有效促使生根数的增加,当NAA的浓度为1.0 mg/L时,其单株平均生根数远高于其在添加了2.0 mg/L的NAA 和2.0 mg/L的IBA的培养基上的单株平均生根数。综合分析认为,1/2MS+1.0 mg/L的NAA的培养基最适宜于矾根增殖苗的生根,在此培养基上的生根率和单株平均生根数均较高,且根系发达,植株健壮(图3),经炼苗后移栽,其长势良好(图4)。

图3 不同浓度的NAA和IBA对矾根‘莓果’不定根诱导的影响Fig.3 Effects of different concentrations of NAA and IBA on adventitious roots induction from H.‘Mei Guo’
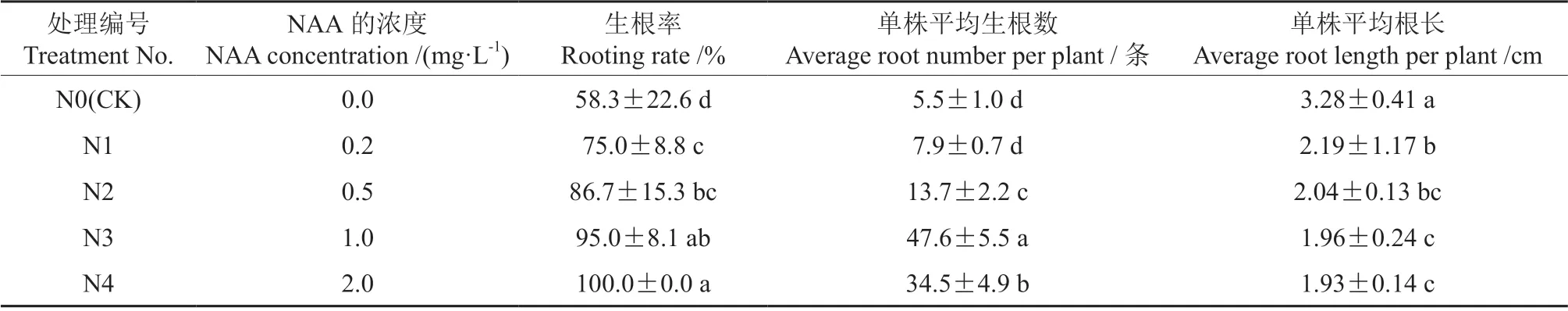
表4 不同浓度的NAA对矾根‘莓果’不定根诱导的影响Table 4 Effects of different concentrations of NAA on adventitious roots induction from H.‘Mei Guo’

表5 不同浓度的IBA对矾根‘莓果’不定根诱导的影响Table 5 Effects of different concentrations of IBA on adventitious roots induction from H.‘Mei Guo’
3 结论与讨论
前人已在矾根组培繁育方面开展了一些研究。有关研究者在对矾根品种‘香茅’‘饴糖’和‘紫色宫殿’的研究中,分别以其顶芽、茎基部等作为外植体进行丛生芽诱导,均取得了较好效果[5,13,15]。然而,此类外植体的数量十分有限,而且取样会对母本造成较大破坏,不可适用于母本数量稀少的资源的快速繁育。杨玉萍等[16]分别以‘紫雏菊’的叶片、叶柄和根段作为外植体进行不定芽诱导的试验研究,结果表明,叶片和叶柄的不定芽诱导率均较高,叶柄的诱导效果最佳。邹清成等[14]以嫩叶为外植体进行矾根不定芽诱导试验,结果得出,其最适诱导培养基是MS+2.0 mg/L的6-BA+0.1 mg/L 的NAA,出芽率仅为70.00%。这些研究结果说明,可采用叶片和叶柄作为外植体进行不定芽诱导,取材更容易且对母本的伤害小。本课题组还分别以矾根‘巴黎’和‘闪秋’的叶柄和叶片为外植体进行不定芽诱导,结果得出,最适培养基成分分别为MS+0.2 mg/L的6-BA+0.1 mg/L 的NAA和MS+0.5 mg/L的6-BA+0.1 mg/L的NAA。在此最适条件下,矾根‘巴黎’的不定芽再生率高达89.58%,‘闪秋’的不定芽再生率为75.00%(相关论文待发表)。然而,矾根‘莓果’使用上述培养基进行诱导时,不仅诱导率较低且不定芽生长状况较差。基因型的差异很可能成为不同品种不同外植体所用最适培养基不同的重要原因。本研究获得的矾根‘莓果’不定芽再生的最适培养基为MS+1.0 mg/L的6-BA +0.1 mg/L的NAA,在此培养基中,其叶片和叶柄的诱导率分别达到86.11%和91.67%,且其平均出芽数分别为3.20和2.73个,说明诱导再生效果良好。据此认为,MS+1.0 mg/L的6-BA +0.1 mg/L的NAA这一培养基可以作为组培繁育较困难的矾根品种的首选诱导培养基。

图4 矾根‘莓果’生根苗移栽后的生长状态Fig.4 Growth status of transplanted H.’Mei Guo’ seedlings with roots
在培养基中添加植物生长调节剂诱导不定芽的形成是植物离体培养中常用的方法,所用的植物生长调节剂和外植体不同,其效果也具有一定的差异[17]。研究中发现,在同样添加了NAA的培养基中,叶片和叶柄对TDZ和6-BA的响应具有一定的差异,虽然在添加了0.05 mg/L的TDZ的培养基上叶片不定芽诱导率较高,但其平均出芽数远低于其在添加了1.0 mg/L的6-BA处理的,且在添加了最适浓度的TDZ和6-BA的培养基上叶柄诱导率有明显差异,而在MS+1.0 mg/L的6-BA+0.1 mg/L的NAA的培养基上叶片和叶柄的诱导效果均更佳。综合比较认为,6-BA与NAA的组合使用更适于矾根‘莓果’不定芽的诱导。
丛生芽的增殖系数是矾根组培快繁效率的重要影响因素之一。李川等[18]在对4个矾根品种的增殖试验后发现,矾根的增殖系数受到品种和添加的植物生长调节剂的种类和浓度的影响。已有研究者报道,矾根增殖培养一般为单独添加6-BA或KT,但在6-BA或KT中加入适量的NAA或IAA后其增殖生长的状态更佳[13-15],这说明植物生长调节剂的联合应用可能更适于其增殖培养。然而,在本研究的预试验阶段,在不同浓度的6-BA培养基中加入了0.1 mg/L的IAA进行矾根增殖培养试验,结果显示,6-BA和IAA的组合使用对矾根的增殖培养并没有显著的促进作用。而加入了0.1 mg/L 的NAA的培养基会使得丛生芽基部产生少量的愈伤组织,也不利于增殖培养。本研究在MS培养基上单独添加6-BA,并在其浓度为0.5 mg/L时获得了最大增殖系数,据此认为,MS+0.5 mg/L的6-BA是矾根‘莓果’的最适增殖培养基。
生根诱导作为矾根移栽前的重要步骤已被前人作了初步的研究。除矾根‘花毯’以MS作为基础培养基更优外[19],大部分报道认为,1/2MS是矾根生根培养的适宜基础培养基。例如,田莉等[2]使用矾根‘巴黎’的不定芽为材料进行生根诱导培养,其最适培养基为1/2MS+1.0 mg/L的IBA,其生根率高达100%;蒲春林等[20]以1/2MS+ 0.2 mg/L的NAA+0.5 mg/L的AC为培养基进行矾根生根培养,其效果最好,生根率达95%。邹清成等[14]以矾根嫩叶诱导的丛生芽进行生根诱导,其最佳生根培养基是1/2MS+0.1 mg/L的NAA,生根率为95.33%;孙翊等[15]在试验中发现,矾根‘紫色宫殿’的最适生根诱导培养基是1/2MS+0.2 mg/L 的NAA,生根率为100%。然而,矾根‘莓果’在使用上述添加了低浓度的IBA或NAA的培养基进行生根培养时,效果较差,不能形成健壮的根系。本研究结果表明,矾根‘莓果’最适生根培养基为1/2MS+1.0 mg/L的NAA,生根率较高,且生根数较多。然而,过高浓度的NAA和IBA也都会抑制单株平均根长的增加,这可能由生长素类生长调节剂促进新根形成和维管系统分化消耗了大量养分所致[21]。至于形成这种差异的具体机理,还有待于进一步的研究。
本研究分别以矾根‘莓果’的叶片和叶柄作为外植体,开展了不定芽诱导、丛生芽增殖和试管苗生根的系统研究,筛选出了最佳培养基配方,并初步建立了矾根离体繁殖体系。结果表明:矾根‘莓果’叶片和叶柄不定芽诱导的最适培养基均为MS+1.0 mg/L的6-BA+ 0.1 mg/L的NAA,不定芽诱导率分别高达86.11%和91.67%;丛生芽增殖培养的适宜培养基是MS+0.5 mg/L的6-BA,增殖系数达3.97;增殖试管苗生根的适宜培养基是1/2MS+1.0 mg/L的NAA,生根率达95.0%,且获得的单株平均生根数最多。本研究对不同矾根品种组培快繁体系的建立具有一定的借鉴意义,可为矾根的离体培养、种质资源保存及遗传转化研究提供一定的技术支撑。然而,由于本研究对矾根‘莓果’快繁体系的研究仅为初步尝试,其中所施用的外源生长调节剂的种类还有一定的局限性,在今后的研究中应该尝试更多种类的植物生长调节剂和更多类型的外植体,以期获得更能适合矾根‘莓果’快繁的外源激素和外植体组合。
