杧果矮化基因GA2ox的克隆、亚细胞定位及表达分析
2020-05-06黄国弟欧克纬龙凌云庞新华卢业飞
张 继,黄国弟,张 宇,欧克纬,龙凌云,庞新华,卢业飞
(广西农业科学院 广西亚热带作物研究所,广西 南宁 530001)
选育矮化品种和矮化砧木是实现杧果以及其他多年生乔化果树产业良性发展的重要途径之一[1-2]。以往对矮化机理的研究多集中在辐射诱变、整形修剪[3]、生理生化指标测定[4-5]等方面,基因调控赤霉素(GA)合成而影响矮化效应方面的研究鲜见报道[6]。矮化特性已成为关于乔化果树产业发展研究的热点。植物中参与赤霉素合成分解的酶较多,GA2ox(赤霉素2β氧化酶)就是其中之一,该酶是一种抑制活性GA合成的酶,可以降低活性GA含量,从而达到调节植物株高的目的[7-8]。GA2ox也是唯一一种降解活性GA的关键酶,GA2ox在GA代谢过程中具有负调节GA合成的作用[6]。GA2ox是使活性GA失活的关键酶,是由多基因编码的双加氧酶[9-10]。GA2ox作用于有生物活性的GA1和GA4,将其转变成无活性的GA8和GA34[11]。GA2ox调节GA代谢途径已在拟南芥中得到证实[12]。2004年,课题组自主选育的‘桂热杧82号’Mangifera indicaL.cv.Guire No.82通过了广西农作物品种登记[13]。该品种又名‘桂七杧’,树势中庸,树姿开张,树冠卵圆形,具有矮化特性。有关该品种矮化特性分子层面的研究尚未开展,不确定其是否与GA相关。目前,关于杧果GA合成途径中关键酶基因的功能研究鲜见报道。因此,本项目以‘桂热杧82号’为供试材料,进行GA2ox基因克隆、亚细胞定位以及表达分析,将该基因命名为MiGA2ox,探讨MiGA2ox基因调控赤霉素合成与植株矮化的关系,旨在为研究杧果树体发育过程中GA合成调控以及GA信号转导的作用提供参考,并为矮生型杧果品种及矮化砧木的选育提供参考[14-18]。
1 材料与方法
2018—2019年,在广西亚热带作物研究所优势作物繁育及综合开发新技术重点实验室进行试验。
1.1 材 料
1.1.1 试验材料
‘桂热杧82号’种植于广西亚热带作物研究所杧果种质资源圃。采集刚抽生无病虫害侵染的嫩叶放入装有液氮的冰壶中,迅速带回实验室,置于-70 ℃冰箱保存备用[19-20]。
1.1.2 耗 材
DNA Marker、T4DNA连接酶、Q5®超保真DNA聚合酶、2×Taq Master Mix、First Choice RLM-RACE Kit、5×RT Reaction Buffer、dNTP、RNaes Inhibitor、M-MLV RTase、凝胶回收试剂盒购自天根生化科技(北京)有限公司,接头和引物由华大基因生物科技(深圳)有限公司合成。
1.1.3 载体及感受态
克隆载体pGEM-T Vector购于华大基因生物科技(深圳)有限公司;JM109感受态保存于广西亚热带作物研究所优势作物繁育及综合开发新技术重点实验室;亚细胞定位载体pK7FWGF2.0和PEASY-T1由迦康创因生物科技(武汉)有限公司提供。
1.2 方 法
杧果叶片总RNA的提取参考侯哲等的方 法[21],略有改动。
1.2.1 RNA反转录
解冻First-Strand cDNA Synthesis Kit试剂,上下轻柔颠倒混匀,短暂离心后放置冰上待用。冰上配制RNA-Primer Mix,在预冷的RNasefree反应管内加入总RNA 1 μg、250 μmol/L随机引物1 μg,最后加入DEPC处理水使终体积至 13 μL。RNA变性:混匀RNA-Primer Mix,进行短暂离心,65 ℃变性10 min后立即放于冰上。配制反转录反应液:在RNA-Primer Mix反应管内,加入RNA-Primer Mix 13 μL、5×RT Reaction Buffer 5 μL、25 mmol/L dNTP 1 μL、25 U/μL RNaes Inhibitor 1 μL、200 U/μL M-MLV RTase 1 μL,加入DEPC处理水使终体积至25 μL。反转录反应:混匀反应Mix,短暂离心后37 ℃孵育1 h。反应结束后,85 ℃灭活处理5 min,-20 ℃保存反转录产物,待用。
1.2.2 目的片段克隆及回收
根据GenBank中公布的GA2oxcDNA序列,设计1对简并引物,分别是GA2ox-F:AAYGGYGATRTBGGHTGGRTYGAATA;GA2ox-R:TGCYTYACRCTYTTAAAYCTYCCATTWGTCA。参考1.2.1,进行反转录。PCR反应体系为 100 ng/µL模 板cDNA 1 μL、50 mmol/L Primer-F 1 μL、50 mmol/L Primer-R 1 μL、25 mmol/L dNTPs 4 μL,加ddH2O至总反应体系50 μL。PCR反应程序为94 ℃ 5 min;94 ℃ 40 s,58 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min,4 ℃保存。PCR产物选择2.0%(质量分数)琼脂糖凝胶电泳分析。回收目的片段,连接到pGEM-T Vector载体上,转化JM109感受态细胞,取阳性单克隆摇菌并进行测序。
1.2.3 3'末端获得
将Ramdom 6替换为接头引物R11466(GCAGGACTGCAGCTGACTGACTACT30VN)进行反转录,孵育温度42 ℃,反转录酶的失活反应温度95 ℃。PCR反应体系及程序同1.2.2。以通用引物R16326(GGTGGTAGAGCTCGCAGGA CTGCAGCTGACTG)和特异的外侧引物GA2ox3′ GSP-1(CCGCCATGTCCGGATATTCA)、GA2ox3′ GSP-2(ATCCAACAACACTTCCGGCT)进 行 首轮扩增。PCR扩增体系为100 ng/µL cDNA 2 µL,10×PCR Buffer 4 µL,2.5 mmol/L dNTP 4 µL,上下游引物各2 µL,0.5 µL rTaq酶,用ddH2O补足至40 μL。PCR反应程序为94 ℃ 3 min;94 ℃ 40 s,60 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min,4 ℃保温。以稀释10倍的第1轮PCR产物为模板,以内侧引物R16324(AGAGCTCGCAGG ACTGCAGCAGCTGACTGACTAC)分别与GA2ox3′ GSP-1、GA2ox3′ GSP-2进行第2轮扩增,PCR反应体系同第1轮扩增。将PCR产物进行1.0%(质量分数)琼脂糖凝胶电泳分析,并进行切胶回收目的片段,连接到PEASY-T1载体上转化感受态细胞后,鉴定出阳性菌落进行测序。
1.2.4 5′末端获得
cDNA的获得同1.2.3。利用GA2ox5′ GSP-1(GCACCTGCATAATCAACCACAA)进行PCR的第1轮扩增。PCR反应体系为100 ng/µL cDNA 2 µL,10×PCR Buffer 4 µL,2.5 mmol/L dNTP 4 µL,上下游引物各2 µL,0.5 µL rTaq酶,补充ddH2O使终体积至40 μL。PCR反应程序为 94 ℃ 5 min;94 ℃ 50 s,60 ℃ 50 s,72 ℃ 2 min,35个循环;72 ℃ 1 min,4 ℃保温。以稀释10倍的第1轮PCR产物为模板,利用GA2ox5′ GSP-2(GCTTGGGTACTGGCAAAAGC)进行第2轮扩增,PCR反应体系和测序同1.2.4的第1轮扩增。
1.2.5 编码序列生物信息学分析
将3′末端、5′末端和中间目的基因片段拼接成完整GA2ox基因序列。利用NCBI提供的Blast程序进行GA2ox基因序列同源搜索以及相似性分析。采用MEGA6.0软件构建系统进化树;采用ProtParam(http://web.expasy.org/protparam/)在线分析GA2ox编码蛋白质的相对分子质量、理论等电点和稳定性[22];采用Phobius(http://www.phobius.sbc.su.se/)软件分析GA2ox编码蛋白质的信号肽以及蛋白质的跨膜结构域;采用DNAMAN软件预测GA2ox编码蛋白质的疏水性和二级结构。
1.2.6 实时荧光定量RT-PCR(qRT-PCR)分析
利用Beacon Designer设计引物,探究MiGA2ox基因在‘桂热杧82号’和‘金煌杧’随机不同时期中的表达情况。以杧果actin内参基因设计actin-F和actin-R引物。根据已克隆得到的MiGA2ox序列设计特异引物GA2ox-YGF和GA2ox-YGR。cDNA的获得同1.2.1。PCR定量反应步骤:1)将All-in-OneTMqPCR Mix在室温下融解,轻柔地上下颠倒混匀并进行短暂离心。2)冰上配制PCR Reaction Mix,包括2×All-in-OneTMqPCR Mix 10 μL、qPCR Primer (1 μmol/L) 2 μL、cDNA Template 2 μL,加入ddH2O使终体积至20 μL。在试验中设计了NTC(no template control),其为阴性对照,即用水代替模板cDNA,其他试剂不变,从而确保体系无污染。3)将反应管进行短暂离心,确保所有反应液在反应管底部。PCR反应程序为95 ℃ 10 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,40个循环;72 ℃ 10 min。PCR反应结束后,进行溶解曲线分析,即温度控制在72~95 ℃,每间隔10 s升高0.5 ℃,最后25 ℃保持30 s。试验设置3次重复。采用7300 System软件和2-ΔΔCt方法进行数据分析。
1.2.7 亚细胞定位
取长势健康的莲座期拟南芥叶片18张,用剪刀将其裁成0.5 mm宽的细条,放入10 mL酶解液(1.5% Cellulase R10与0.4% Macerozyme R10)中酶解110 min,将酶解液过滤200目细胞筛后转移至50 mL离心管中,100×g离心3 min,留沉淀,沉淀即原生质体。取适量洗液(MMG溶液)溶解原生质体。在MiGA2ox基因的ORF引入SalI和XbaI酶切位点,提取正确克隆的质粒,同pK7FWGF2.0-GFP质粒用SalI和XbaI双酶切,分别回收小片段和大片段,用T4DNA连接酶连接,从而得到pK7FWGF2.0-GFP/GA2ox融合表达载体,转入JM109,PCR、酶切筛选阳性克隆,并对阳性克隆进行测序验证。通过激光共聚焦显微镜进行观察。
2 结果与分析
2.1 MiGA2ox基因克隆
以杧果叶片RNA反转录的cDNA第1链为模板,用特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分离,在约900 bp处存在肉眼清晰可见的特异性条带(图1)。

图1 GA2ox基因序列中间片段Fig.1 Intermediate fragments in GA2ox gene sequence
根据已获得的GA2ox基因中间片段的序列信息分别设计2条特异引物(GA2ox3′ GSP-1、GA2ox3′ GSP-2)与通用引物进行PCR扩增,得到约900 bp的DNA片段(图2)。

图2 GA2ox基因 3′末端Fig.2 3′ terminal in GA2ox gene
根据已获得的GA2ox基因中间片段的序列信息分别设计2条特异引物(GA2ox5′ GSP-1、GA2ox5′ GSP-2)与通用引物进行PCR扩增,得到约400 bp的DNA片段(图3)。

图3 GA2ox基因 5′末端Fig.3 5′ terminal in GA2ox gene
利用DNAMAN软件对3′末端、5′末端及中间片段进行拼接,得到基因的全长序列。用BLAST进行核苷酸相似性检索,发现GA2ox序列与橙子(XM_006467404.3)、柑橘(XM_006449629.2)、木薯(XM_021738345.1)、巴西橡胶树(XM_021820571.1)、陆地棉(XM_ 016896568.1)、中棉(XM_012597405.1)的一致性分别为79%、79%、78%、78%、76%、75%。将杧果与上述6个物种GA2ox氨基酸序列进行多重序列对比,结果表明,GA2ox氨基酸序列较为保守(图4)。


图4 MiGA2ox与其他植物GA2ox同源性的比对Fig.4 Homology alignment of MiGA2ox and GA2ox from other plants
为了研究杧果GA2ox的进化情况,构建了GA2ox基因序列的系统进化树(图5)。由图5可见,杧果GA2ox与山黄麻GA2ox1(PON72625.1)、山黄麻GA2ox2(PON57518.1)、川桑GA2ox(XP_010110967.1)、面包树GA2ox1(ALS88210.1)、面包树GA2ox2(ALS88211.1)、面包树GA2ox3(ALS88212.1)亲缘关系较近,其次为蓖麻GA2ox(XP_015574955.1)、麻风树GA2ox(NP_001292962.1)、橡胶树GA2ox(XP_021649315.1)、木薯GA2ox(XP_021594037.1)、橡胶树GA2ox(XP_021676263.1)。
2.2 MiGA2ox基因编码氨基酸序列理化性质分析
经Protparam(http://web.expasy.org/protparam/) 在线分析,GA2ox序列均含有完整的开放阅读框,终止密码子为TGA。GA2ox编码341个氨基酸,产物的相对分子质量为38 729.40 Da,等电点为6.56。其中酸性氨基酸(Asp+Glu)41个,碱性氨基酸(Arg+Lys)39个。该蛋白为不稳定蛋白,脂肪指数为80.32,亲水性总平均值为-0.301。
Phobius在线分析结果表明,GA2ox编码的蛋白质可能有信号肽。同时进行GA2ox蛋白序列的跨膜结构域预测(图6)和GA2ox蛋白质的二级结构预测(图7)。结果显示,该蛋白的整条肽链均位于细胞膜外,结合上述信号肽的预测,推断该蛋白在细胞质基质中合成后,经蛋白质转运,直接锚定于细胞膜外的特定部位行使功能。
利用DNAMAN预测GA2ox的疏水性,结果如图8所示。由图8可见,GA2ox多肽链第91位的谷氨酸具有最低值-3.18,亲水性最强;第1位的蛋氨酸具有最高值2.84,疏水性最强。整体来看,亲水性氨基酸均匀分布在整个肽链中,无明显的疏水区域,疏水区域与亲水区域交替出现,这与不存在跨膜结构域的特征相吻合。
2.3 MiGA2ox基因在随机时间点的表达特征分析
在2个随机时间点进行实时荧光定量RT-PCR(qRT-PCR)分析,测定杧果叶片MiGA2ox基因表达量,结果如图9所示。由图9可见,在随机的2个时间点,具有矮化特性杧果品种‘桂热杧82号’的MiGA2ox基因表达量远高于乔化品种‘金煌杧’。
2.4 MiGA2ox基因编码蛋白的亚细胞定位
将构建的GA2ox基因的瞬时表达载体GA2ox-GFP转化到拟南芥原生质体中,使用基因枪轰击拟南芥原生质体24 h后,通过共聚焦激光扫描显微镜观察绿色荧光蛋白的信号,结果如图10所示。由图10可见,转GA2ox-GFP载体的绿色荧光分布在细胞核中。
3 结论与讨论
本试验中克隆得到广西地方矮化品种‘桂热杧82号’GA2ox基因,将该基因命名为MiGA2ox。经氨基酸序列分析发现,MiGA2ox编码蛋白有信号肽、无跨膜结构且无明显疏水区域;亚细胞定位结果显示,MiGA2ox基因编码的蛋白位于细胞核中行使功能;实时荧光定量qRT-PCR分析结果表明,在随机的2个时间点,具有矮化特性杧果品种‘桂热杧82号’中MiGA2ox基因的表达量均高于其在‘金煌杧’中的表达量。由此分析得出,‘桂热杧82号’MiGA2ox基因的高表达与其矮生性状有关。
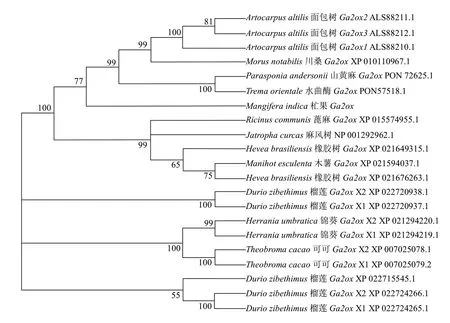
图5 MiGA2ox系统进化分析Fig.5 Phylogenetic analysis of MiGA2ox

图6 GA2ox编码蛋白的信号肽及跨膜结构域分析Fig.6 Signal peptide and transmembrane domain analysis of GA2ox encoding protein
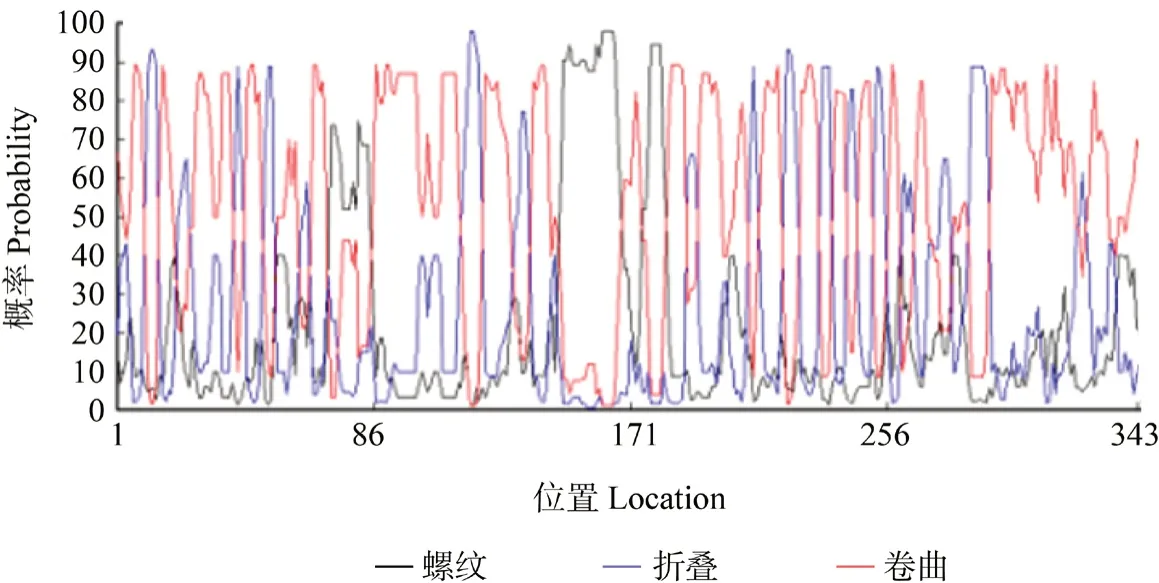
图7 GA2ox编码蛋白二级结构分析Fig.7 Secondary structure analysis of GA2ox encoding protein

图8 GA2ox编码蛋白疏水性分析Fig.8 Hydrophobicity analysis of GA2ox encoding protein
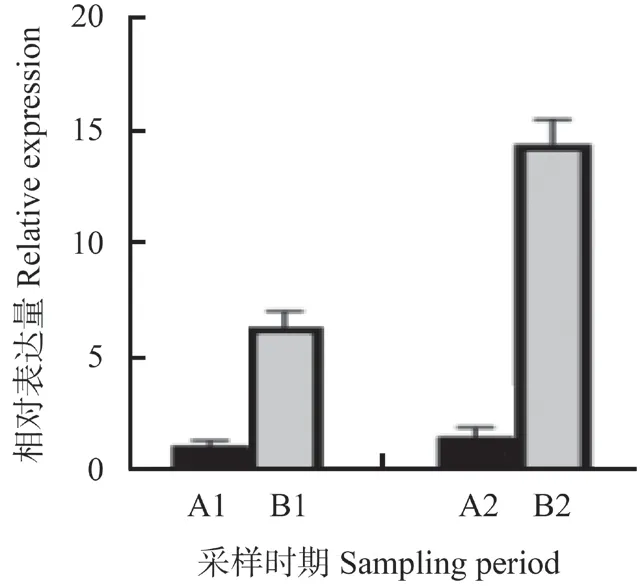
图9 ‘桂热杧82号’和‘金煌杧’中MiGA2ox在不同 时期的表达量Fig.9 Expression analysis of MiGA2ox in ‘Gui re No.82’ and ‘Jinhuangmang’ during different periods
将约900 bp的3′末端、约400 bp的5′末端和约900 bp的中间片段进行拼接,得到1个2 051 bp 全长序列。由于在酶处理过程中,RNA的3′末端或5′末端可能有个别碱基被消化,导致两端不完全一致,所以无准确的3′末端、5′末端和中间片段。RACE的结果往往是调取其中一个转录本的信息,仅是结果的一种情况,所以不能精准判断。本研究中将MiGA2ox基因定位于细胞核,而GA受体也在细胞中相同的位点[22-26]。这表明GA2ox可作为GA受体对生物活性GAs具有高亲和力,将其转换成失活形式[27]。MiGA2ox基因的亚细胞定位研究有利于研究其上下游级联组分析其在GA信号转导中的作用。利用BLAST进行氨基酸序列相似性检索分析,MiGA2ox核苷酸序列与橙子、柑橘的同源性最高,达到79%,与木薯、橡胶树、陆地棉、中棉的同源性均在75%以上。说明MiGA2ox编码氨基酸序列具有较高的保守性。通过构建系统进化树,结合其他植物GA2ox序列可知,杧果GA2ox与山黄麻、川桑、面包树、柑橘亲缘关系较近,与蓖麻、麻风树、橡胶树、木薯、橡胶树亲缘关系较远,这些分析结果的获得可为克隆同源基因提供参考。

图10 MiGA2ox编码蛋白在拟南芥原生质体中的亚细胞定位Fig.10 Subcellular localization of MiGA2ox encoding protein in Arabidopsis thaliana protoplast
但本研究中未能把模式植物拟南芥与杧果的GA2ox序列进行系统进化比较,不能依据模式植物拟南芥GA2ox基因的类别来判断杧果GA2ox基因的所属类别。另外,本研究中仅随机比较了2个时间点的MiGA2ox基因表达量,若选择开花期、抽芽期及果实成熟期等杧果关键物候期进行实时荧光定量分析,可更全面、准确地判断乔化和矮化杧果品种在不同物候期MiGA2ox基因表达量的变化规律。根据‘桂热杧82号’和‘金煌杧’MiGA2ox基因在不同时期表达量的对比分析结果,可以判断MiGA2ox基因参与调控矮化性状的表型,由于目前尚无构建成熟的杧果遗传转化体系,因此下一步的研究方向为利用模式植物烟草进行转MiGA2ox基因的表达研究,及MiGA2ox基因调控杧果矮生性状表型的分子机理。
