抑制miR-31表达对人角质形成细胞增殖、凋亡的影响研究
2020-04-27石娴,石年
石 娴,石 年
尖锐湿疣作为人乳头状瘤病毒(HPV)感染所致的皮肤黏膜增殖性疾病,主要发生在生殖器部位,严重威胁人类健康,尤其是高危型HPV引起的尖锐湿疣,会导致病人皮损角质形成细胞的过度增殖,极大增加了进展为基底细胞癌或皮肤鳞癌的风险[1-2]。研究[3]表明,尖锐湿疣是一个多基因调控的复杂的发生及进展过程。微小RNA(micro RNA,miR)作为广泛存在于生物体内的高度保守短小RNA,在细胞增殖、分化、凋亡、免疫反应等多种生物学功能中发挥重要作用[4]。有研究[5]指出,尖锐湿疣病人皮损组织中miR-31表达异常,可能参与了其发生、进展过程。本研究拟利用反义寡核苷酸技术(antisense oligonueleotide,ASO)特异性抑制miR-31表达,观察其对人角质形成细胞系HaCaT细胞增殖、凋亡的影响,以期为临床实践提供基础资料。
1 材料与方法
1.1 主要试剂和仪器 人角质形成细胞系HaCaT细胞购自江苏凯基生物公司,RPMI-1640培养液(含10%胎牛血清)购自美国Gibico公司,青链霉素混合液购自碧云天生物公司,LipofectamineTM2000转染试剂购自美国Invitrogen公司,miR-31基因序列、miR-31 ASO和对照ASO、内参引物均由生工生物工程(上海)股份有限公司设计合成,Trizol总RNA提取试剂盒购自美国Invitrogen公司,逆转录试剂盒及PCR试剂盒购自宝生物公司,四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)均购自美国Sigma公司,Annexin V-FITC/PI凋亡检测试剂盒购自上海高创化学科技有限公司,Transwell小室和基底胶均购自美国Corning公司,BCA蛋白检测试剂盒购自碧云天生物研究所,兔抗Rho相关结构域BTB蛋白质1(RhoBTB1)抗体购自江莱生物公司,ABI实时荧光定量PCR仪购自美国ABI公司,全自动酶标仪购自美国Bio-Rad公司,流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养及转染 将HaCaT细胞培养于RPMI-1640培养液(含10%胎牛血清)中,于37 ℃、5%CO2条件下恒温培养。细胞处理前24 h,将细胞接种于6孔板中,于细胞汇合度达到60%左右时,利用LipofectamineTM2000转染试剂盒对不同组细胞分别进行转染。ASO组:转染miR-31 ASO,序列:5′-AGC UAU GCC AGC AUC UUG CCU-3′;对照ASO组:转染对照ASO,序列:5′-UUC UCC GAA CGU GUC ACG UTT-3′;空白对照组:转染空白质粒。
1.2.2 实时荧光定量PCR检测不同转染组细胞中miR-31表达 取转染后培养48 h细胞,用细胞裂解液进行裂解后,用Trizol总RNA提取试剂盒提取细胞中总RNA,利用紫外分光光度计检测样品纯度,取A260/A280≥1.80的合格样本完成后续实验。利用逆转录试剂盒将总RNA逆转录为单链cDNA,以模板链cDNA作为模板,利用PCR试剂盒进行PCR操作。miR-31及内参引物分别为,miR-31引物:上游5′-CAT CTT CAA AAG CGG ACA CTC T-3′,下游5′-ACA ATA CAT AGC AGG ACA GGA AG-3′;U6引物:上游5′-TGC GGG TGC TCG CTT CGG CAG C-3′,下游5′-CCA GTG CAG GGT CCG AGG T-3′。PCR反应条件:94 ℃ 60 s,92 ℃ 45 s,56 ℃ 30 s,74 ℃ 30 s,36个循环。每个样品均设置3个平行反应复孔。以U6为参照,用2-△△Ct法获得不同组细胞中miR-31相对表达量。
1.2.3 MTT法检测不同转染组细胞增殖情况 将各组转染后处于对数生长期细胞接种于96孔板,细胞数约为5×103/孔,分别于培养0、24、48、72、96 h时,每孔加入MTT液20 μL,继续培养4 h,去除孔中培养液后,将DMSO加入,室温条件下振荡8 min,用全自动酶标仪取490 nm波长处,对各孔吸光度(A)值进行测量,以A值代表细胞增殖能力。
1.2.4 Annexin V-FITC/PI双染色检测不同转染组细胞凋亡情况 取各组转染后培养48 h细胞,用胰蛋白酶对细胞进行消化后收集细胞,用PBS液洗涤3次,于2 000 r/min离心5 min,收集细胞,加入缓冲液重新悬浮,使细胞浓度调整为1×105个/mL,取细胞悬液100 μL,放置于流式管中,分别将Annexin V-FITC和PI加入,于避光条件下,振动摇匀10 min,利用流式细胞仪对细胞凋亡情况进行检测。
1.2.5 PI单染色法检测不同转染组细胞周期 取转染后48 h细胞,胰酶消化后收集细胞,用预冷PBS液洗涤,加入70%乙醇固定,于4 ℃下过夜孵育。加入RNaseA,于37 ℃条件下孵育40 min,取出后放置于冰上以终止RNaseA作用,将PI加入,于4 ℃条件下避光反应30 min,用流式细胞仪检测细胞周期变化。
1.2.6 Western blotting检测不同转染组细胞中RhoBTB1蛋白表达 取各组转染后培养48 h细胞,加入细胞裂解液裂解,用总蛋白提取试剂盒对总蛋白进行提取,并用BCA蛋白检测试剂盒进行检测。取总蛋白,用SDS-PAGE进行凝胶电泳,电转移至硝酸纤维素膜上,用5%脱脂奶粉进行封闭60 min,用PBST进行洗膜。滴加兔抗RhoBTB1抗体(1∶1 000稀释),4 ℃下过夜孵育。PBST洗膜3次,将山羊抗兔二抗IgG加入,孵育120 min,PBST洗膜3次,ECL电化学发光反应后,拍照并用Image J图像分析软件进行分析,以GAPDH为内参,获得目的蛋白相对表达量。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 不同转染组细胞中miR-31表达量比较 ASO组细胞中miR-31表达量为(0.37±0.09),明显低于对照ASO组(0.91±0.11)和空白对照组(0.89±0.13)(P<0.01),而对照ASO组和空白对照组差异无统计学意义(P>0.05)。
2.2 不同转染组细胞增殖情况比较 ASO组细胞在24、48、72、96 h时A值均低于对照ASO组和空白对照组(P<0.05~P<0.01),而对照ASO组和空白对照组细胞不同时点A值差异均无统计学意义(P>0.05)。3组细胞随着时间推移,A值均较之前有所逐渐增加(P<0.01)(见表1)。

表1 不同转染组在不同时点细胞增殖情况比较(A值;
q检验:与AOS组比较*P<0.05,**P<0.01;与0 h比较△P<0.05,△△P<0.01;与24 h比较#P<0.05,##P<0.01;与48 h比较+P<0.05,++P<0.01;与72 h比较-P<0.05,--P<0.01
2.3 不同转染组细胞凋亡情况比较 3组细胞凋亡率差异有统计学意义(P<0.01),ASO组细胞凋亡率明显高于对照ASO组和空白对照组(P<0.01),而对照ASO组和空白对照组细胞凋亡率差异无统计学意义(P>0.05)(见表2、图1)。
2.4 不同转染组细胞周期情况比较 ASO组G0/G1期细胞比例明显高于对照ASO组和空白对照组,而S期和G2期细胞比例明显低于对照ASO组和空白对照组(P<0.01)(见表3、图2)。
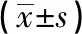
表2 不同转染组细胞凋亡情况比较
q检验:与AOS组比较**P<0.01
2.5 不同转染组细胞中RhoBTB1蛋白表达比较 Western blotting检测结果显示,ASO组细胞中RhoBTB1蛋白表达量明显高于对照ASO组和空白对照组,差异均有统计学意义(P<0.01),而对照ASO组和空白对照组细胞中RhoBTB1蛋白表达量差异无统计学意义(P>0.05)(见表4、图3)。

表3 不同转染组细胞周期的变化
q检验:与AOS组比较**P<0.01
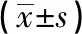
表4 不同转染组细胞中RhoBTB1蛋白表达比较
q检验:与AOS组比较**P<0.01
3 讨论
尖锐湿疣的发生是涉及多因素、多基因参与的复杂过程,引起尖锐湿疣的HPV感染与生殖器部位恶性肿瘤的发生密切相关[6],尖锐湿疣病人皮损处角质形成细胞的过度增殖增加癌变的风险[7]。miR作为一种高度保守的短小RNA,在细胞增殖、分化、凋亡等过程中发挥重要作用,且参与了恶性肿瘤发生及进展过程[8]。研究表明,miR-31在结肠癌[9]、胃癌[10]等恶性肿瘤中呈高表达,亦有研究[5]指出,miR-31在尖锐湿疣病人皮损中呈高表达。为进一步探讨miR-31对HaCaT细胞增殖和凋亡的影响,本研究利用ASO技术特异性抑制miR-31表达,结果显示,ASO组细胞中miR-31表达量明显低于对照ASO组和空白对照组,说明HaCaT细胞中miR-31被特异性抑制。
本研究显示,ASO组细胞在24、48、72、96 h时A值均低于对照ASO组和空白对照组,说明在特异性抑制miR-31表达后,细胞增殖被显著抑制,提示miR-31可能参与了HaCaT细胞增殖过程,在HaCaT细胞大量增殖过程中发挥重要作用。本研究还显示,ASO组细胞凋亡率明显高于对照ASO组和空白对照组,说明特异性抑制miR-31可明显抑制细胞凋亡的发生,进一步对细胞周期分析发现,ASO组G0/G1期细胞比例明显高于对照ASO组和空白对照组,而S期和G2期细胞比例明显低于对照ASO组和空白对照组,说明抑制miR-31表达可阻止细胞从G1期向S期进展,从而影响HaCaT细胞增殖过程,同时加速细胞凋亡的发生。RhoBTB1基因位于人染色体10q21.3区域,是RhoBTB亚家族重要成员,在细胞转录、细胞骨架调控、离子通道装配、蛋白泛素化等过程中发挥重要作用[11],被认为是一种肿瘤抑制因子,在恶性肿瘤组织中呈低表达[12],多项研究[13-14]表明,RhoBTB1是miR-31作用靶点。本研究显示,ASO组细胞中RhoBTB1蛋白表达量明显高于对照ASO组和空白对照组,说明特异性抑制miR-31可促进RhoBTB1蛋白表达,推测miR-31可能通过调控RhoBTB1蛋白表达而实现对HaCaT细胞增殖和凋亡的影响。
综上所述,miR-31可能参与了人角质形成细胞系HaCaT细胞增殖、凋亡过程,可能通过调控RhoBTB1蛋白表达而实现这一生物学过程,但具体作用机制尚待进一步研究明确。
