薄荷和罗勒提取物体外抗氧化及保肝活性研究
2020-04-14许传俊明艳林
李 煊,梁 诗,黄 雯,许传俊,明艳林*
(1.厦门华侨亚热带植物引种园/ 厦门市植物引种检疫与植物源产物重点实验室,福建 厦门 361002;2.福建省亚热带植物研究所/ 福建省亚热带植物生理生化重点实验室,福建 厦门 361006)
唇形科有10 亚科220 余属3500 余种,多为半灌木或灌木,一年生至多年生草本植物,主产于地中海及中亚地区,我国有99 属800 余种[1—2]。唇形科植物富含多种芳香油成分,具有明显的芳香气味,挥发性油类是其中研究较为深入的化学组分。
薄荷(Mentha haplocalyx) 和罗勒(Ocimum basilicum)均为常见的唇形科药食两用植物,餐饮中可作为调味料、香料或凉拌菜、煲汤等[3—4],两者皆为解表类中药[5—8],但薄荷和罗勒常被混用。《中国药典》(2020)记载,薄荷为唇形科植物的干燥地上部分,夏、秋二季薄荷茎叶茂盛或花开至三轮时,选晴天,分次采割,晒干或阴干其地上部分可入药,味辛,性凉,归肺、肝经,主要用于疏散风热,清利头目,利咽,透疹,疏肝行气[9]。现代药理研究表明,薄荷主要含有挥发油、黄酮、氨基酸、萜类等物质[10],具有镇痛消炎[11]、抗菌[12]、抗病毒[13]、抗氧化[14]、降血糖[15]等作用。罗勒味辛、甘,性温,归肺、脾、胃、大肠经,全草可入药,具有疏风解表、化湿和中、行气活血、解毒消肿之功效。罗勒主要含有挥发油、黄酮及其苷类、香豆素、多糖等成分[16],具有抗菌[17]、抗炎[1]、抗氧化[18]、驱蚊虫[19]及降糖、降脂[20]等作用。目前关于薄荷、罗勒的研究并不完善,相关研究主要集中在挥发油活性方面,对其保肝活性鲜有报道。本文通过自由基清除实验及酒精性肝损伤细胞模型实验对薄荷、罗勒水和乙醇提取物的抗氧化活性及保肝效果进行研究。
1 材料与方法
1.1 材料与试剂仪器
薄荷和罗勒采于厦门华侨亚热带植物引种园。HepG2 细胞株购自中国科学院上海细胞库。DMEM培养基购自上海源培生物科技股份有限公司;胎牛血清(FBS)购自Gibco 公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、噻唑蓝(MTT)购自Sigma 公司;其他试剂均为国产分析纯。
主要仪器有Thermo MK3 型酶标仪、Thermo 超低温冰箱、EYELA N-1100S-W 旋转蒸发仪、Christ Alpha 2-4 LD plus 冷冻干燥机、Thermo 二氧化碳恒温培养箱、PerkinElmer Lambda25 紫外分光光度计等。
1.2 方法
1.2.1 提取物制备
称取薄荷和罗勒干粉,分别用水和95%乙醇按料液比1:20,45 ℃超声提取,收集滤液减压浓缩(45 ℃)至无醇味,得到薄荷、罗勒水提物和醇提物浸膏。将浸膏于-80 ℃超低温冰箱预冻12 h 后,冷冻干燥,得到提取物干燥粉末,密封保存于-20 ℃。
1.2.2 DPPH 自由基清除测定
分别取2 mL 不同浓度薄荷水提物、醇提物(50、100、200、400、800 μg·mL-1)和罗勒水提物、醇提物(100、200、400、600、800 μg·mL-1)以及阳性对照Vc(5、10、15、20、25 μg·mL-1)待测液,加入2 mL 0.1 mmol·L-1DPPH 自由基溶液,摇匀,避光30 min后于517 nm 波长处测定吸光度Ai;将DPPH 自由基溶液用等体积无水乙醇代替,其他同前,测吸光度Aj;将样品用等体积无水乙醇代替,其他同前,测吸光度 Ae。DPPH 自由基清除率 K=[1-(Ai-Aj)/Ae]×100%。
1.2.3 ABTS 自由基清除测定
取7.9 mg ABTS 溶于10 mL 蒸馏水,另取1.3 mg过硫酸钾溶于10 mL 蒸馏水,混合两种溶液即得ABTS 储备液,室温条件下避光储存过夜,使用时稀释4 倍。分别取不同浓度薄荷水提物(20、40、60、80、100 μg·mL-1)、薄荷醇提物(1、2、5、10、25 μg·mL-1)、罗勒水提物(20、40、60、80、100 μg·mL-1)、罗勒醇提物(10、20、30、40、50 μg·mL-1)以及阳性对照Vc(2.5、5、10、15、25 μg·mL-1)样品液和ABTS 稀释液等量混合,在734 nm 处测吸光度;将样品液用等体积水代替,其他同前,测吸光度。ABTS 自由基清除率K′=[1-(Ai′-Ae′)/(Aj′-Ae′)]×100%,K′为清除率,Ai′为加试样反应后ABTS 溶液的吸光度,Aj′为不加试样溶液的吸光度;Ae′为不加ABTS 溶液的吸光度。
1.2.4 细胞存活率测定
于96 孔板接种对数生长期HepG2 细胞每孔3000 个,37 ℃孵育24 h,分别加入不同浓度薄荷水提物(终浓度0、20、40、80、160、320 μg·mL-1)、薄荷醇提物(终浓度 0、6.25、12.5、25、50、100 μg·mL-1)、罗勒水提物(终浓度0、62.5、125、250、500、1000 μg·mL-1)、罗勒醇提物(终浓度0、8、16、32、64、128 μg·mL-1)药液,37 ℃孵育24 h 后,每孔加入20 μL 5 mg·mL-1MTT 培养液,孵育4 h,弃上清液,每孔加100 μL DMSO,震荡20 min 后,用酶标仪测定570 nm 吸光度值。
细胞活力(%)=(药物组吸光度值-调零孔吸光度值)/(对照孔吸光度值-调零孔吸光度值)×100%。
1.2.5 酒精刺激HepG2 细胞存活率测定
参考罗燕梅等[21]方法,于96 孔板接种对数生长期HepG2 细胞每孔3000 个,37 ℃孵育24 h,分别加入不同浓度薄荷、罗勒水提物和醇提物(0、5、10、20、50 μg·mL-1)预处理24 h,各组加入终浓度800 mmol·L-1乙醇诱导损伤,正常对照组加入等量培养液,其他同1.2.4 处理并计算细胞活力。
1.2.6 数据处理
采用GraphPad Prism 6 进行数据分析。
2 结果与分析
2.1 薄荷、罗勒水提物和醇提物DPPH 自由基清除能力
比较薄荷、罗勒水提物和醇提物与Vc(阳性对照)的DPPH 自由基清除能力。结果表明,薄荷、罗勒提取物均具有一定的抗氧化活性,其中薄荷水提物和醇提物具有较好的DPPH 自由基清除效果,且作用效果相近,而罗勒水提物和醇提物对DPPH 自由基的清除效果较弱。DPPH 自由基清除能力大小依次为Vc>薄荷醇提物>薄荷水提物>罗勒醇提物>罗勒水提物(图 1),其半效应浓度(EC50)分别为12.65 μg·mL-1、70.42 μg·mL-1、75.77 μg·mL-1、354.87 μg·mL-1、451.53 μg·mL-1(表1)。
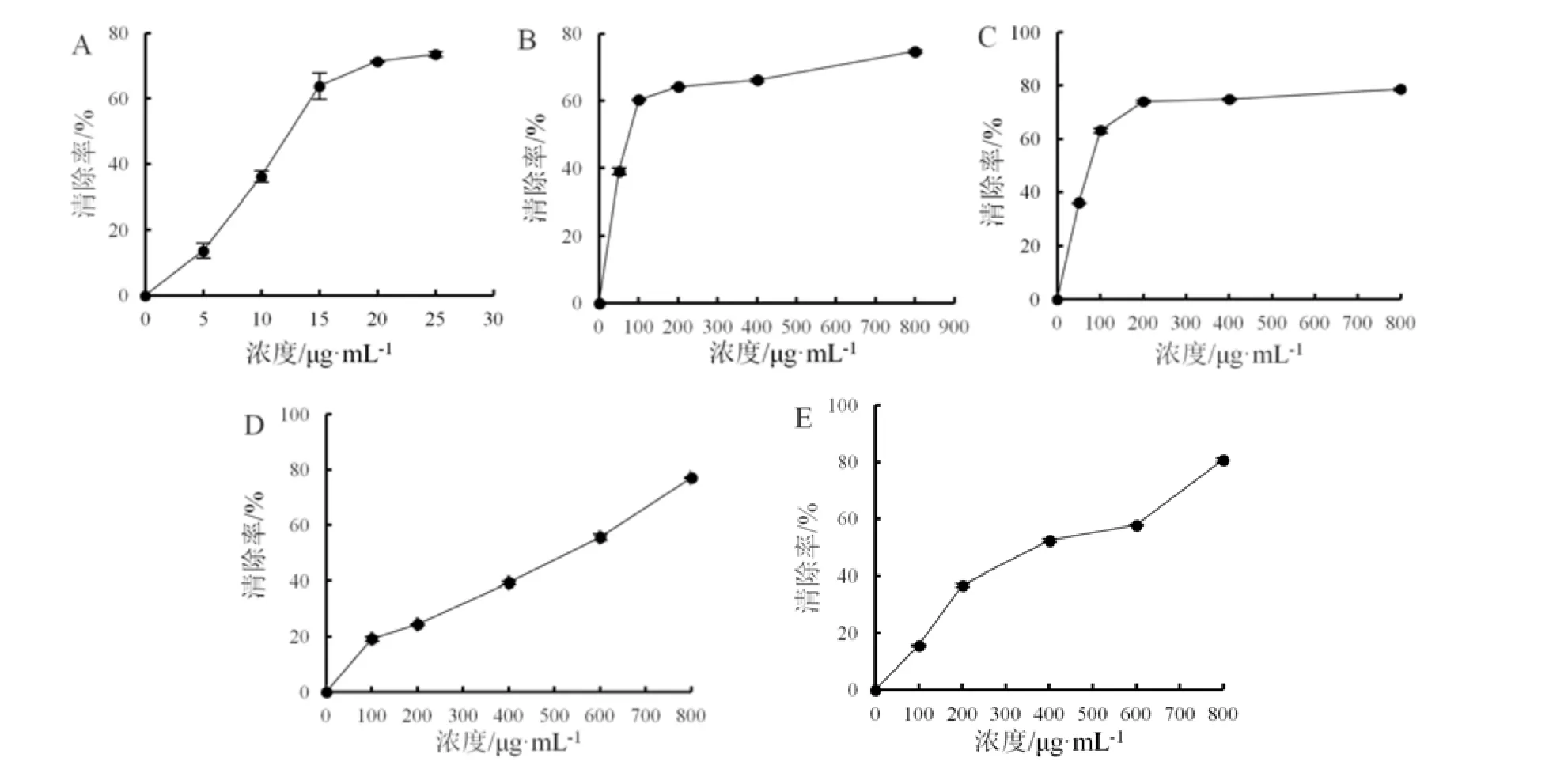
图1 薄荷和罗勒水、醇提取物的DPPH 自由基清除能力Fig.1 DPPH radical scavenging capacity of Mentha haplocalyx and Ocimum basilicum extracts with water and ethanol
2.2 薄荷、罗勒水提物和醇提物ABTS 自由基清除能力
评价薄荷、罗勒水提物、醇提物和Vc(阳性对照)清除ABTS 自由基的能力。与清除DPPH 自由基能力相似,薄荷提取物整体上具有更好的ABTS 自由基清除效果,但不同的是,薄荷醇提物显示出优于阳性对照Vc的自由基清除效果,而罗勒水取物和醇提物均呈现出较好的ABTS 自由基清除效果。ABTS 自由基清除能力大小依次为薄荷醇提物>Vc>罗勒醇提物>薄荷水提物>罗勒水提物(图2),其半效应浓度(EC50)分别为9.04 μg·mL-1、9.31 μg·mL-1、18.03 μg·mL-1、22.18 μg·mL-1、36.88 μg·mL-1(表1)。
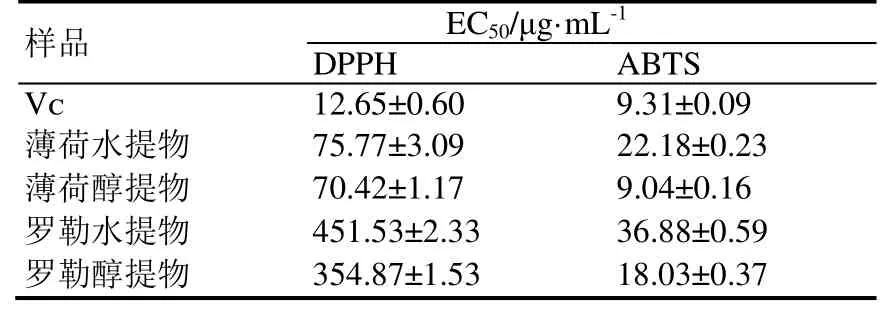
表1 薄荷、罗勒提取物自由基清除能力Table 1 Radical scavenging capacity of Mentha haplocalyx and Ocimum basilicum extracts
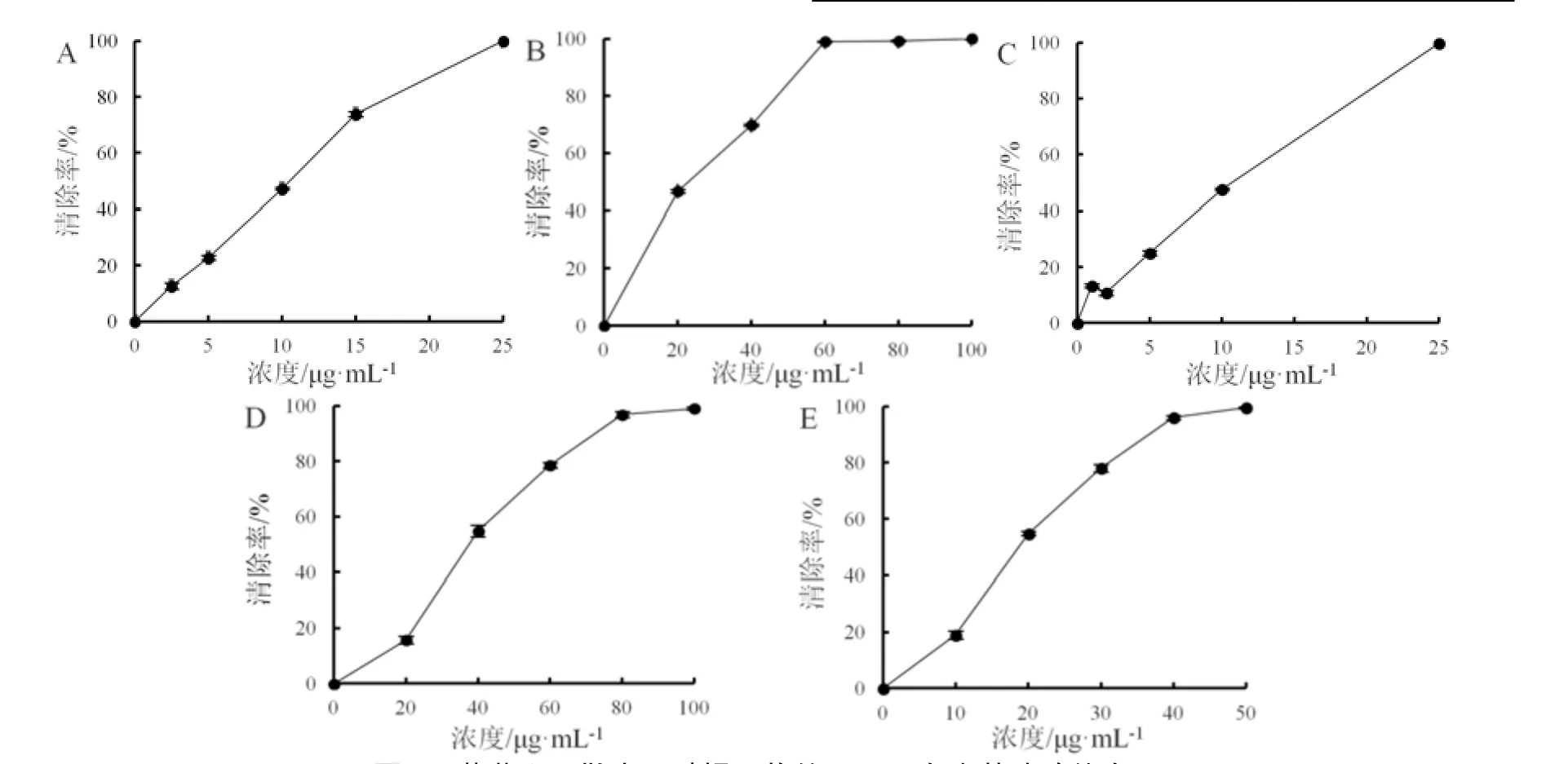
图2 薄荷和罗勒水、醇提取物的ABTS 自由基清除能力Fig.2 ABTS radical scavenging capacity of Mentha haplocalyx and Ocimum basilicum extracts with water and ethanol
2.3 薄荷、罗勒水提物和醇提物对酒精诱导HepG2细胞的影响
采用HepG2 细胞模型评价薄荷、罗勒水提物和醇提物对酒精肝损伤的保护效果,首先对薄荷、罗勒水提物和醇提物的细胞毒性进行测定。结果表明,薄荷水提物、醇提物和罗勒水提物、醇提物分别在320 μg·mL-1、100 μg·mL-1、500 μg·mL-1、128 μg·mL-1浓度范围内对模型细胞株HepG2 无细胞毒性(图3)。
在对薄荷、罗勒水提物和醇提物细胞毒性评价的基础上,选择无毒浓度5、10、20、50 μg·mL-1进行酒精肝损伤保护效果评价。结果表明,薄荷水提物、薄荷醇提物和罗勒水取物对乙醇诱导的HepG2 细胞损伤有明显的保护效果,而罗勒醇提物未见明显效果(图4)。薄荷水提物和醇提物处理组中,与对照相比,模型组(eth)细胞存活率分别下降至41.21%和41.80%,而使用薄荷水提物和醇提物处理的药物浓度组细胞存活率显著增加,在浓度50 μg·mL-1处理下,薄荷水提物和醇提物使细胞存活率分别比模型组提高了33.97%、44.72%;罗勒水提物处理组中,模型组细胞存活率相对于对照组下降至26.35%,50 μg·mL-1罗勒水提物处理的细胞存活率比模型组提高了59.40%。
3 讨论
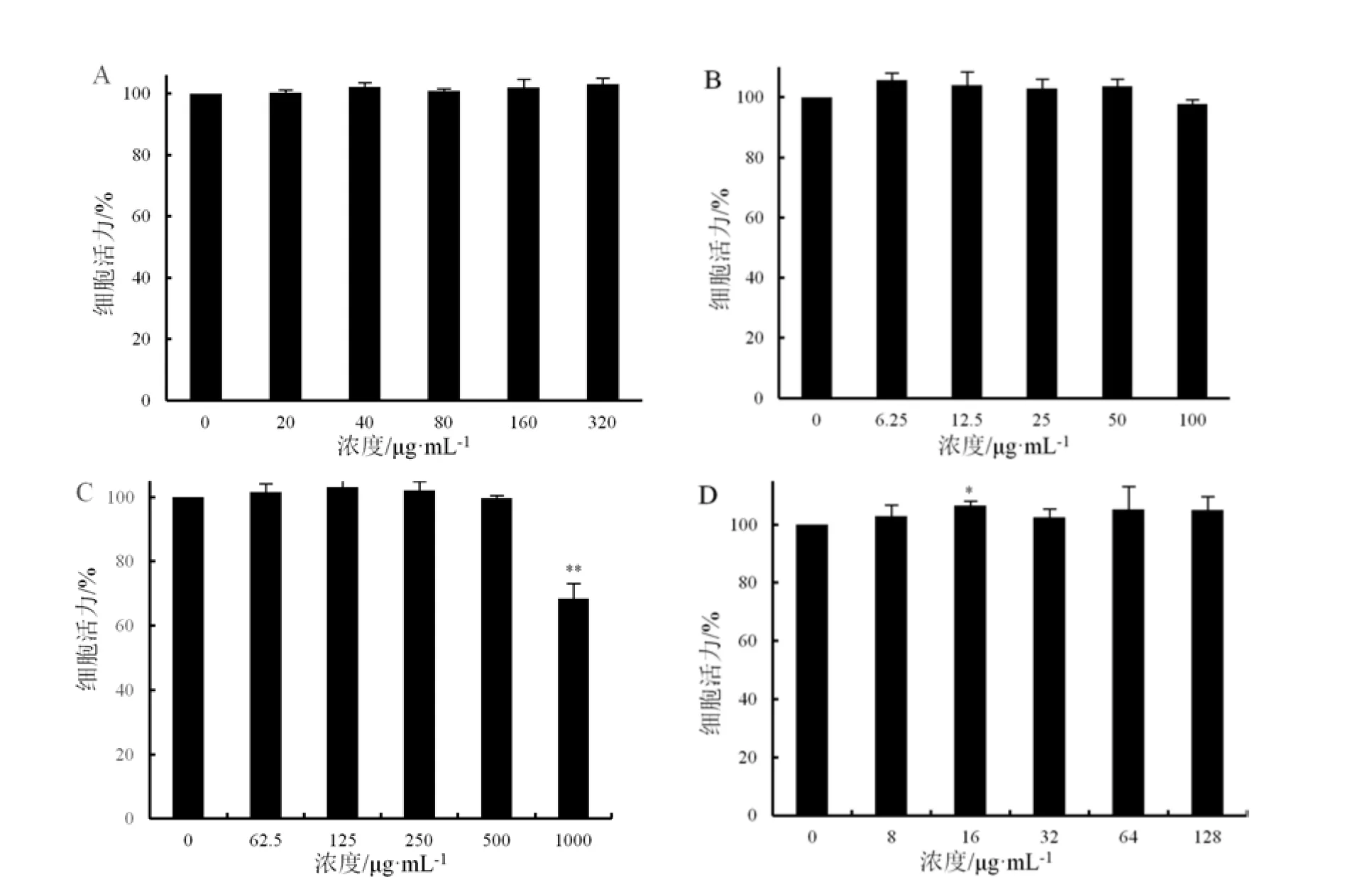
图3 薄荷、罗勒提取物对HepG2 细胞的毒性Fig.3 Cytotoxicity of Mentha haplocalyx and Ocimum basilicum extracts to HepG2 cells
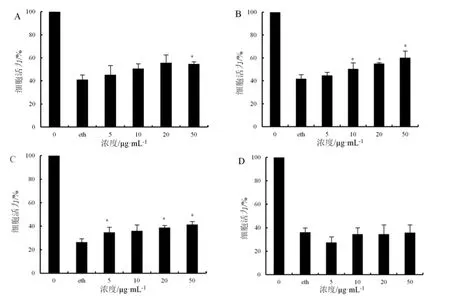
图4 薄荷、罗勒提取物对酒精性肝损伤的保护作用Fig.4 Protective effect of Mentha haplocalyx and Ocimum basilicum extracts on alcoholic liver injury
本文采用DPPH、ABTS 自由基清除实验评价两种唇形科植物水提物和醇提物的体外抗氧化能力,并通过体外HepG2 细胞模型测定其对酒精性肝损伤的保护作用。结果表明,薄荷与罗勒的提取物具有较好抗氧化活性,其中薄荷提取物的抗氧化能力整体上优于罗勒提取物,醇提物的抗氧化效果优于水提物。薄荷水提物和醇提物对DPPH 自由基的清除效果较好,且EC50值相差不大,分别为75.77 μg·mL-1、70.42 μg·mL-1,薄荷醇提物对ABTS 自由基的清除效果更甚于阳性对照Vc,EC50值为9.04 μg·mL-1,显示出极好的抗氧化能力。相比于DPPH 自由基的清除效果,罗勒水提物和醇提物对ABTS 自由基有更好的清除效果。薄荷和罗勒的抗氧化能力及差别可能主要归因于薄荷中挥发油、黄酮、多酚含量更高[1,22—24]。体外酒精肝损伤细胞模型实验表明,薄荷水提物、薄荷醇提物和罗勒水提物显著地提高了酒精诱导后HepG2 细胞的存活率,且效果呈现剂量依赖性,但罗勒醇提物没有明显的效果。在酒精性肝损伤发生、发展过程中,氧化应激、炎症、凋亡等因素起着重要推动作用[25]。薄荷和罗勒提取物的抗氧化能力,可能有助于减轻酒精性肝损伤过程中的氧化应激程度,但薄荷和罗勒提取物的保肝功效可能并不完全依赖其抗氧化能力,其保肝机制有待进一步研究。
