云南常见药用石斛DNA 条形码筛选
2020-04-14徐素素陈军文刘祥宇张敬丽
徐素素,高 静,陈军文,刘祥宇,张敬丽*
(1.云南农业大学园林园艺学院,云南 昆明 650201;2.云南农业大学西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201;3.云南农业大学云南省药用植物生物学重点实验室,云南 昆明 650201;4.云南农业大学农学与生物技术学院,云南 昆明 650201)
石斛是我国传统名贵中药材,始载于《神农本草经》,自古以来被列为药材上品,具有益胃生津、滋阴清热等功效,在抗衰老、抗肿瘤、调节血糖等方面作用显著[1—4],越来越多的石斛药材被加工成保健品、中成药制剂。石斛属(Dendrobium)是兰科(Orchidaceae)种类最多的属之一,《中国植物志》中记载石斛属有74 种和2 变种[5—6]。云南有石斛属植物58 种和2 变种[7],是中国石斛资源最丰富的省份,是中国石斛属植物地理分布中心和起源中心,也是中药石斛的主要来源地和产地[8—9]。云南省内以“石斛”命名的药材高达27 种[10],多用于治疗感冒咳嗽、黄疸型肝炎、胃炎、湿疹、跌打损伤等病症[11]。
由于石斛市场需求量大,自身繁殖率低、生长慢,生境破坏等原因,野生石斛资源濒临绝灭,现已被列为濒危中药品种之一[12]。药用石斛资源珍贵且加工后失去原有形态特征,导致石斛药材掺假现象严重,药用石斛的临床疗效和安全应用得不到保障,亟需为石斛属植物的鉴别建立快速、准确以及简便的鉴定方法,以保障石斛临床用药的安全性和有效性。仅凭借传统的鉴定方法难以准确地将中药材从其混伪品中区分[13—15]。DNA 条形码(DNA barcoding)是利用标准的DNA 序列从基因层面对物种进行鉴别,不受时间、环境、物种等因素的影响,具有较强的通用性和较高的识别准确率[16];陈士林团队[17—19]历时10 年完成11000 余种样品的DNA 条形码研究,首次建立以ITS2为核心,psbA-trnH为辅的植物类药材DNA 条形码鉴定体系,并提出以ITS2序列作为植物通用DNA 条形码,极大提升了中药材鉴定能力,并被纳入《中国药典》2015 年版四部[20]。目前,DNA 条形码已成功应用于多个科属的药用植物及药材鉴定[21—22];在形态学上难以辨别的五味子(Schisandra chinensis)、金钱草(Lysimachia christinae)等药用植物鉴定中也有较好的应用[23—24]。DNA 条形码技术在石斛属中的应用也越来越广泛[25],相关研究利用DNA 条形码技术已成功区分多个石斛属物种[26—28]。
本研究应用核基因片段ITS和ITS2序列以及叶绿体基因片段psbA-trnH和matK序列对云南省内常见的12 种药用石斛进行鉴定研究,为药用石斛的基源鉴定提供技术依据。
1 材料与方法
1.1 材料
用于DNA 条形码分析的36 份实验材料来自云南野兰堂生物科技有限公司兰科植物种质资源圃(表1),由云南农业大学孟珍贵副教授鉴定,凭证标本保存于云南农业大学云南省药用植物生物学重点实验室。从GenBank 数据库下载116 条序列用于后续分析(表2)。

表1 石斛属植物样本采集信息Table 1 Sample information of Dendrobium species
1.2 试剂与仪器
CTAB、NaCl、EDTA、氯仿、异戊醇和乙醇等为分析纯;Tris、NaOH、液氮、灭菌双蒸水、琼脂糖粉;RNA 酶、2×TaqPCR Master Mix、D10000Marker、D5000Marker、6×Loading buffer 等。
DYY-8C 型电泳仪(北京六一仪器厂);台式冷冻离心机(Beckman Coulter);PCR 仪[MJ Research(Waltham,MA,USA) PTC200-well thermal cycler];紫外分光光度计(UV-2550 型,SHIMADZU 公司)、凝胶成像系统等。
1.3 方法
1.3.1 DNA 提取
称0.2 g 石斛新鲜叶片,放入研钵中并加入液氮冷冻,快速研磨成粉,参考李金璐等[29]改良的CTAB法提取总DNA。
1.3.2 PCR 扩增
通用引物和PCR 反应参考陈士林等[17]的研究,通用引物在擎科生物科技有限公司昆明分部合成。ITS、ITS2、psbA-trnH及matK扩增引物见表3。PCR扩增体系总体积为25 μL,包括2×TaqPCR Mix 12.5 μL,DNA 模板2 μL,正反向引物各1 μL,ddH2O 8.5 μL。用1%琼脂糖凝胶电泳检测PCR 产物。扩增成功的PCR产物由擎科生物科技有限公司双向测序。
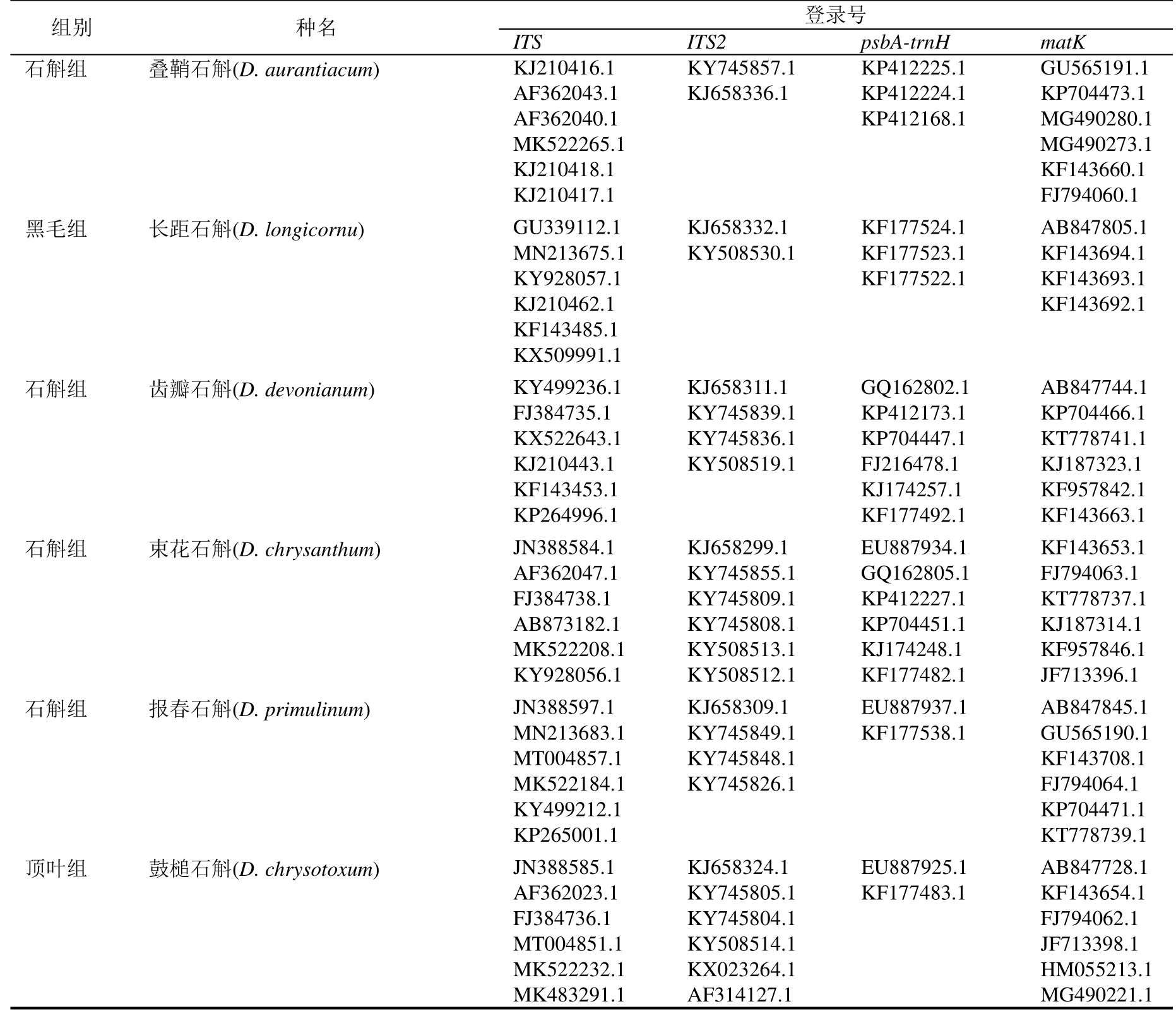
表2 从GenBank 中下载序列信息Table 2 The information of sequence downloaded from GenBank
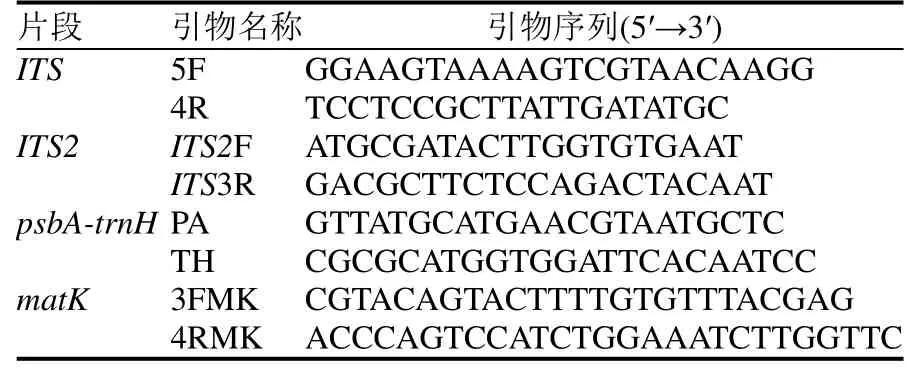
表3 序列引物Table 3 The sequence primers
1.4 数据处理
通过DNAMan 对双向测序结果进行校对拼接,去除低质量序列及引物区。基于隐马尔科夫模型(HMMer)的注释方法[30],去除5.8S 和28S 区段获得ITS2间隔区序列;psbA-trnH序列则根据GenBank数据库中的序列比对获得间隔区。
使用MEGA 7.0(Molecular Evolutionary Genetics Analysis)软件分析序列碱基组成、GC 含量、保守位点、变异位点和简约信息位点;基于K2P(Kimura 2-parameter)模型计算种内种间遗传距离及构建NJ(Neighbor Joining)系统发育树,用自举检验法(Bootstrap test)检验系统各分支置信度,循环1000 次。
2 结果与分析
2.1 扩增及测序成功率分析
对36 个药用石斛样品提取总DNA 后利用通用引物进行PCR 扩增并测序。测序结果表明,所有序列的峰图清晰、基线平整(图1),四条序列的扩增及测序成功率均为100%。
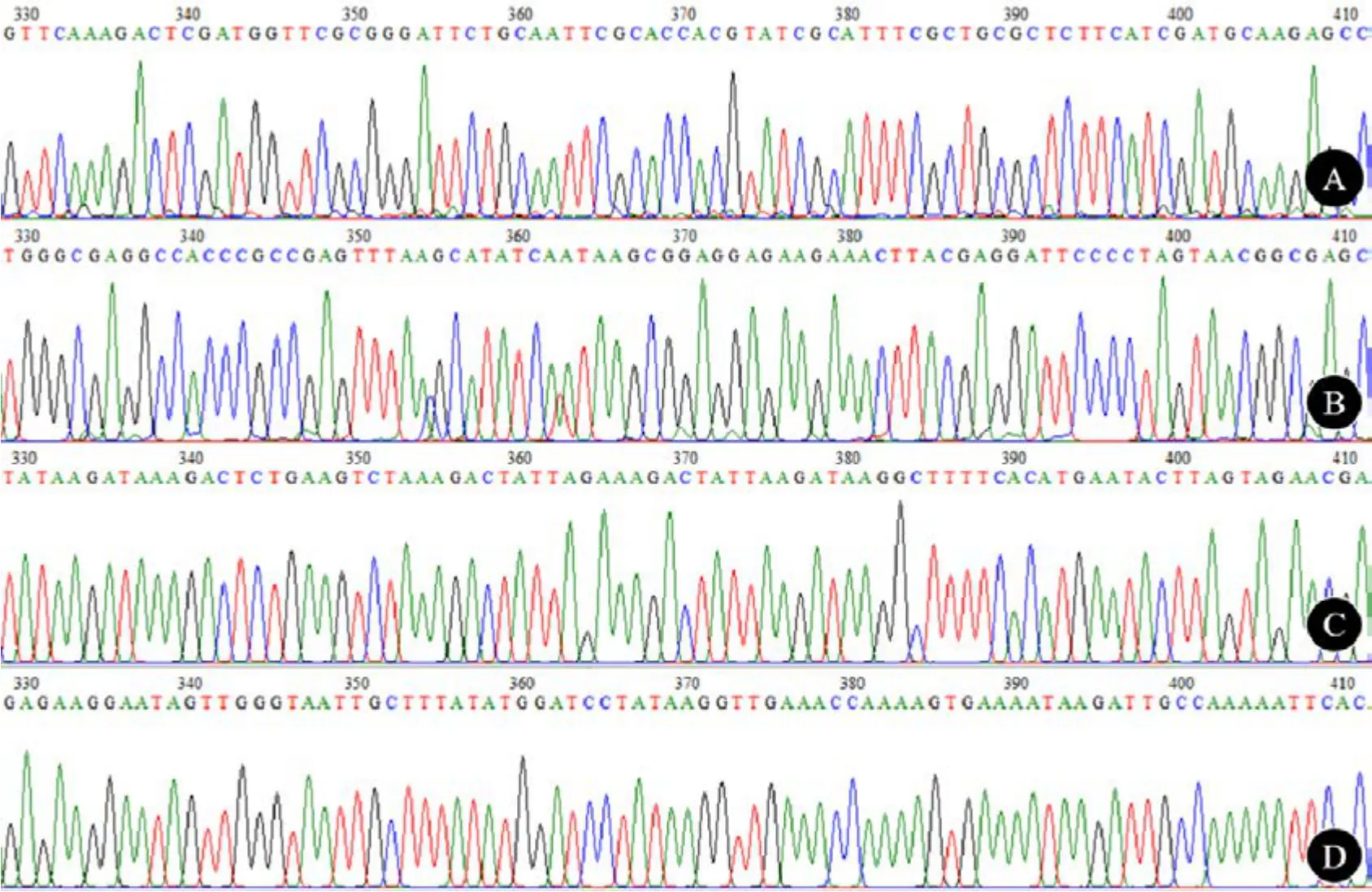
图1 部分样品测序峰图Fig.1 The partial peak graph of some samples
2.2 4 条候选序列特征分析
用于序列分析的ITS序列有72 条,ITS2序列60 条,psbA-trnH序列58 条和matK序列70 条,其中包括从GenBank 数据库下载的36 条ITS序列、24条ITS2序列、22 条psbA-trnH序列和34 条matK序列(表4)。比对后的序列长度matK>psbA-trnH>ITS>ITS2,均小于1000 bp,满足理想的DNA 条形码长度要求。GC 平均含量ITS>ITS2>psbA-trnH>matK,分别为53.1%、52.7%、34.6%、32.1%。保守位点数psbA-trnH>ITS>ITS2>matK,分别占各自总位点数的89.6%、52.1%、47.4%、45.5%,psbA-trnH序列最保守。matK序列变异度最大,变异位点数占总位点数的54.8%;psbA-trnH序列的变异位点最少,变异位点占总位点数的10.0%(表4)。
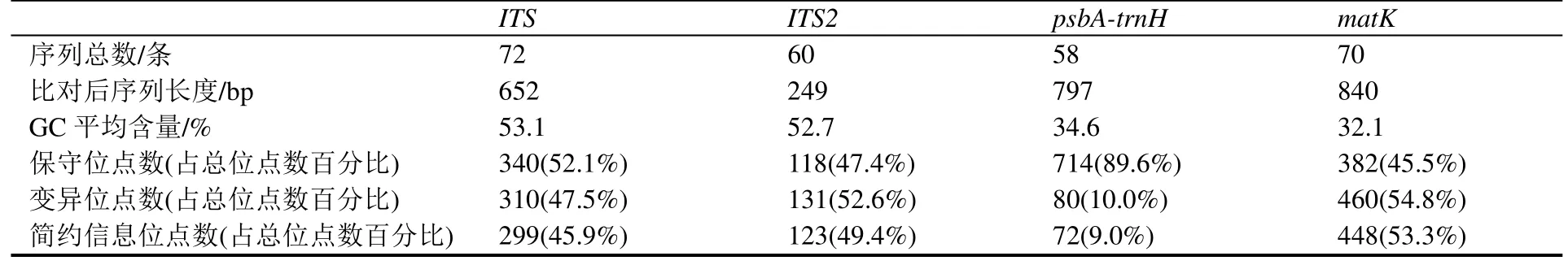
表4 4 条序列在12 种药用石斛中的序列特征Table 4 The sequence characteristics of four sequences in twelve medicinal Dendrobium species
2.3 DNA 条形码Gap 分析
利用MEGA 7.0 软件基于K2P 遗传距离模型计算四条序列和样品的平均种内、种间遗传距离,包括ITS序列72 条,ITS2序列60 条,psbA-trnH序列58 条,matK序列70 条。四条序列的平均遗传距离matK>ITS2>ITS>psbA-trnH;matK序列为0.509,ITS2序列为0.176,ITS序列为0.157,psbA-trnH序列为0.016;种内平均遗传距离ITS2>ITS>psbA-trnH=matK;ITS2序列为0.007,ITS序列为0.005,psbA-trnH序列与matK序列都为0.002;种间平均遗传距离matK>ITS2>ITS>psbA-trnH,matK序列为0.556,ITS2序列为0.194,ITS序列为0.171,psbA-trnH序列为0.018。统计分析样品的平均种内、种间遗传距离,得出遗传距离分布图(图2),ITS序列与ITS2序列的平均种内种间遗传距离趋势大致相同且重叠较少。
2.4 系统发育分析
构建12 种药用石斛ITS、ITS2、psbA-trnH、matK序列的NJ 系统发育树,如图3~图6。

图2 4 条序列的Barcoding Gap 图Fig.2 The Barcoding Gap diagram of four sequences
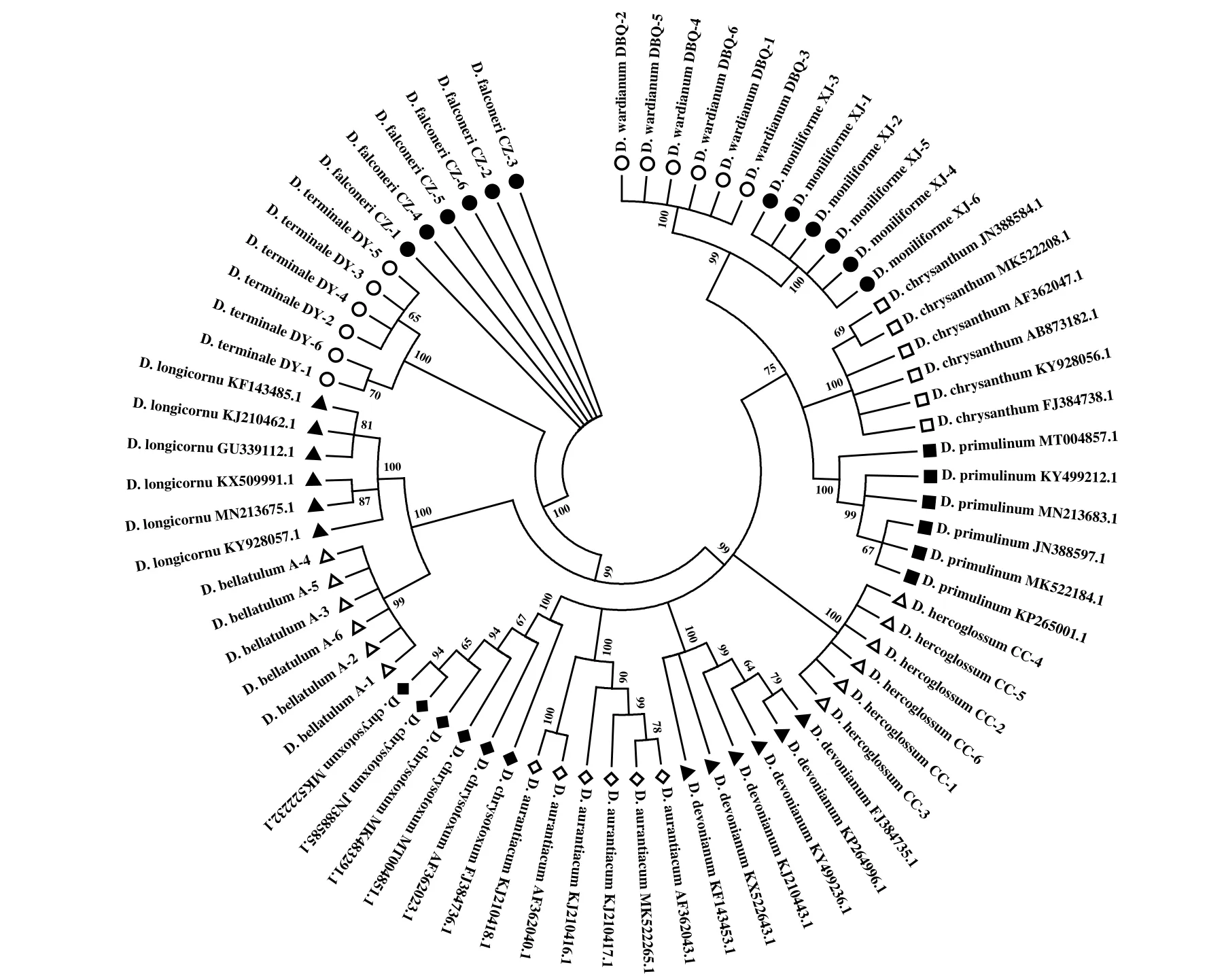
图3 基于ITS 序列构建的NJ 系统发育树Fig.3 NJ phylogenetic tree based on ITS sequences
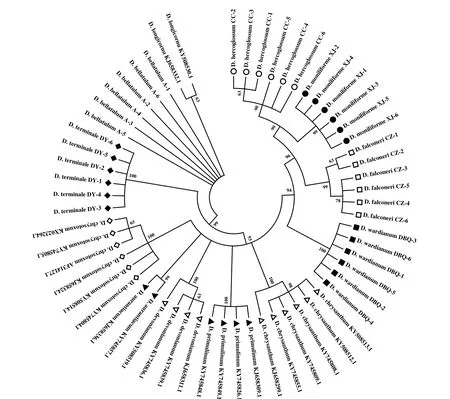
图4 基于ITS2 序列构建的NJ 系统发育树Fig.4 NJ phylogenetic tree based on ITS2 sequences
如图3 所示,基于ITS序列构建的系统发育树将12 种药用石斛全部区分开,并且具有较高支持度,可靠性较高;ITS2序列将系统发育树分为11枝,区分开10 种药用石斛,未能区分开来自黑毛组的长距石斛(D.longicornu) 和矮石斛(D.bellatulum)(图4);基于psbA-trnH序列构建的系统发育树不仅区分出全部石斛,还将齿瓣石斛(D.devonianum)分成两个平行枝且聚在一起(图5);基于matK序列构建的系统发育树仅区分6 种药用石斛,且支持度较低(图6)。
3 讨论
3.1 DNA 条形码序列的获取
DNA 条形码不受时间、环境、物种等因素的影响,具有较强的通用性和较高的识别准确率[16]。DNA 的提取是运用DNA 条形码技术进行物种鉴定的先决条件,PCR 扩增及测序成功率是评价DNA条形码技术实用性及通用性的指标[31]。目前核糖体ITS、ITS2基因和叶绿体基因组psbA-trnH、matK和rbcL序列是石斛常用的分子标记,这些片段对石斛种间有较高的识别率[32—34]。本研究参考李金璐等[29]的CTAB 法进行总DNA 提取,4 条候选序列(ITS、ITS2、psbA-trnH和matK)的PCR 扩增及测序成功率均为100%,说明ITS、ITS2、psbA-trnH和matK序列在石斛属中容易获得。
3.2 不同条形码序列Barcoding Gap 评估

图5 基于psbA-trnH 序列构建的NJ 系统发育树Fig.5 NJ phylogenetic tree based on psbA-trnH sequences
Barcoding Gap 是指物种的 DNA 条形码序列在物种间变异大于种内变异,且存在一个明显间隔区[29]。本研究基于4 条序列构建的Barcoding Gap都没有明显的间隔区,但ITS序列与ITS2序列的种内和种间存在重叠的部分较少,有偏向两端的趋势(图2)。黄海等[12]发现石斛属植物ITS序列具有明显的Barcoding Gap,张爱丽等[35]对主要滇产石斛鉴别中也发现ITS序列具有明显的Barcoding Gap,这与本研究结果基本一致。
3.3 云南常见药用石斛DNA 条形码的筛选
DNA 条形码能对不同物种进行快速准确的鉴定,但到目前为止还没有找到适合植物界通用的DNA 条形码。陈士林等[17]通过大量研究,提出将ITS2作为药用植物鉴定的通用条形码序列,中国植物DNA 条形码研究组也建议将ITS/ITS2序列作为种子植物的核心条形码[36]。Kress 等[37]研究发现,psbA-trnH序列具有易扩增和通用性好的优点,建议将ITS和psbA-trnH两个片段作为植物通用条形码。邵世光等[33]对15 种常见的枫斗类石斛的psbA-trnH序列成功测序,并将叶绿体基因psbA-trnH间区与核基因组的rDNAITS序列联合使用,作为枫斗类石斛分子鉴别的DNA 条形码候选序列。对4 个候选序列所构建的系统发育树分析,psbA-trnH和ITS序列鉴定结果较好;ITS序列的支持度高于psbA-trnH序列,结果更具说服力,但psbA-trnH序列将齿瓣石斛分为两平行枝,说明psbA-trnH序列在种内的鉴定结果优于ITS序列。ITS2序列未能区分长距石斛和矮石斛,matK序列虽然变异度高,但构建的系统发育树聚类散乱,仅区分6 种药用石斛。
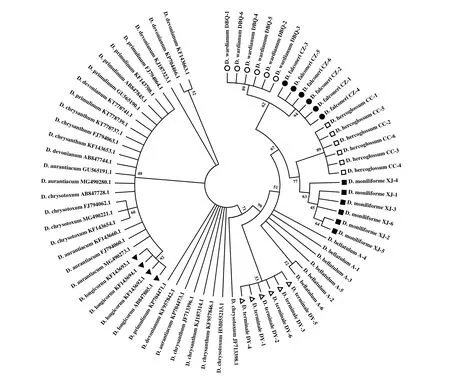
图6 基于matK 序列构建的NJ 系统发育树Fig.6 NJ phylogenetic tree based on matK sequences
综合来看,建议以ITS和psbA-trnH序列作为云南常见药用石斛鉴定序列,这可以为云南常见药用石斛的基源鉴定提供可靠技术保障。
