小麦-黑麦6RS/6AL易位染色体的遗传稳定性及其在配子中的传递
2020-03-23李庆成李亚洲范超兰赵来宾张舒洁陈雪姣甯顺腙袁中伟张连全刘登才
李庆成 黄 磊 李亚洲 范超兰 谢 蝶 赵来宾 张舒洁 陈雪姣 甯顺腙 袁中伟 张连全 刘登才 郝 明
小麦-黑麦6RS/6AL易位染色体的遗传稳定性及其在配子中的传递
李庆成**黄 磊**李亚洲 范超兰 谢 蝶 赵来宾 张舒洁 陈雪姣 甯顺腙 袁中伟 张连全 刘登才 郝 明*
四川农业大学小麦研究所, 四川成都 611130
小麦-黑麦6RS/6AL易位系HM812-41携带抗白粉病基因。为评价其育种利用潜力, 以HM812-41为亲本分别与推广品种蜀麦580、蜀麦830和蜀麦969杂交, 杂种F1与中国春进行正反交, 研究6RS/6AL易位染色体在不同背景中的遗传稳定性及其通过雌雄配子的传递规律。同时, 利用“双顶交”法改良易位系的综合农艺性状。基因组原位杂交结果表明, 6RS/6AL易位染色体在传递过程中结构稳定。6RS/6AL易位染色体可以高频率地通过雌、雄配子传递, 其传递率分别为45.05%~53.33%和43.94%~53.04%。初步分析“双顶交”F2分离群体表明, 6RS/6AL易位染色体对主要农艺性状如株高、穗长、小穗数和自交结实率没有明显的不利影响。用“双顶交”法可以快速地改良易位系的综合农艺性状。
小麦; 黑麦; 白粉病; 6RS/6AL易位; 配子传递率; 遗传稳定性
小麦近缘属种蕴藏着大量抗病虫、耐逆、优质、丰产等基因。通过远缘杂交和染色体工程技术, 将外源优良基因导入, 可以拓宽小麦育种的遗传基础。小麦-黑麦1RS/1BL易位是应用外源基因育种最为成功的例子。1RS/1BL易位系同时携带抗小麦叶锈病()、秆锈病()、条锈病()和白粉病基因()。同时, 在一些遗传背景下, 该易位系还能增加根系的生物量[1-2]。突出的抗病、抗逆能力促进了1RS/1BL易位在全球范围内的广泛应用。除此之外, 偃麦草[3-4]、簇毛麦[5-6]、冰草[7-8]等物种的实践应用, 对我国小麦遗传育种工作发展也起到了极大的促进作用。
小麦-外源附加系、代换系和易位系是小麦导入外源基因的主要形式。其中, 臂间易位是外源优异基因利用的重要形式, 而小片段易位携带的外源染色体片段小, 被认为是育种利用的最佳形式。相比于小片段易位, 小麦-外源臂间易位创制简单、高效。因此, 臂间易位仍然是目前导入外源基因的重要形式。导入的外源染色体臂对缺失小麦染色体臂的遗传补偿性、易位染色体本身的遗传稳定性、传递率及其是否连锁严重不利农艺性状是影响其育种应用的关键[9-11]。以我国自主创制和成功应用的6VS/6AL易位为例, 李桂萍等[10]发现, 虽然小麦-簇毛麦6VS/6AL易位染色体在不同小麦背景下, 通过雄配子的传递率均低于通过雌配子的传递率, 但两者的传递率均接近50%的理论值(雌配子49.2%; 雄配子44.7%)。不仅如此, 除携带强抗白粉病基因, 6VS/6AL对穗长和粒重还有正向效应[12-13]。这些因素可能是6VS/6AL成功应用于我国小麦品种选育的重要基础。
黑麦(L., RR)表现出良好的抗病、抗逆特征, 含丰富的白粉病抗性基因[14]。黑麦染色体1R、2R、4R、5R、6R均含有白粉病抗性基因[15-21]。其中, 正式命名的有5个, 分别是位于1RS染色体臂的和[15,17,19]、2R染色体长臂上的[16]、6R染色体长臂的[16]和短臂的[21]。是最近被发现和命名的一个源于黑麦的抗白粉病基因, 来源于中国黑麦地方品种秦岭黑麦。Hao等[21]利用6R(6A)双单体, 诱导着丝粒“断裂-融合”, 获得含的6RS/6AL纯合易位系。为更好地利用6RS染色体臂所携带的抗白粉病基因, 本研究用6RS/6AL纯合易位系HM812-41与不同小麦品种杂交、测交, 通过分子标记和原位杂交鉴定, 分析6RS/6AL染色体在不同小麦背景中的遗传稳定性及其通过雌、雄配子的传递规律。同时, HM812-41的遗传背景来自地方品种开县罗汉麦和中国春, 综合农艺性状差。利用分子标记技术检测F2分离群体, 评价6RS/6AL易位对主要农艺性状的影响, 同时改良易位系的遗传背景。
1 材料与方法
1.1 植物材料
小麦-黑麦6RS/6AL纯合易位系HM812-41, 普通小麦品种(系)WJL5606、WJL3931、D-2-3-4、中国春(CS)、蜀麦580、蜀麦830、蜀麦969、蜀麦80、蜀麦126; 2个“双顶交”(double-top cross, DTC) F2群体[22](蜀麦969/HM812-41//WJL5606/3/蜀麦80和蜀麦969/HM812-41//WJL5606/3/蜀麦921)用于温室白粉病鉴定; “双顶交”F2群体蜀麦969/HM812-41//蜀麦830/3/WJL3931和蜀麦969/HM812-41//WJL 5606/ 3/蜀麦126, 种植于四川农业大学成都校区惠和基地, 用于农艺性状调查。分离群体由四川农业大学小麦研究所创制, 其他由四川农业大学小麦研究所选育或保存。
1.2 花粉活力鉴定
采用I2-KI染色法鉴定花粉活力。具体操作方法与刘英华等[23]一致。试验分3个不同日期取样, 作为重复。
1.3 易位染色体的雌、雄配子传递分析
纯合易位系HM812-41在开花前人工去雄, 2~3 d后, 分别用蜀麦580、蜀麦830和蜀麦969的花粉进行授粉, 获得杂种F1。为研究易位染色体通过雌、雄配子的传递率, 将杂种F1分别做父、母本与中国春测交; 测交F1种子于室内发芽, 分单株移栽至塑料盆后置温室生长。在移栽前, 剪取植株的根尖用于细胞学鉴定。用CTAB法[24]提取苗期叶片基因组DNA, 用于后续的分子标记鉴定。正、反测交F1后代中, 含外源易位染色体的植株占总植株的百分数即为易位染色体通过相应配子的传递率。
1.4 分子标记鉴定
含抗白粉病基因的6RS染色体区段特异分子标记为KU.962, 目的条带大小约为400 bp[21]。该标记为显性标记, 对应引物由成都擎科生物技术有限公司合成(http://www.tsingke.net/)。PCR体系20 μL, 含10 μL 2×PCR Mix、1 μL引物(正、反引物各0.5 μL, 浓度为10 μmol L–1)、1 μL模板DNA (约100 ng μL–1)和8 μL ddH2O。扩增程序为95℃初始变性5 min; 然后95℃变性30 s, 60℃退火30 s, 72℃延伸, 35个循环; 最后72℃延伸10 min[25]。扩增产物经1.5%琼脂糖凝胶电泳检测, UVP凝胶成像系统成像。
1.5 原位杂交鉴定
以生物素标记的秦岭黑麦基因组DNA为探针, 以高温蒸汽打断的中国春基因组DNA为封组, 进行基因组荧光原位杂交(Genomehybridization, GISH)检测6RS染色体。普通小麦和黑麦通用着丝粒探针6C6[26], 黑麦着丝粒探针pAWRC.1[27]用于检测易位染色体的着丝粒组成。分别以节节麦AS60和秦岭黑麦基因组DNA为模板PCR扩增, 琼脂糖凝胶电泳回收目标条带后, 用缺口平移法, 以地高辛和生物素标记为荧光探针。按Hao等[28]的流程进行原位杂交。
1.6 白粉病抗性鉴定
温室的培养条件为16 h光照/22℃和8 h黑暗/16℃, 湿度70%。待鉴定材料中间混种诱发材料为SY95-71。于三叶期, 收集诱发材料上自然发病的混合白粉菌孢子, 抖落在待鉴定植株上, 每15 d记录一次叶片和叶鞘的抗病表现, 直到成熟期。将抗病反应分为抗病(无可见病斑和白粉菌孢子堆)和感病(有病斑或孢子堆) 2种[12]。
1.7 农艺性状调察
在成熟期调察株高、穗长、小穗数和自交结实率。株高为植株最高处(不包括芒)距地面高度; 穗长为穗基部距顶部(不包括芒)长度; 仅用各发育小穗基部2朵小花统计自交结实率。自交结实率 = (结实种子数/小花总数)×100%。
2 结果与分析
2.1 6RS/6AL易位染色体着丝粒组成
利用小麦-黑麦通用着丝粒探针6C6和黑麦着丝粒特异探针pAWRC.1检测6RS/6AL易位染色体(图1)。原位杂交结果显示, 该易位染色体的着丝粒区域同时具有两个探针的杂交信号, 表明小麦和黑麦均对其着丝粒的形成具有贡献。
2.2 杂合状态下6RS/6AL易位染色体的传递率及结构稳定性
以小麦品种蜀麦580、蜀麦830和蜀麦969为母本, 易位系为父本杂交, 获得6RS/6AL和6A双单体杂种F1, 再分别与中国春正反交, 获得测交杂种F1。以是否含有6RS特异分子标记KU.962的目标条带判断是否存在6RS/6AL易位染色体, 从而推断6RS/6AL通过雌雄配子的传递率。如表1所示, 6RS/6AL在3个不同遗传背景中, 通过雌配子的传递率分别为45.05%、53.33%和48.00%, 经χ2检验, 与理论值(50%)无显著差异(值分别为0.35、0.47和0.73); 通过雄配子的传递率分别为46.24%、53.04%和43.94%, 与理论值也无显著差异(值分别为0.47、0.51和0.32)。虽然涉及蜀麦969的杂交组合中, 6RS/6AL通过雌配子的传递率略高于通过雄配子, 但统计检验差异并不显著(= 0.75); 另外2个组合的雌、雄配子传递能力没有差异。
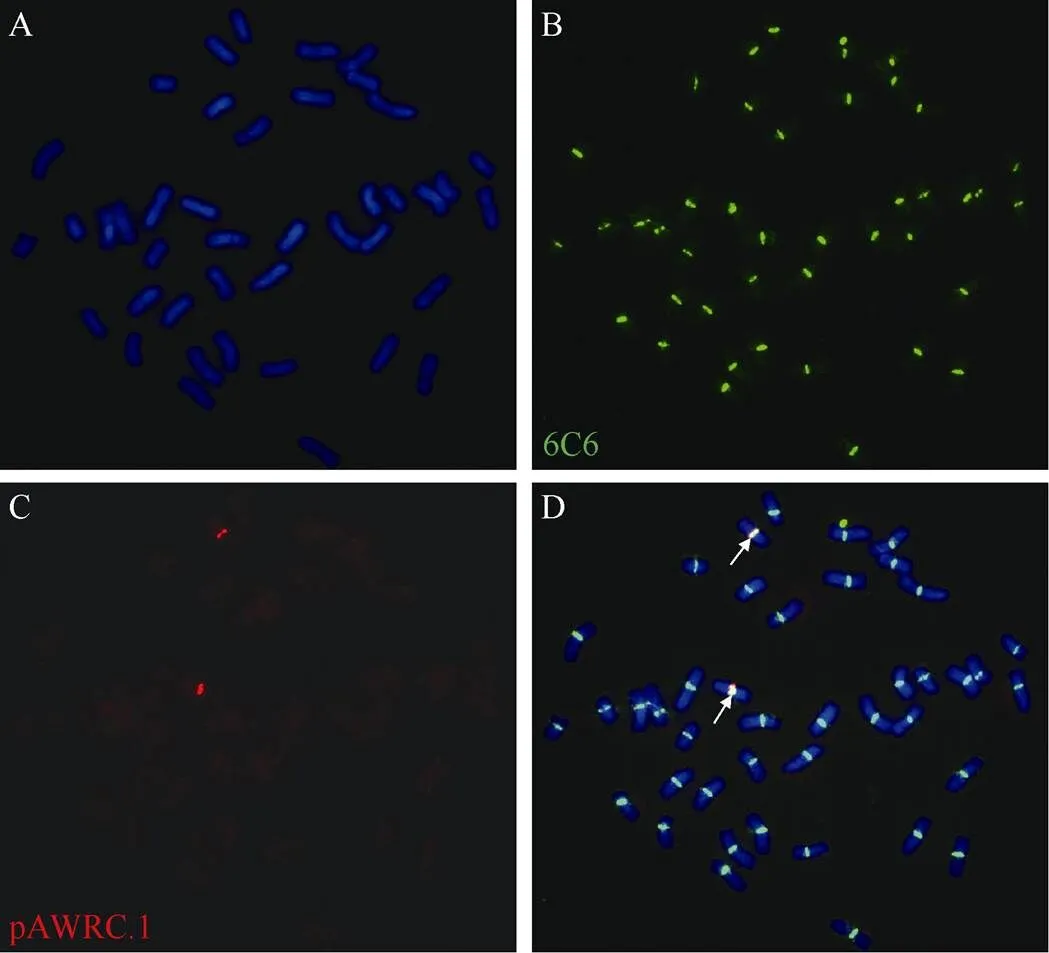
图1 6RS/6AL易位系的染色体着丝粒
A: 易位系HM812-41的42条染色体。B: 探针6C6检测的易位系HM812-41着丝粒。C: 探针pAWRC.1的易位系HM812-41着丝粒。D: B和C的整合。箭头指易位染色体6RS/6AL的着丝粒。
A: 42 chromosomes of the translocation line HM812-41; B: centromeres of the translocation line HM812-41 detected by the probe 6C6; C: centromeres of the translocation line HM812-41 detected by the probe pAWRC.1; D: merging of B and C. Arrows show the centromeres of the translocated chromosome 6RS/6AL.
为判断6RS/6AL易位染色体在传递过程中的结构稳定性, 随机选取了41个上述含有KU.962特异分子标记的植株(蜀麦580/HM812-41//CS 15株、蜀麦830/HM812-41//CS 15株、蜀麦969/HM812-41//CS 11株)进行基因组原位杂交鉴定。所有41个植株均含单条完整的6RS/6AL易位染色体, 表明6RS/6AL易位染色体在杂交过程中结构稳定, KU.962特异分子标记可以用于追踪6RS/6AL易位染色体。
2.3 6RS/6AL易位染色体白粉病抗性稳定性
蜀麦580、蜀麦830和蜀麦969在温室感白粉病, HM812-41在温室抗白粉病, 它们之间的杂种F1抗白粉病, 表明6RS/6AL携带的能稳定表达白粉病抗性。为进一步评价在不同遗传背景下的抗病稳定性, 随机选取蜀麦969/HM812-41// WJL5606/3/蜀麦80 F2组合的16个单株和蜀麦969/ HM812-41//WJL5606/3/蜀麦921 F2组合的23个单株, 种植于温室进行白粉病抗性鉴定。利用KU.962检测是否含有6RS/6AL易位染色体。结果表明, 所有含KU.962目标条带的单株(分别为10和14株)均抗白粉病, 表明在不同遗传背景下具有稳定的白粉病抗性。同时, 不含有目标条带的单株(分别为6株和9株)表现出抗病或者感病, 表明所涉及的小麦品种(系)可能含有其他的白粉病抗性基因。

表1 6RS/6AL易位染色体在小麦背景中通过雌雄配子的传递率
2.4 6RS/6AL易位染色体对农艺性状的影响
利用I2-KI花粉染色法, 调查易位系HM812-41的花粉活性。根据I2-KI染色成蓝黑色的花粉比例推测, 易位系的平均花粉活力为94.1%, 与普通小麦中国春(93.0%)和D-2-3-4 (95.2%)差异均不显著(检验,值分别为0.31和0.32)。但是, 易位系HM812-41综合农艺性状差, 植株高(2018年, 田间平均株高为137.2 cm; 同期种植的审定品种蜀麦580、蜀麦830和蜀麦969平均分别为84.2、83.2和89.9 cm)。
为评价6RS/6AL易位染色体对农艺性状的影响,利用“双顶交”法, 结合分子标记辅助选择, 获得蜀麦969/HM812-41//蜀麦830/3/WJL3931 F2(简称Pop.1; 115株)和蜀麦969/HM812-41//WJL5606/3/蜀麦126 F2(简称Pop.2; 107株) 2个分离群体, 这些群体单株理论上只含有12.5%的易位系血缘(图2-A)。田间观察表明, 降低易位系的血缘, 能快速地改良易位系的农艺性状(图2-B)。依据KU.962分子标记的有无, 将2个群体分别划分成含6RS/6AL的亚群体(Pop.1+, 72株; Pop.2+, 76株)和不含6RS/6AL的亚群体(Pop.1–, 43株; Pop.2–, 31株)。比较2个群体各自亚群体间的株高、穗长、小穗数和结实率差异, 判断6RS/6AL易位染色体的影响。在Pop.2群体中, 含6RS/6AL易位染色体单株的平均结实率(92.6%)极显著高于不含易位染色体单株的平均自交结实率(85.7%)(两尾-test,= 0.005)。但是, 其余性状在两个群体各自亚群体间没有差异(图3)。

图2 6RS/6AL易位系的改良流程和植株表现
A: 6RS/6AL易位系的改良流程; B: 田间植株表现。从左至右的单株分别为: 易位系HM812-41、蜀麦580、蜀麦830、蜀麦969、蜀麦969/HM812-41 F1、蜀麦969/HM812-41//蜀麦830 F1、蜀麦969/HM812-41//蜀麦830/3/WJL3931 F1和蜀麦969/HM812-41//蜀麦830/3/WJL3931 F2。
A: Crossing diagram for improving 6RS/6AL translocation line; B: the progenies’ performance. The plants from left to right are the translocation line HM812-41, Shumai 580, Shumai 830, Shumai 969, Shumai 969/HM812-41 F1, Shumai 969/HM812-41//Shumai 830 F1, Shumai 969/HM812-41//Shumai 830/3/WJL3931 F1, and Shumai 969/HM812-41//Shumai 830/3/WJL3931 F2, respectively.

图3 两个“双顶交”F2分离群体的主要农艺性状表现
A: 株高; B: 穗长; C: 小穗数; D: 自交结实率。Pop.1+和Pop.1–分别表示含和不含6RS/6AL易位染色体的蜀麦969/HM812-41//蜀麦830/3/WJL3931 F2亚群体; Pop.2+和Pop.2–分别表示含和不含6RS/6AL易位染色体的蜀麦969/HM812-41//WJL5606/3/蜀麦126 F2亚群体。**: 表示含(+)与不含(–)6RS/6AL易位染色体亚群体间差异极显著(两尾-test,< 0.01)。
A: plant height; B: spike length; C: spikelet number; D: seed set ratio. Pop.1+ and Pop.1–, represent sub-population with and without 6RS/6AL translocation from Shumai 969/HM812-41//Shumai 830/3/WJL3931 F2population, respectively. Pop.2+ and Pop.2–, represent subpopulation with and without 6RS/6AL translocation from Shumai 969/HM812-41//WJL5606/3/Shumai 126 F2population. **: significantly difference between sub-populations with and without 6RS/6AL translocation (two-way-test,< 0.01).
3 讨论
外源染色体在小麦背景中的稳定性和传递率是影响其利用的关键因素之一。本研究通过分子标记对易位系HM812-41与不同品种杂种F1和中国春的测交F1分离群体鉴定表明, 6RS/6AL易位染色体能够正常地通过雌雄配子传递, 传递频率与理论值(50%)无显著差异, 且雌雄配子间无显著差异。我们前期也发现, 在6R与6A双单体自交过程中, 6R的传递率高[自交传递率为(116/158)×100%=73.4%; 未发表数据]。张文俊等[29]在研究黑麦6R染色体在小麦背景中的传递时, 发现6R在6R(6D)代换系中, 通过雌、雄配子的传递频率只有8.8%和10.3%, 传递频率较低。这种传递率的差异可能与6R染色体的来源以及缺失的小麦染色体有关。利用扬麦18 (6VS/6AL易位系)和扬麦22 (6VS/6DL易位系)构建的高代重组自交系, Zhao等[13]发现, 6VS/6AL易位染色体的传递率显著高于6VS/6DL。表明小麦6D染色体(臂)的缺失本身也可能影响配子的传递率, 而6R (或6RS)和6V(或6VS)本身对配子传递率无明显影响。基因组原位杂交鉴定表明, 本研究中所有经检测的含特异分子标记测交植株均含有一条完整6RS/6AL易位。综合上述结果表明, 在杂交过程中, 该易位系既可做母本, 也可做父本, 具有很大的灵活性, 且基本可排除易位染色体重新断裂的潜在不利影响。
小麦-黑麦6RS/6AL易位染色体稳定表达白粉病抗性, 且对主要农艺性状没有明显的不利影响, 是抗白粉病小麦育种的重要抗源。许多外源导入系的遗传背景较差, 育种家利用的积极性不高。前期, 本课题组对综合农艺性状差的人工合成小麦, 采用“双顶交”法成功进行了育种改良, 已选育审定了3个品种[22]。本研究中, 我们采取同样的策略改良6RS/6AL易位系HM812-41, 虽然目前仅得到F2代的材料, 但改良材料表现出良好的综合农艺性状。因此, 有必要对该育种方法进一步扩大利用, 改良小麦育种原始材料, 推动小麦遗传改良工作。
4 结论
小麦-黑麦6RS/6AL易位染色体在不同小麦背景稳定表达白粉病抗性, 且杂交过程中通过雌雄配子传递率高, 染色体结构稳定, 是抗白粉病育种的重要资源。“双顶交”法在改良综合农艺性状差的材料中具有重要潜力, 值得进一步推广应用。
[1] Ehdaie B, Whitkus R W, Waines J G. Root biomass, water-use efficiency, and performance of wheat-rye translocations of chromosomes 1 and 2 in spring bread wheat ‘Pavon’., 2003, 43: 710–717.
[2] Sharma S, Xu S, Ehdaie B, Hoops A, Close T J, Lukaszewski A J, Waines J G. Dissection of QTL effects for root traits using a chromosome arm-specific mapping population in bread wheat.,2011, 122: 759–769.
[3] 张爱民, 童依平, 王道文. 小麦遗传育种学家李振声. 遗传, 2008, 30: 1239–1240. Zhang A M, Tong Y P, Wang D W. Wheat geneticist Li Zhensheng., 2008, 30: 1239–1240 (in Chinese).
[4] Li Z S, Li B, Tong Y. The contribution of distant hybridization with decaploidto wheat improvement in China., 2008, 35: 451–456.
[5] 陈佩度, 张守忠, 王秀娥, 王苏玲, 周波, 冯祎高, 刘大钧. 抗白粉病高产小麦新品种南农9918. 南京农业大学学报, 2002, 25: 105–106. Chen P D, Zhang S Z, Wang X E, Wang S L, Zhou B, Feng Y G, Liu D J. New wheat variety Nannong 9918 with high yield and powdery mildew resistance., 2002, 25: 105–106 (in Chinese with English abstract).
[6] Cao A, Xing L, Wang X, Yang X, Wang W, Sun Y, Qian C, Ni J, Chen Y, Liu D, Wang X, Chen P. Serine threonine kinase gene, a key member of powdery mildew resistance gene, confers powdery mildew resistance in wheat., 2011, 108: 7727–7732.
[7] 李立会, 杨欣明, 李秀全, 董玉琛, 陈学明. 通过属间杂交向小麦转移冰草优异基因的研究. 中国农业科学, 1998, 31(6): 1–6. Li L H, Yang X M, Li X, Dong Y C, Chen X M. Introduction of desirable genes frominto common wheat by intergeneric hybridization., 1998, 31(6): 1–6 (in Chinese with English abstract).
[8] 杜丽媛, 刘伟华, 杨欣明, 李秀全, 李立会. 小麦-冰草新种质普冰2011姊妹系的育种效应分析. 植物遗传资源学报, 2016, 17: 395–403. Du L Y, Liu W H, Yang X M, Li X Q, Li L H. Breeding achievement analysis of novel wheat-germplasm sister lines pubbing 2011., 2016, 17: 395–403 (in Chinese with English abstract).
[9] Sears E R. Chromosome engineering in wheat. In: Stadler Symp., Vol. 4, University of Missouri, Columbia, USA. 1972, pp 23–38.
[10] 李桂萍, 陈佩度, 张瑞奇, 王春梅, 曹爱忠, 张守忠. 小麦-簇毛麦6VS/6AL易位染色体在不同小麦背景中的遗传稳定性及其在配子中的传递. 麦类作物学报, 2007, 27: 183–187. Li G P, Chen P D, Zhang R Q, Wang C M, Cao A Z, Zhang S Z. Transmission of the 6VS/6AL chromosome through gametes and its genetic stability in different genetic background., 2007, 27: 183–187 (in Chinese with English abstract).
[11] 王海燕, 肖进, 袁春霞, 徐涛, 于春燕, 孙昊杰, 陈佩度, 王秀娥. 携带抗白粉病基因的小麦-簇毛麦小片段易位染色体在不同小麦背景中的传递率及遗传稳定性. 作物学报, 2016, 42: 361–367. Wang H Y, Xiao J, Yuan C X, Xu T, Yu C Y, Sun H J, Chen P D, Wang X E. Transmission and genetic stability of no-homoeologous small fragment wheat-translocation chromosomes within various cultivar backgrounds of common wheat., 2016, 42: 361–367 (in Chinese with English abstract).
[12] 李桂萍, 陈佩度, 张守忠, 赵和. 小麦-簇毛麦6VS/6AL易位染色体对小麦农艺性状的影响. 植物遗传资源学报, 2011, 12 : 744–749. Li G P, Chen P D, Zhang S Z, Zhao H. Effects of the 6VS/6AL translocation chromosome on agronomic characteristics of wheat., 2011, 12: 744–749 (in Chinese with English abstract).
[13] Zhao R, Liu B, Jiang Z, Chen T, Wang L, Ji Y, Hu Z, He H, Bie T. Comparative analysis of genetic effects of wheat-translocations T6V#2S·6AL and T6V#4S·6DL., 2019, https://doi.org/10.1111/pbr.12711.
[14] Martis M M, Zhou R, Haseneyer G, Schmutzer T, Vrána J, Kubaláková M, König S, Kugler K G, Scholz U, Hackauf B, Korzun V, Schön C C, Dolezel J, Bauer E, Mayer K F X, Stein N. Reticulate evolution of the rye genome., 2013, 25: 3685–3698.
[15] Heun M. Introgression of powdery mildew resistance from rye into wheat., 1990, 80: 242–245.
[16] Friebe B, Heun M, Tuleen N, Zeller F J, Gill B S. Cytogenetically monitored transfer of powdery mildew resistance from rye into wheat., 1994, 34: 621–625.
[17] Hsam S L K, Zeller F J. Evidence of allelism between genesandand chromosomal location of powdery mildew and leaf rust resistance genes in the common wheat cultivar Amigo., 1997, 116: 119–122.
[18] Ren T H, Yang Z J, Yan B J, Zhang H Q, Fu S L, Ren Z L. Development and characterization of a new 1BL.1RS translocation line with resistance to stripe rust and powdery mildew of wheat., 2009, 169: 207–213.
[19] An D, Zheng Q, Zhou Y, Ma P, Lv Z, Li L, Li B, Luo Q, Xu H, Xu Y. Molecular cytogenetic characterization of a new wheat-rye 4R chromosome translocation line resistant to powdery mildew., 2013, 21: 419–432.
[20] Fu S L, Ren Z L, Chen X M, Yan B J, Tan F Q, Fu T H, Tang Z X. New wheat-rye 5DS-4RS·4RL and 4RS-5DS·5DL translocation lines with powdery mildew resistance., 2014, 127: 743–753.
[21] Hao M, Liu M, Luo J, Fan C, Yi Y, Zhang L, Yuan Z, Ning S, Zheng Y, Liu D. Introgression of powdery mildew resistance geneon rye chromosome arm 6RS into wheat., 2018, 9: 1040.
[22] Hao M, Zhang L, Zhao L, Dai S, Li A, Yang W, Xie D, Li Q, Ning S, Yan Z, Wu B, Lan X, Yuan Z, Huang L, Wang J, Zheng K, Chen W, Yu M, Chen X, Chen M, Wei Y, Zhang H, Kishii M, Hawkesford M J, Mao L, Zheng Y, Liu D. A breeding strategy targeting the secondary gene pool of bread wheat: introgression from a synthetic hexaploid wheat., 2019, 132: 2285–2294.
[23] 刘英华, 赵桃, 龙海, 邓光兵, 潘志芬, 余懋群. 簇毛麦()矮秆突变体的鉴定. 麦类作物学报, 28: 946–949. Liu Y H, Zhao T, Long H, Deng G B, Pan Z F, Yu M Q. Characterization of a dwarf mutant in., 2008, 28: 946–949 (in Chinese with English abstract).
[24] Yan Z, Wan Y, Liu K. Identification of a novel HMW glutenin subunit and comparison of its amino acid sequence with those of homologous subunits., 2002, 47: 220–225.
[25] Qiu L, Tang Z X, Li M, Fu S L. Development of new PCR-based markers specific for chromosome arms of rye (L.)., 2016, 59: 159–165.
[26] 邹晓欢, 郝明, 罗江陶, 张连全, 袁中伟, 刘登才. 中国特有小麦的易位染色体鉴定. 麦类作物学报, 33: 1065–1070. Zou X H, Hao M, Luo J T, Zhang L Q, Yuan Z W, Liu D C. Identification of translocated chromosomes in Chinese endemic wheat accessions., 2013, 33: 1065–1070 (in Chinese with English abstract).
[27] 唐宗祥. 重复序列引起小麦染色体结构、基因组及性状的改变. 四川农业大学博士学位论文, 2006, 四川雅安. Tang Z X. Variation of Chromosomal Structure, Genome and Phenotype of Wheat Caused by Repetitive DNA Sequence. PhD Dissertation of Sichuan Agricultural University, Ya’an, Sichuan, China, 2006 (in Chinese with English abstract).
[28] Hao M, Luo J, Yang M, Zhang L, Yan Z, Yuan Z, Zheng Y, Zhang H, Liu D. Comparison of homoeologous chromosome pairing between hybrids of wheat genotypes Chinese Springand KL with rye., 2011, 54: 959–964.
[29] 张文俊, 景健康, 胡含. 黑麦6R染色体在小麦背景中的传递. 遗传学报, 1995, 22: 211–216. Zhang W J, Jing J K, Hu H. The transmission of rye chromosome 6R in wheat background., 1995, 22: 211–216 (in Chinese with English abstract).
Genetic stability of wheat-rye 6RS/6AL translocation chromosome and its transmission through gametes
LI Qing-Cheng**, HUANG Lei**, LI Ya-Zhou, FAN Chao-Lan, XIE Die, ZHAO Lai-Bin, ZHANG Shu-Jie, CHEN Xue-Jiao, NING Shun-Zong, YUAN Zhong-Wei, ZHAN Lian-Quan, LIU Deng-Cai, and HAO Ming*
Triticeae Research Institute, Sichuan Agricultural University, Chengdu 611130, Sichuan, China
The wheat-rye 6RS/6AL translocation line HM812-41 harbors the powdery mildew resistance gene. In order to evaluate the potential utilization in breeding, the translocation line was crossed to common wheat varieties Shumai 580, Shumai 830, and Shumai 969. The F1hybrids were then reciprocally crossed with Chinese spring to estimate the genetic stability of 6RS/6AL and its transmission rate through male and female gametes in different genetic backgrounds. Double-top crossing (DTC) strategy was used to improve the agronomic traits of the translocation line. Genomehybridization analysis indicated that the 6RS/6AL translocation was very stable during transmission. The 6RS/6AL translocation was transmitted to offsprings with a high frequency, which was 45.05%–53.33% for female gametes and 43.94%–53.04% for male gametes. Based on the agronomical performances of DTC F2populations, we found that the 6RS/6AL translocation was not linked to obvious defects for major agronomic traits, such as plant height, spike length, spikelet number and seed-setting ratio in selfing. The agronomic traits of the translocation line can be obviously improved through DTC strategy.
wheat; rye (); powdery mildew; 6RS/6AL translocation; gamete transmission; genetic stability
2019-08-07;
2019-12-26;
2020-01-16.
10.3724/SP.J.1006.2020.91051
郝明, E-mail: haomingluo@foxmail.com, Tel: 028-82650313
**同等贡献(Contributed equally to this work)
李庆成, E-mail: 1808654030@qq.com; 黄磊, E-mail: 1129559183@qq.com
本研究由四川省教育厅重点项目(16ZA0028)和四川省科技厅应用基础研究面上项目(2019YJ0415)资助。
This study was supported by the Key Projects of Sichuan Provincial Department of Education (16ZA0028) and the Applied Basic Research Programs of Science & Technology Department of Sichuan Province (2019YJ0415).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200115.1349.025.html
