费尔干猪毛菜病程相关蛋白SfPR1a基因的异源表达增强了烟草对干旱、盐及叶斑病的抗性
2020-03-23衡友强游西龙
衡友强 游西龙 王 艳
费尔干猪毛菜病程相关蛋白基因的异源表达增强了烟草对干旱、盐及叶斑病的抗性
衡友强 游西龙 王 艳*
新疆大学生命科学与技术学院/ 新疆生物资源与基因工程重点实验室, 新疆乌鲁木齐 830046
为明确一年生草本盐生植物费尔干猪毛菜(Drob)病程相关蛋白基因(GenBank登录号为JQ670917)是否参与了植物对逆境胁迫的响应, 采用qRT-PCR检测了该基因在不同组织部位和脱落酸(ABA)、茉莉酸(JAs)、乙烯合成直接前体(ACC)等相关激素胁迫及NaCl处理下的表达规律, 同时对转基因烟草在盐、旱及丁香假单胞菌等胁迫下的抗性进行了鉴定。结果显示,基因在费尔干猪毛菜根中的表达量显著高于茎叶中, 且受到ABA、JAs、ACC、NaCl的积极诱导; 干旱胁迫下, 转基因烟草的丙二醛(MDA)含量显著低于野生型烟草, 显示出较强的抗旱表型; 盐胁迫下, 异源表达的转基因烟草幼苗生长显著优于野生型烟草; 丁香假单胞菌攻毒后的转基因烟草叶片呈现严重的坏死反应, 但植株的整体抗性表型显著优于野生型烟草; 亚细胞定位结果显示该蛋白定位于植物细胞质外体空间。以上结果表明, 费尔干猪毛菜病程相关蛋白基因参与了植物对非生物及生物胁迫的抗性。
病程相关蛋白基因; 表达规律; 转基因烟草; 抗性功能; 亚细胞定位
盐、碱、干旱和病原微生物等外界胁迫已经成为影响农作物产量的关键因素。为解决日益增长的人口与粮食短缺之间的矛盾, 通过基因工程手段挖掘并利用抗逆植物的基因资源是改良农作物农艺性状的有效手段之一。当植物感知外界胁迫时会迅速产生次级信号如茉莉酸(JAs)[1-3]、乙烯(ET)[4-5]、水杨酸(SA)[6]、过氧化氢(H2O2)[7]等, 从而在体内产生复杂的互作网络, 诱导胁迫相关基因的表达进而发挥抗性功能。病程相关蛋白(pathogenesis-related proteins, PRs)是一类被生物和非生物胁迫诱导产生的蛋白总称, 在植物的防御体系中发挥重要作用[8-12]。目前在真菌[13-14]和动物[15]中也发现了该蛋白的同源物。依据PRs的分子量、空间结构以及血清学关系, 病程相关蛋白被分成17个亚家族[16-17], 并命名为PR1~PR17, 其中最早发现的是烟草病程相关蛋白TaPR1[10]。PR1亚家族因其序列保守、种类繁多、功能强大等特点成为备受关注的一类病程相关蛋白。编码该蛋白的基因往往受到细菌[18-19]、病毒[20]、真菌[21]等生物胁迫和盐、旱等非生物胁迫[22-23]的诱导, 暗示其可能在应对环境胁迫时发挥重要作用, 因而常常作为植物系统获得性抗性(systemic acquired resistance, SAR)的标记基因[18]。
费尔干猪毛菜(Drob.)属C4藜科双子叶一年生草本植物, 主要分布在我国新疆北部的盐碱化土壤区域, 其整个生长周期处于严重盐渍、干旱等复杂的恶劣生境, 是极具生态和研究价值的泌盐盐生植物[24]。然而, 目前对费尔干猪毛菜发挥抗性功能的分子机制仍知之甚少。本课题小组前期从费尔干猪毛菜中克隆获得了一个盐响应的病程相关蛋白基因[22], 本研究拟利用qRT-PCR技术探究该基因在费尔干猪毛菜不同组织、不同植物激素及盐胁迫下的表达模式, 同时通过对烟草的遗传转化明确其对生物和盐、旱等非生物胁迫的抗性功能, 为解析该基因的抗性分子机制及费尔干猪毛菜的抗性机理奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 将采自新疆吉木萨尔县古尔班通古特沙漠的费尔干猪毛菜种子去除种翅后经0.1%升汞(氯化汞)表面消毒8 min, 无菌水反复冲洗, 直至去除表面残留升汞(约5~6次)后备用。于正常MS培养基中萌发生长20 d后转移至不同胁迫条件的MS培养基中处理, 取处理不同时间的费尔干猪毛菜互生前四节茎叶和根作为总RNA的提取材料。烟草(L.)品种W38由北京林业大学赠送, 以55~60 d左右的烟草无菌苗叶片为转化受体材料。平均培养温度25℃, 光照时间16 h d-1, 黑暗8 h d-1, 相对湿度40%。以无菌生长50 d再土培25 d长势大小基本一致的野生型和转基因烟草进行盐、干旱和生物攻毒处理。
1.1.2 菌种、质粒及试剂 大肠杆菌() DH5α感受态细胞购买于北京全式金生物技术有限公司; 丁香假单胞菌(tomato DC3000)由中国科学院新疆生态与地理研究所惠赠; 植物总RNA提取试剂盒RNAprep pure Tissue Kit购于美国Omega BioTek公司, RNA-Free DNase I购自天根生物科技有限公司; Prime Scrip II 1st Strand cDNA Synthesis Kit试剂盒购自TaKaRa公司; 实时荧光定量试剂Power SYBRGreen PCR Master Mix购自ABI公司; 茉莉酸JAs、脱落酸ABA、潮霉素和卡那霉素购自Sigma-Aldrich公司; 乙烯合成前体ACC购自Calbiochem公司; PCR引物由上海生工生物工程技术服务有限公司合成。
1.2 SfPR1a蛋白的同源性比对及保守结构域分析
从NCBI数据库中下载其他物种中的PR1氨基酸序列, 用DNAMAN软件进行氨基酸序列同源性分析及保守结构域分析。
1.3 SfPR1a基因的表达
将MS培养基中生长20 d的费尔干猪毛菜幼苗分别移至含有终浓度为50 μmol L-1ABA、50 μmol L-1ACC、100 μmol L-1JAs和600 mmol L-1NaCl的MS固体培养基上胁迫处理, 分别取处理1、6、24 h的茎叶混合样品, 依照试剂盒说明书并结合RNA-Free DNaseI试剂提取不同组织部位和不同胁迫处理下的总RNA, 采用Nano DropND-1000分光光度计和琼脂糖凝胶电泳检测总RNA的浓度及纯度, 合成第1条cDNA链。随后参照说明书进行实时荧光定量PCR (Applied Biosystems Interface 7500)。以费尔干猪毛菜(上游引物P1: 5'-AAGATCTGGCACCACACCTTC-3'; 下游引物P2: 5'-CACACCATCACCAGAATCGA-3')为内参基因,基因(GenBank登录号为JQ 670917)特异性引物,P1 (5¢-CCAACCAA AGGAAGGGCGA-3¢)和P2 (5¢-CACACACC TTATTGGCGGCA-3¢)。反应体系含10 μL SYBRPremix、2 μL cDNA模板、0.5 μL正/反向引物、0.4 μL Rox、加蒸馏水补足至25 μL。PCR扩增程序为95℃预变性30 s; 95℃变性30 s, 58℃退火30 s, 72 ℃延伸30 s, 35个循环; 72℃延伸10 min。设每个时间点3个生物学重复, 每个生物学重复3个技术重复。采用2–DDCt法处理数据, 利用Prism 5.0软件进行生物统计学分析。
1.4 转基因烟草的获得及分子鉴定
采用反复冻融法将课题组前期构建的植物表达载体pCAMIA1301-1-SfPR1a[25]转化至农杆菌EHAl05, 利用叶盘法转化烟草[26]。通过终浓度为20 mg L-1潮霉素的两代筛选, 获得T2代纯系转基因烟草。以烟草基因为内参基因[27](上游引物P1: 5¢-AGGTGGAGACATGGGTGGTG-3¢; 下游引物P2: 5¢-TCATTAGGCACACAGA TCTCTG-3¢), 通过qRT-PCR分析转基因烟草中基因的表达, 具体方法同1.3。
1.5 转基因烟草的抗旱能力分析
将无菌生长50 d的烟草幼苗移至花土︰蛭石︰珍珠岩=3︰1︰1的基质中于16 h光照/8 h黑暗光周期下培养25 d, 对长势基本一致的野生型和转基因烟草进行自然控水干旱处理2周。MDA是膜脂过氧化的产物, 其含量可反映植物细胞在干旱胁迫下的受损程度。取第四轮叶片(从下到上)测定丙二醛(MDA)含量[28]; 控水2周后复水1周, 统计植株存活率。每组实验3个生物学重复, 每个生物学重复5株苗。
1.6 转基因烟草种苗抗盐能力分析
将表面消毒灭菌的野生型与转基因型烟草种子分别播于正常和含有200 mmol L-1NaCl的MS固体培养基中, 15 d后观察烟草种子的萌发和生长情况, 同时测定相对生长量。正常MS培养基中生长15 d的烟草幼苗重, 记为W1, 200 mmol L-1NaCl胁迫处理下生长相同天数的烟草重, 记为W2, 相对生长量(relative growth yield, RGY) 的计算公式为(W1-W2)/W1× 100%。
对无菌生长50 d再土培25 d长势大小基本一致的野生型和转基因烟草以50 mmol L-1NaCl为浓度梯度每隔4 h进行一次盐浇处理, 直至NaCl浓度为200 mmol L-1, 处理2周, 测定叶绿素和可溶性蛋白[29-30]含量。
1.7 转基因烟草抗叶斑病能力的分析
丁香假单胞菌tDC3000在含有50 mg L-1利福平的LB液体培基中28℃ 200转 min-1条件下过夜培养至OD600为0.6~0.8, 离心收集菌体, 用10 mmol L-1MgCl2重悬至终浓度为0.1备用。按照Lee等[31]的方法接种丁香假单胞菌, 小心地将叶片翻过来露出背轴面。用不带针头的1 mL注射器对准烟草叶背面, 将稀释的菌液通过压力渗透的作用进入叶片间隙, 随后覆上保鲜膜保湿, 于25℃、70%相对湿度, 光照16 h/黑暗8 h的温室中培养。分别在10 d和45 d后对接种的烟草叶片照相记录, 按照Gao等[32]的方法用ImageJ软件统计叶面菌斑面积, 观察攻毒60 d后烟草的整体生长状况。
1.8 SfPR1a的亚细胞定位
利用生物信息学网站(https://psort.hgc.jp/form2. html)对SfPR1a蛋白进行亚细胞定位预测, 随后将目的基因偶联绿色荧光蛋白的亚细胞定位表达载体pCAMIA1302-和空载对照pCAMIA 1302通过基因枪法轰击洋葱表皮[33], 18 h后徒手撕片, 激光扫描共聚焦显微镜(Nikon, JPN)观察。
1.9 统计学分析
利用Prism 5.0软件对所记录的数据进行统计学检验分析, 每组数据均由3个独立的生物学重复计算获得。不同字母表示有显著性差异,<0.05表示差异显著,<0.01表示差异极显著。
2 结果与分析
2.1 SfPR1a蛋白氨基酸序列生物信息学分析
将费尔干猪毛菜SfPR1a与水稻、大豆、青稞和橡胶树的PR1氨基酸序列比对发现不同物种间PR1中相同的氨基酸序列高达60%以上, 并且在其C端都具有PR1蛋白家族所共有的CAP保守结构域(CXYXPXXGNXXGXXPY)(图1), 表明费尔干猪毛菜基因编码的蛋白属于PR1蛋白家族成员。
2.2 SfPR1a基因的表达规律
基因在根中的相对表达量比茎叶高约200倍(图2-A)。为明确该基因是否受植物激素和NaCl的诱导, 分别用50 μmol L-1ABA、50 μmol L-1ACC、100 μmol L-1JAs和600 mmol L-1NaCl处理20 d龄的费尔干猪毛菜幼苗, 分别提取处理0、1、6和24 h幼苗茎叶的总RNA, 进行qRT-PCR分析。结果显示, ABA胁迫处理1 h后基因的相对表达量显著升高, 尽管处理6 h后稍有下降但仍显著高于对照组, 在24 h表达量达到峰值, 增长约250倍(图2-B)。费尔干猪毛菜幼苗经乙烯合成前体ACC处理后,基因呈现先上升后下降的趋势, 但表达量均显著高于处理前, 其中处理后6 h表达量最高, 增长约4500倍(图2-C)。基因在100 μmol L-1JAs处理后的表达趋势与ACC处理基本一致, 但整体表达差异倍数相对较低(图2-D)。600 mmol L-1NaCl处理下,基因呈现早期1 h积极应答, 6 h达到峰值, 表达量增长了约40倍, 胁迫24 h后与对照无显著差异(图2-E)。以上结果表明费尔干猪毛菜基因受到ACC、JAs等生物胁迫相关激素和ABA等非生物胁迫相关激素的诱导表达, 同时也受到非生物胁迫NaCl的诱导表达, 与前期研究结果趋势一致。以上结果为后期进一步研究基因的生物和非生物胁迫抗性功能提供了理论基础。

图1 费尔干猪毛菜SfPR1a蛋白与其他PR1蛋白家族成员的比较
不同物种PR1蛋白GenBank登录号: 水稻(AJR16763.1)、大豆(XP003545775.1)、青稞(CAA79703.1)、橡胶树(ALS87256.1)、费尔干猪毛菜(AFR90191.1)。
GenBank accession numbers of different species:Group(AJR16763.1),(XP003545775.1),(CAA79703.1),(ALS87256.1), and(AFR90191.1).
2.3 转基因烟草的获得及鉴定
为明确基因的功能, 采用叶圆盘法转化模式植物烟草, 用终浓度20 mg L-1的潮霉素对再生的转化烟草及种子进行两代的筛选, 获得3株T2代纯系转基因烟草。利用qRT-PCR技术检测了基因在转基因烟草OE4、OE5和OE10不同株系中的表达(图3), 后期将它们作为基因功能验证的试验材料。
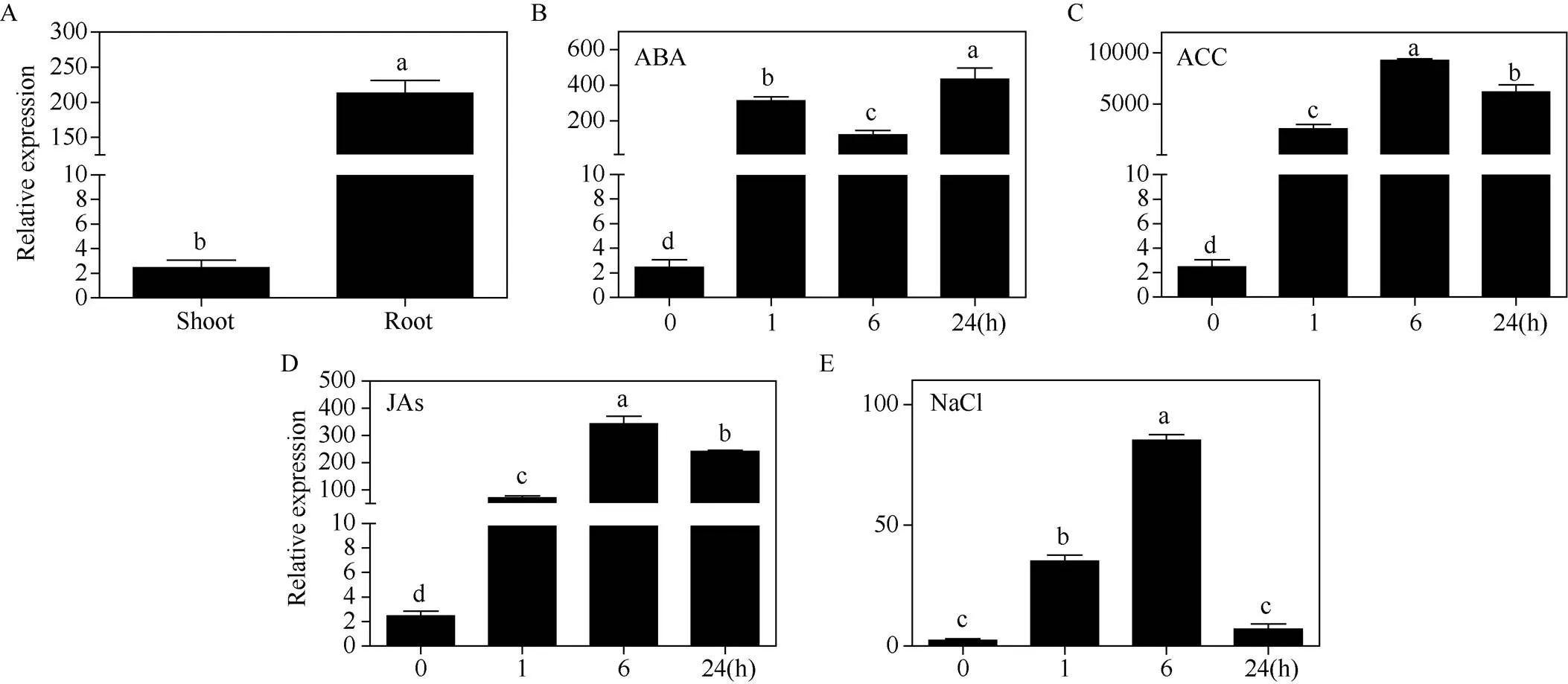
图2 SfPR1a基因在费尔干猪毛菜不同组织部位以及不同处理下的表达分析
基因在茎叶和根中(A)、ABA (B)、ACC (C)、JAs (D)以及NaCl (E)处理下的相对表达量。每组实验设3个生物学重复, 不同字母表示存在显著差异(0.05)。
The relative expression ofgene in aerial part and root (A) and under the conditions of ABA (B), ACC (C), JAs (D), and NaCl (E), respectively. Three biological replicates were set for each experiment. Bars labelled with different letters are significantly different at< 0.05.

图3 SfPR1a基因在转基因烟草中的表达分析
标以不同小写字母的柱值差异显著(< 0.05)。
Bars labelled with different letters are significantly different at< 0.05.
2.4 转SfPR1a烟草抗旱性分析
对长势大小一致的烟草进行自然控水处理2周, 转基因和野生型烟草叶片均呈现不同程度的萎蔫, 但转基因烟草叶片的萎蔫和失水程度较轻于野生型烟草(图4-A)。测定结果显示, 干旱胁迫后野生型烟草MDA含量显著增加, 而转基因植株中其含量变化差异不大(图4-B), 表明相同胁迫条件下野生型烟草受到了严重的膜损伤。野生型和转基因型烟草控水4周复水1周后, 转基因烟草植株的生长状况(图4-C)及存活率(图4-D)显著优于野生型烟草。以上结果表明, 费尔干猪毛菜基因的异源表达显著增强了转基因烟草的抗旱性。

图4 转SfPR1a基因烟草在干旱胁迫下的抗性
A: 干旱胁迫处理2周后的烟草生长表型; B: 干旱胁迫处理2周后的烟草MDA含量变化; C: 干旱胁迫处理4周复水1周后的烟草生长表型; D: 干旱胁迫处理4周复水1周后的烟草存活率统计。图中不同小写字母间表示存在显著性差异(0.05)。
A: phenotype of tobacco under drought stress treatment for two weeks; B: MDA content of tobacco under for two weeks drought treatment; C: phenotype of tobaccos under drought stress for four weeks and then re-water for one week. D: survival rate (D) of tobaccos under drought stress for four weeks and then re-water for one week. Bars labelled with different letters are significantly different at0.05.
2.5 转SfPR1a基因烟草抗盐性分析
将表面消毒灭菌的转基因和野生型烟草种子分别播种于正常MS培养基和含有200 mmol L-1NaCl的MS培养基中生长15 d。观察发现, 除OE10株系外, 在正常培养基上生长的野生型烟草与转基因烟草的种子萌发情况和生长表型没有明显差异(图5-A左), 而盐胁迫条件下3个转基因株系的生长均显著优于野生型烟草(图5-A右), 尤其是萌发势较差的过表达株系OE10。同时转基因烟草在盐胁迫下积累的生物量要显著高于野生型烟草(图5-B)。成苗阶段, 经200 mmol L-1NaCl胁迫处理2周后, 野生型烟草出现了一定程度的萎蔫(图5-C), 而转基因烟草未表现出任何胁迫状态, 但二者的叶绿素含量和可溶性蛋白含量等生理生化指标却无显著性差异(数据未显示)。以上结果表明,基因的异源表达增强了转基因烟草的耐盐性。
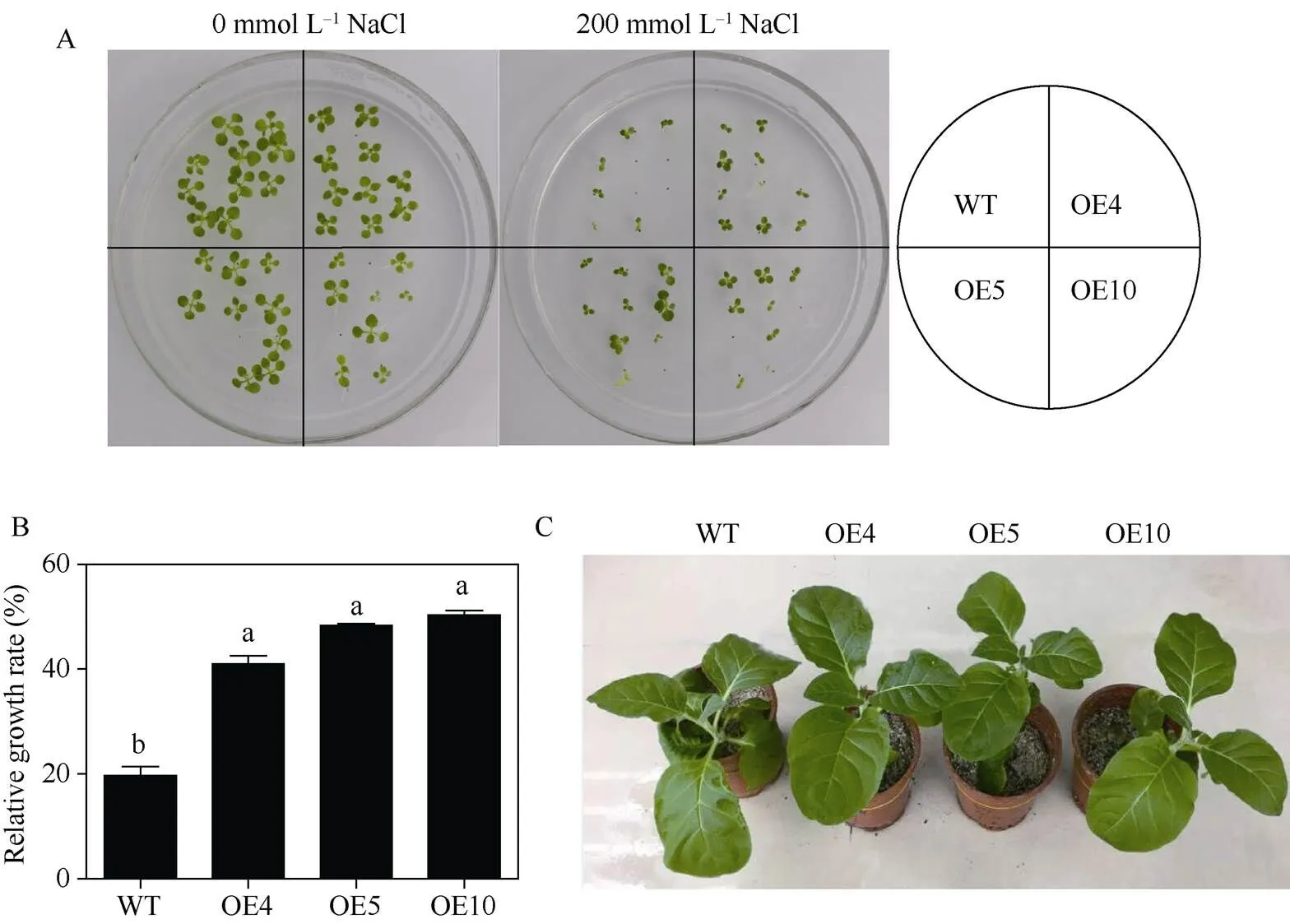
图5 转SfPR1a基因烟草在盐胁迫下的抗性
200 mmol L–1NaCl胁迫下的烟草萌发生长表型(A)及相对生长量(B); 250 mmol L–1NaCl胁迫下的烟草成苗抗盐表型(C)。图中标以不同小写字母的柱值差异显著(0.05)。
The phynotypic growth of tobaccos after germination (A) and relative growth in 200 mmol L–1NaCl medium (B); C: tolerance of tobacco at the adult stage under 250 mmol L–1NaCl for 2 weeks. Bars labelled with different letters are significantly different at0.05
2.6 转SfPR1a基因烟草抗叶斑病分析
为明确费尔干猪毛菜病程相关蛋白基因是否能够提高植株的抗病能力, 对长势和大小基本一致的转基因和野生型烟草叶片注射了丁香假单胞菌tDC3000。接种10 d后, 两者叶片的菌斑面积没有明显差异(图6-A); 接种45 d后, 野生型烟草的菌斑面积没有显著性变化, 而转基因烟草叶片的菌斑面积显著高于野生型烟草(图6-B和图6-C)。接种60 d后转基因烟草的整体生长状况显著优于野生型烟草(图6-D)。以上结果表明基因提高了转基因烟草对叶斑病的抗性。
2.7 亚细胞定位
生物信息学分析基因编码的蛋白质具有信号肽序列, 属于分泌型蛋白, 提示该蛋白定位表达在胞外。利用基因枪法将目的基因与绿色荧光蛋白基因偶联的表达质粒和仅含有绿色荧光蛋白基因的空载对照轰击至洋葱表皮中瞬时表达, 转化18 h后徒手撕片, 用激光扫描共聚焦显微镜观察绿色荧光以确定目的蛋白在细胞中的分布。转有绿色荧光蛋白空载对照pCAMBIA1302-的洋葱表皮中, 整个细胞都有绿色荧光的分布, 无明显的细胞表达特异性(图7-A)。而在转有融合目的基因pCAMBIA1302--的洋葱表皮中, 绿色荧光包围整个细胞, 胞质及胞内其他细胞器中并无分布(图7-B~D)。结合理论预测和初步试验结果, 推测SfPR1a蛋白表达定位于细胞的质外体空间, 这可能与其抗性功能的发挥密切相关。
3 讨论
本试验显示,基因在费尔干猪毛菜地上和地下部分均有表达(图2-A), 与Linthorst等[34]证明烟草和矮牵牛基因表达结果一致。基因在根中的表达量显著高于在地上部分中, 这可能与根作为最先接触并感知外界土壤刺激的植物器官以应对不利环境有着密切的关系。
早期研究发现, 水稻和基因受茉莉酸(JA)、水杨酸(SA)、过氧化氢(H2O2)、蛋白酶抑制剂斑蝥素和稻瘟病菌()的显著诱导表达[35-37]; Wang等[38]和Gao等[39]的研究结果也同样显示了百合和小麦基因受脱落酸(ABA)、茉莉酸甲酯(MeJA)和乙烯(EH)的诱导表达。本研究结果也显示基因受生物胁迫相关激素ACC、JAs及非生物胁迫相关激素ABA和盐的胁迫诱导表达, 推测该基因可能是多种信号通路交叉对话的下游靶基因, 后期仍需对基因启动子及调节机制做进一步的深入研究。

图6 转SfPR1a基因烟草对叶斑病的抗性
A: 接菌10 d后烟草叶片菌斑面积; B: 接菌45 d后的烟草叶片; C: 接菌45 d后烟草叶片菌斑面积; D: 接菌60 d后烟草植株的生长表型。图中标以不同小写字母的柱值差异显著(0.05)。
A: plaque area after inoculation offor 10 d; B: tobacco leaves inoculated withfor 45 d; C: plaque area after inoculation offor 45 d; D: growth phenotype of tobaccos after 60 d ofinoculation. Bars labelled with different letters are significantly different at0.05
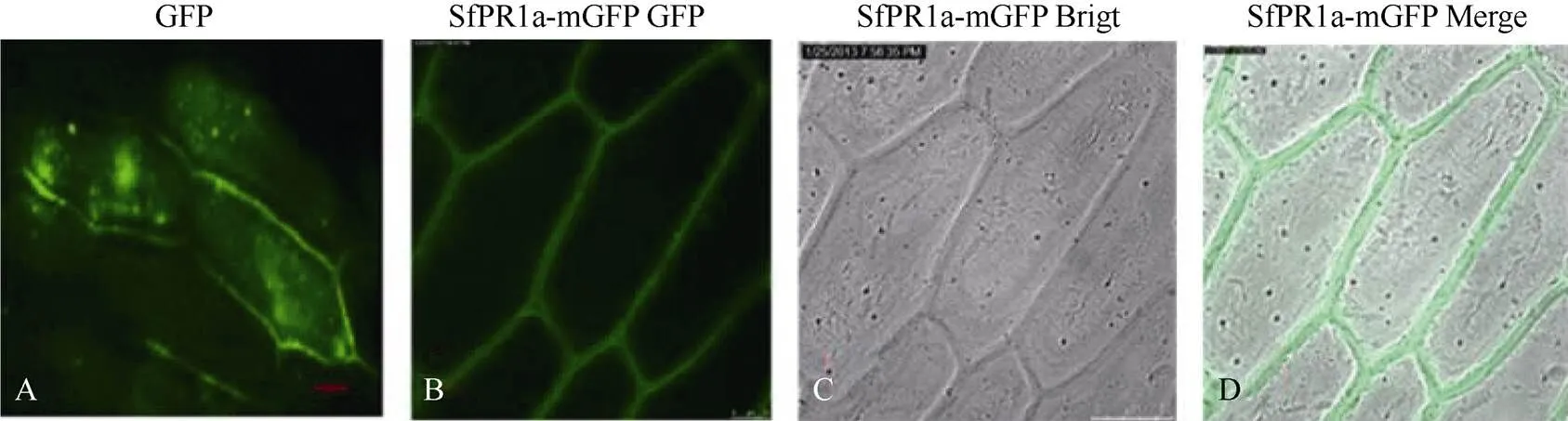
图7 SfPR1a的亚细胞定位
A: 空载对照mGFP的荧光图; B: 融合蛋白SfPR1a-mGFP的荧光图; C: 明场下的图B; D: 荧光图B与明场图C的叠加效果图。
A: control empty plasmid (GFP) viewed under fluorescence filter; B: SfPR1a-mGFP transformed cells viewed under fluorescence filter (B) to show the location of GFP protein; C: SfPR1a-mGFP transformed cells shape under bright field; D: merge of B and C. Bar = 50 µm.
基因提高了烟草对盐和干旱胁迫的抗性,这与之前对来自烟草[40]和拟南芥[41]PR1蛋白分别具有抗渗透和干旱胁迫的研究结果一致。值得注意的是,基因的异源表达显著地提高了烟草在种子萌发阶段的生长, 而对具有抗盐表型的成苗进行叶绿素和蛋白含量进行生理生化指标检测时, 转基因烟草和野生型烟草之间没有显著差异(结果未显示), 该蛋白发挥生理功能的机制尚不明确。
烟草[42]和小麦[43]基因的异源表达增强了植物对病原微生物的抗性。本研究中, 接种丁香假单胞菌后, 转基因烟草叶片显示出比野生型烟草叶片更加严重的病理反应, 但纵观两者的表型, 转基因烟草的整体生长状况显著优于野生型烟草。有文献报道称[44], 拟南芥基因通过诱导其他PR家族成员的表达诱发了植物的SAR反应, 从而赋予拟南芥对丁香假单胞菌的抗性。作为SAR的具体表现之一, 超敏反应(hypersensitivity)和过敏性坏死反应(chypersensitive necrosis reaction)均会通过感染部位叶片迅速死亡的植物免疫过程达到抗菌作用。因此, 推测转基因烟草可能通过异源表达的诱发了植株在感染部位的过敏性坏死反应或超敏反应导致感染部位叶片迅速死亡, 从而有效抑制病原菌在植物体内的扩散, 这可能是提高植物抗病性的有效策略之一。然而, Lincoln等[45]研究发现, 番茄PR1蛋白通过结合Rac1复合物以抑制细胞程序性死亡(PCD), 从而保护植物在病原体感染后正常生长。Wang等[38]的研究表明, PR1蛋白在SAR的过程中通过与LhSorTGA2蛋白相互作用以调节其他防御相关基因的表达, 从而提高了植物在病原微生物感染过程中的抗性功能。综上所述, 不同来源的植物PR1蛋白在植物抗病过程中通过不同的机制发挥了抗生物胁迫功能。此外, 有研究显示植物可通过释放NO增强PR1蛋白的含量从而减少病原菌在叶片中的积累[47], 推测基因的表达可能与无机信号分子之间存在普遍的联系; Lu等[43]研究发现同一物种中不同的PR1蛋白以不同的形式存在, 如小麦的PR1-1主要以单体存在, 而PR1-5以二聚体存在, 该现象与PR1蛋白发挥作用之间的内在联系也值得我们进一步研究; 根据Tosarini等[47]的研究发现, 可可中发现的2种PR1蛋白TcPR-1g和TcPR-1f均具有23个疏水性氨基酸形成的受体样激酶保守结构域, 暗示PR1蛋白生物学功能的发挥可能与激酶信号通路的转导有关。以上研究结果极大丰富了我们对PR1蛋白抗病机理的认识。
结合亚细胞定位预测和本研究结果, 初步确定SfPR1蛋白可能作为一种分泌型蛋白定位在胞外, 这一结果与拟南芥AtPR1蛋白的定位结果相一致[48]。PR1作为一种受胁迫诱导表达的蛋白质, 其亚细胞定位必然与防御功能的发挥密切相关。Gao等[37]的研究表明, 定位表达在胞外的可可TcPR1蛋白具有抑制真菌生长的作用。目前, 尽管PR1蛋白发挥抗菌作用的分子机制尚不清楚, 但可以明确的是来自不同物种的PR1蛋白在植物抵御生物胁迫抗性过程中发挥十分重要的作用。
4 结论
费尔干猪毛菜病程相关蛋白基因在根中的表达高于在地上茎叶中, 且该基因受到生物胁迫相关激素ACC、JAs以及非生物胁迫相关激素ABA和NaCl的显著诱导; 其异源表达显著提高了转基因烟草对盐、旱及丁香假单胞菌的抗性。SfPR1a可能定位表达在细胞外, 属分泌型蛋白。
[1] Balbi V, Devoto A. Jasmonate signalling network in: Crucial regulatory nodes and new physiological scenarios., 2008, 177: 301–318.
[2] Mahabub A M, Nahar K, Hasanuzzaman M, Fujita M. Exogenous jasmonic acid modulates the physiology, antioxidant defense and glyoxalase systems in imparting drought stress tolerance in different brassica species., 2014, 8: 279–293.
[3] Wasternack C. Jasmonates: an update on biosynthesis, signal transduction and action in plant stress response, growth and development., 2007, 100: 681–697.
[4] Wang L C, Li H, Ecker J R. Wang K LC, Li H, Ecker JR. Ethylene biosynthesis and signaling networks., 2002, 14: S131–S151.
[5] Guo H, Ecker J R. The ethylene signaling pathway: new insights., 2004, 7: 40–49.
[6] Ali S, Mir Z A, Bhat J A, Tyagi A, Chandrashekar N, Yadav P, Rawat S, Sultana M, Grover A. Isolation and characterization of systemic acquired resistance marker geneand its promoter from., 2018, 8: 10–24.
[7] Mejía-Teniente L, Durán-Flores F de D, Chapa-Oliver A M, Torres-Pacheco I, Cruz-Hernández A, González-Chavira M M, Ocampo-Velázquez R V, Guevara-González R G. Oxidative and molecular responses inL. after hydrogen peroxide, salicylic acid and chitosan foliar applications., 2013, 14: 10178–10196.
[8] Bantel Y, Darwiche R, Rupp S, Schneiter R, Sohn K. Localization and functional characterization of the pathogenesis-related proteins Rbe1p and Rbt4p in., 2018, 13: 1371–1385.
[9] Abraham A, Chandler D E. Tracing the evolutionary history of the CAP superfamily of proteins using amino acid sequence homology and conservation of splice sites., 2017, 85: 137–157.
[10] Ohshima M,Matsuoka M, Yamamoto N,Tanaka Y, Kano-Murakami Y, Ozeki Y,Kato A,Harada N,Ohashi Y. Nucleotide sequence of thegene of., 1987, 225: 246–246.
[11] Tornero P, José G, Conejero V, Pablo V. Twogenes from tomato are differentially regulated and reveal a novel mode of expression for a pathogenesis-related gene during the hypersensitive response and development., 1997, 10: 624–634.
[12] Klaus M, Aaron L, Thomas E, Allen M, Jürg S, Kay A L, Jeffery L D, Robert A D. The transcriptome ofduring systemic acquired resistance., 2001, 26: 403–410.
[13] Li Z T, Dhekney S A, Gray D J.gene family of grapevine: a uniquely duplicatedgene from a vitisinter specific hybrid confers high level resistance to bacterial disease in transgenic tobacco., 2011, 30: 1–11.
[14] Ichiro M, Takayoshi I, Shigemi S, Yuki Y, Hiroyuki K, Sakino H, Yasunobu O, Yuko O. Characteristic expression of twelve ricefamily genes in response to pathogen infection, wounding, and defense-related signal compounds (121/180)., 2008, 279: 415–427.
[15] Maria T R G, Carlos E S L, Juana M J V, Cesar V F B, Ernesto O, Lourival D P. Transcriptomic and proteomic analyses reveal the diversity of venom components from the vaejovid scorpion., 2018, 10: 359–384.
[16] Jung H W, Tschaplinski T J, Wang L, Jane G, Jean T G. Priming in systemic plant immunity.,2009, 324: 89–91.
[17] Fumihiko S, Hisashi K, Yasuyoshi S, Nobuo K, Yasuyuki Y. Synthesis and secretion of tobacco neutral PR-5 protein by transgenic tobacco and yeast., 1995, 211: 909–913.
[18] Leendert C V L, Martijn R, Corné P. Significance of inducible defense-related proteins in infected plants., 2006, 44: 135–162.
[19] Sayaka I, Ei’ichi I, Keiichi W, Yukio N. Transcriptome analysis reveals key roles of AT-LBR2 in LPS-induced defense responses in plants., 2017, 18: 995–1008.
[20] Antoniw J F, Ritter C E, Pierpoint W S, Vanloon L C. Comparison of three pathogenesis-related proteins from plants of two cultivars of tobacco infected with TMV., 1980, 47: 79–87.
[21] Lu S, Edwards M. Molecular characterization and functional analysis of PR-1-like proteins identified from the wheat head blight fungus fusarium graminearum., 2017, 108: 510–520.
[22] 王艳, 陈西, 周连洁, 杨中敏. 费尔干猪毛菜病程相关蛋白基因()的克隆及在盐胁迫下的表达分析. 植物科学学报, 2013, 31: 164–170. Wang Y, Chen X, Zhou L J, Yang Z M. Cloning of pathogen-related protein gene () fromand its expression analysis under salt stress., 2013, 31: 164–170(in Chinese with English abstract).
[23] 马立功, 张匀华, 孟庆林, 石凤梅, 刘佳, 李易初, 王志英. 向日葵病程相关蛋白基因的克隆与功能. 作物学报, 2015, 41: 1819–1827. Ma L G, Zhang Y H, Meng Q L, Shi F M, Liu J, Li Y C, Wang Z Y. Cloning and function analysis of pathogenesis related protein genefrom sunflower ()., 2015, 41: 1819–1827 (in Chinese with English abstract).
[24] 高海波, 曾幼玲, 张富春. 费尔干猪毛菜愈伤组织的诱导、分化及植株再生体系的建立. 武汉植物学研究, 2008, 26: 634–638. Gao H B, Zeng Y L, Zhang F C. Callus induction differentiation and establishment of plantlet regeneration system of., 2008, 26: 634–638 (in Chinese with English abstract).
[25] 王艳, 陈西, 周莲洁, 杨中敏. 费尔干猪毛菜病程相关蛋白基因的表达规律和植物表达载体构建. 生物技术通报, 2014, (1): 116–124. Wang Y, Chen X, Zhou L J, Yang Z M. Expression profiles of pathogen-related protein gene () fromand construction of plant expression vectors., 2014, (1): 117–124 (in Chinese with English abstract).
[26] Matsuo K, Fukuzawa N, Matsumura T. A simple agroinfiltration method for transient gene expression in plant leaf discs., 2016, 122: 351–356.
[27] 王燃, 许亚龙, 李泽锋, 卢鹏, 孟利军, 曹培健. 基于芯片数据的烟草qRT-PCR内参基因鉴定与验证. 烟草科技, 2017, 50(11): 1–8. Wang R, Xu Y L, Li Z F, Lu P, Meng L J, Cao P J. Identification and validation of tobacco reference genes for qRT-PCR based on microarray data., 2017, 50(11): 1–8 (in Chinese with English abstract).
[28] Hodges D M, DeLong J M, Forney C F, Prange R K. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds., 1999, 207: 604–611.
[29] Gitelson A A, Merzlyak M N. Remote estimation of chlorophyll content in higher plant leaves., 1997, 18: 2691–2697.
[30] Wang J, Lan X X, Jiang S X, Ma Y L, Zhang S Y, Liu Y, Li X R, Lan H Y.frompositively regulates salt and drought tolerance in transgenic tobacco., 2017, 130: 1–17.
[31] Lee O R, Kim Y J, Balusamy S R D, Khorolragchaa A, Sathiyaraj G, Kim M K, Yang D C. Expression of the ginsengin Arabidopsis confers resistance against fungal and bacterial infection., 2012, 506: 85–92.
[32] 高建昌, 郭广君, 国艳梅, 王孝宣, 杜永臣. 平台扫描仪结合ImageJ软件测定番茄叶面积. 中国蔬菜, 2011, 2(1): 73–77. Gao J C, Guo G J, Guo Y M, Wang X W, Du Y C. Measuring plant leaf area by scanner and ImageJ software., 2011, 2(1): 73–77 (in Chinese with English abstract).
[33] Indra K V, Vimla V. Transformation of wheat via particle bombardment., 1999: 111: 349–358.
[34] Linthorst H J, van Loon L C, van Rossum C M, Mayer A, Bol J F, van Roekel J S, Meulenhoff E J, Cornelissen B J. Analysis of acidic and basic chitinases from tobacco and petunia and their constitutive expression in transgenic tobacco., 1990, 3: 252–258.
[35] Ganesh K A, Nam S J, Randeep R. A novel rice (L.) acidicgene highly responsive to cut, phytohormones, and protein phosphatase inhibitors., 2000, 274: 157–165.
[36] Ganesh K A, Randeep R, Nam S J. Rice (L.)gene is phytohormonally regulated in close interaction with light signals., 2000, 278: 290–298.
[37] Ganesh K A, Randeep R, Nam-Soo J, Vishwanath P A. Signalling molecules and blast pathogen attack activates riceandgenes: a model illustrating components participating during defence/stress response., 2001, 39: 1095–1103.
[38] Wang L, Guo Z H, Zhang Y B, Wang Y J, Wang L, Yang G, Li W M, Wang R Y, Xie Z K. Characterization of LhSorTGA2, a novel TGA2-like protein that interacts with LhSorNPR1 in oriental hybrid lily sorbonne., 2017, 58: 46–57.
[39] Gao L, Wang S, Li X Y, Wei X J, Zhang Y J, Wang H Y, Liu D Q. Expression and functional analysis of a pathogenesis-related protein 1 gene,, involved in wheat resistance against leaf rust fungus., 2015, 33: 797–805.
[40] Stintzi A, Heitz T, Kauffmann S, Legrand M, Fritig B. Identification of a basic pathogenesis-related, thaumatin-like protein of virus-infected tobacco as osmotin., 1991, 38: 137–146.
[41] Liu W X, Zhang F C, Zhang W Z, Song L F, Wu W H, Chen Y F.Di19 functions as a transcription factor and modulates,, andexpression in response to drought stress., 2013, 6: 1487–1502.
[42] Alexander D, Goodman R M, Gut R M, Glascock C, Weymann K, Friedrich L, Maddox D, Ahlgoy P, Luntz T, Ward E. Increased tolerance to two oomycete pathogens in transgenic tobacco expressing pathogenesis-related protein 1a., 1993, 90: 7327–7331.
[43] Lu S, Faris J D, Sherwood R, Edwards M C. Dimerization and protease resistance: new insight into the function of., 2013, 170: 105–110.
[44] Cao H, Glazebrook J, Clarke J D, Volko S, Dong X. Thegene that controls systemic acquired resistance encodes a novel protein containing ankyrin repeats., 1997, 88: 57–63.
[45] Lincoln J E, Sanchez J P, Zumstein K, Gilchrist D G. Plant and animalfamily members inhibit programmed cell death and suppress bacterial pathogens in plant tissues., 2018, 19: 2111–2123.
[46] Li Z, Liang W S, John P C. Effects of modifying alternative respiration on nitric oxide-induced virus resistance and PR1 protein accumulation., 2014, 95: 2075–2081.
[47] Tosarini T R, Ramos P Z,Profeta G S,Baroni R M,Massirer K B,Couñago R M,Mondego J M C. Cloning, expression and purification of kinase domains of cacao PR-1 receptor-like kinases., 2018, 146: 78–84.
[48] Pečenková T, Pleskot R, Žárský V. Subcellular localization of Arabidopsis pathogenesis-related 1(PR1) protein., 2017, 18: 825–838.
Pathogenesis-related protein genefromenhances the resistances to drought, salt and leaf spot disease in transgenic tobacco
HENG You-Qiang, YOU Xi-Long, and WANG Yan*
Xinjiang Key Laboratory of Biological resources and Genetic Engineering / College of Life Science and Technology, Xinjiang University, Urumqi 830046, Xinjiang, China
In order to investigate whether, a pathogenesis-related protein gene from an annual halophytic speciesDrob., was involved in the response to plant defense, qRT-PCR was employed to detect its expression patterns under abscisic acid (ABA), jasmonic acid (JAs), ethylene synthesis direct precursor (ACC), and NaCl treatments. We also identified resistances to salt, drought andtomato (tDC3000) of transgenic tobacco were identified. The expression ofgene in roots was significantly higher than that in shoots, and positively induced by ABA, JAs, ACC, and NaCl treatments. The malondialdehyde (MDA) content of transgenic tobacco was significantly lower than that of wild-type tobacco, showing a strong resistance to drought. The ectopic expression ofgene improved plant growth under salt stress. After infection of, transgenic tobacco leaves showed serious necrosis reaction, but the overall resistance phenotype of the plants was significantly better than that of WT. Subcellular localization analysis showed SfPR1a was localized in the plant cell apoplastic space. The above results indicated that thegene is involved in plant resistance to abiotic and biotic stresses.
pathogenesis-related protein gene; expression pattern; transgenic tobacco; resistance function; subcellular localization
2019-06-04;
2019-12-26;
2020-01-15.
10.3724/SP.J.1006.2020.94082
王艳, E-mail: wangyanxju@126.com
E-mail: hengyouqiang706567@163.com
本研究由新疆生物资源基因工程重点实验室开放课题(2017D04026)和国家自然科学基金项目(31860061)资助。
This study was supported by the Xinjiang Key Laboratory of Biological Resources Genetic Engineering (2017D04026) and the National Natural Science Foundation of China (31860061).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200115.1140.022.html
