转基因玉米MIR604基体标准物质研制
2020-03-23李夏莹宋贵文翟杉杉柳方方张秀杰武玉花
李 俊 李 亮 李夏莹 宋贵文 沈 平 张 丽 翟杉杉 柳方方 吴 刚 张秀杰,* 武玉花,*
转基因玉米MIR604基体标准物质研制
李 俊1李 亮2李夏莹3宋贵文3沈 平3张 丽1翟杉杉1柳方方2吴 刚1张秀杰3,*武玉花1,*
1中国农业科学院油料作物研究所/ 农业农村部油料作物生物学与遗传育种重点实验室, 湖北武汉 430062;2中国农业科学院生物技术研究所, 北京 100081;3农业农村部科技发展中心, 北京 100025
转基因生物安全监管是生物技术产业健康发展的保障, 而转基因检测标准物质是进行转基因监管检测的物质基础, 缺少标准物质就难以保证检测数据的准确性、可靠性和可比性。转基因玉米MIR604是我国批准进口用作加工原料的转基因品种, 对其安全监管亟须制备标准物质。本项目通过对转基因玉米MIR604种子进行原材料鉴定、研磨、过筛、含水量测定等步骤, 制备出转基因玉米MIR604纯品基体标准物质。均匀性检验和稳定性检验结果表明, 本批标准物质在瓶内和瓶间均具有良好的均匀性, 可在常温下运输1个月, 长期稳定性达到6个月, 量值稳定。本批标准物质的特性量值为转基因DNA与总DNA的拷贝数比值, 由9家实验室采用MIR604/二重数字PCR联合定值, 量值为0.50。充分评估了标准物质定值结果的各个不确定度分量, 合成扩展不确定度为0.06 (copy/copy)。本批标准物质规格为1 g 瓶–1, 使用时最小取样量为100 mg, 可用于转基因玉米MIR604的安全监管和定量标识、以及实验室质量控制等领域。
转基因玉米MIR604; 基体标准物质; 数字PCR; 实时荧光PCR; 联合定值
随着生物技术产业的迅速发展, 对转基因生物安全监管工作, 政府越来越重视, 民众越来越关注。2007年至今, “中央一号文件”已有8次明确提及转基因, 强调“加强农业转基因技术研发和监管, 在确保安全的基础上慎重推广”[1]。实施转基因生物安全管理和标识, 一方面要建立转基因检测标准方法, 另一方面要研制转基因生物标准物质。转基因生物标准物质是一种或多种足够均匀和很好地确定了的特性(转基因成分和含量), 在转基因检测中用以校正测量装置、评价测量方法或给材料赋值的一种材料和物质[2-3]。近年来, 我国转基因产品检测方法的标准化工作进展迅速, 建立了完善的转基因检测标准方法体系, 涵盖国家标准、农业农村部发布的具国家标准效力的公告以及进出口检验检疫行业标准等。相对于标准方法, 我国转基因检测标准物质研制工作严重滞后于转基因生物安全监管工作的实际需求。而转基因检测标准物质是保障检测结果准确、可靠、可比、有效和可溯源的物质基础, 转基因检测标准物质的缺乏将严重影响转基因产品的安全评价、身份验证、国内监管、进出口检验、企业自控和国际贸易互认等工作[4-5]。
为了对转基因产品进行有效的监管和实施转基因产品标识法规, 原则上, 每种批准商业化的转化体都必须研制对应的标准物质, 欧盟、美国、日本等从2000年前后就开始大力研制转基因检测标准物质, 于2004年公开发售研制成功的标准物质产品。研制转基因检测标准物质最多的研发机构主要有欧盟联合研究中心下属的标准物质与测量研究所(Institute for Reference Materials and Measurements, IRMM)和美国石油化学家学会(American Oil Chemists’ Society, AOCS)[6]。到2017年, 欧盟IRMM针对在欧盟商业化生产的转基因作物已经研发127种转基因检测基体标准物质, 涵盖了六大作物的30个转基因品种, 如转基因大豆GTS40-3-2、转基因玉米 MON863、转基因油菜73496等, 每个品种有2~6个浓度梯度; IRMM还研发了4种质粒标准物质, 包括转基因玉米MON810、98140、NK603和转基因大豆356043[5]。美国的AOCS生产了35种基体粉末标准物质和19种纯品基因组DNA标准物质, 涉及的转化体几乎覆盖目前已在国际市场上商业化种植的转基因作物[7]。
为了满足不断增长的食用油和饲料需求, 我国从2003年开始大量进口转基因产品用作加工原料, 批准进口的品种包括19个玉米、14个大豆、9个棉花、8个油菜和1个甜菜。在转基因生物安全监管工作中, 我国一直从国外购买转基因检测标准物质, 周期长、价格昂贵。为了消除对国外标准物质的严重依赖, 从2008年开始我国自主研发标准物质。转基因玉米MIR604是先正达公司(Syngenta)研发的抗虫转基因玉米, 2008年我国批准其进口用作加工原料, 是我国进行转基因生物安全监管的重要对象。转基因玉米MIR604采用农杆菌介导法将修饰的抗虫基因表达盒(pMTL-mcry3A-Tnos)和磷酸甘露糖异构酶基因表达盒(pZmUbiInt-pmi-Tnos)转化到玉米中, 在受体基因组中外源基因为单拷贝插入, 插入位点的旁侧基因组序列已经阐释清楚, 5′端旁侧基因组序列长1312 bp, 3′端旁侧基因组序列长1570 bp[8]。
本研究的目的是研制转基因玉米MIR604基体标准物质, 用于对转基因玉米MIR604及其加工产品的定性和定量检测, 为我国转基因生物安全管理和标识制度的实施提供有效的技术支撑。通过转基因玉米MIR604基体标准物质的研制, 建立起转基因玉米检测基体标准物质制备、检测、质量控制、定值和量值溯源的技术平台。
1 材料与方法
1.1 实验材料
转基因玉米MIR604种子由先正达公司提供。
1.2 原材料研磨及过筛
采用冷冻研磨系统Spex6870研磨转基因玉米MIR604种子。先在仪器中注入液氮, 令仪器充分冷却。待其充分冷却后, 将种子和撞子装入样品瓶, 浸入液氮, 以电磁为动力, 带动钢制撞子粉碎研磨。样品瓶在破碎过程中处于全封闭状态, 可避免样品间的交叉污染以及外界污染。优化后的冷冻研磨程序为预冷10 min, 运行3 min, 停止2 min, 5个循环。
研磨后的玉米粉末, 用振动分筛机(8411-A, 湖南湘潭)以40、80、120和160目标准筛分筛, 120目以上颗粒需第2次研磨, 研磨后, 干燥、过筛, 与第1次筛分的120目以下颗粒混合在一起, 用粉末混匀机进行(YG-1KG, 进杰机械)正反转混匀。混匀程序为30转 min–1, 搅拌3 h, 停止1 h, 4个循环。混匀后装入干燥密封瓶中备用。
1.3 DNA提取及质量评价
取研磨的玉米粉末100 mg, 用Qiagen的DNeasy Plant Mini Kit试剂盒按说明书提取其基因组DNA, 将提取的DNA溶解到90 μL 0.1×TE缓冲液中, 基因组DNA完全溶解后, 在Nanodrob 1000仪器上采用紫外分光光度法测定DNA溶液的OD230、OD260、OD280, 考察DNA的纯度和浓度。然后制备1%的琼脂糖凝胶, 取 1 μL DNA溶液进行凝胶电泳分析, 评估DNA的完整性。
1.4 PCR
1.4.1 普通PCR 在PCR仪C1000 (伯乐, Hercules, CA, USA)上进行普通PCR, 25 µL反应体系含1 µL DNA模板, 1× PCR buffer [含10 mmol L–1Tris HCl (pH 8.3), KCl 50 mmol L–1], 200 μmol L–1dNTPs, 2.5 mmol L–1MgCl2, 250 nmol L–1的正向引物和反向引物, 1 UDNA聚合酶。反应程序为94°C 2 min预变性; 94°C 15 s, 60°C 30 s, 72°C 30 s, 35次循环; 72°C 保温2 min。PCR产物经琼脂糖凝胶电泳分离, EB染色后鉴定是否存在扩增产物。
1.4.2 实时荧光PCR 在CFX96实时荧光PCR仪(伯乐, Hercules, CA, USA)上进行实时荧光PCR扩增, 玉米转化体MIR604、MON810、T25、MON863、NK603、TC1507和玉米内标基因的PCR体系均含基因组DNA 2.0 μL, 1×Man Universal PCR Master Mix, 400 nmol L–1primer, 200 nmol L–1probe, 1 UDNA 聚合酶, 加ddH2O至总反应体积为20 μL。反应程序为95ºC变性10 min; 95ºC变性15 s, 60ºC退火延伸1 min, 50个循环。
1.4.3 数字PCR 在微滴数字PCR平台QX200上进行MIR604/二重数字PCR, 优化后的反应体系为20 μL, 包含10 μL 2×ddPCR Master Mix, 10 μmol L–1正向引物和反向引物各0.8 μL、探针0.4 μL, DNA模板2 μL。将20 μL PCR体系和70 μL微滴生成油(droplet generation oil)加入微滴生成卡, 覆盖专用胶垫后置微滴生成仪生成微滴。将生成的微滴转移至PCR管, 置普通PCR仪C1000进行PCR扩增。PCR程序为95ºC 变性10 min; 95ºC变性15 s, 57.7ºC退火延伸1 min, 50个循环; 98ºC酶变性10 min; 4ºC保存。扩增后, 将96孔板置微滴读取仪中读取信号, 并使用软件QuantaSoft V1.3.2.0分析实验数据。
1.5 标准物质联合定值
参加定值的实验室需配备数字PCR系统, 并有一定的技术权威性[9]。首先, 由组织单位制定详细的定值实施方案, 详细规定样品的发送、保存、操作步骤、反应体系、程序及操作注意事项等。然后将经过质量验证的引物/探针和制备的粉末标准物质分发给9家实验室, 严格根据定值实施方案操作, 测定后将软件QuantaSoft V1.3.2.0导出的数据反馈给组织单位, 汇总并处理数据。
2 结果与分析
2.1 原材料鉴定
2.1.1 典型性鉴定 首先对转基因玉米种子进行转化体特异性及“排他性”检测, 以验证原材料是否是预期的转基因玉米MIR604, 以及转基因玉米MIR604是否被其他玉米转化体污染。根据“基体标准物质候选物鉴定方法”(农业部1485号公告- 19-2010), 取至少3000粒种子研磨成粉末, 用1 g粉末提取基因组DNA。以提取的基因组DNA作为实时荧光PCR模板, 用内标准基因和6种转基因玉米转化体特异性引物/探针(MIR604、MON863、MON810、NK603、T25、TC1507)进行PCR扩增, 引物/探针信息见表1。扩增结果显示, 只有MIR604转化体特异性引物有典型扩增曲线, 对其他转化体的引物均没有扩增曲线。仅内标基因和MIR604引物/探针序列有典型扩增曲线, 其他转化体均无扩增曲线, 表明转基因原材料确为转基因玉米MIR604的种子, 且没被其他的玉米转化体污染。
2.1.2 纯度鉴定 采用四分法抽取玉米MIR604种子240粒, 用Qiagen的DNeasy Plant Mini Kit试剂盒提取单粒基因组DNA, 用MIR604转化体特异性引物探针MIR604F/R/P进行实时荧光PCR扩增。检测结果显示240粒种子均为阳性。根据泊松分布原理, 在95%的置信度下, 其纯度≥98.76%。
2.1.3 基因型鉴定 转基因玉米种子的基因型与其转基因含量密切相关, 根据MIR604转化体的分子特征, 在插入位点的两侧基因组序列上分别设计1条引物(MIR604GF/MIR604GR), 在插入位点处设计1条探针(MIR604GP)(图1), 序列见表1。将插入位点特异性引物探针组合MIR604GF/R/P与MIR604转化体特异性引物探针MIR604F/R/P组合使用, 鉴定转基因玉米MIR604种子的基因型。对于纯合种子, 2条染色体上均含有外源插入序列, 只有引物探针组合MIR604F/R/P有典型扩增曲线, 而引物探针组合MIR604GF/R/P无扩增曲线; 对于杂合种子, 一条染色体上有插入序列, 另一条染色体上没有, 2个引物探针组合均有典型扩增曲线。对于阴性植株, 因不含有外源插入序列, 只有引物探针组合MIR604GF/R/P有典型扩增曲线(图1)。将单粒提取的基因组DNA作为PCR的模板, 用MIR604转化体、插入位点和内标基因3个引物/探针组合同时进行PCR扩增。扩增结果显示, 240粒种子的单粒DNA中3个引物/探针组合均有典型扩增曲线(图2), 表明原材料MIR604种子均为杂合种子。

表1 引物探针信息表
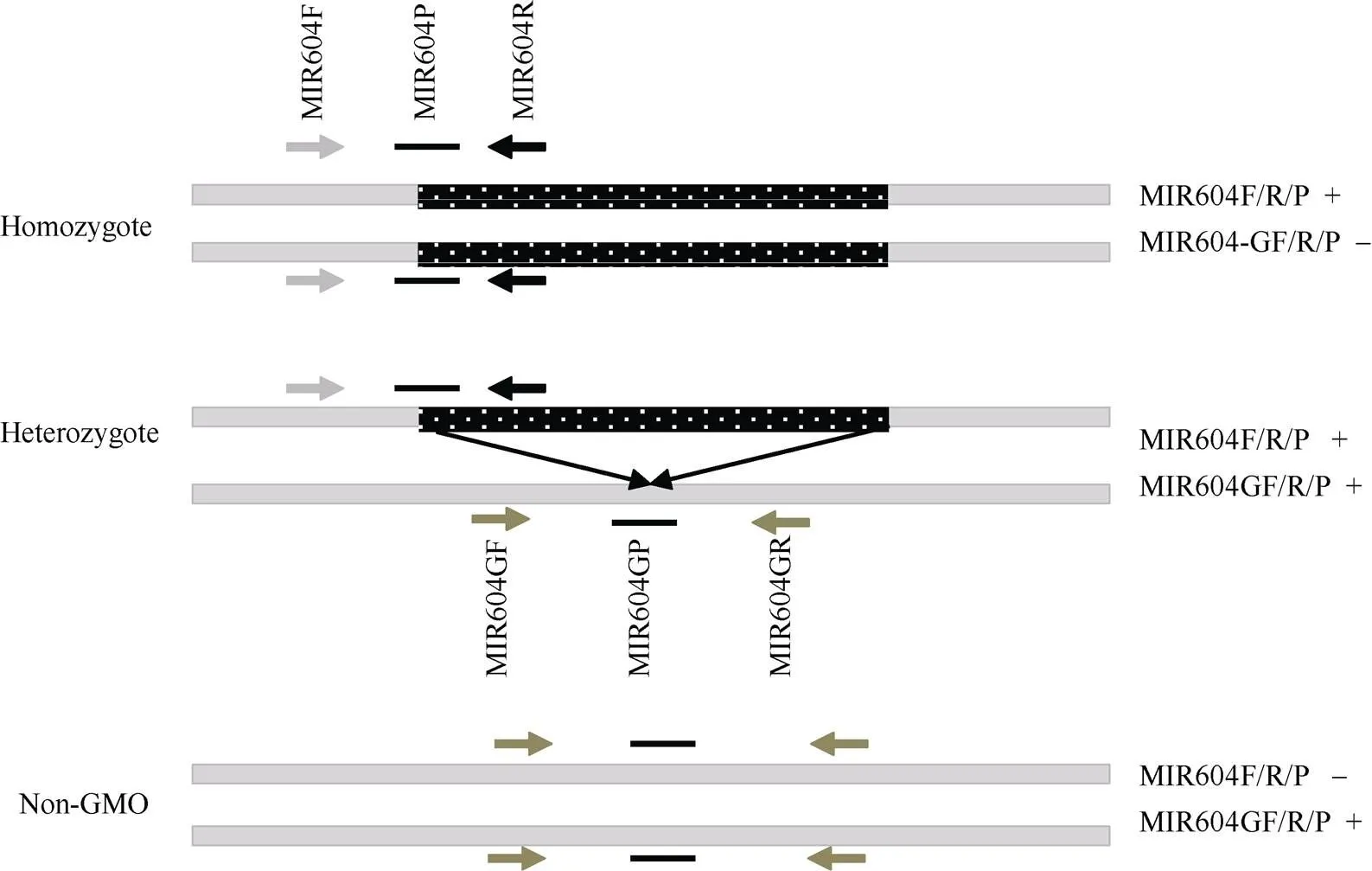
图1 鉴定转基因种子基因型的原理示意图
灰白矩形表示受体基因组DNA, 带白斑点的黑色矩形表示外源插入序列, 箭头表示引物位置, 加粗黑线表示探针位置。
The grey rectangles indicate the recipient genomic DNA, the black rectangles with white spots indicate the insert DNA, the arrows indicate the position of the primers, and the bold black lines indicate the position of the probes.

图2 杂合种子的扩增曲线图
2.2 粉末标准物质制备
2.2.1 种子研磨 将种子清洗、烘干后, 在冷冻研磨系统Spex6870中研磨。研磨完后, 过筛, 120目以上的颗粒经第2次研磨, 研磨好的粉末装入干燥密封瓶中。称取10 g粉末利用振动分筛机进行颗粒大小测定, 重复3次。转基因原材料粉末约有50%的颗粒介于120~200 μm之间, 而颗粒度小于200 μm的颗粒均占80%以上, 与欧盟制备的粉末标准物质的粒度大小相近。
2.2.2 含水量测定 粉末标准物质的含水量与其稳定性密切相关, 称取6份MIR604玉米粉末, 每份2 g, 用卡尔费休滴定法测试含水量, 测试6个重复。粉末含水量(4.30±0.03)%, 低于农业部1782号公告- 8-2012规定的10%[16]。
2.2.3 均匀性初检 将转基因玉米MIR604种子粉末在混匀机中混匀。混匀过程中每隔3 h取样一次, 共取样4次。每次选不同的部位取样, 取9份, 每份100 mg。提取样品的基因组DNA, 采用表1中MIR604转化体和玉米内标基因特异性引物探针进行荧光定量PCR扩增。以基因型鉴定的纯品MIR604基因组DNA作为标准品, 绘制标准曲线。依据标准曲线计算样品的转基因含量(转基因和内标基因拷贝数比值)。采用方差分析法检验数据, 检验结果表明, 从不同位置抽取的样品其量值均在0.45~0.55的区间内波动, 没有明显差异(图3), 均匀性良好, 且不随混匀时间的长短发生变化, 表现出良好的稳定性。

图3 均匀性初检样品的量值测定结果
2.2.4 分装和保存 将转基因玉米MIR604种子粉末分装, 称取约1.00 g (0.98~1.02 g)的粉末置玻璃瓶中, 调节高压氮气的低压表气压到0.5~0.8 MPa之间, 将调节好气流量的氮气橡胶管对准玻璃瓶口充气, 约2~3 s, 移除氮气管, 同时将橡胶塞盖紧, 将加好塞的玻璃瓶在自动轧盖机上轧盖。分装完成后粘贴标准物质初级标签。分装好的标准物质规格约为每瓶1.00 g (0.98~1.02 g), 分装400瓶。−20℃保存。
2.3 均匀性检验
从制备的400瓶标准物质中随机抽取15瓶, 分别标记1~15, 从每瓶上中下3个位置取3个子样, 每份取样量为100 mg, 共取样45份。在重复性实验条件下测定抽取的样品, 从而使样品间的差异完全反映样品间的不均匀性。提取样品DNA, 采用荧光定量PCR扩增MIR604转化体和内标准基因, 用
基因型鉴定的纯品基因组DNA作为标准品绘制标准曲线, 定量标准物质样品中MIR604特异性序列和内标基因的拷贝数比值, 15瓶标准物质的转基因含量水平在0.5左右波动(图4)。方差分析法是通过组间(瓶间)方差和组内(瓶内)方差的比较来判断各组测量值之间有无系统性差异, 如果二者的比值小于统计检验的临界值, 则认为样品是均匀的[17]。采用单因素方差分析法(检验法)对拷贝数比值进行均匀性检验, 统计分析结果表明<0.05(14,30)(表 2), 分装后的种子粉末在瓶内和瓶间均匀性无显著性差异, 因此判定种子粉末具有良好的均匀性。

图4 均匀性检验样品的测试结果

表2 均匀性检测测试数据的方差分析结果


式中,bb为瓶间标准偏差,bb为不确定度,12为组间方差,22为组内方差,为组内测量次数。
相对标准不确定度

据农业部发布的标准《转基因植物及其产品成分检测DNA提取和纯化》(农业部1485号公告-4- 2010)[18]以及试剂盒的操作说明, 通常推荐以100 mg的粉末样品作为原料提取基因组DNA。本研究中进行标准物质的均匀性检验, 抽取的子样也是100 mg, 显示标准物质在瓶内和瓶间均具有良好的均匀性。因此, 建议本批标准物质的最少取样量为100 mg。
2.4 稳定性检验

将短期稳定性检验样品分别存储在4℃、25℃、37℃、60℃, 分别在第0周、第1周、第2周、第4周后取样并储存于−70℃, 每次每个贮存温度随机选取3瓶, 每瓶重复取样3次(= 3,= 3), 取样后统一检测。提取DNA后进行荧光定量PCR检测, 梯度稀释经基因型鉴定的纯品MIR604基因组DNA, 配置标准品, 进行荧光定量PCR扩增, 绘制MIR604转化体特异性序列和内标基因的标准曲线, 计算样品中转化体特异性基因和内标基因拷贝数, 进而计算其转基因含量(表3)。对数据进行检验显示, 储存4周后, 在4℃、25℃、37℃和60℃下粉末标准物质的转基因含量未发生显著变化, 表现出良好的短期稳定性。因此, 本批标准物质可以在常温下稳定储存和运输4周, 特性量值不会发生显著变化。


表3 标准物质拷贝数比值的短期稳定性检验结果

表4 标准物质拷贝数比值长期稳定性检验结果

2.5 定值
为确定标准物质的量值, 组织9家实验室利用MIR604/二重数字PCR进行联合定值。定值结果如表5所示。根据 “标准物质定值的通用原则及统计学原理(JJF1343-2012)”[17], 对各家实验室返回的数据先后进行如下检验。(1)用狄克逊法和格拉布斯法进行9家实验数据的可疑值检验, 未在实验室内发现可疑数据; (2)采用达戈斯提诺法对所有联合定值的原始数据进行正态分布检验, 测定数据呈正态分布; (3)用狄克逊法对9组定值数据平均值进行实验室间数据组可疑值检验, 判定无界外值; (4)用科克伦法检验9组数据是否等精度, 结果9组数据的方差无显著差异, 实验室间数据组等精度。由于9家实验数据服从正态分布, 且实验室间等精度, 计算总平均值和总标准差(表5), 将总平均值0.5027作为转基因和内标基因比值的标准值, 将总标准差0.001作为联合定值引入的不确定度。

表5 转基因MIR604玉米种子粉末标准物质转基因和内标基因比值联合定值数据
2.6 不确定度评估
标准物质定值结果的合成不确定度由3个部分组成。第1部分是标准物质定值过程带来的A类和B类不确定度的合成不确定度c; 第2部分是标准物质不均匀性所引起的标准不确定度bb; 第3部分是物质在有效期内的不稳定性所引起的标准不确定度s, 包括短期不稳定性(ss)和长期不稳定性(ls)引入的不确定度[9,17]。标准物质均匀性不确定度和稳定性不确定度已在均匀性检验和稳定性检验时分别评估, 评估结果汇总在表6中。标准物质联合定值带来的A类不确定度是统计测量数据、测量次数及所要求的置信水平计算出的标准偏差, 统计分析联合定值数据, 其不确定度为0.001, 相对不确定度为0.002 (表5)。标准物质联合定值引入的B类不确定度主要来源于错误识别阳性微滴和阴性微滴产生的不确定度和数字PCR微反应体积不一致产生的不确定度[19-20]。在进行定值前, 充分优化了二重数字PCR方法, 采用特别设计的自动识别软件, 不产生难以识别的微滴, 其不确定度忽略不计。因此B类不确定度主要统计数字PCR微滴体积不一致产生的不确定度。本项目采用8通道微滴生成仪(DG8)生成微滴, 斯洛文尼亚的国家生物研究所(the National Institute of Biology, NIB)在实验室间组织了8通道微滴生成仪生产的微滴体积的联合测量, 平均体积0.715 nL, 扩展不确定度0.014 nL[21]。本项目选取NIB的测量不确定度作为微滴体积不一致引入的不确定度, 则其相对不确定度:
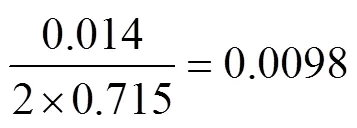
MIR604/二重数字PCR微滴体积不一致引入的不确定度合成为:
vr
各不确定度分量见表6, 合成本批标准物质的相对不确定度为:
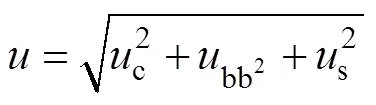
扩展不确定度为0.06 (= 2, 95%置信度)。本批标准物质的量值表示为0.50 ± 0.06。

表6 标准物质标准值的不确定度分量及合成
3 讨论
本批转基因玉米MIR604标准物质是以杂合种子为原料制备的纯品标准物质, 与欧盟IRMM研制的质量分数标准物质相比, 制备工艺相对简单, 省去了阳性粉末和阴性粉末的称量混匀过程。鉴于纯品标准物质的优点, 美国的AOCS长期致力于生产纯品粉末标准物质和纯品DNA标准物质, IRMM在后来生产的标准物质中也增加了纯品类型, 如转基因玉米DP-004114-39 (ERM-BF439)[22]。AOCS生产了13个纯品玉米标准物质, 包括2个非转基因玉米标准物质和11个转基因玉米标准物质[23]。11个转基因玉米标准物质均为以杂合种子为原料生产的纯品标准物质, 其特性值均表述为“Pure, heterozygous”[24]。对于纯品标准物质, 原材料的鉴定环节非常关键, 标准物质的转基因含量与原材料的纯度和基因型密切相关。AOCS仅用转化体特异性实时荧光PCR鉴定原材料的身份, 没有采用单粒法鉴定原材料的纯度和基因型, 导致生产的标物存在着转基因含量不确定的风险。本实验室采用数字PCR测定AOCS生产的玉米标准物质(GA21, 0407-B; MIR604, 0607-A2; MIR162, 1208-A; MON88017, 0406-D)的转基因含量, 测量值在34.03%~59.91%之间波动[7]。
本项目中制备本批标准物质的原材料通过随机抽样240粒种子, 对单粒种子一一鉴定, 考察原材料的纯度和基因型。所有籽粒的检测结果均为阳性且均为杂合种子, 根据泊松分布, 计算出在95%的置信度下原材料的纯度大于98.5%。因为原材料的单粒PCR检测是一种破坏性检测, 检测后不能再用作标准物质的原材料, 因此导致我们不能对所有的原材料一一检测。为了获得标准物质的准确量值, 本研究在原材料鉴定的基础上, 采用二重微滴数字PCR方法联合定值, 标准值为转基因含量(转基因和内标基因比值)。数字PCR是一种不依赖标准物质的核酸绝对定量方法, 目前已被美国国家标准技术研究院(National Institute of Standards and Technology, NIST)用于核酸标准物质的量值测定, 也被应用于欧盟IRMM转基因检测标准物质研制的定值中。如欧盟IRMM研制的白血病诊断质粒标准物质(ERM-AD263a–ERM-AD263f)和美国发布的乳腺癌诊断基因组DNA标准物质(SRM2373)均采用数字PCR方法定值[25-26]。在联合定值前, 本实验室建立了MIR604/二重数字PCR方法, 消除了单重PCR中取样误差对定值结果的影响。而且对数字PCR的引物/探针浓度、退火温度进行了充分优化; 考察了数字PCR的定量极限、检测极限、动力学范围和重复性等参数, 保证定值过程中阳性微滴和阴性微滴的准确识别。转基因含量由9家实验室采用数字PCR仪通过不依赖标准物质的数字PCR方法测量而确定。另外, 荧光定量PCR仪、移液器等设备在投入使用前都进行了校准, 确保定值结果的准确、有效和可溯源。研制的本批标准物质具有准确的量值, 全面评估了其定值不确定度, 克服了AOCS生产的纯品粉末标准物质的缺陷。
4 结论
本批标准物质的特性量值为转基因DNA与总DNA拷贝数比值, 由9家实验室采用二重数字PCR联合测定。转基因玉米MIR604粉末标准物质中转基因DNA与总DNA拷贝数比值为0.50, 扩展不确定度为0.06。通过荧光定量PCR检测标准物质的均匀性和稳定性, 结果表明该标准物质的均匀性和稳定性良好, 在4℃和−20℃条件下可以稳定保存。该标准物质已通过全国标准物质管理委员会组织的国家标准物质技术委员会专家的评审, 获得标准物质证书[编号GBW(E)100505]。转基因玉米种子粉末标准物质的成功研制为我们互相开展标准物质的研制提供了技术基础, MIR604标准物质的使用将有效地解决我国实验室间转基因检测结果不可比的问题, 为我国的玉米及其加工产品的检测、监测提供技术保障。
[1] 沈平, 武玉花, 梁晋刚, 卢新, 章秋艳, 王颢潜, 刘鹏程. 转基因作物发展及应用概述. 中国生物工程杂志, 2017, 37(1): 119–128. Shen P, Wu Y H, Liang J G, Lu X, Zhang Q Y, Wang H Q, Liu P C. The overview in development and application of genetically modified crops., 2017, 37(1): 119–128 (in Chinese with English abstract).
[2] 于亚东, 卢晓华, 倪晓丽, 陈文祥, 胡晓燕, 吴忠祥, 王亚平. 标准物质通用术语和定义. JJF 1005-2016. 北京: 中国标准出版社, 2016. pp 1–22. Yu Y D, Lu X H, Ni X L, Chen W X, Hu X Y, Wu Z X, Wang Y P. General Terms and Definitions Used in Connection with Reference Materials. JJF 1005-2016. Beijing: Standards Press of China, 2016 (in Chinese).
[3] 周云龙, 吴刚, 宋贵文, 王灿华, 卢长明, 龙丽坤, 朱莉, 沈平, 张丽, 张秀杰, 李亮, 李昂, 李文龙, 李飞武, 李允静, 杨立桃, 金芜军, 武玉花, 姜羽, 章秋燕. 转基因生物标准物质研制与应用. 北京: 中国质检出版社, 2014. pp 39–61. Zhou Y L, Wu G, Song G W, Wang C H, Lu C M, Long L K, Zhu Li, Shen P, Zhang L, Zhang X J, Li L, L A, Li W L, Li F W, Li Y J, Yang L T, Jin W J, Wu Y H, Jiang Y, Zhang Q Y. Development and Application of Reference Materials for Genetically Modified Organisms. Beijing: China Quality Inspection Press, 2014. pp 39–61 (in Chinese).
[4] Ciabatti I, Marchesi U, Froiio A, Paternò A, Ruggeri M, Amaddeo D. Role of the “National Reference Centre for Genetically Modified Organisms (GMO) Detection” in the official control of food and feed., 2005, 29(2): 31–34.
[5] Lauwaars M, Anklam E. Method validation and reference materials., 2004, 9: 253–258.
[6] 张丽, 吴刚, 武玉花, 沈平, 宋贵文, 周云龙. 转基因产品检测标准物质的定值和不确定度研究进展. 农业生物技术学报, 2014, 22: 362–371. Zhang L, Wu G, Wu Y H, Shen P, Song G W, Zhou Y L. Research progress on value characterization and uncertainty evaluation of reference materials for genetically modified organisms., 2014, 22: 362–371 (in Chinese with English abstract).
[7] Wu Y, Li J, Li X, Zhai S S, Gao H F, Li Y, Zhang X, Wu G. Development and strategy of reference materials for the DNA-based detection of genetically modified organisms., 2019, 411: 1729–1744.
[8] Steiner H Y, Chen E, Meghji M. Corn event MIR604. Patent No: US 8884102B2, 2014. pp 1–33.
[9] 余逵, 刘清贤, 陈保华. 一级标准物质技术规范, JJF 1006-1994. 北京: 中国标准出版社, 1994. pp 1–21. Yu K, Liu Q X, Chen B H. Technical Norm of Primary Reference Material, JJF 1006-1994. Beijing: Standards Press of China, 1994. pp 1–21 (in Chinese).
[10] Mazzara M, Munaro B, Foti N, Savini C, Van Den Eede G. Event-specific method for the quantification of maize line MIR604 using real-time PCR—validation report and protocol—maize seeds sampling and DNA extraction. 2007 [2017-05-10] pp 1–76. http://gmo-crl.jrc.ec.europa.eu/ gmomethods/docs/QT-EVE-ZM-013.pdf.
[11] International Organization for Standardization. Foodstuffs- Methods of analysis for the detection of genetically modified organisms and derived products—Quantitative nucleic acid based methods. ISO 21570:1-103, 2005.
[12] Mazzara M, Foti N, Price S, Paoletti C, Van Den Eede G. Event-specific method for the quantitation of maize line MON 863 using real-time PCR—Validation report and protocol. 2005[2017-05-10]. pp 1–84. http://gmo-crl.jrc.ec.europa.eu/ gmomethods/docs/QT-EVE-ZM-009.pdf.
[13] Mazzara M, Paoletti C, Puumalaainen J, Rasulo D, Van Den Eede G. Event-specific method for the quantitation of maize line NK603 using real-time PCR—Validation report and protocol. 2005 [2017-05-10], pp 1–108. http://gmo-crl.jrc.ec.europa.eu/ gmomethods/docs/QT-EVE-ZM-008.pdf.
[14] Mazzara M, Grazioli E, Savini C, Van Den Eede G. Event-specific method for the quantification of maize line T25 using real-time PCR—Validation report and validated method. 2013 [2017-05-10], pp 1–102. http://gmo-crl.jrc.ec.europa.eu/ gmomethods/ docs/QT-EVE-ZM-011.pdf.
[15] Mazzara M, Foti N, Price S, Paoletti C, Van Den Eede G. Event-specific method for the quantitation of maize line TC1507 using real-time PCR—Validation report and protocol—Sampling and DNA extraction of maize TC15O7. 2005 [2017-05-10]. pp 1–58. http://gmo-crl.jrc.ec.europa.eu/gmomethods/docs/QT-EVE- ZM-010.pdf.
[16] 周云龙, 卢长明, 刘信, 曹应龙, 宋贵文, 沈平, 吴刚, 杨立桃, 王晶, 王江, 李允静, 李飞武, 赵欣. 转基因植物及其产品成分检测: 基体标准物质制备技术规范, 农业部1782号公告- 8-2012. 北京: 中国农业出版社, 2012. pp 1–14.Zhou Y L, Lu C M, Liu X, Cao Y L, Song G W, Shen P, Wu G, Yang L T, Wang J, Wang J, Li Y J, Li F W, Zhao X. Detection of Genetically Modified Plants and Derived Products: Technical Specification for Manufacture of Matrix Reference Material. Announcement No.1782 of the Ministry of Agriculture-8-2012. Beijing: China Agriculture Press, 2012. pp 1–14 (in Chinese).
[17] 阚莹, 李红梅, 孟凡敏, 卢晓华, 郭敬, 胡晓燕, 王亚平. 标准物质定值的通用原则及统计学原理, JJF 1343-2012. 北京: 中国标准出版社, 2012. pp 1–66. Kan Y, Li H M, Meng F M, Lu X H, Guo J, Hu X Y, Wang Y P. General and Statistical Principles for Characterization of Reference Materials, JJF 1343-2012. Beijing: Standards Press of China, 2012. pp 1–66 (in Chinese).
[18] 金芜军, 沈平, 张秀杰, 彭于发, 宋贵文, 黄昆仑, 张大兵, 宛煜嵩. 转基因植物及其产品成分检测DNA提取和纯化, 农业部1485号公告-4-2010. 北京: 中国农业出版社, 2010. pp 1–12. Jin W J, Shen P, Zhang X J, Peng Y F, Song G W, Huang K L, Zhang D B, Wan Y S. Detection of genetically modified plants and derived products—DNA extraction and purification. Announcement No.1485 of the Ministry of Agriculture-4-2010. Beijing: China Agriculture Press, 2010. pp 1–12 (in Chinese).
[19] Kline M C, Duewer D L. Evaluating droplet digital polymerase chain reaction for the quantification of human genomic DNA: lifting the traceability fog., 2017, 89: 4648–4654.
[20] Duewer D L, Kline M C, Romsos E L, Toman B. Evaluating droplet digital PCR for the quantification of human genomic DNA: converting copies per nanoliter to nanograms nuclear DNA per microliter., 2018, 410: 2879–2887.
[21] Košir A B, Divieto C, Pavšič J, Pavarelli S, Dobnik D, Dreo T, Bellotti R, Sassi M P, Žel J. Droplet volume variability as a critical factor for accuracy of absolute quantification using droplet digital PCR., 2017, 409: 6689–6697.
[22] European Union. Certification report: The certification of different mass fractions of DP-ØØ4114-3 in maize seed powder. Certified reference materials ERM®-BF439a, ERM®-BF439b, ERM®-BF439c, ERM®-BF439d and ERM®-BF439e. Luxembourg: Publications Office of the European Union, 2015.
[23] AOCS. Certified reference materials (CRMs). https://www. aocs.org/ crm#maize [2018-07-13].
[24] AOCS. Certificate of Analysis AOCS 1208-A, MIR162 maize. https://www.aocs.org/store/shop-aocs/shop-aocs?productId=125101624 [2018-07-13].
[25] European Union. Certification report: the certification of the copy number concentration of solutions of plasmid DNA containing a BCR-ABL b3a2 transcript fragment, Certified reference materials: ERM®-AD623a, ERM®-AD623b, ERM®-AD623c, ERM®- AD623d, ERM®-AD623e, ERM®-AD623f. Luxembourg: Publications Office of the European Union. © European Union, 2012. pp 1–53.
[26] Haynes R J, Kline M C, Toman B, Scott C, Wallace P, Butler J M, Holden M J. Standard reference material 2366 for measurement of human cytomegalovirus DNA., 2013, 15: 177–185.
Development of genetically modified maize MIR604 matrix reference materials
LI Jun1, LI Liang2, LI Xia-Ying3, SONG Gui-Wen3, SHEN Ping3, ZHANG Li1, ZHAI Shan-Shan1, LIU Fang-Fang2, WU Gang1, ZHANG Xiu-Jie3,*, and WU Yu-Hua1,*
1Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture and Rural Affairs, Oil Crops Research Institute, Chinese Academy of Agricultural Sciences, Wuhan 430062, Hubei, China;2Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3Development Center of Science and Technology, Ministry of Agriculture and Rural Affairs, Beijing 100025, China
The safety supervision of genetically modified organisms (GMO) is the guarantee for the healthy development of the biotechnology, and the reference materials (RM) are the material basis for GMOs detection. The lack of RMs makes it difficult to ensure the accuracy, reliability and comparability of the test data. GM maize MIR604 is approved for import as a raw material in China. The safety supervision of GM maize MIR604 urgently requires to prepare RMs. The pure GM maize MIR604 matrix RMs were prepared through the steps of raw material identification, grinding, sieving and water content determination. The results of homogeneity test and stability test showed that the RMs in this batch had good homogeneity within the bottle and between the bottles, the property value of the RMs was stable, allowing them to be transported at room temperature for one month, as even for six months verified by the long-term stability test. The copy number ratio of the transgenic DNA to the total DNA was collaboratively characterized by nine laboratories using the duplex digital PCR of MIR604/. The certified value was 0.50. The various uncertainty components of the RM characterization results were fully evaluated, and the expanded uncertainty was combined to be 0.06 (copy/copy). The specification of RMs of this batch is 1 g bottle–1and the minimum sample size is 100 mg. This batch of RMs can be used in the fields of safety supervision and labelling of MIR604, and laboratory quality control.
GM maize MIR604; matrix reference material; digital PCR; Real-time PCR; collaborative characterization
2019-08-28;
2019-12-26;
2020-01-15.
10.3724/SP.J.1006.2020.93047
张秀杰, E-mail: zhxj7410@sina.com, Tel: 010-59198153; 武玉花, E-mail: wuyuhua@oilcrops.cn, Tel: 027-86711573
E-mail: lijuner@163.com, Tel:027-86711573
本研究由国家转基因生物新品种培育重大专项(2016ZX08012003)和国家自然科学基金项目(31601581)资助。
This study was supported bythe National Major Project for Developing New GM Crops (2016ZX08012003) and the National Natural Science Foundation of China (31601581).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200115.1122.014.html
