HBV 前S1编码链锁核酸的设计及体外抗HBV效果观察
2020-03-17彭彬许桂丹韦武均农顺强陈晓昊肖树荣潘柳叶邓益斌
彭彬 许桂丹 韦武均 农顺强 陈晓昊 肖树荣 潘柳叶 邓益斌
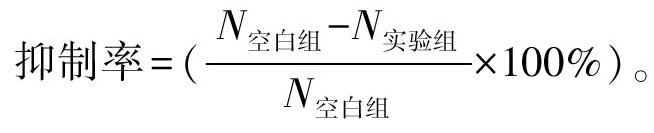
【摘要】 目的 针对乙型肝炎病毒(hepatitis B virus,HBV)前S1 dsDNA同聚嘌呤区设计反基因寡核苷酸药物-锁核酸(locked nucleic acid,LNA),并在体外观察抑制HBV复制的效果。
方法 针对HBV前S1 dsDNA的3023~3037 nt、3094~3109 nt两个同聚嘌呤区,利用RNA structure软件分别设计并合成LNA,以阳离子脂质体为载体,将药物转染入HepG2.2.15细胞内,采用荧光定量PCR技术和化学发光免疫技术分别检测3 d、6 d和9 d细胞培养上清液中HBV DNA和HBsAg的含量;CCK8法检测锁核酸对HepG2.2.15细胞代谢的影响。
结果 LNA对HepG2.2.15细胞的HBV DNA转录和HBsAg表达有显著的抑制作用,并且抑制效果随着时间进一步加强,在第9天的抑制率分别为45.37%和52.09%。两个同聚嘌呤组与空白对照组比较差异均有统计学意义(均P<0.05),而封闭3023~3037nt同聚嘌呤区的LNA抑制作用较强,且最适序列长度为15~25 bp。CCK8实验显示LNA对HepG2.2.15细胞无任何明显的代谢影响。
结论 针对前S1 dsDNA同聚嘌呤区的反基因锁核酸分子在体外能够有效地抑制HBV的复制,以封闭3023~3037 nt靶位效果较强,且合适序列长度为15~25 bp。
【关键词】 反基因寡核苷酸药物;乙型肝炎病毒;锁核酸;反基因治疗
中图分类号:R73 文献标志码:A DOI:10.3969/j.issn.1003-1383.2020.02.003
【Abstract】 Objective To design an antisense oligodeoxynucleotide,a locked nucleic acid,against the pre-S1 dsDNA homopolyfluoride region of hepatitis B virus(HBV),and observe the inhibition effect of HBV replication in HepG2.2.15 cells.
Methods The two polymorphic regions of 3023-3037 nt and 3094-3109 nt of pre-S1 dsDNA of hepatitis B virus were designed and synthesized by RNA structure software.The transfected HepG2.2.15 cells were mediated by cationic liposome.Fluorescence quantitative polymerase chain reaction(PCR) and chemiluminescence immunoassay were used to detect the content of HBV DNA and HBsAg in cell culture supernatants at 3,6 and 9 days,respectively.The effect of LNA on the metabolism of HepG2.2.15 cells was detected by CCK8 method.
Results LNA significantly inhibited HBV DNA replication and HBsAg expression in HepG2.2.15 cells,and the inhibition rate increased with time.After 9 days,the inhibition rates were 45.37% and 52.09%,respectively.The difference between the experimental group and the control group was statistically significant (both P<0.05),while the blocking effect of LNA in the 3023-3037 nt polypyrogenic region was stronger,and the optimal sequence length was 15-25 bp.LNA has no significant metabolic effect on cells.
Conclusion The anti-gene-locked nucleic acid molecule targeting the pre-S1 dsDNA homomeric region can effectively inhibit the replication of HBV in vitro,and the effect of blocking the target of 3023-3037 nt is strong,and the suitable sequence length is 15-25 bp.
【Key words】 antisense oligodexymucleotide;hepatitis B virus;locked nucleic acid;antigene therapy
锁核酸(locked nucleic acid,LNA)是近年来被人们发现的核苷酸衍生物,1994年,Rodriguez等在发酵副产物中发现LNA。四年后,Koshkin等[1]对LNA进行了第一次合成与杂交试验,随后,Wang等[2~3]进一步报道了LNA相关结构与性能的实验。目前发现,锁核酸在反基因治疗应用中有着非常好的效果,与其他的寡核苷酸相比,锁核酸具有以下优点:(1)LNA单体结合到寡核苷酸链中可以显著地提高解链温度,在與DNA、RNA互补成为双链时可以提供很强的热稳定性,每引入一个LNA单体,可以使解链温度提高3℃[4~6];(2)LNA因其特殊结构,能够具备抗3脱氧核苷酸酶降解的能力,抗酶解能力强[7~9];(3)LNA与DNA、RNA的结合可以对目的基因进行调控或者抑制,同时又可以被Rnase H识别,从而对mRNA进行降解[10~13];(4)LNA在与DNA、RNA结合时,具有出色的错配辨别力[14];(5)脂溶性好[15];(6)半衰期长[16]。因此,为了观察锁核酸是否能够抑制HBV DNA的复制和HBsAg的表达,本研究针对HBV preS1 dsDNA两个同聚嘌呤区分别设计并合成锁核酸序列,以脂质体介导为载体,将反基因药物转染入HepG2.2.15细胞株,并进一步观察其抗乙肝病毒效果,为寻找新的乙肝病毒靶点和设计新型抗乙肝病毒药物提供现实依据。
1 材料与方法
1.1 材料
HepG 2.2.15细胞是Hep2细胞在染色体上整合了HBV基因组的肝肿瘤细胞株,能够在细胞上清液稳定表达HBsAg、HBeAg、HBV DNA等物质,由右江民族医学院附属医院检验科许桂丹硕士惠赠,右江民族医学院科学实验中心常规培养于含G418、1%胎牛血清的高糖型DMEM培养基中,37℃、50 mL/CO2条件下;高糖型DMEM培养基、G418、胎牛血清等购自GIBCO公司;LipofectamineTM 3000购自美国Invitrogen公司;荧光定量PCR检测HBV DNA试剂盒购自湖南圣湘生物科技有限公司;乙型肝炎病毒HBsAg定量检测试剂盒购自郑州安图生物工程股份有限公司;化学发光免疫测定仪购自郑州安图生物工程股份有限公司;实时定量PCR仪购自美国ABI公司。
1.2 方法
1.2.1 反基因锁核酸的合成与修饰
从NCBI基因库中搜索到HBV ayw亚型全基因组序列(3.2 kb DNA,NC:003977.1,GI:21326584),利用RNA structure 6.0软件针对编码链的3023~3037 nt、3094~3109 nt两个同聚嘌呤区分别设计1条长度不等的反基因寡核苷酸序列:(1)3023~3037 nt同聚嘌呤區:5CA*AA*TGCT*CCCGCT*C 3(15pb);(2)3094~3109 nt同聚嘌呤区:5T*GT*TGTCA*ATAT*GCC 3(15pb)。以上各序列中,标注*号的前一个碱基进行锁核酸(LNA)修饰。各序列经BLAST排除与人同源后由上海生物工程有限公司合成修饰并纯化。
1.2.2 实验分组与脂质体转染
本实验设药物组和空白组(未经转染的HepG2.2.15细胞)。实验组包括:(1)互补3023~3037 nt同聚嘌呤区序列:LNA-脂质体组;(2)互补3094~3109 nt同聚嘌呤区序列:LNA-脂质体组。将HepG 2.2.15细胞按1×105个/mL接种于6孔板培养板中,每孔最终稀释量为 2 mL,实验组为两个,即3023~3037 nt同聚嘌呤区组,3094~3109 nt同聚嘌呤区组,每组复孔按照数字随机表各设6个复孔,待细胞贴壁达50%~60%后分别在各组的每个复孔中加入用脂质体包裹着的反基因药物,分别在3 d、6 d、9 d[17]收集各孔培养上清液(-20℃保存备用)。转染步骤按脂质体说明书操作。
1.2.3 培养上清液HBsAg含量测定
采用化学发光免疫技术检测,每个样品重复测量3次,严格按试剂盒说明书及仪器操作说明书操作,HBsAg浓度以IU/mL表示。
1.2.4 培养上清液HBV DNA含量测定
采用实时荧光定量PCR法检测。取培养上清液500 μL于新的1.5 mL EP管中,高速离心后留200 μL,加450 μL DNA提取液及4 μL内标溶液,100℃恒温处理15 min。按比例(HBV PCR反应液27 μL/份+Taq酶3 μL/份)取相应量的PCR反应液及Taq酶,充分混匀后按30 μL/管分装到PCR 八连管中,备用;往上述PCR反应管中用带滤芯吸嘴分别按量加入处理过的待测样本核酸、阴性质控品、强阳性质控品、临界阳性质控品及不同浓度的定量参考品的上清液各20 μL,盖紧PCR管盖后瞬时离心数秒后放置于荧光定量PCR仪中,扩增条件:92℃预变性 2 min,93℃ 45 s,55℃ 60 s共 10个循环,93℃ 30 s,55℃ 45 s 共30个循环,72℃终延伸5 min共1个循环。由计算机软件自动分析所收集的荧光信号并计算出定量结果,采用计算对数平均值的方法计算HBV DNA平均拷贝数。并按以下公式计算抑制率:
抑制率=(N空白组-N实验组N空白组×100%)。
1.2.5 锁核酸对细胞毒性检测
根据CCK8比色法操作说明书检测反基因药物锁核酸对HepG2.2.15细胞代谢活性的影响。
1.3 统计学方法
所有数据应用SPSS 17.0统计学软件分析,计量资料符合正态分布,采用均数±标准差(±s)表示,组间比较采用One-Way ANOVA检验,进一步两两比较采用LSD检验,若方差不齐则用Games-Howell,检验水准:α=0.05,双侧检验。
2 结果
2.1 封闭不同靶位的反基因锁核酸抑制HBV DNA复制的效果
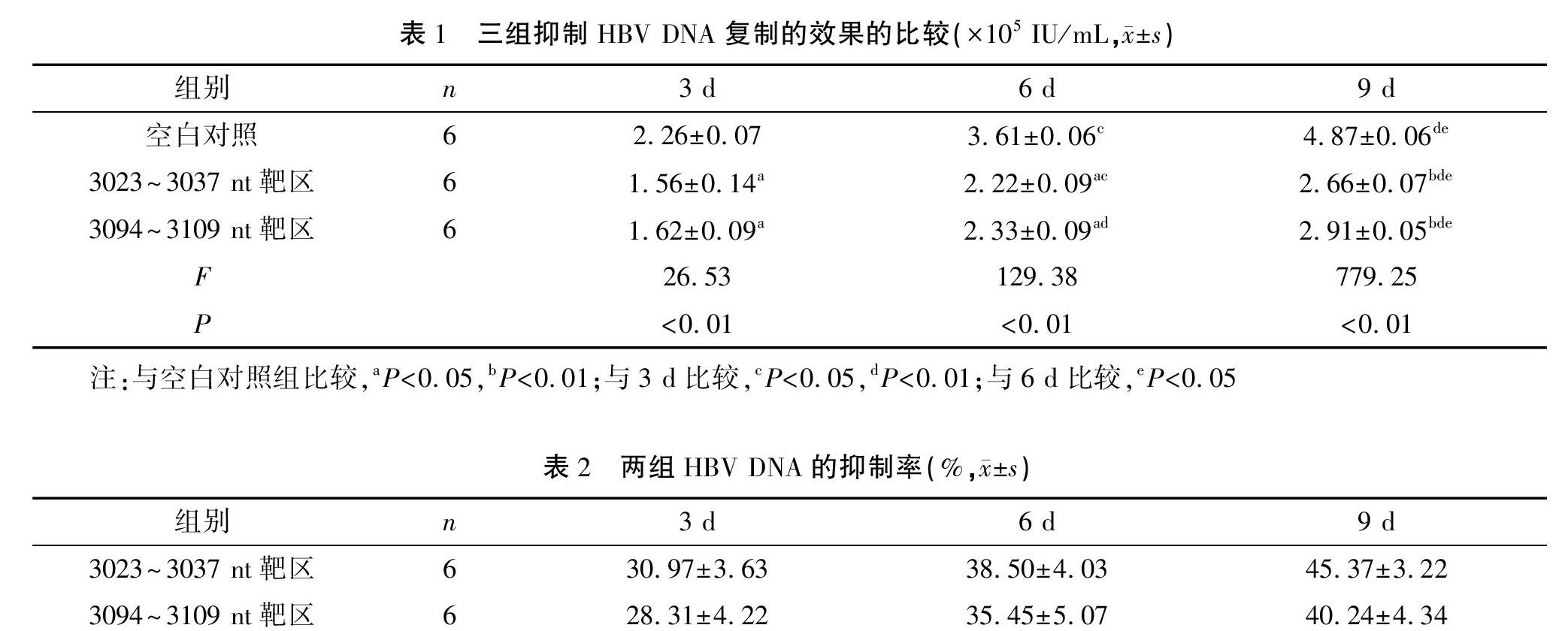
锁核酸加入第3天后,HBV DNA的复制、转录即开始受到抑制,且抑制效果随着时间推移进一步升高。两个实验组与空白对照组比较差异有统计学意义(均P<0.05),而封闭3023~3037 nt同聚嘌呤区的反基因LNA对HBV DNA复制的抑制效果最明显。见表1。
2.2 封闭不同靶位的反基因锁核酸抑制HBV DNA复制率
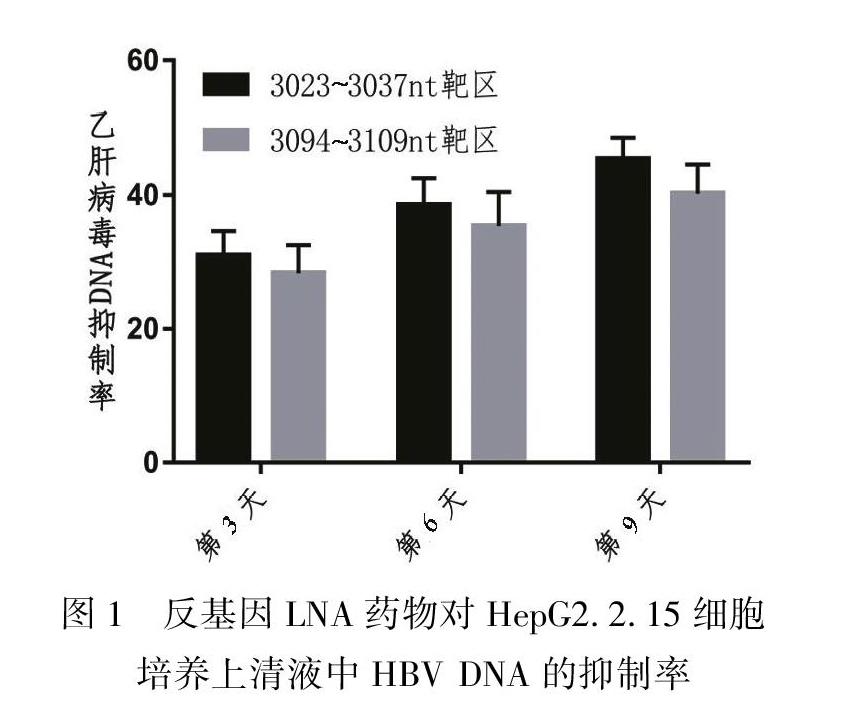
在反基因锁核酸加入9 d后抑制率最高可以达到45.37%,两个不同的靶区以3023~3037 nt同聚嘌呤区封闭效果最强。见表2、图1。
2.3 反基因锁核酸对乙型肝炎病毒表面抗原(HBsAg)表达的抑制作用
反基因药物锁核酸加入第3天后,锁核酸对HBsAg的表达开始发挥抑制作用,且抑制效果随着时间的增加呈现上升的趋势,两个实验组与对照组比较差异有统计学意义(均P<0.05),而3023~3037 nt靶区对HBsAg表达的抑制作用最强。见表3。
2.4 反基因锁核酸对乙型肝炎病毒表面抗原(HBsAg)表达的抑制率
反基因寡核酸药物锁核酸加入第3天后,LNA对HBsAg的表达开始发挥抑制作用,3023~3037 nt靶区对HBsAg表达的抑制作用最强。见表4、图2。
2.5 CCK8比色法檢测锁核酸对细胞代谢的影响
用药第9天,采用CCK8比色法检测锁核酸组A 值为(2.209±0.006),对照组A 值为(2.207±0.008),比较差异无统计学意义(P>0.05),提示反基因药物锁核酸对HepG2.2.15细胞代谢基本无影响。
3 讨论
含有前S1的蛋白主要存在于Dane颗粒和管型颗粒上,前S1蛋白在病毒侵入人体的复制和转录等过程起到了非常重要的作用,是急性乙型肝炎的临床诊断、疗效观察和预后的良好指标。
因此,本研究针对HBV前S1 ds DNA编码链的3023~3037 nt靶区和3094~3109 nt靶区两个同聚嘌呤区设计合成1条序列长度不等的反基因锁核酸分子,由LipofectamineTM 3000脂质体介导转染HepG2.2.15细胞株,通过检测空白组和实验组的HBV DNA和HBsAg含量等指标来评价反基因锁核酸分子的疗效,实验结果显示,封闭3023-3037 nt靶区在体外抑制preS1 基因复制与表达的作用最强,抑制作用随时间呈递增趋势,其中,在9 d的 HBV DNA抑制率是45.37%、HBsAg为 52.09%,这两个序列长度相同,在同一实验中,对乙肝病毒DNA、HBsAg的抑制效果以3023~3037 nt靶区最强,可能说明该区相对于3094~3109 nt靶区来说更加能够有效地通过核孔进入细胞核内,识别并结合到HBV dsDNA的同聚碱基配对区形成三链杂交分子,能够更加有效地对病毒靶基因的复制和表达起到抑制作用,具体机制尚未清楚,下一步实验将针对该机制进行研究, 为后面研究反基因锁核酸在HBV治疗上提供了重要的理论、实验依据。此外,CCK8检测结果证实锁核酸对细胞的代谢活性无明显毒性作用。
总之,通过对比preS1 dsDNA同聚嘌呤区的反基因锁核酸分子的两条序列,观察HBV DNA、HBsAg等实验指标,以封闭3023~3037 nt靶区效果最强,且合适序列长度在15~25 bp之间,这为前S1的靶位提供了理论和实验依据,也为HBV的药物治疗提供了有效的靶位。
参 考 文 献
[1]Kumar R,Singh SK,Koshkin AA,et al.The first analogues of LNA (locked nucleic acids):phosphorothioate-LNA and 2-thio-LNA[J].Bioorg Med Chem Lett,1998,8(16):2219-2222.
[2]Wang G,Gunic E,Girardet JL,et al.Conformationally locked nucleosides.Synthesis and hybridization properties of oligodeoxynucleotides containing 2,4-C-bridged 2-deoxynucleosides[J].Bioorg Med Chem Lett,1999,9(8):1147-1150.
[3]Wang G,Middleton PJ,Lin C,et al.Biophysical and biochemical properties of oligodeoxy-nucleotides containing 4-C- and 5-C-substituted thymidines[J].Bioorg Med Chem Lett,1999,9(6):885-890.
[4]Kumar P,Truong L,Baker YR,et al.Synthesis,Affinity for Complementary RNA and DNA,and Enzymatic Stability of Triazole-Linked Locked Nucleic Acids (t-LNAs)[J].ACS Omega,2018,3(6):6976-6987.
[5]Booy EP,Mcrae EK,Koul A,et al.The long non-coding RNA BC200 (BCYRN1) is critical for cancer cell survival and proliferation[J].Mol Cancer,2017,16(1):109.
[6]Tian K,Chen X,Luan B,et al.Single Locked Nucleic Acid-Enhanced Nanopore Genetic Discrimination of Pathogenic Serotypes and Cancer Driver Mutations[J].ACS Nano,2018,12(5):4194-4205.
[7]Kasuya T,Hori S,Watanabe A,et al.Ribonuclease H1-dependent hepatotoxicity caused by locked nucleic acid-modified gapmer antisense oligonucleotides[J].Sci Rep,2016,6:30377.
[8]Dieckmann A,Hagedorn PH,Burki Y,et al.A Sensitive In Vitro Approach to Assess the Hybridization-Dependent Toxic Potential of High Affinity Gapmer Oligonucleotides[J].Mol Ther Nucleic Acids,2018,10:45-54.
[9]Biagetti M,Cuccioloni M,Bonfili L,et al.Chimeric DNA/LNA-based biosensor for the rapid detection of African swine fever virus[J].Talanta,2018,184:35-41.
[10] Ogino S,Konishi H,Ichikawa D,et al.Detection of fusion gene in cell-free DNA of a gastric synovial sarcoma[J].World J Gastroenterol,2018,24(8):949-956.
[11] Gougelet A,Sartor C,Bachelot L,et al.Antitumour activity of an inhibitor of miR-34a in liver cancer with beta-catenin-mutations[J].Gut,2016,65(6):1024-1034.
[12] Komatsu H,Inui A,Umetsu S,et al.Evaluation of the G145R Mutant of the Hepatitis B Virus as a Minor Strain in Mother-to-Child Transmission[J].PLoS One,2016,11(11):e165674.
[13] Javanbakht H,Mueller H,Walther J,et al.Liver-Targeted Anti-HBV Single-Stranded Oligonucleotides with Locked Nucleic Acid Potently Reduce HBV Gene Expression In Vivo[J].Mol Ther Nucleic Acids,2018,11:441-454.
[14] Fontenete S,Carvalho D,Guimaraes N,et al.Application of locked nucleic acid-based probes in fluorescence in situ hybridization[J].Appl Microbiol Biotechnol,2016,100(13):5897-5906.
[15] 鄧益斌,农乐根,梁祚仁,等.LNAzyme设计及其体外特异性抑制丙型肝炎病毒C基因的表达[J].世界华人消化杂志,2014,22(14):1992-1997.
[16] 邓益斌,农乐根,梁祚仁,等.HCV LNAzyme对病毒5非编码区基因调控的特异性抑制作用[J].基础医学与临床,2014,34(10):1363-1366.
[17] 邓益斌,温旺荣.反基因锁核酸体外抑制乙肝病毒前S1基因表达[J].基础医学与临床,2013,33(6):722-725.
(收稿日期:2019-07-08 修回日期:2019-11-02)
(编辑:梁明佩)
