广西六堡茶和重庆沱茶的微生物多样性分析
2020-01-13杨雅焯
杨雅焯,汪 迎,李 辉,庄 静
(南京农业大学园艺学院/茶叶科学研究所,江苏 南京 210095)
六堡茶是一种后发酵紧压茶,具有独特的槟榔香味,因“红、浓、陈、醇”的风味品质和清血管、助消化、降“三高”等保健功能而得到国内外爱茶人士的认可[1-2]。沱茶有别于其他茶类,属再加工茶中的紧压茶,为重庆和云南特有,主要分为云南沱茶、普洱沱茶和重庆沱茶3种。重庆沱茶一般选用中上等晒青、烘青和炒青毛茶为原料,然后进行搭配、筛分、整形、拼堆、称料、蒸压成型、干燥等工序,其成品茶形似碗臼,色泽乌黑油润,汤色澄黄明亮,滋味醇厚甘和[3]。
紧压茶的后发酵过程里,由于温度、湿度等原因,微生物大量生长繁殖。这些微生物在代谢活动中,为了满足自己对碳、氮的需求,会分泌胞外酶,分解、转化和降解纤维素、果胶等茶叶内含物,从而形成紧压茶的独特滋味成分[4]。六堡茶特有色香味的形成,就是蛋白质、茶多酚等物质在发酵过程中,由于水分、温度及有益微生物的综合作用,发生水解、糖解和氧化聚合等物理和化学变化而形成的[5]。传统沱茶以大叶种为原料、晒青为主要原料,搭配炒青、小量烘青,中小叶种调节滋味,同样需要一个后发酵过程[3]。因此,紧压茶生产及加工过程中所产生的有益微生物对其风味品质起着至关重要的作用。
不同产地的紧压茶微生物群落组成有所不同[6-7]。云南普洱茶的菌株种类主要以霉菌和酵母菌为主[9];湖南茯砖茶的主要微生物有冠突散囊菌属(Crytospora)、黑曲霉、青霉属等[9];四川康砖茶的细菌优势菌为葡萄球菌属(Staphyloccus)和芽孢杆菌属(Bacillus),霉菌优势菌为黑曲霉属、青霉属、灰绿霉属等[6]。六堡茶发酵时绿麹菌、灰霉菌、毛菌、白羽菌等真菌会促进茶多酚氧化水解,但是若干霉菌如黑霉菌则会使发酵茶产生恶劣气味[10];重庆沱茶的微生物群落组成目前尚不清楚。有益微生物的生长会促进紧压茶品质,但是杂菌的出现则会破坏紧压茶的风味质量,影响其保健功能。因此,提高紧压茶品质及安全性则显得至关重要。通过对紧压茶进行微生物多样性分析,可以为优化紧压茶微生物群落结构,稳定其品质提供帮助[9]。目前,关于利用高通量测序技术对广西六堡茶和重庆沱茶中微生物菌群分布情况的分析还未见报道。
本试验通过高通量测序,利用ITS和16S rDNA序列测定方法分析了两种不同紧压茶中真菌及细菌群落组成。初步探讨了广西六堡茶和重庆沱茶微生物组成差异,为寻找和利用紧压茶中的优势菌,提高紧压茶的品质和安全性提供一定的理论依据。
1 材料和方法
1.1 试验材料
选取紧压茶广西六堡茶和重庆沱茶为试验材料,两者均为2017年生产的成品茶。分别编号为WY1(广西六堡茶)和WY2(重庆沱茶)。对每个样品取样进行3次生物学重复。
1.2 紧压茶样品微生物总DNA的提取
参照Omega微生物总DNA提取试剂盒(北京诺博莱德科技有限公司)的使用说明对紧压茶样品进行微生物总DNA的提取。
1.3 PCR扩增
真菌ITS检测选用的扩增引物为ITS1F-ITS2R(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′)[11]。细菌16S检测选用的扩增引物为515F-907R(515F:5′-GTGCCAGCMGCCGCGG-3′,907R:5′-CCGTCAATTCMTTTRAGTTT-3′)[12]。对提取的紧压茶微生物总DNA进行PCR扩增,采用2%琼脂糖凝胶电泳检测纯化后的PCR产物。
1.4 测序
紧压茶样品微生物总DNA ITS和16S rDNA测序由南京集思惠远生物科技有限公司完成。
1.5 数据处理和分析
对高通量测序检测到的数据与已有的ITS区和16S区数据库进行比对分析。对检测到的数据进行过滤拼接,获得有效序列[13]。利用R语言中的函数来制作OTU维恩图和微生物群落组成的柱状分析图。利用Muthur软件计算Chao-1指数和聚类分析图,相关数据统计利用Excel软件。
2 结果与分析
2.1 PCR扩增结果
按照Omega微生物总DNA提取试剂盒的使用说明对紧压茶样品微生物进行总DNA提取,采用2%琼脂糖凝胶电泳检测每个样品纯化后的PCR产物。真菌检测的ITS序列长度为600bp,细菌16S rDNA测定的序列片段长度为460 bp,图1表明,获得与预期大小相符的条带。
2.2 OTU(Operational Taxonomic Units)韦恩图分析比较
维恩图展示了广西六堡茶和重庆沱茶共有的OTU数及各自特有的OTU数(图2)。广西六堡茶特有的真菌OTU数为18,重庆沱茶特有的真菌OTU数为87。两样品的真菌OTU总数为138,重合的OTU数为33,占总数的24%,且重庆沱茶有较多特有的真菌类群。细菌类群中,广西六堡茶特有的OTU数为265,重庆沱茶特有的OTU数为20。两者的OTU总数为403,相同的OTU数为118,重复率为29%,且广西六堡茶的特有细菌类群远大于重庆沱茶。
2.3 真菌和细菌多样性分析
广西六堡茶和重庆沱茶微生物多样性统计结果见表1。广西六堡茶的真菌群落为2门、8纲、11目、12科、14属,细菌群落为11门、20纲、38目、71科、99属。重庆沱茶的真菌群落为2门、5纲、5目、3科、4属,细菌群落为8门、16纲、23目、43科、48属。Chao-1指数是反映物种丰富度的综合指标,Chao-1指数越大,物种丰富度越高;Shannon 指数与群落多样性成正比,Shannon指数越大,群落多样性越高。由表1可知,重庆沱茶真菌的物种丰富度大于广西六堡茶,群落多样性则小于广西六堡茶,而其细菌的物种丰富度及群落多样性都小于广西六堡茶。

图1 广西六堡茶和重庆沱茶的真菌及细菌PCR产物Fig.1 PCR products from fungi and bacteria in Guangxi Liubao and Chongqing Bowl teas注:A:真菌;B:细菌。M:Marker;WY1:广西六堡茶;WY2:重庆沱茶。下同。

图2 广西六堡茶和重庆沱茶的真菌及细菌OTU维恩图Fig.2 Fungal and bacterial OTU Venn diagrams of Guangxi Liubao and Chongqing Bowl teas

表1 广西六堡茶和重庆沱茶的微生物多样性统计结果
2.4 真菌和细菌物种变化分析
丰度分布曲线反映了两种紧压茶随着OTU数量的增加,真菌及细菌物种丰富程度和均匀程度的变化(图3)。当OTU数量较少时,广西六堡茶和重庆沱茶的真菌及细菌丰度曲线斜率较大,物种丰富程度和均匀程度较差。随着OTU数量的增加,曲线逐渐平缓。重庆沱茶的真菌丰度曲线宽度大于广西六堡茶,且其真菌丰度曲线比广西六堡茶的平坦。因此,重庆沱茶的真菌物种丰富程度和均匀程度均高于广西六堡茶。广西六堡茶的细菌丰度曲线宽度大于重庆沱茶且其细菌丰度曲线比重庆沱茶的平坦,说明广西六堡茶的细菌物种丰富程度和均匀程度均高于重庆沱茶。

图3 广西六堡茶和重庆沱茶中真菌及细菌丰度分布曲线Fig.3 Distribution of fungal and bacterial abundance in Guangxi Liubao and Chongqing Bowl teas
2.5 不同分类水平下微生物菌落分析
2.5.1 门分类水平下两个样品真菌及细菌的菌落结构分析 门分类水平下,广西六堡茶和重庆沱茶的真菌及细菌菌落结构分析结果见图4。广西六堡茶的真菌菌落主要是子囊菌门(Ascomycota),占比90.1%。重庆沱茶的真菌菌落主要是担子菌门(Basidiomycota)和子囊菌门(Ascomycota),子囊菌门(Ascomycota)占比最大,为80.78%。广西六堡茶的细菌菌落主要是放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria),放线菌门(Actinobacteria)占比最大,为49.96%。重庆沱茶的细菌菌落主要是变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria),蓝藻菌门(Cyanobacteria)占比最大,为91.45%。

图4 广西六堡茶和重庆沱茶门分类水平下的真菌及细菌Fig.4 Fungal and bacterial phyla found in Guangxi Liubao and Chongqing Bowl teas
2.5.2 广西六堡茶和重庆沱茶中真菌及细菌的菌落属结构分析 属分类水平下,广西六堡茶和重庆沱茶的真菌及细菌菌落结构分析结果见图5。广西六堡茶的真菌菌落主要是Blastobotrys,占比3.57%。重庆沱茶的真菌菌落主要是青霉属(Penicillium)和烟管菌属(Bjerkandera),烟管菌属(Bjerkandera)占比最大,为16.85%。广西六堡茶的细菌菌落主要是乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、Saccharopolyspora和鞘脂单胞菌属(Sphingomonas),其中Saccharopolyspora占比最大,为47.45%。重庆沱茶的细菌菌落占比较低。

图5 广西六堡茶和重庆沱茶属分类水平下的真菌及细菌Fig.5 Fungal and bacterial genera found in Guangxi Liubao and Chongqing Bowl teas
2.5.3 真菌物种丰度聚类分析 属分类水平下对广西六堡茶和重庆沱茶的真菌物种丰度进行聚类分析结果见图6。广西六堡茶和重庆沱茶相对丰度较高的真菌相差较大。广西六堡茶的真菌优势菌为Blastobotrys,重庆沱茶的真菌优势菌为纤孔菌属(Bjerkandera)、青霉属(Penicillium)、德巴利酵母属(Debaryomyces)。重庆沱茶的真菌优势菌丰度高于广西六堡茶。
3 讨论与结论
近年来,高通量测序技术在茶树基因组[14]、转录组[15-16]、小RNA组[17-18]、微生物[19-20]等领域取得较大的进展。本试验利用高通量测序技术分析比较了广西六堡茶和重庆沱茶微生物菌群组成和多样性,发现Blastobotrys是六堡茶的真菌优势菌,鞘脂单胞菌属(Sphingomonas)、Saccharopolyspora、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)是六堡茶的细菌优势菌。这与温志杰等检测到六堡茶在渥堆过程中不仅有真菌,也存在着大量细菌的结果相接近[21]。徐书泽利用高通量技术对成品六堡茶进行真菌多样性研究时,也发现了Blastobotrys的存在[22]。纤孔菌属(Bjerkandera)、青霉属(Penicillium)、德巴利酵母属(Debaryomyces)为重庆沱茶的真菌优势菌,但是并没有检测到其明显的细菌优势菌群。在整个紧压茶茶类中,对沱茶的微生物研究极少,目前对重庆沱茶微生物菌群的研究还未见报道。重庆沱茶与下关沱茶的加工工艺相似,Li等通过荧光原位杂交技术(FISH)与新一代测序(NGS)对下关沱茶微生物丰度和多样性进行分析,发现在发酵过程中,微生物主要是真菌,且霉菌占主要优势,这与我们在重庆沱茶中发现的微生物组成种类大致相近[23]。
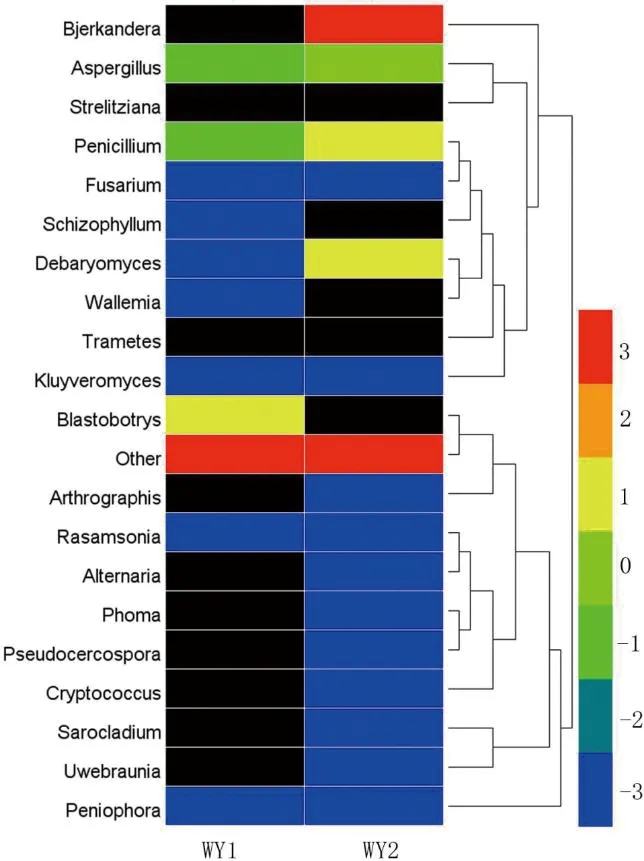
图6 在属分类水平上广西六堡茶和重庆沱茶真菌聚类图Fig.6 Cluster analysis on fungal genera found in Guangxi Liubao and Chongqing Bowl teas
结合本试验中的OTU维恩图,多样性统计结果,丰度分布曲线和聚类图等分析结果表明:重庆沱茶的真菌物种丰富度和均匀度均高于广西六堡茶,而细菌物种丰富度及均匀度则低于广西六堡茶,微生物群落多样性低于六堡茶,且无细菌优势菌群。这种差异可能与六堡茶及重庆沱茶的加工工艺有关,两种茶皆有毛茶初制、精制、拼配、蒸压、干燥和陈化等基本工序,不同的是,六堡茶多了“渥堆”的关键工艺。渥堆时,由于温度、湿度、养分适宜的原因,微生物大量繁殖,理想的生长环境为微生物多样性创造了良好条件,除真菌外,还有大量细菌的存在[21]。除此之外,由于两者的产地不同,气候条件不同,在茶叶干燥时,六堡茶使用的是晾置干燥,而重庆沱茶由于产地空气湿度较大,则会选择低温慢烘,不同的环境条件和干燥工艺可能会增加重庆沱茶真菌的物种丰富度[3,24]。六堡茶在陈化阶段,随着陈化进行,真菌多样性会呈现一个先降低后升高的趋势。本试验中,六堡茶真菌物种丰富度和均匀度低于重庆沱茶,也可能是由于取样时两者处于不同的陈化阶段所造成的差异[25]。
本研究通过提取广西六堡茶和重庆沱茶成品茶的微生物总DNA,采用高通量测序技术分析比较了两种紧压茶的微生物组成及多样性,初步探讨了广西六堡茶和重庆沱茶微生物组成差异,为寻找和利用紧压茶中的优势菌,提高紧压茶的品质和安全性提供了一定的理论依据。高通量测序技术可以简化研究步骤,缩短研究周期,快速得到实验数据[26-27],但是由于测序的分子片段较短,无法在种水平上进行微生物群落结构分析,若要进一步分析紧压茶中各种微生物对其品质形成的作用,仍需结合传统分离技术加以研究[25]。
