幽门螺杆菌CagA对胃黏膜Runx3抑制作用的分子机制探讨
2019-12-13许燕川符丽珍何利沉
许燕川,符丽珍,何利沉
幽门螺杆菌(Helicobacterpylori,H.pylori)是Ⅰ类致癌因子,与胃癌的发生及发展密切相关[1]。细胞毒素相关蛋白A(Cytotoxin-associated protein A, CagA)是由H.pylori分泌的重要毒力因子,目前研究显示CagA阳性菌株比CagA阴性菌株有更强的毒性,导致胃癌的风险也更高[2-3]。当CagA阳性菌株感染人胃黏膜上皮细胞后,便会通过Ⅳ型分泌系统将CagA蛋白注射到胃黏膜上皮细胞内,进入细胞内的CagA蛋白可通过多种途径影响细胞增殖、改变细胞表型,并增加胃癌风险[4],但目前尚未完全探明其作用机制。Runx3是一种肿瘤抑癌基因,对胃黏膜上皮细胞的生长起重要调控作用,其表达异常也与胃癌发生密切相关[5]。近期研究[6]显示CagA阳性菌株感染可导致Runx3表达沉默,但尚不明确该沉默作用的分子机制,本研究拟初步探讨该问题。另外,相较于正常胃黏膜细胞,AGS等胃癌细胞株的遗传背景可能发生较大变化,许多抑癌基因在这类肿瘤细胞中表达完全缺失或明显下降[7],因此难以有效反映CagA与胃黏膜上皮细胞相互作用的真实情况,故本研究选择永生化胃黏膜上皮细胞株GES-1来探讨H.pyloriCagA对胃黏膜Runx3抑制作用的分子机制,报道如下。
1 材料与方法
1.1 细胞株与菌株
GES-1细胞株,购自北京大学肿瘤医院细胞遗传室;H.pyloriHp-MEL27,分离自湖北省慢性浅表性萎缩性胃炎患者;大肠杆菌DH5-α购自日本TaKaRa公司。GES-1细胞处理后分为5组:空白对照组(不予额外处理);空载体组(应用空载体转染);pWT-CagA质粒组(应用CagA基因真核表达载体转染);PR-CagA(B-)质粒组(应用CagA基因EPIYA-B酪氨酸磷酸化位点突变载体转染);PR-CagA(D-)质粒组(应用CagA基因EPIYA-D酪氨酸磷酸化位点突变载体转染)。
1.2 试剂
pMD18-T原核克隆载体,购自日本TaKaRa公司;platinum tap酶,Lipofectamine2000,pcDNA3.1(+)真核表达载体,EcoRI、XhoI、T4连接酶,均购自美国thermo fisher scientific公司;凝胶回收试剂盒,购自美国Axygen公司;无内毒素质粒中提试剂盒,购自福州飞净生物;鼠CagA单克隆抗体、兔ENO1多克隆抗体,均购自美国Abcam公司;辣根过氧化物酶标记的羊抗兔和羊抗鼠单克隆抗体,鼠GAPDH单克隆抗体,均购自上海信帆生物;NF-κB抑制剂BYA11-7082,购自江苏碧云天;Src激酶抑制剂PP1、MEK抑制剂PD98059、P38MAPK抑制剂SB203580,均购自美国Cell signaling technology公司。
1.3 方法
1.3.1 CagA基因真核表达载体构建 设计引物如下:上游引物(含kozak序列及EcoRI酶切位点):CATGAATTCGCC-ACCATGACTAACGAAAC,下游引物(含XhoI酶切位点):CGCCTCGAGTTAAGATTTCTGGAAAC,产物大小3 510 bp。培养Hp-MEL27,提取基因组DNA为模板,PCR扩增条件:95 ℃预变性5 min,94 ℃变性1 min,50 ℃退火30 s,72 ℃延伸4 min,共30个循环;最后72 ℃延伸10 min。双酶切后将CagA基因和pcNDA3.1载体连接,构建CagA基因真核表达载体,标记为pWT-CagA。
1.3.2 CagA点突变载体构建 针对CagA蛋白的EPIYA-B、EPIYA-D酪氨酸磷酸化位点,各设计1对引物,见表1。各对引物中上游引物均加入Kozak序列和EcoRI酶切位点。将突变后的CagA基因和pcDNA3.1载体连接后,进行测序鉴定,确定其蛋白产物失去磷酸化激活的位点,分别标记为PR-CagA(B-)、PR-Cag(D-)。
1.3.3 GES-1细胞转染 分别构建pWT-CagA、PR-CagA(B-)、PR-Cag(D-)重组质粒及空载体,用于转染GES-1细胞。另设空白对照组,其GES-1细胞未经任何处理。根据Lipofectamine 2000转染试剂说明书操作。48 h后采集总蛋白,用于检测Runx3 蛋白表达水平。

表1CagA点突变引物设计
1.3.4 与CagA介导的Runx3抑制有关的信号通路检测 分别采用BAY11-7082、PP1、PD98059、SB203580预孵育GES-1细胞 1 h,再用pWT-CagA重组质粒及空载体转染上述细胞。48 h后采集总蛋白,用于检测Runx3 蛋白表达水平。
1.3.5 Runx3蛋白表达水平检测 采用Western Blotting 方法,检测Runx 蛋白表达水平。提取并测定总蛋白浓度,采用变性聚丙烯酰胺凝胶电泳处理蛋白质样品,取下凝胶,进行蛋白印迹反应及化学发光试剂盒显色反应,观察结果。
1.4 统计学方法

2 结果
2.1 CagA表达载体及突变载体的鉴定
①对CagA表达载体,使用EcoRI和XhoI进行双酶切鉴定,显示在3 500 bp左右(CagA)和5 000 bp左右(pcDNA3.1)各有1条带,见图1。且重组质粒测序结果与HP-MEL27 cagA基因序列完全一致。②采用重组质粒测序验证CagA点突变载体构建结果,EPIYA序列的B和D位点的3345位点及3506位点均发生A→G突变,导致酪氨酸密码子TAC突变为半胱氨酸TGC,使CagA蛋白失去磷酸化激活的位点。利用DNAman6.0软件预测pWT-CagA和两组PR-CagA的蛋白质二级结构,显示PR-CagA(B-)中899位的氨基酸由酪氨酸突变位半胱氨酸,但二级构象均为螺旋;PR-CagA(D-)中953位酪氨酸突变为半胱氨酸,但二级构象均为折叠。蛋白其它位置二级结构也均一致,提示位点突变未影响蛋白质整体的二级结构。
2.2 CagA刺激对胃黏膜Runx3 蛋白表达的影响
①在转染质粒后,检测各组细胞CagA表达水平,显示空白对照组及空载体组均无CagA及PY-99表达,而pWT-CagA组及两个PR-CagA组均有CagA高表达,且两个PR-CagA组PY-99均无明显表达,见图2。②经pWT-CagA转染后,GES-1细胞Runx3蛋白表达量明显低于空白对照组、空转染组及2个PR-CagA组,见图3、图4。

图1pWT-CagA酶切鉴定结果 1、3质粒单酶切;2、4质粒双酶切

图25种方案转染后GES-1细胞中CagA及PY-99表达情况 1空白对照组;2空载体组;3 pWT-CagA质粒组;4 PR-CagA(B-)质粒组;5 PR-CagA(D-)质粒组

图35种方案转染后GES-1细胞中Runx3表达情况 1空白对照组;2空载体组;3 pWT-CagA质粒组;4 PR-CagA(B-)质粒组;5 PR-CagA(D-)质粒组

图45种方案转染后GES-1细胞中Runx3表达情况对比 *与pWT-CagA质粒组对比,P<0.001
2.3 PP1能够阻断CagA的Runx3抑制作用
与空载体组对比,转染pWT-CagA后,Runx3表达水平明显下降(P<0.05)。使用PP1预孵育后,再进行转染,则pWT-CagA组和空载体组Runx3表达水平对比,差异无统计学意义(P>0.05)。见图5、图6。

图5PP1预孵育对CagA抑制Runx3作用的影响 1 空载体组;2 pWT-CagA组
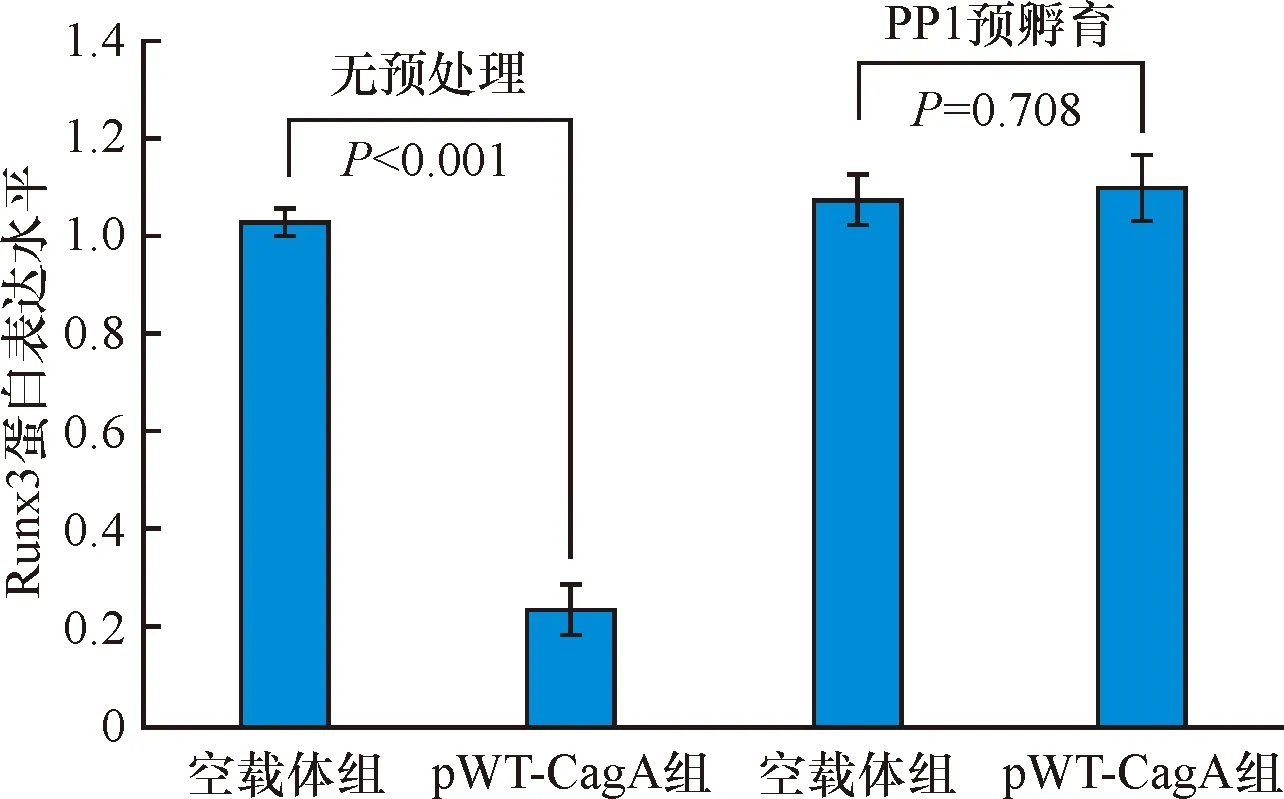
图6无预处理及PP1预孵育后空载体组与pWT-CagA组Runx3蛋白表达水平对比
2.4 PD98059能够阻断CagA的Runx3抑制作用
与空载体组对比,转染pWT-CagA后,Runx3表达水平明显下降(P<0.05)。使用PD98059预孵育后,再进行转染,则pWT-CagA组和空载体组Runx3表达水平对比,差异无统计学意义(P>0.05)。见图7、图8。

图7PD98059预孵育对CagA抑制Runx3作用的影响 1 空载体组;2 pWT-CagA组

图8无预处理及PD98059预孵育后空载体组与pWT-CagA组Runx3蛋白表达水平对比
2.5 SB203580能够阻断CagA的Runx3抑制作用
与空载体组对比,转染pWT-CagA后,Runx3表达水平明显下降(P<0.05)。使用SB203580预孵育后,再进行转染,则pWT-CagA组和空载体组Runx3表达水平对比,差异无统计学意义(P>0.05)。见图9、图10。

图9SB203580预孵育对CagA抑制Runx3作用的影响 1 空载体组;2 pWT-CagA组

图10无预处理及SB203580预孵育后空载体组与pWT-CagA组Runx3蛋白表达水平对比
2.6 BAY11-7082能够阻断CagA的Runx3抑制作用
与空载体组对比,转染pWT-CagA后,Runx3表达水平明显下降(P<0.05)。使用BAY11-7082预孵育后,再进行转染,则pWT-CagA组Runx3表达水平仍明显低于空载体组(P<0.05),但与未进行预孵育时的pWT-CagA组对比,Runx3表达水平有明显升高(P<0.05)。见图11、图12。

图11BAY11-7082预孵育对CagA抑制Runx3作用的影响 1 空载体组;2 pWT-CagA组

图12无预处理及BAY11-7082预孵育后空载体组与pWT-CagA组Runx3蛋白表达水平对
3 讨论
H.pylori感染是胃癌的独立危险因素[8],且胃癌Ⅲ期、Ⅳ期患者H.pylori感染率显著上升[9]。CagA是H.pylori分泌的最主要毒性因子之一[10],其可以通过如下机制影响细胞增殖及分化,从而增加肿瘤风险:①在Src家族蛋白酪氨酸激酶,如c-Src、Lyn等作用下,其C末端的EPIYA序模中的酪氨酸残基发生磷酸化修饰,磷酸化的CagA可与蛋白酪氨酸磷酸酶SHP-2中的SH2结构域结合,进而激活SHP-2,而激活的SHP-2又可参与MAPK/MEK/ERK途径,引起细胞过渡增殖及表型改变[11-12]。②CagA还能够通过不依赖于酪氨酸磷酸化的方式,与Grb2 c-Met受体、PLCγ等因子结合,参与Raf/MEK/MAPK信号途径,进而引起细胞过度增殖及表型改变[13-14]。
Runx3是一种肿瘤抑制基因,在胃癌细胞中经常表达缺失或显著下降[15-16]。观察性研究发现Runx3异常表达与H.pylori感染有关[17-18],但尚不明确H.pylori对Runx3的抑制作用是否与CagA有关。本研究首先发现,在GES-1细胞中,转染CagA可导致Runx3表达下降:将WT-CagA转染至GES-1细胞48 h后,Runx3表达水平明显下降。CagA C末端的酪氨酸残基的磷酸化对于调节CagA的功能有重要作用[19],本研究发现利用点突变使CagA蛋白失去磷酸化激活的位点后,CagA对Runx3的影响受到的抑制,GES-1细胞中Runx3的表达升高至与未转染CagA时相近,这提示CagA能够直接影响Runx3的表达,且这种影响可能主要通过CagA的磷酸化途径。CagA的磷酸化途径主要影响MAPK/MEK/ERK信号通路,因此本研究进一步使用PP1、PD98059、SB203580预孵育GES-1细胞,以从不同途径阻断MAPK/MEK/ERK信号通路,其中PP1是Src激酶抑制剂,PD98059是MEK抑制剂,SB203580是P38MAPK抑制剂。结果显示预孵育后再使用WT-CagA转染GES-1细胞,Runx3表达水平与未转染WT-CagA时接近,这进一步说明CagA的磷酸化途径是导致CagA抑制Runx3表达的主要途径,这与Liu等[20]报道结果相符。
黄宣等[21]报道提示H.pylori感染能够经过MEK/ERK信号通路,激活核内转运因子NF-κB的表达,而后者使调控炎症反应的重要通路,激活后能够促进IL-8、IL-6等前炎症因子表达;Sokolova等[22]报道进一步指出上述信号通路与胃癌发生及发展密切相关。本研究显示CagA对NF-κB的促进作用可能参与了CagA对Runx3的抑制作用:利用NF-κB抑制剂BAY11-7082阻断NF-κB信号通路后,Runx3表达有一定升高,但与于未转染WT-CagA时对比,Runx3表达仍明显更低,这提示NF-κB信号通路可能不是影响CagA对Runx3的抑制作用的主要途径,但仍有一定相关性。
综上,本研究显示,H.pyloriCagA能够抑制胃黏膜Runx3的表达,且这种抑制作用可能与MAPK/MEK/ERK信号通路有关。但本研究所选阻断剂有限,可能难以全面反映CagA对Runx3抑制作用的分子机制,有待后续研究补充。
