TLR9信号通路分子与乙肝相关肝细胞癌患者术后病毒激活的关系
2019-12-13姜娜杨晓飞李瑛王光东魏鑫
姜娜,杨晓飞,李瑛,王光东,魏鑫
目前国内约60%的肝癌患者多由慢性乙型肝炎进展所致,称为乙肝相关肝细胞癌;而乙肝相关肝细胞癌患者体内存在乙肝病毒感染状态与恶性肿瘤状态,接受抗肿瘤治疗过程中易出现病毒激活现象,病毒激活后会诱发机体免疫损伤,使肝脏炎症反应加重,导致肝硬化进程加快[1-2]。而乙肝病毒属非致细胞病变DNA病毒,经结合浆细胞样树突状细胞(dendritic cell,DC)表面Toll样受体9(Toll like receptor 9,TLR9),诱导依赖髓样分化因子信号通路激活,促使机体免疫反应被启动[3]。有报道认为机体免疫缺陷与病毒持续性存在有关,尤其是DC与TLR9信号通路分子障碍会诱发病毒持续性感染,而激活TLR9信号通路相关分子对病毒复制具有一定抑制作用[4]。但目前鲜有报道探讨TLR9信号通路分子与乙肝相关肝细胞癌患者术后病毒激活的关系,故本文展开相关研究,旨在为该病治疗提供参考依据,报道如下。
1 资料与方法
1.1 一般资料
纳入2016年4月至2019年4月于西安市第八医院肝病科及空军军医大学第二附属医院传染科收治的102例接受手术治疗的乙肝相关肝细胞癌患者为对象,获两院医学伦理委员会批准。按术后病毒激活情况分为激活组(30例)和未激活组(72例),其中激活组男24例,女6例,年龄18~74(51.25±4.89)岁;肿瘤大小:≤5 cm 24例,>5 cm 6例;分化程度:Ⅰ~Ⅱ期9例,Ⅲ~Ⅳ期21例。未激活组男45例,女27例,年龄20~75(52.03±5.20)岁;肿瘤大小:≤5 cm 46例,>5 cm 26例;分化程度:Ⅰ~Ⅱ期21例,Ⅲ~Ⅳ期51例。两组一般资料比较差异无统计学意义(P>0.05)。
1.2 纳入、排除标准
1.2.1 纳入标准 ①乙肝相关肝细胞癌诊断:慢性乙肝诊断参考《慢性乙型肝炎防治指南(2010年版)》[5],乙型肝炎病程持续6个月以上;乙肝表面抗原携带者再次出现肝炎症状、体征,其它病因排外。肝细胞性肝癌诊断参考《原发性肝癌诊疗规范(2011年版)》[6],甲胎蛋白低于400 μg/L,且至少有两种影像学检查(如磁共振成像、腹部B超等)示肝细胞性肝癌;甲胎蛋白高于400 μg/L,且至少有一种影像学检查示肝癌占位性病变。同时符合以上两者即可确诊为乙肝相关肝细胞癌。②年龄≥65岁。③所有患者肿瘤均可切除,均接受手术治疗。④肝功能Child-Pugh分级A级。⑤血清乙型肝炎病毒DNA低于102IU/mL。⑥入组前3个月内未行其他抗肿瘤治疗。⑦知情同意。
1.2.2 排除标准 ①伴心、肝、肾、肺等重要脏器功能不全;②精神疾患;③术后病理确诊为非肝细胞性肝癌;④围术期非肝功衰竭致死亡者。
1.3 方法
1.3.1 手术治疗 所有手术均由同一组手术医生完成。术前行常规检查,取平卧位,麻醉成功后采用安尔碘行术区皮肤消毒处理,并使用消毒手术薄膜覆盖。留取右肋缘下切口(长约8 cm),皮肤切开后逐层进腹。待探查后明确肝脏肿瘤切除术式。患者通常于术后10 d左右出院,待出院后以门诊复查或电话等形式随访6个月,分析术后病毒激活等情况。病毒激活判断标准[7]:①血清乙型肝炎病毒DNA载量升高≥1 log10IU/mL,且血清天门冬氨酸氨基转移酶或丙氨酸氨基转移酶升高2~3倍;②既往乙型肝炎E抗原或乙肝表面抗原阳性经治疗后呈阴性,且伴乙肝病毒核心抗体阳性,血清学中表面抗原重新逆转呈阳性。满足以上任意一项即可确诊为病毒激活。
1.3.2 外周血单个核细胞、浆细胞样树突状细胞及TLR9信号通路分子mRNA表达检测 分别于术前及术后1周采集清晨肝素抗凝外周血12 mL,行外周血单个核细胞(peripheral blood mononuclear cell,PBMC)、浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)及TLR9信号通路分子mRNA表达检测。
(1)PBMC:滴管取静脉血10 mL置入50 mL离心管中,加入室温磷酸盐缓冲液10 mL,吹打混匀。将淋巴细胞分离液20 mL置入另50 mL离心管中,离心管倾斜45°,距分离液界面约1.0 cm处顺着管壁滴入已稀释好的静脉血,2 000 rpm/min离心30 min。离心后采用1 mL针管吸取白膜层[上层(血浆与大部分血小板)与中层(淋巴细胞分离液)交界部位有一白膜层,即为PBMC],置入10 mL离心管中,以5倍体积的磷酸盐缓冲液重悬,1 000 rpm/min离心10 min,弃上清后重复洗涤,以Buffer重悬PBMC,定容1 mL,计数。
(2)pDCs:计数PBMC,100 μL Buffer重悬细胞,敷BDCA2 PE 10 μL,4 ℃冰箱保存10 min。2 mL Buffer洗细胞,300 g离心10 min,后弃上清,再次洗细胞并离心。加入80 μL Buffer使细胞重悬,置入Anti-PE Micro Beads 20 μL后混匀,4 ℃冰箱保存15 min。加入2 mL Buffer洗细胞,300 g离心10 min,后弃上清将细胞重悬至500 μL。于磁场中置入MS Separation columns,利用500 μL Buffer对柱子进行3次冲洗,将细胞悬液吸至柱中,待滤过后再次冲洗柱子,自磁场中取出柱子,与EP管相连,并置入1 mL Buffer,配套注射器打出。
(3)TLR9信号通路分子mRNA表达:按照RNAprep Pure细胞总RNA抽取试剂盒(北京天根生物有限公司)说明书行RNA抽提,采用Nanodrop分光光度计(北京百道亨仪器设备有限公司)测定RNA浓度和OD值(OD260/OD280保证在1.8~20.0之间)。取等量RNA量置入0.5 μL微量离心管中,加DEPC水13.2 μL,并加入10×RT Buffer 2.0 μL、25×dNTP Mix 0.8 μL、10×RT Random Primers 2.0 μL,混合均匀后70 ℃加热持续5 min变性。后加入Multi ScribeTMReverse Transcriptase 1.0 μL及RNase Inhibitor 1.0 μL,混均后行逆转录(25 ℃ 10 min,37 ℃ 120 min,85 ℃ 5 min,4 ℃∞)。后稀释引物(引物终浓度50 μmol/L),在各管中添加入相关试剂(总体积20 μL,上下游引物各1.0 μL,ROX 0.8 μL,SYBA 10.0 μL,cDNA 2 μL,H2O 6.2 μL),两步法行实时荧光定量聚合酶链反应(Step1:95 ℃10 min;Step2×40:95 ℃ 15 s,60 ℃ 1 min;Melt Curve:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s),后获取CT值,计算2-ΔΔCT。检测TLR9、髓样分化因子88(myloid differentiation factor 88,MyD88)、白介素1受体相关激酶(interleukin-1 receptor associated kinase,IRAK1)、肿瘤坏死因子受体相关蛋白6(TNF-receptor-associated factor 6,TRAF6)、转化生长因子激酶1(transforming growth factor-activated kinase 1,TAK1)、干扰素调节因子7(interferon regulatory factor 7,IRF7)的mRNA表达水平。
1.3.3 外周血血浆细胞因子表达水平检测 采用酶联免疫吸附试验测定血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-α(interferon-α,IFN-α)、白介素6(interleukin-6,IL-6)、白介素12(interleukin-12,IL-12)水平,试剂盒均由上海莱兹生物有限公司提供。
1.3.4 肿瘤组织及癌旁组织中TLR9信号通路分子mRNA表达检测
(1)实时荧光定量聚合酶链反应:取肝脏组织20 mg,磷酸盐缓冲液冲洗后加入1 mL Trizol试剂(美国Thermo公司),Trizol法提取样本总RNA,行RNeasy Mini Kit纯化。采用Nanodrop分光光度计测定RNA浓度和OD值(OD260/OD280确保在1.8~20.0之间)。实时荧光定量聚合酶链反应及聚合酶链反应同外周血TLR9信号通路分子mRNA表达检测。
(2)免疫组织化学:自病理科取石蜡切片置入60 ℃烘片机,持续20 min。经二甲苯脱蜡、复水、抗原修复、封闭、显色、苏木精复染、脱水等处理后封片。
(3)蛋白质提取:取-80 ℃保存的组织 50 mg,磷酸盐缓冲液冲洗后剪碎,加入Ripa 200 μL+蛋白酶抑制2 μL+PMSF 2 μL后漩涡振荡,冰上摇床30 min。15 000 rpm/min离心5 min后取上清,置入另一空离心管中,以BCA 蛋白浓度法检测样品中蛋白浓度。5×SDS-PAGE缓冲液加入后混匀,沸水持续煮10 min,冷却后置入-80 ℃冰箱。
(4)蛋白免疫印迹:按蛋白浓度计算体积后点样,经电泳、转膜、封闭、敷一抗、ECL发光液检测、曝光处理后显影定影。
1.4 观察指标
分析两组手术前后外周血PBMC、DC数目及血浆中细胞因子表达水平,探讨手术前后外周血pDCs中TLR9信号通路分子mRNA表达水平,并观察两组肿瘤组织及癌旁组织中TLR9信号通路分子mRNA表达水平,分析癌旁组织中TLR9及相关分子蛋白表达情况与病毒激活的关系。
1.5 统计学方法

2 结果
2.1 两组手术前后外周血PBMC、DC数目比较
激活组手术前后外周血PBMC、DC数目较未激活组比较差异均无统计学意义(P>0.05),见表1。

表1两组手术前后外周血PBMC、DC数目比较
2.2 两组手术前后外周血pDCs中TLR9信号通路分子mRNA表达水平比较
激活组术前MyD88、IRF7的mRNA 表达水平均显著低于未激活组(P<0.05);两组术后TLR9信号通路分子(TLR9、MyD88、IRAK1、TRAF6、TAK1、IRF7)mRNA 表达水平均显著低于术前(P<0.05);激活组术后TLR9、TRAF6、TAK1、IRF7的mRNA 表达水平均显著低于未激活组(P<0.05),见表2。
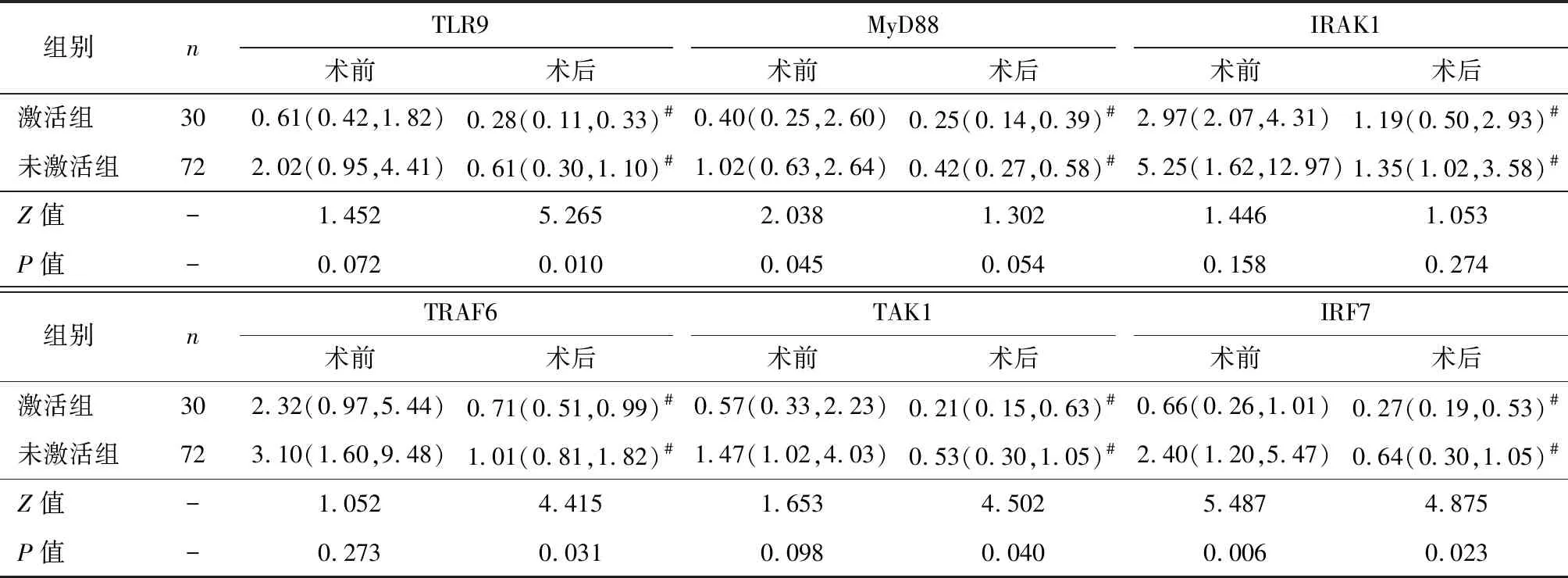
表2两组手术前后外周血pDCs中TLR9信号通路分子mRNA表达水平比较 [M(Q1, Q3)]
注:与同组术前比较,#P<0.05
2.3 两组手术前后外周血血浆中细胞因子表达水平比较
两组术后IL-6均显著高于术前(P<0.05),且未激活组术后TNF-α显著高于术前(P<0.05);激活组术后TNF-α显著低于未激活组(P<0.05),见表3。
2.4 两组肿瘤组织中TLR9信号通路分子mRNA表达水平比较
激活组肿瘤组织中TLR9、MyD88、IRAK1、TRAF6、TAK1、IRF7分子mRNA 表达水平较未激活组比较差异无统计学意义(P>0.05),见表4。
2.5 两组癌旁组织中TLR9信号通路分子mRNA表达水平比较
激活组癌旁组织中TLR9 mRNA 表达水平显著高于未激活组(P<0.05),其他分子mRNA表达水平较未激活组比较差异无统计学意义(P>0.05),见表5。
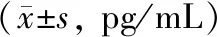
表3两组手术前后外周血血浆中细胞因子表达水平比较
注:与同组术前比较,#P<0.05
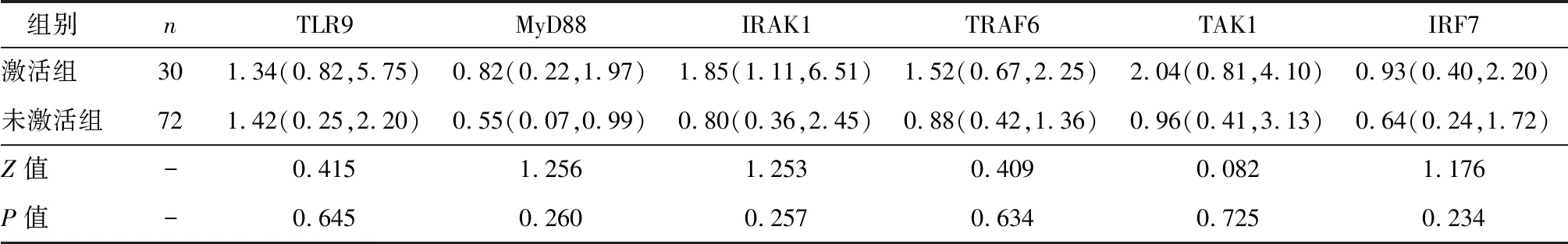
表4两组肿瘤组织中TLR9信号通路分子mRNA表达水平比较 [M(Q1, Q3)]
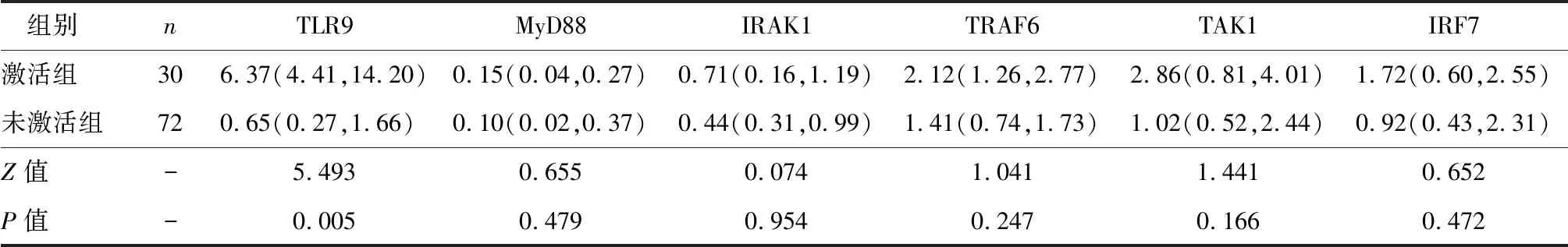
表5两组癌旁组织中TLR9信号通路分子mRNA表达水平比较 [M(Q1, Q3)]
2.6 癌旁组织中TLR9及相关分子蛋白表达情况与病毒激活的关系
经检测癌旁组织TLR9及相关分子蛋白(MyD88、IRF7)水平,以免疫组化方法验证其是否表达于癌旁组织中,后以Western Blotting检测方法检验病毒激活与癌旁组织中上述分子蛋白表达水平的关系。结果显示,TLR9、MyD88、IRF7均表达于肝脏癌旁组织中,其中TLR9呈强阳性,MyD88呈阳性,IRF7呈弱阳性(图1);蛋白免疫印迹显示,未激活组癌旁组织中TLR9蛋白表达水平较激活组明显下降(图2)。

图1免疫组化检测癌旁组织中TLR9及相关分子蛋白表达水平(×100) A:TLR9;B:MyD88;C:IRF7

图2蛋白免疫印迹检测两组癌旁组织中TLR9及相关分子蛋白表达水平 1-4 激活组;5-8 未激活组;A:TLR9;B:MyD88;C:IRF7
3 讨论
据报道,国内属乙肝病毒感染高流行区,90%人群感染乙肝病毒后呈隐形感染状态或自行恢复,部分患者感染后进展为慢性纤维化、肝癌[8-9]。分析乙肝病毒激活原因,有报道认为与机体免疫系统失衡导致肝脏表面病毒复制增多有关,其中DC、T淋巴细胞等免疫细胞参与患者机体免疫反应,成纤维细胞、库否细胞等肝脏内其它细胞也参与清除乙肝病毒免疫反应[10]。另有报道发现,乙肝病毒经DC表面TLR9被机体识别,使MyD88分子信号通路被激活,诱发机体免疫反应,其中DC起着重要作用[11]。
本研究结果显示,激活组手术前后外周血PBMC、DC数目与未激活组并无明显变化,与龙建云等[12]报道相似。张卡等[13]发现慢性乙肝患者DC、PBMC数目与正常人无明显差异。笔者推测,乙肝相关肝细胞癌患者术后病毒复制及激活与PBMC、DC数目改变无关,可能与DC细胞功能障碍相关,推测DC上TLR9信号通路分子可能参与乙肝相关肝细胞癌患者术后病毒激活过程。
本研究结果显示,激活组术前MyD88、IRF7的mRNA 表达明显低于未激活组,术后TLR9、TRAF6、TAK1、IRF7的mRNA 表达明显低于未激活组,提示外周血pDCs中TLR9信号通路分子可能参与乙肝相关肝细胞癌患者术后病毒激活过程。分析其原因,笔者认为,TLR9往往高表达于PBMC、DC上,在病原体识别、免疫激活中发挥着重要意义;而血清乙肝病毒DNA结合DC上TLR9,可使MyD88信号通路和P38MAPK通路被激活,上调IRF7调节因子,诱发前炎症因子及细胞因子释放,实现病毒清除作用。以往报道发现,慢性乙肝患者外周血中DC细胞数目明显减少,且存在功能障碍,pDCs中TLR9 mRNA表达低于正常水平,伴IFN-α减少[14]。Dong T等[15]报道TLR9激动剂能抑制病毒复制,与本结论类似,预示外周血TLR9 mRNA高表达者术后病毒激活风险低。而MyD88属TLR9信号通路下游关键分子,经蛋白-蛋白结构连接IL-IR相关激酶家族IRAK后诱发一系列功能性分子释放。既往报道也认为术前MyD88 mRNA表达减少与慢性乙肝患者术后病毒激活相关[16]。Zhang X等[17]报道MyD88能使HepG2.2.15肝细胞系与乙肝转基因小鼠上病毒复制受抑,下调MyD88表达会导致IFN-α对病毒复制的抑制作用减弱。TAK1、TRAF6属TLR9信号通路分子下游环节,上述靶基因缺陷会使TLR9所致TNF-α、IFN-α、IL-6、IL-12释放受抑[18]。而IRF7属TLR9信号通路中最后作用分子,乙肝相关肝细胞癌患者手术前后pDCs中IRF7表达减少与病毒激活密切相关。
本研究发现,未激活组术后TNF-α显著较术前高,且TNF-α明显低于未激活组,提示乙肝相关肝细胞癌患者术后TNF-α分泌减少与术后病毒激活有关。分析原因,乙肝病毒激活多因机体免疫系统失衡所致肝脏表面病毒复制增多,如乙肝表面抗原阳性肿瘤者化疗时淋巴细胞功能受抑,TNF-α分泌减少。喻一奇等[19]发现风湿性疾病合并乙肝病毒感染者免疫抑制治疗后存在病毒激活现象。笔者推测,乙肝相关肝细胞癌患者术后病毒激活过程中,肿瘤坏死因子可能发挥着重要作用。
本研究发现,激活组肿瘤组织中TLR9信号通路分子mRNA 表达较未激活组并无明显变化,而激活组癌旁组织中TLR9 mRNA 表达明显高于未激活组,证实癌旁组织中TLR9高表达是患者术后病毒激活的高危因素。既往报道认为,恶性肿瘤中DC等免疫细胞上表达的TLR对机体固有免疫、适应性免疫具有调节作用,诱导机体细胞因子大量释放;而肿瘤细胞表面表达的TLR能确保肿瘤细胞躲避宿主监视[20-21]。笔者推测,癌旁组织中TLR9表达可能对乙肝病毒逃脱宿主监视具有保护作用,基于机体免疫力下降后诱发病毒激活。本研究中,两组癌旁组织中MyD88信号通路分子表达并无明显改变,推测肝脏组织中TLR9并非经MyD88信号通路诱发机体炎症因子分泌。此外,本研究发现,蛋白免疫印迹示未激活组癌旁组织中TLR9蛋白表达水平较激活组明显下降,进一步证实乙肝相关肝细胞癌患者术后病毒激活与癌旁组织中TLR9高表达有关,手术应激后乙肝病毒被释放入血,TLR9表达低者细胞因子表达水平较低,无法应对机体反应,易导致病毒复制增多。
综上,TLR9信号通路分子与乙肝相关肝细胞癌患者术后病毒激活有关,其具体机制尚需大规模样本研究验证。
