硒对线粒体STAT3活性表达及细胞凋亡的影响研究*
2019-11-25杨胜祥张旭涛华晓芳
杨胜祥,张旭涛,华晓芳△
(1.湖北省恩施土家族苗族自治州中心医院/武汉大学恩施临床学院,湖北恩施 445000;2.湖北省建始县中医医院心内科,湖北恩施 445300)
硒是人体必需的微量元素,通过在机体中辅助多种酶类重要的调节功能,维持人体健康[1]。大量的临床数据及科研报道显示硒与心血管疾病存在相关性。冠心病的发病率与血硒水平存在逆向相关,血硒水平是判定冠心病的重要指标[2]。动脉粥样硬化的主要原因是内皮细胞膜脂质的过氧化反应,低硒导致抗氧化酶类活性下降,加剧动脉粥样硬化,补硒对动脉粥样硬化患者有明显的治疗效果[3]。此外,低硒也是导致克山病的主要原因,其病理学表现为心肌坏死[4]。因此,硒在心肌细胞的凋亡中具有重要作用。
信号转导和转录活化因子3(the signal transducer and activator of transcription 3,STAT3)在心脏各类细胞形成和信号转导中起重要作用。STAT3具有多种功能,其中就包含可以影响线粒体转运孔,参与能量代谢的调控,线粒体STAT3的表达及活性变化也可以从侧面反映心肌细胞的活性[5]。琥珀酸脱氢酶定位于线粒体内膜,参与线粒体产生腺苷三磷酸(ATP)的过程,其水平变化代表细胞内线粒体的活性。
低硒影响线粒体STAT3表达量[6],但是与心肌细胞凋亡的关系仍不清楚。因此,本实验采用乳鼠原代心肌细胞,通过低硒培养液和正常硒培养液培养,检测STAT3、琥珀酸脱氢酶及凋亡相关蛋白的表达,探讨低硒对线粒体活性和心肌细胞凋亡的影响及其分子机制。
1 材料与方法
1.1实验动物 选取出生3 d的C57BL/6小鼠6只,体质量(10±0.2)g,购自南京模式动物中心,见图1。

图1 出生3 d的乳鼠
1.2仪器与试剂 琥珀酸脱氢酶活性检测试剂盒购自美国Sigma公司,分光光度计购自美国Thermo公司,免疫印迹抗体均购自美国Abcam公司,流式细胞仪购自美国BD公司。
1.3方法
1.3.1乳鼠心肌细胞提取和培养 乳鼠浸入75%无水乙醇1~2 min,剪开胸骨,取出心脏,置于预冷的Hanks培养液,去除心脏周围的多余组织。用预冷的Hanks漂洗3次,将心脏放入胰酶中剪碎。37 ℃水浴10 min,自然沉淀后弃上清液。再次胰酶消化10 min,移液器混匀,加培养基终止消化,重复6次。将消化所得细胞1 000 r/min离心10 min,加入适量培养基混匀,置于37 ℃、5 % CO2恒温培养箱培养,24 h后观察细胞状态。
1.3.2低硒培养液浓度确定 取生长良好的原代心肌细胞,分别用含有0、0.01、0.05、0.08、0.10、0.50 μmol/L和1.00 μmol/L亚硒酸钠的培养液及正常培养液进行培养,见图2。36 h后检测不同浓度硒处理组细胞凋亡率。乳酸脱氢酶(LDH)检测发现,0.10 μmol/L硒处理组与正常培养液组毒性差异无统计学意义,可作为正常硒对照组,而过高或过低的硒浓度均表现出不同程度的细胞凋亡率,0.05 μmol/L硒处理组心肌细胞凋亡率为50%,后续实验以含0.05 μmol/L硒的培养液作为低硒组。

A:0;B:0.01 μmol/L;C:0.05 μmol/L;D:0.08 μmol/L
图2不同浓度亚硒酸钠刺激原代心肌细胞病理图片(×50)
1.3.3心肌细胞线粒体提取 取适量的对照组和低硒处理组心肌细胞,胰酶消化离心后加入适量的细胞裂解液,置于匀浆器,冰上研磨。4 ℃ 1 200 g离心15 min去除细胞核后,10 000 g离心10 min,弃上清液得到线粒体沉淀。加入适量的线粒体储存液-80 ℃保存线粒体。
1.3.4线粒体琥珀酸脱氢酶活性检测 待测样品与标准品按说明书稀释比例配好,加入酶标包被板。封板37 ℃孵育30 min。弃去液体,用提前配好的洗涤液清洗5次,每孔加酶标试剂50 μL后,封板37 ℃孵育30 min。用洗涤液清洗5次后显色,37 ℃避光显色15 min,采用分光光度计于600 nm检测琥珀酸脱氢酶活性。
1.3.5免疫印迹法检测STAT3、p-STAT3及凋亡相关蛋白Bax、Bcl-2水平 取对照组和低硒组心肌细胞线粒体,裂解后Nanodrop 2000(美国Thermo公司)检测蛋白浓度。取相同量的线粒体裂解液或全细胞裂解液,加入SDS凝胶,80 V 120 min电泳,350 mA转膜4 h。5 %无糖脱脂奶粉封闭1 h,按抗体说明书稀释比例孵育一抗室温4 h,TBST清洗3次,室温孵育二抗1 h后,于暗室显影。Image J灰度分析检测各条带光密度值。
1.3.6流式细胞术检测心肌细胞凋亡率 收集对照组和低硒组心肌细胞,0.01 mol/L PBS洗涤后加入预冷的70%无水乙醇固定2 h。PBS重悬细胞,经过滤网过滤后,1 000 r/min离心5 min,弃去PBS。PI染色液4 ℃避光孵育0.5 h。流式细胞仪于488 nm检测心肌细胞凋亡率。
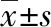
2 结 果
2.1心肌细胞线粒体酶活力及STAT3表达变化 低硒处理原代心肌细胞36 h后,提取对照组和低硒组心肌线粒体,检测琥珀酸脱氢酶活力变化。与对照组相比,低硒组琥珀酸脱氢酶活性明显下降,差异有统计学意义(P<0.05),见图3A。p-STAT3是STAT3的活性状态,线粒体裂解后,通过免疫印迹检测线粒体p-STAT3和总STAT3的表达情况,并以p-STAT3与总STAT3比值来显示STAT3活性。结果显示低硒组线粒体STAT3活性与对照组相比明显降低(P<0.01),但总STAT3差异无统计学意义(P>0.05),见图3B。

图3 两组心肌细胞琥珀酸脱氢酶酶活性及STAT3表达变化
2.2凋亡相关蛋白表达变化 与对照组比较,低硒组Bax蛋白表达明显升高,Bcl-2蛋白表达降低,差异有统计学意义(P<0.05),见图4。

图4 两组心肌细胞凋亡相关蛋白Bax和Bcl-2表达量变化
2.3心肌细胞凋亡情况 PI荧光点图观察到,对照组细胞主要为非凋亡细胞,而低硒组心肌细胞出现大量凋亡细胞。低硒组心肌细胞凋亡率为(42.62±2.21)%,高于对照组的(6.13±2.32)%,差异有统计学意义(P<0.05),见图5。

图5 两组心肌细胞凋亡情况
3 讨 论
硒元素作为人体必需的微量元素之一,与抗氧化、机体免疫、衰老、疾病等方面有重要的联系[7]。硒缺乏导致的疾病,绝大多数都是由氧化损伤引起。研究发现,由血硒含量降低引起的心肌细胞损伤主要以线粒体损伤为主,体现在线粒体膜受损,活性氧产生,脂类氧化物含量升高,导致心肌细胞凋亡[8]。作为线粒体信号转导与转录因子家族的一员,p-STAT3和细胞损伤紧密相关[9]。大量的临床数据和研究结果表明STAT3蛋白在心肌病患者和模型动物均表达降低,提示STAT3参与心肌病病理学过程[10]。研究发现STAT3与线粒体呼吸链复合物Ⅰ共同作用,在保留电子传递链复合物和稳定细胞内ATP水平以维持正常线粒体的保护功能中起十分重要的作用[11]。相关研究表明,硒能够上调细胞中STAT3活性,从而实现其对下游基因的调控,参与细胞的凋亡过程[12]。有研究表明,线粒体STAT3的活性与大鼠心脏功能有着明显的正相关[13-14]。本研究分离了C57BL/6乳鼠心肌细胞,通过低硒处理模拟心肌细胞硒缺乏后的病理环境。分离心肌细胞线粒体后,通过免疫印迹检测p-STAT3/STAT3的变化显示线粒体STAT3的活性变化。笔者发现,低硒条件下STAT3的活性下降,但是STAT3蛋白表达量并没有发生改变。检测琥珀酸脱氢酶活性可以间接表明线粒体活性变化,结果显示低硒处理后心肌细胞的线粒体活性也受到影响,与对照组相比有明显的降低。这些结果表明低硒处理后影响了心肌细胞线粒体STAT3的活性,从而导致线粒体功能受损。
STAT3在心肌缺血模型中起保护作用,但是由硒缺失引起的心肌细胞损伤对线粒体STAT3活性影响是否会引起凋亡信号的产生促进心肌细胞凋亡还未有明确的报道,因此笔者采用离体的心肌细胞通过低硒处理,在细胞水平上研究这一问题。在STAT3受到低硒影响的前提下,检测了凋亡相关蛋白Bax和Bcl-2的表达水平,结果显示低硒组Bax蛋白表达明显升高,Bcl-2蛋白表达降低。流式细胞术检测结果显示,低硒处理后导致心肌细胞凋亡率上升。
综上所述,硒缺乏降低了心肌细胞线粒体STAT3活性和线粒体活力,促进细胞凋亡相关蛋白的表达,最终导致心肌细胞凋亡。本研究进一步阐明了硒缺乏导致心肌疾病的致病机制,为硒相关治疗药物的开发提供了理论依据。
