以烟草花叶病毒为载体的μE3单克隆抗体的制备及鉴定①
2019-11-20魏德强
李 旭 魏德强
(东北林业大学生命科学学院,哈尔滨150040)
雌三醇(μE3) 分子式为 C18H24O3,分子量为288.38 Da。雌三醇是一种半抗原,在体内通过雌二醇的代谢而产生,其主要是存在于尿液中的一种天然的雌激素,在胎盘中芳构化形成雌三醇[1]。雌三醇在孕妇体内含量的变化与巨大儿和唐氏综合征或爱德华氏综合征等疾病密切相关[2-5]。在孕妇体内未结合的雌三醇浓度非常低,则预示着胎儿存在染色体异常的可能,可能患有爱德华氏综合征或唐氏综合征;而雌三醇异常升高,则增加了孕妇怀有巨大儿的风险,因此雌三醇检测是筛查孕妇胎儿畸形的重要指标,在优生优育中有着重要作用。
免疫学方法是利用抗原、抗体间的特异性反应对目标抗原进行分析,从而避免了传统化学分析法耗时耗力的弊端,可以对μE3等生物学样品进行直接检测分析[6-9],能够很大程度地提高检测的时效性和准确性,给临床诊断和治疗提供了便捷、可靠的保障。然而,μE3为小分子半抗原,不具有免疫原性,很难获得高特异性和高亲和力的单克隆抗体。
近些年来,棒状烟草花叶病毒(Tobacco mosaic virus,TMV)通过遗传方法和化学方法改变其原有性状,而被用来作为半抗原的载体。TMV由许多个结构相同的重复单元构成,均为对称结构,这些对称的重复结构单元可以使多个半抗原分子在其表面呈高重复性和高密度的有序排列,相对于传统载体BSA等更加有效地提高了半抗原的免疫原性,使半抗原能够诱导产生强烈有效的免疫反应[10]。本研究拟通过烟草花叶病毒与μE3结合,提高μE3的免疫原性,来获得针对μE3的高亲和力的特异性单克隆抗体。
1 材料与方法
1.1实验材料 BALB/c小鼠,6~8周龄,雄性,购于中国农科院哈尔滨兽医研究所;μE3蛋白购于国药集团化学试剂有限公司;亚型鉴定试剂盒购于Roche 公司;TMV-EPMK (赖氨酸突变体烟草花叶病毒)、TMV-EPMK-μE3和CPMV-μE3的化学链接均由长春应用化学研究所提供;红细胞裂解液、弗氏完全佐剂、弗氏不完全佐剂、次黄嘌呤/氨基蝶呤/胸腺嘧啶脱氧核苷培养基添加物(Hypoxantin/aminopterin/thymidin,HAT)、聚乙二醇(分子量1 600)、胎牛血清(Fetal calf serum,FBS)、次黄嘌呤/胸腺嘧啶脱氧核苷培养基添加物(Hypoxantin/thymidin,HT)、牛血清白蛋白、葡萄球菌A 蛋白(protein A)均购于Sigma公司;无血清培养基MD6 和Sp2/0 细胞由大庆麦伯康生物技术有限公司提供。
1.2方法
1.2.1免疫 小鼠免疫时间间隔为14 d,三次常规免疫后再进行一次加强免疫,具体免疫时间表如表1 所示。选择3只BALB/c雄性小鼠,在其背部皮下、腋窝、腹腔及腹股沟采取多点注射的免疫方法,第1次免疫使用弗氏完全佐剂,TMV-EPMK-μE3剂量为每只小鼠40 μg/0.3 ml,14 d后用弗氏不完全佐剂进行第2次免疫,免疫剂量同第1次,再间隔14 d后用弗氏不完全佐剂与第2次相同剂量进行第3次免疫。第3次免疫后10 d取小鼠尾部血清,用间接ELISA[10]方法检测效价。腹部加强免疫,不使用佐剂,剂量为每只40 μg/0.3 ml,加强免疫3 d后进行细胞融合。
1.2.2细胞融合与筛选 取加强免疫后的BALB/c小鼠脾细胞与对数生长期的Sp2/0细胞按2∶1比例混合在一起,1 000 g离心3 min,弃掉上清,于90 s内缓慢滴加聚乙二醇,并迅速加入经过37℃预热后的培养基,然后放于37℃ 5%CO2培养箱静止10 min。1 000 g 离心3 min后用添加10% FBS和1% HAT的MD6培养基悬起混匀,用12道移液器加在96孔细胞培养板中后放入37℃,5%CO2的培养箱中封闭培养8~10 d。之后在包被TMV-EPMK-μE3蛋白的ELISA板中加入细胞上清液进行间接高通量的ELISA(HTS-ELISA)筛选,并最终将确定的阳性细胞孔内细胞挑选出来进行亚克隆。
1.2.3杂交瘤细胞放大培养、抗体的纯化 亚克隆后的杂交瘤细胞通过细胞培养转瓶再进行扩大培养,具体操作方法如下:①亚克隆后的杂交瘤细胞通过半量换液,逐步从96孔细胞培养板转移至细胞培养皿中;②通过细胞计数板,取108个细胞接种于1 L 细胞培养转瓶中继续培养,观察细胞状态;③10~14 d后90%以上的细胞死亡,进行离心取细胞上清液,0.45 μm 的滤膜过滤;④再利用Proten A亲和层析对抗体进行纯化;⑤获得抗TMV-EPMK-μE3的抗体经透析罐透析浓缩,加入等体积甘油-20℃保存备用。
1.2.4获得抗体的亚型鉴定 筛选到的单克隆抗体使用罗氏 (Roche) 亚型鉴定试剂盒进行亚型鉴定,具体操作方法如下:①用1%BSA 的PBS缓冲液将获得的抗体稀释至终浓度为1 μg/ml;②在反应管中加入 150 μl浓度为 1 μg/ml 的抗体溶液, 25℃ 30 s 后混匀;③将试剂盒内亚型鉴定试纸条黑色端朝下插入反应管中, 静止放置 5 min;④试纸条上阳性条带出现(约5~10 min)即开始观察结果,根据条带位置对比判断获得的抗体所属亚型。
1.2.5特异性鉴定 包被TMV-EPMK、TMV-EPMK-μE3和CPMV- μE3, 三种抗原浓度均为0.5 g/ml, 用1×PBSTB将单克隆抗体将浓度配制成10 μg/ml,每个单克隆抗体配制300 μl,然后进行4倍梯度稀释,对TMV-EPMK-μE3免疫获得的单克隆抗体进行ELISA检测,确定获得的单克隆抗体的特异性。
表1 免疫接种时间表
Tab.1 Schedule of immunization

DaysStepsAdjuvantInoculation position0 d1st immunizationFreund′ s complete adjuvantDorsum/Former armpit/Inguinal regions/Abdominal14 d2nd immunizationFreund′ s incomplete adjuvantDorsum/Former armpit/Inguinal regions/Abdominal28 d3rd immunizationFreund′ s incomplete adjuvantDorsum/Former armpit/Inguinal regions/Abdominal38 dThe titer of serum--3 days before fusionBooster immunization-Abdominal
2 结果
2.1杂交瘤细胞株的建立 3次免疫结束后10 d,取小鼠尾部血清测得效价如图1所示。免疫小鼠血清效价为1/2MaxOD所对应的血清的稀释倍数,因此1号、2号和3号小鼠的血清效价分别为1∶100 000、1∶100 000、5∶100 000,3只小鼠对抗原的反应性都较高。
最终选择1号小鼠取脾脏进行细胞融合。融合后第8天观察融合细胞生长状态,第10天对其进行高通量ELISA筛选,获得阳性信号较强且生长状态良好的杂交瘤细胞4 株,将确定的4个强阳性孔中的细胞挑出至新的96孔细胞培养板中继续培养,然后经过24孔板、6孔板的放大培养和HAT、HT选择性培养基的筛选后进行亚克隆,每个亚克隆挑选出长势旺盛、抗体分泌相对多的细胞株各1个,并命名为TE1-1、TE2-1、TE3-1和TE4-1。将获得的4株细胞用转瓶扩大培养10~14 d,细胞凋亡达到90%,此时抗体分泌量最大,收集细胞上清液,再利用蛋白A纯化后,获得4 株单克隆抗体。
2.2特异性抗体的获得及鉴定
2.2.1单克隆抗体的 SDS-PAGE 鉴定 获得的TE1-1、TE2-1、TE3-1和TE4-1抗体通过 SDS-PAGE进行检测,如图2所示在抗体轻链与重链的位置,即25 kD和50 kD处都有一条清晰可见的条带。没有明显杂带出现,可以判断获得抗体的纯度基本都在 95%以上。
2.2.2抗体效价测定 包被抗原TMV-EPMK-μE3,包被液为pH=9.5的碳酸盐缓冲液,抗原浓度0.5 μg/ml,上样抗体 4 倍梯度稀释,获得抗体效价如图3所示,TE3-1和TE4-1抗体效价为 105K∶4,最低检测限约为5 ng,TE1和TE2抗体效价为105 000∶1.5,最低检测限约为 1 ng。结果表明植物病毒作为半抗原的载体可以制备出高亲和力的单克隆抗体。
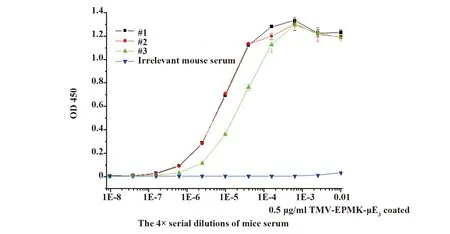
图1 TMV-EPMK-μE3第三次免疫小鼠后的效价Fig.1 Titer after third TMV-EPMK-μE3 immunization in mice
2.2.3抗体的亚型鉴定 在实验中均采用蛋白A柱对抗体进行纯化,IgM与IgG1在低盐条件下不结合或弱结合蛋白A柱 ,因此所获得的抗体亚型应为IgG2a、IgG2b或IgG3等重链类型。通过对亚克隆后的4株抗体亚型的鉴定,TE1-1和TE3-1单抗重链为IgG2b;TE2-1和TE4-1单抗重链为IgG2a,轻链类型均为 κ(表2)。
2.2.44株抗体的特异性鉴定 通过包被 CPMV-μE3、TMV-EPMK-μE3和 TMV-EPMK和水,对 TMV-EPMK-μE3免疫获得的单克隆抗体进行 ELISA特异性检测,结果见图4,TE2-1和TE4-1不与CPMV-μE3发生反应,而与TMV-EPMK-μE3和TMV-EPMK产生较强的抗原抗体反应,说明TE2-1和TE4-1是针对TMV-EPMK的抗体;TE1-1 和TE3-1不与TMV-EPMK 发生反应,而与TMV-EPMK-μE3和CPMV-μE3发生较强的抗原抗体反应,说明TE1-1 和TE3-1不与载体产生交叉反应,是 μE3的特异性抗体。
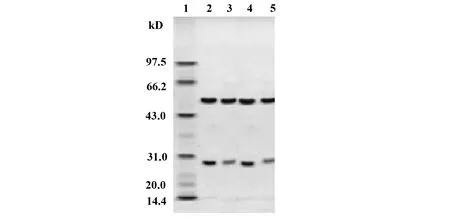
图2 TE1-1、TE2-1、TE3-1和TE4-1 SDS-PAGE电泳图Fig.2 SDS-PAGE of TE1-1,TE2-1,TE3-1 and TE4-1Note: 1.Marker;2.TE1-1;3.TE2-1;4.TE3-1;5.TE4-1.
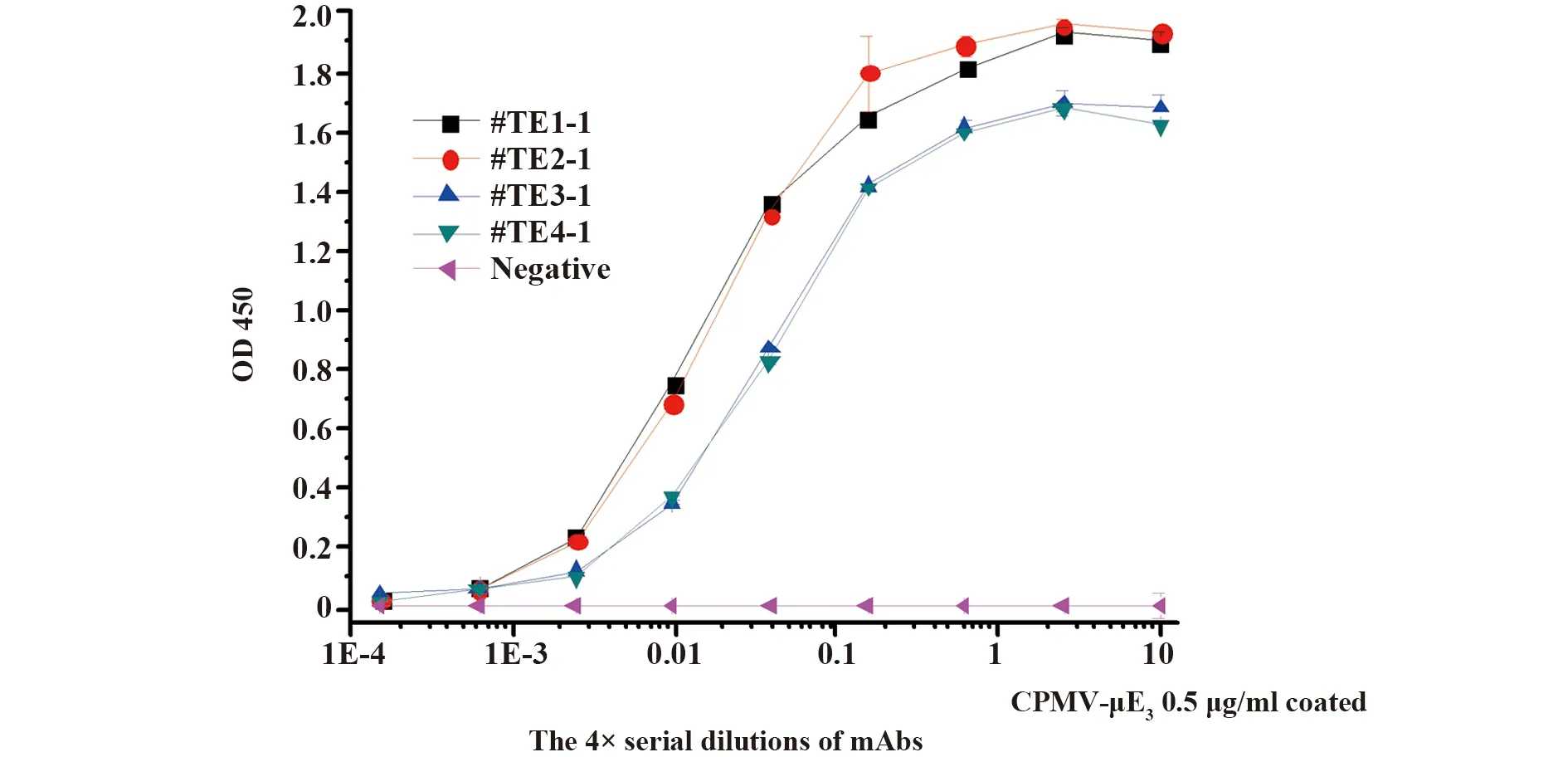
图3 TMV-EPMK-μE3 4株单克隆抗体效价测定Fig.3 Titration ELISA for anti-TMV-EPMK-μE3 mAbs
表2 单克隆抗体的亚型鉴定
Tab.2 Subtypes identification of monoclonal antibodies

No.The type of light chainThe type of heavy chainTE1-1κIgG2bTE2-1κIgG2aTE3-1κIgG2bTE4-1κIgG2a
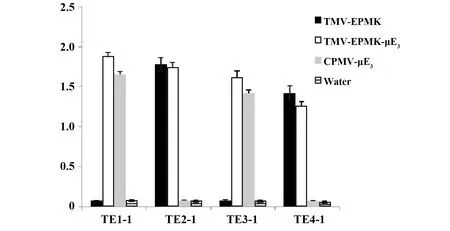
图4 TMV-EPMK-μE3免疫小鼠获得单克隆抗体的特异性分析Fig.4 Specificity analysis of mAbs against TMV-EPMK-μE3
3 讨论
TMV 有一个简单的由单个外壳蛋白缠绕的6.4 kB(+)-单链 RNA 功能结构,其为RNA病毒,并且能够对其进行简单的基因操控。TMV能够使植物感染,但最近研究表明,通过基因改造或化学修饰后其可以应用于疫苗的研发中。在疫苗的研发中,抗原可以通过TMV 作为载体递呈给抗原递呈细胞,进而刺激机体完成较强免疫应答[11]。
μE3作为半抗原,不具备免疫原性,无法单独刺激机体并引起有效的免疫应答,把半抗原与通过化学方法或基因改造的分子载体 (Protein carrier) 结合,使半抗原成为该蛋白质的一个或多个抗原决定簇,该半抗原就会获得免疫原性,并且能刺激机体产生相应的抗体[12-15]。在本实验中TMV作为半抗原μE3的载体,利用通过化学连接形成的TMV-EPMK-μE3复合体来免疫小鼠,再通过高效高通量单抗杂交瘤筛选技术获得了针对 μE3的2株单克隆抗体,对抗体纯度、特性及抗原抗体反应性均作了分析,实验获得的高亲和力的 针对μE3的单克隆抗体可以检测母体血液和尿液中的μE3浓度,从而判断胎儿的健康和发育状况,对能够引起胎儿畸形的爱德华氏综合征或唐氏综合征进行产前筛查[16]。
通过本实验研究,半抗原μE3利用TMV作为载体,使其免疫原性获得了有效提高,能够刺激机体产生高效的免疫应答反应,对动物机体不产生毒性反应。将来还需要测试不同的结构特征的半抗原或抗原与植物病毒纳米粒子载体还需做进一步的测试研究。此外,进一步深入研究纳米粒子形状为基础的抗原载体在动物体内是如何影响免疫应答的机理的也是非常重要的。
