螺内酯通过抑制左心室肥厚大鼠促肥大生长因子的表达和c-Raf/ERK1/2信号通路的活化来预防左心室肥厚
2019-11-20张维新张玲燕
刘 红 张维新 张玲燕
(河南省郑州市中医院内五科,郑州450000)
左心室肥厚(Left ventricular hypertrophy,LVH)是心肌重塑的一个特征,是一种机体对动脉高血压或主动脉瓣狭窄引起的压力超负荷的补偿机制。左心室肥厚是心律失常、猝死、舒张功能障碍和充血性心力衰竭的危险因素[1]。成人心肌细胞无法通过提高蛋白质合成速率来应对压力和生长刺激,从而导致细胞体积增加。其他研究显示,除心肌细胞肥大外,压力超负荷也可导致间质细胞增殖和细胞外基质生成,以及血管周围和间质胶原沉积增加[2]。压力超负荷导致心脏组织中配体的局部释放,包括生长因子如血小板源生长因子(Platelet-derived growth factor,PDGF)激活其酪氨酸激酶受体和转化生长因子β(Transforming growth factor-β,TGF-β)激活其丝氨酸-苏氨酸激酶受体[3,4]。多种信号转导通路均涉及心肌细胞肥大的病理过程,其中包括丝氨酸-苏氨酸激酶(c-Raf)及其下游分子丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)的级联反应[5,6]。细胞外信号调节激酶1/2(Extra-cellular signal-regulated kinases,ERK 1/2)是MAPK的一个亚组,在调节导致心肌肥厚的基因表达中发挥关键作用[7,8]。ERK 1/2的磷酸化与心脏转录因子c-myc和GATA4的上调有关[9]。GATA4是大多数心脏表达的结构基因和肥大相关基因的关键转录因子,其中包括心房利钠肽(Atrial natriuretic peptide,ANP)基因[10,11]。在人类中,c-Raf的突变与遗传性疾病如Noonan综合征中的心脏肥大有关,这表明c-Raf在心脏肥大的病理生理调节中具有重要作用[12]。多项数据表明,肿瘤发生与调节心脏肥大的信号通路之间存在相似性,其中包括c-Raf/ERK1/2 信号通路[13-15]。众所周知,醛固酮是一种可引起心肌肥厚的类固醇类激素,为肾素-血管紧张素系统的一部分[16]。螺内酯是一种醛固酮受体拮抗剂,多项研究均证实螺内酯可用于治疗慢性心力衰竭、抑制快速心房起搏所致电重构、调节心肌胶原重建等作用[17-18],最近动物实验模型研究表明,螺内酯可预防由于异丙肾上腺素引起的心肌肥厚[19]。本研究旨在探讨螺内酯对压力超负荷诱导的左心室肥厚大鼠免疫及炎症因子的影响,及其在左心室肥厚中的作用机制。
1 材料与方法
1.1材料
1.1.1实验材料 螺内酯购自江苏正大丰海制药有限公司(国药准字:H32020077); van Gieson染色液购自南京森贝伽生物科技有限公司;PDGF-BB和TGF-β1 ELISA试剂盒购自美国R&D Systems公司;组织裂解缓冲液购自瑞士Roche公司; BCA蛋白质测定试剂盒购自美国Pierce公司; RNeasy Mini试剂盒购自美国Qiagen公司; RNA逆转录试剂盒、MultiScribe逆转录酶、dNTP和RNase抑制剂、Applied Biosystems 7500实时PCR系统购自美国Applied Biosystems公司;Synergy Brands(SYBR)Premix Ex TaqTM试剂盒购自日本TaKaRa Holdingsn公司;Sircol Soluble Collagen Assay胶原蛋白检测试剂盒购自英国Biocolor公司;兔抗大鼠磷酸化-ERK1/2、小鼠抗大鼠总ERK1/2、兔抗大鼠磷酸化c-Raf和兔抗大鼠总c-Raf抗体均购自R&D Systems公司;HRP-标记的二抗购自艾美捷科技有限公司;增强的化学发光ECL试剂盒购自美国Perkin-Elmer公司。
1.1.2实验动物及分组 使用6~8周体重210~260 g的雄性SD大鼠(四川大学实验动物中心)进行研究,严格按照国家卫生研究院实验动物护理和使用指南中的建议进行实验,本研究已获得动物实验伦理委员会批准。将40只大鼠随机分为对照组(Control)、模型组(Model)、螺内酯组(Spironolactone)和假手术组(Sham),每组10只。在本研究中,对照组大鼠为相同饲养条件下饲养但未进行建模的大鼠;模型组大鼠为建立压力超负荷诱导的左心室肥厚模型的大鼠;螺内酯组大鼠为应用螺内酯处理的左心室肥厚模型大鼠;假手术组大鼠为只进行开腹手术操作但未进行腹主动脉缩窄丝线结扎的大鼠。
1.2方法
1.2.1动物模型建立 参考胡咏梅等文献报道的方法[20],采用腹主动脉缩窄法建立压力超负荷诱导的左心室肥厚大鼠模型。所有手术均在2%戊巴比妥钠腹腔麻醉下进行,在大鼠双侧肾动脉上方游离腹主动脉,在主动脉长轴旁平行放置直径0.7 mm 的7号针头,然后用丝线将腹主动脉及针头捆扎在一起,然后抽出针头,即可造成腹主动脉狭窄。假手术组未用丝线结扎,其他步骤与模型组相同。术后第4周对大鼠进行心脏超声检查,若舒张末期左室后壁厚度和舒张末期室间隔厚度明显增加则证实形成左心室肥厚。
1.2.2治疗方案 将20只建模后的大鼠随机分为螺内酯组和模型组,每组各10只。对照组大鼠未做手术处理。将螺内酯溶于生理盐水(0.9%NaCl)中,每天按照20 mg/kg的剂量对螺内酯组大鼠进行灌胃,根据大鼠体重计算螺内酯用量,将螺内酯溶解到2 ml生理盐水中,然后对大鼠进行灌胃。为了排除溶剂对本试验的影响,因此本研究对模型组、假手术组和对照组大鼠灌胃等体积(2 ml)的生理盐水,共治疗8周。最后一次灌胃后12 h内处死大鼠,收集血液和左心室组织用于后续分析。
1.2.3组织学分析 将左心室切除并快速固定在10%福尔马林中,石蜡包埋。切片厚度为7 μm,将切片用van Gieson染色以检测心室的胶原沉积[21]。在光学显微镜下观察染色切片并用数码相机拍照。
1.2.4PDGF-BB和TGF-β1的检测 采用ELISA试剂盒检测大鼠左心室PDGF-BB和TGF-β1的水平。将100 mg快速冷冻的左心室组织在500 μl含有50 mmol/L Tris HCl (pH 7.5)、150 mmol/L NaCl、10 mmol/L EDTA、0.25%Triton X-100、0.1%NP-40、1 mmol/L PMSF和cocktail蛋白酶抑制剂的裂解缓冲液中匀浆。裂解物在4℃下以14 000 g离心15 min。将ELISA水平标准化为每种样品的总蛋白质水平。
1.2.5RT-qPCR 使用RNeasy Mini试剂盒从大鼠左心室心肌中提取总RNA。使用RNA逆转录试剂盒、MultiScribe逆转录酶(50 U/μl)、dNTP和RNase抑制剂(20 U/μl)反转总RNA(2.5 μg)。通过Applied Biosystems 7500实时PCR系统和Synergy Brands(SYBR)Premix Ex TaqTM试剂盒进行RT-qPCR,反应体系为25 μl。引物序列如下:ANP,上游:5′- AGC TCA AGC GAG GTC GGA TG-3′,下游:5′- GGC TGC CTG TCC TGT TGG TT -3′。GATA4,上游:5′- CGA AAA GTC GAG GCC TCA AAC TTT G-3′,下游:5′- CGG CCA TGA AGC CAA TCC-3′。c-myc,上游:5′- AGC TCA GTC AGC AGG GAG TG-3′,下游:5′- GGC TGT GTT TGC CTG TCC TG-3′。GAPDH,上游:5′- TCG GGG TGA TGC CTC AAC CT-3′,下游:5′- CGC ACA GTG AAG GCT CAC T-3′。反应条件如下:95℃预变性10 min,95℃ 15 s,60℃ 60 s,40个循环,60℃延伸60 s。使用GAPDH作为内参基因。通过2-ΔΔCt法计算基因的相对表达量。
1.2.6胶原蛋白检测 使用Sircol Soluble Collagen Assay胶原蛋白检测试剂盒测定大鼠左心室匀浆中的总可溶性胶原。将1 ml天狼星红染料加入到10 μl 心室匀浆中,并在室温下孵育30 min。在12,000 g离心10 min后,将沉淀的胶原-染料复合物用1 ml 0.5 mol/L NaOH溶解,并在540 nm处读取吸光度。定量结果表示为胶原蛋白与总蛋白含量的比值。
1.2.7蛋白质印迹分析 将大鼠心室组织在50 mmol/L Tris HCl (pH 7.5)、150 mmol/L NaCl、10 mmol/L EDTA、0.25%Triton X-100、0.1%NP-40、1 mmol/L PMSF和cocktail蛋白酶抑制剂中裂解。通过BCA蛋白质测定试剂盒测量蛋白质浓度。在SDS-聚丙烯酰胺凝胶上分离蛋白质(每个泳道100 μg)并转移到硝酸纤维素膜上。室温下将膜在含有0.1%吐温20和5%脱脂乳的Tris缓冲盐水(pH7.4)中封闭1 h,并在4℃下与以下一抗孵育过夜:兔抗大鼠磷酸化-ERK1/2 (1∶1 000)、小鼠抗大鼠总ERK1/2(1∶1 000)、兔抗大鼠磷酸化c-Raf(1∶1 000)和兔抗大鼠总c-Raf(1∶1 000)。将膜在含有0.1% Tween-20的TBS中洗涤1 h,并用HRP-标记的二抗(1∶2 000)在含有0.1%吐温20和5%脱脂乳的TBS中孵育1 h。使用增强的化学发光ECL试剂盒进行显影。

2 结果
2.1螺内酯可抑制压力超负荷诱导的大鼠左心室肥厚 本研究通过大鼠左心室重量与体重比值(VW/BW)来评价螺内酯对压力超负荷诱导的大鼠左心室肥厚的影响。将大鼠麻醉开胸后迅速去除心脏,首先用冰生理盐水洗清,然后滤纸吸干水分,减去心房及血管组织,分别沿室间隔分离左心室,用电子天平称取左心室重量。图1显示,模型组大鼠VW/BW(3.62±0.31 mg/kg)比对照组(2.65±0.23 mg/kg)显著增加了36.60%,而螺内酯可显著降低大鼠的VW/BW(2.78±0.24 mg/kg)(P<0.05)。
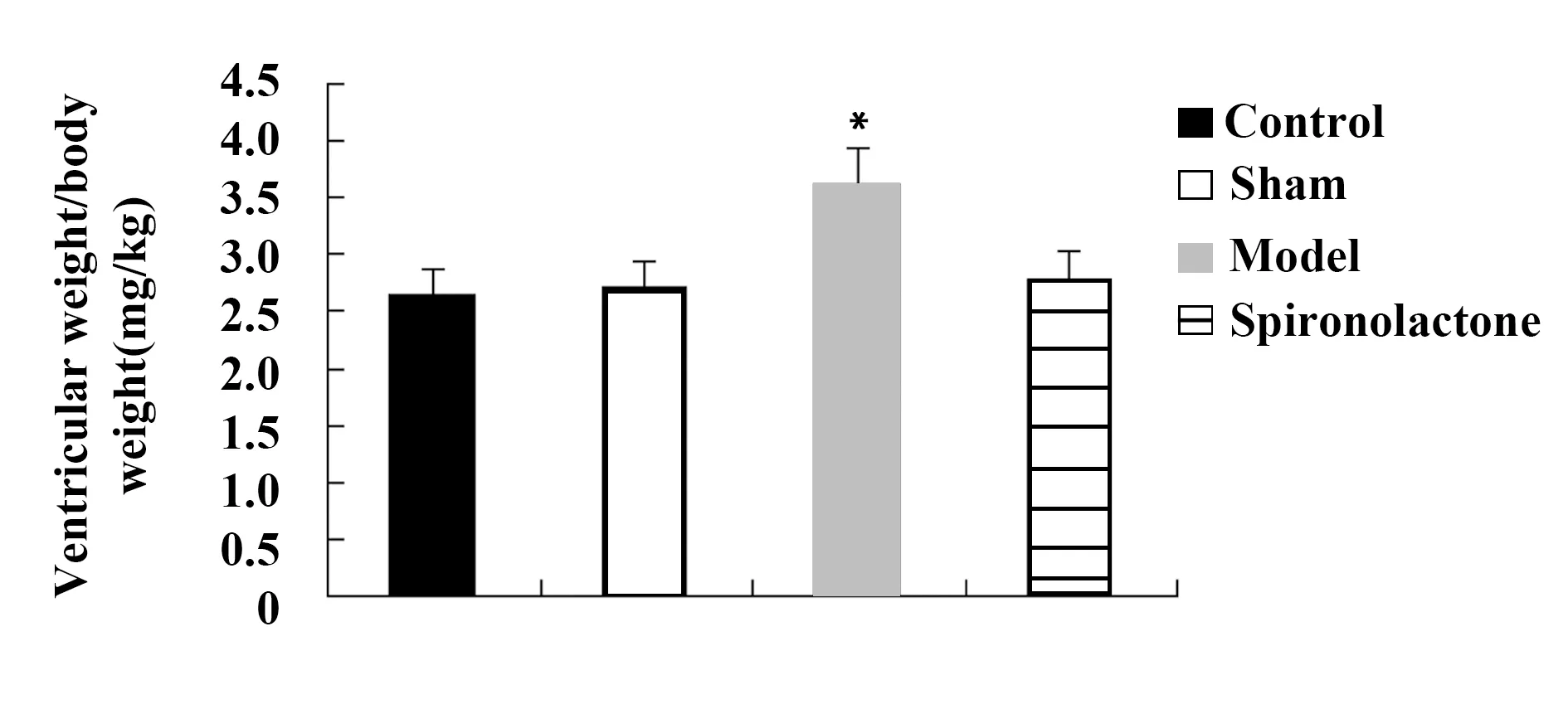
图1 螺内酯对大鼠左心室重量与体重比值(VW/BW)的影响Fig.1 Effect of spironolactone on ratio of left ventricular weight to body weight (VW/BW) in ratsNote: Compared with the control group,*.P<0.05.
2.2螺内酯可抑制压力超负荷诱导的大鼠左心室胶原蛋白沉积 van Gieson染色结果显示,模型组大鼠心室血管周围间质内可见明显的胶原蛋白沉积,而用螺内酯处理可明显降低胶原蛋白的沉积(图2A)。定量结果描述为胶原蛋白含量与总蛋白含量的比值,如图2B显示,与对照组相比(5.21±0.34 μg/mg protein),模型组大鼠心室总胶原蛋白相对表达量显著上调了46.45%(7.63±0.71 μg/mg protein)。而螺内酯组(5.68±0.45 μg/mg protein)显著低于模型组,且与对照组比较差异无统计学意义。
2.3螺内酯可下调压力超负荷诱导的大鼠促肥大生长因子的表达 采用ELISA法检测大鼠左心室促肥大因子血小板源生长因子BB(PDGF-BB)和转化生长因子β1(TGF-β1)的表达,如图3所示,与对照组相比(2.21±0.18 pg/mg protein), 模型组大鼠的PDGF-BB表达量显著上调了70.14%(3.76±0.32 pg/mg protein),螺内酯组(2.54±0.22 pg/mg protein)显著低于模型组,且与对照组差异无统计学意义。与对照组相比(3.14±0.28 pg/mg protein),模型组大鼠的TGF-β1表达量显著上调了118.47%(6.86±0.60 pg/mg protein)。然而,螺内酯组(4.02±0.35 pg/mg protein)显著低于模型组,且与对照组比较差异无统计学意义。
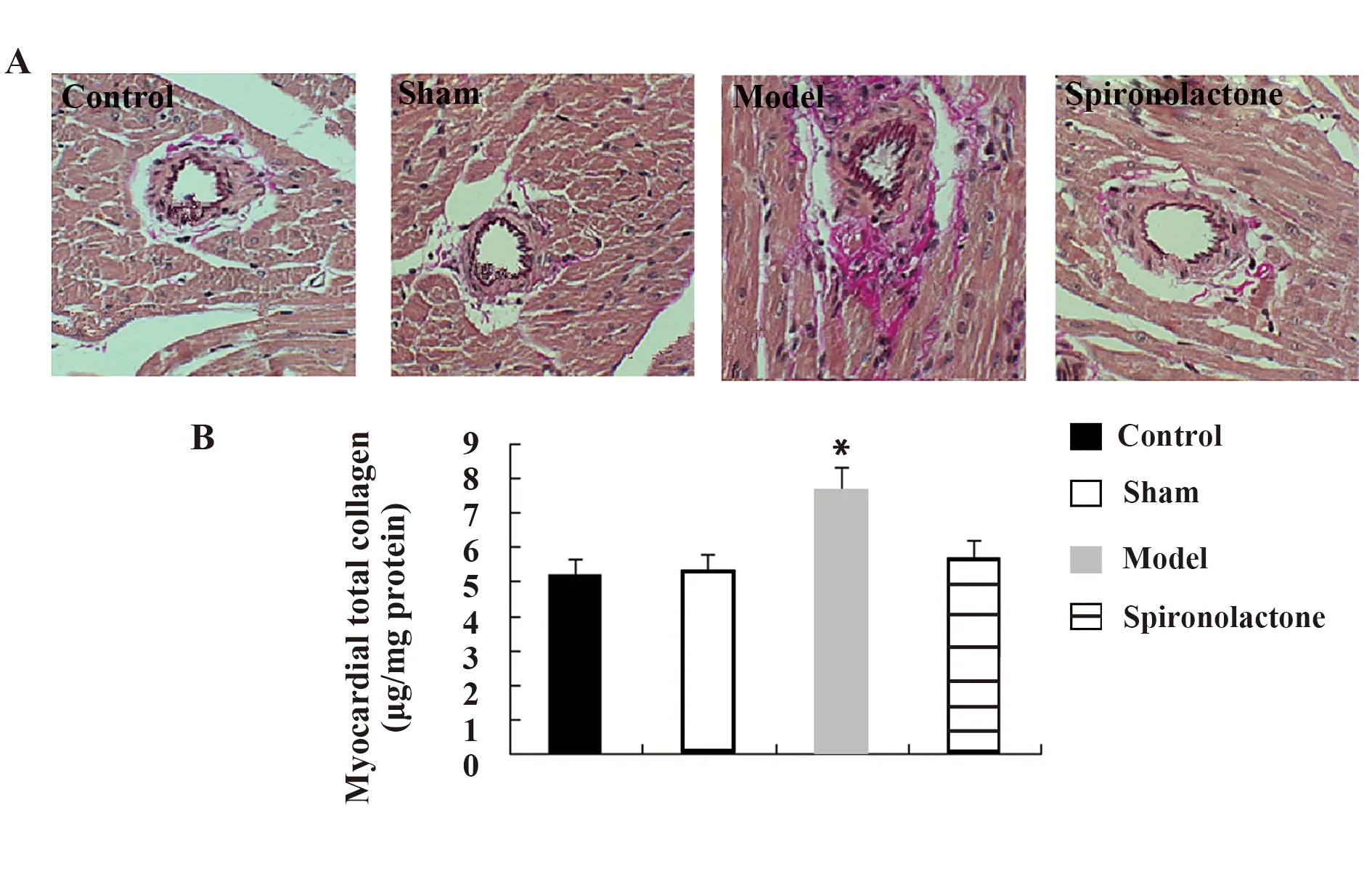
图2 螺内酯对大鼠左心室胶原蛋白沉积的影响Fig.2 Effect of spironolactone on left ventricular collagen deposition in ratsNote: A.Van Gieson staining legend;B.Quantitative analysis of total ventricular collagen in rats;compared with control group,*.P<0.05.

图3 螺内酯对大鼠心室组织PDGF-BB (A)和TGF-β1 (B)表达的影响Fig.3 Effect of spironolactone on expression of PDGF-BB (A) and TGF-β1(B) in rat ventricular tissueNote: Compared with the control group,*.P<0.05.
2.4螺内酯可抑制压力超负荷诱导的大鼠c-Raf/ERK1/2信号通路的活化 采用Western blot检测大鼠左心室组织中c-Raf和ERK1/2的活化情况,研究如图4所示,与对照组相比,模型组大鼠的c-Raf和ERK1/2磷酸化水平分别显著上调了106.25%和74.00%,而螺内酯组显著低于模型组,且与对照组比较差异无统计学意义。
2.5螺内酯可抑制压力超负荷诱导的大鼠促增殖和促肥大转录因子的表达 采用RT-qPCR检测大鼠左心室组织中促增殖核转录因子c-myc和促肥大转录因子GATA4的表达情况,如图5A、B所示,与对照组相比,模型组大鼠的c-myc和GATA4 mRNA表达水平分别显著上调了115.01%和254.00%,而螺内酯处理可抑制c-myc和GATA4 mRNA的上调,显著低于模型组,且与对照组比较差异无统计学意义。此外,心房利钠肽(ANP)基因是一种促肥大基因,其转录受GATA4直接调控。图5C显示,与对照组相比,模型组大鼠的ANP mRNA表达水平显著上调了421.00%,而螺内酯处理可抑制ANP mRNA的上调,显著低于模型组,且与对照组比较差异无统计学意义。
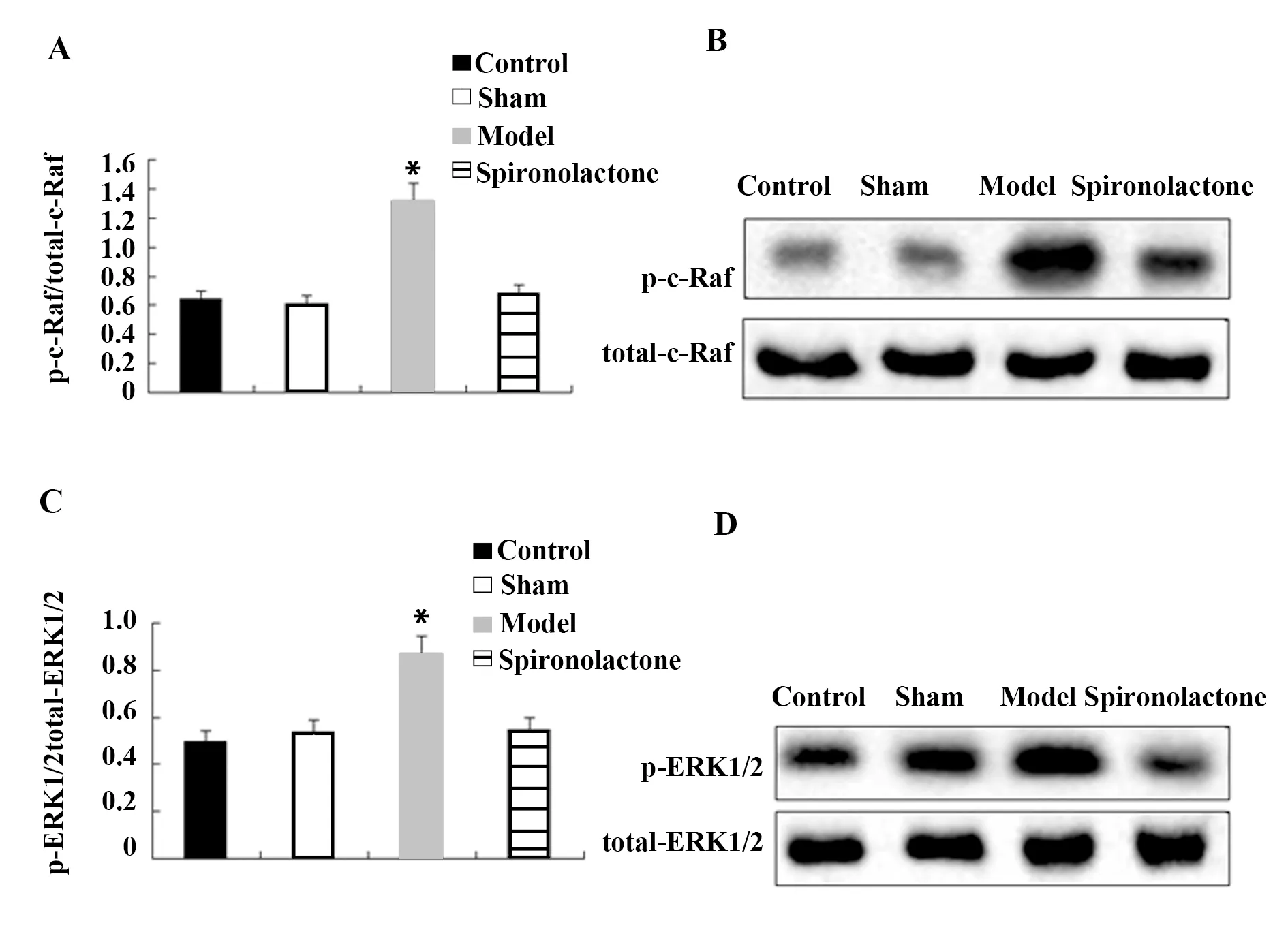
图4 螺内酯对大鼠心室组织c-Raf和ERK1/2磷酸化的影响Fig.4 Effect of spironolactone on c-Raf and ERK1/2 ph-osphorylation in rat ventricular tissueNote: A and B.Quantitative analysis of c-Raf phosphorylation and protein bands; C and D.Quantitative analysis of ERK1/2 phosphorylation and protein bands;compared with the control group,*.P<0.05.

图5 螺内酯对大鼠心室组织c-myc (A)、GATA4 (B)、ANP (C) mRNA表达的影响Fig.5 Effect of spironolactone on expression of c-myc (A),GATA4 (B) and ANP (C) mRNA in rat ventricular tissueNote: Compared with the control group,*.P<0.05.
3 讨论
醛固酮是一种可引起心肌肥厚的类固醇类激素,为肾素-血管紧张素系统的一部分。螺内酯是一种醛固酮受体拮抗剂,多项研究均证实螺内酯可用于治疗慢性心力衰竭、抑制快速心房起搏所致电重构、调节心肌胶原重建等作用,最近动物实验模型研究表明,螺内酯可预防由于异丙肾上腺素引起的心肌肥厚[17-19]。本研究采用腹主动脉缩窄法建立压力超负荷诱导的左心室肥厚大鼠模型,然后探讨了螺内酯对大鼠左心室重量与体重比值(VW/BW)的影响,研究发现模型组大鼠的VW/BW显著增加,而螺内酯可显著降低大鼠的VW/BW。说明螺内酯可有效抑制压力超负荷诱导的左心室肥厚。由于心室胶原蛋白沉积是心室肥厚的主要病理基础,本研究结果显示螺内酯处理可有效降低大鼠心室血管周围间质的胶原蛋白沉积,从而防止左心室肥厚。
前人研究显示,压力超负荷可导致心脏组织中配体的局部释放,包括生长因子PDGF和TGF-β[4]。PDGF-BB和TGF-β1均是促肥大生长因子,参与机体的炎症反应,并且PDGF-BB和TGF-β1的上调可促进间质胶原沉积,进而导致心肌肥大。本研究发现,模型组大鼠的PDGF-BB和TGF-β1表达量显著上调,而螺内酯处理可显著抑制PDGF-BB和TGF-β1的上调,从而阻断心室肥大的发病过程。
多种信号转导通路均涉及心肌细胞肥大的病理过程,c-Raf/ERK1/2信号通路在压力超负荷诱导的大鼠左心室肥厚中具有关键调节作用[9]。在人类中,c-Raf的突变与遗传性疾病如Noonan综合征中的心脏肥大有关,这表明c-Raf在心脏肥大的病理生理调节中具有重要作用[12]。ERK1/2是c-Raf的下游分子,在调节导致心肌肥厚的基因表达中发挥关键作用[22]。本研究发现,模型组大鼠的c-Raf和ERK1/2磷酸化水平分别显著上调了106.25%和74.00%,而螺内酯可明显抑制c-Raf和ERK1/2的活化。
ERK1/2的磷酸化与心脏转录因子c-myc和GATA4的上调有关[9,23,24]。ERK1/2的磷酸化可诱导c-myc的高表达,从而促进细胞增殖、纤维化和胶原沉积[22]。c-Raf/ERK1/2通路的激活也可诱导心肌细胞肥大中的心脏转录因子GATA4的高表达[9]。本研究结果与其他报道一致,c-Raf/ERK1/2信号通路的磷酸化和活化伴随着促增殖核转录因子c-myc的上调,以及促肥大转录因子GATA4的上调,这些因子与细胞增殖和纤维化有关[25]。此外,GATA4可控制促肥大基因ANP的转录[26],本研究中也发现了ANP在模型组大鼠中显著上调。然而,螺内酯处理则可显著抑制c-myc、GATA4和ANP的表达。
综上所述,本研究表明螺内酯可有效抑制压力超负荷诱导的大鼠左心室肥厚。主要是由于螺内酯抑制了促肥大生长因子(PDGF-BB和TGF-β1)的表达,减弱了胶原蛋白沉积。此外,螺内酯可通过抑制c-Raf/ERK1/2信号通路的活化来阻断促肥大相关因子的表达,并降低炎症反应,从而预防左心室肥厚。
