miR-21靶向调控Bcl-2对肠道上皮HT29细胞凋亡的影响及机制研究①
2019-11-20王卫卫邢文韬魏思忱高巧营魏新亮
王卫卫 邢文韬 魏思忱 高巧营 魏新亮 石 亮 孔 郁
(沧州市中心医院消化内二科,沧州061001)
溃疡性结肠炎是炎症性肠道疾病的主要类型之一,可引起人体过度免疫应答,导致炎症细胞因子大量产生,诱发肠道上皮细胞凋亡,临床表现为直肠出血和严重腹泻[1]。该病经柳氮磺胺吡啶水杨酸制剂治疗后仍易复发,严重者甚至进行手术切除[2]。溃疡性结肠炎难以根治且发病率逐年递增[3],而至今对其发病机制及致病因素仍不清楚,因此研究其发病机制显得尤为迫切,更有助于寻找根治溃疡性结肠炎的有效方法。研究表明,某些微小型RNA(microRNA,miRNA)在溃疡性结肠炎组织中异常表达,miR-21是高度表达的miRNA之一[4]。在结肠腺癌细胞Caco-2细胞中,过表达的miR-21通过靶向Rho GTP酶RhoB破坏肠上皮屏障功能[5]。据报道,在胰岛β细胞中,过表达的miR-21可抑制B细胞淋巴瘤/白血病基因-2(B-cell lymphoma/leukemia gene-2,Bcl-2)转录和表达,并诱导细胞凋亡发生[6]。Bcl-2是一种抗凋亡因子,在多种癌症中表达上调[7,8]。目前在溃疡性结肠炎中还没有关于miR-21与Bcl-2关系的研究,因此本文通过下调miR-21,探究在人肠上皮HT29细胞中miR-21对Bcl-2的作用机制和对细胞凋亡的影响,揭示溃疡性结肠炎的发病机理,为该病临床治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1试剂 Trizol、Lipidosome 2000购自美国Invitrogen公司。实时定量PCR试剂盒、逆转录试剂盒购自美国Thermo Fisher公司。外源性TNF-α购自美国PeproTech公司。miR-21 inhibitor、miR-21mimic和Bcl-2 siRNA(si-Bcl-2)购自上海吉玛生物科技公司。RPMI1640培养液、胎牛血清(FBS)购自美国Gibco公司。RIPA裂解液购自北京索莱宝生物公司。BCA试剂盒购自广州永诺生物科技有限公司。青、链霉素和MTT购自上海碧云天生物技术研究所。所用引物由北京六合华大基因有限公司合成。增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)和Ki67 购自美国Santa Cruz公司。Cleavezd Caspase-3、Cleaved Caspase-9购自美国Cell Signaling Technology公司。3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和所有二抗购自北京中杉金桥生物技术有限公司。ELISA试剂盒购自美国Abbkine公司。英夫利昔单抗购自瑞士Cilg AG公司。
1.1.2组织与细胞 正常结肠组织与溃疡性结肠炎组织由广州中医药大学第一附属医院提供,正常结肠组织捐献者无慢性自身免疫性疾病史及癌症家族史。人肠上皮HT29细胞由美国典型培养物保藏中心(American Type Culture Collection,ATCC)提供。用补充有10%FBS、100 U/ml青霉素和100 μg/ml链霉素的RPMI1640细胞培养液培养细胞。培养条件为37℃、5%CO2。
1.2方法
1.2.1细胞分组与转染 将细胞分为HT29组、miR-21 inhibitor组、si-Bcl-2组和si-Bcl-2+miR-21 inhibitor组。将细胞以1×105个/ml接种于6孔板中,次日用10 ng/ml的TNF-α处理HT29细胞24 h,然后用miR-21 inhibitor转染miR-21 inhibitor组细胞,si-Bcl-2转染si-Bcl-2组细胞,si-Bcl-2和miR-21 inhibitor共同转染si-Bcl-2+miR-21 inhibitor组细胞,转染6 h后换液,继续培养用于后续的检测。HT29组细胞仅用TNF-α处理24 h,Opti-MEM 6 h,换液继续培养用于后续的检测。
1.2.2RT-PCR检测miR-21和Bcl-2的mRNA水平 首先在通风橱中抽提各检测样品的总RNA,操作步骤参考Thermo Fisher总RNA提取试剂盒说明书。然后将各样品总RNA进行定量分析,每组取等量RNA进行反转录,操作步骤参考逆转录试剂盒说明书。通过PCR扩增后,用实时定量PCR试剂盒对各检测样品进行定量分析。
1.2.3荧光素酶实验 利用生物信息预测miR-21与Bcl-2之间的连续结合位点,利用PCR将 Bcl-2片段插入荧光素酶载体中作为野生型的Bcl-2质粒(Bcl-2 wt),将连续结合位点突变的Bcl-2片段插入荧光素酶载体中作为突变型的Bcl-2质粒(Bcl-2 mut)。将miR-21与Bcl-2 wt或Bcl-2 mut同时转染HT29细胞,6 h后换液,转染24 h后检测各组细胞的荧光素酶反应强度。
1.2.4MTT检测细胞生存情况 将1.2.1中各组细胞中加入浓度为5 mg/ml的MTT溶液,作用4 h后终止培养。用枪头吸出大部分培养液后,将细胞培养板翻转倒扣于滤纸上吸去残余液体。加入二甲基亚砜低速震荡10 min,充分溶解结晶物后,用酶联免疫检测仪在OD 490 nm处测量各组细胞的吸光度值。
1.2.5流式检测细胞凋亡情况 将1.2.1中各组细胞中加入0.25%的胰蛋白酶进行消化,收集细胞,用预冷后的磷酸盐缓冲液洗涤3次。将细胞用结合缓冲液调整密度至1×106个/ml,取100 μl加入试管中,再加入5 μl Annexin V及10 μl PI避光孵育 15 min,利用流式细胞仪检测各组细胞的凋亡率。
1.2.6ELISA检测炎症细胞因子的表达 收集1.2.1中各组细胞培养上清,采用双抗体夹心ELISA法检测各组细胞中IL-6、IL-1β和IL-8的表达。上清离心去除沉淀物,加入包被好抗体的微孔中,稀释后加入辣根过氧化物酶标记的检测抗体,37℃孵育1 h。洗涤后加入底物,37℃避光孵育15 min,终止液进行终止,利用酶标仪在450 nm波长处测定各孔的OD值。操作步骤参考ELISA试剂盒说明书。

2 结果
2.1正常结肠组织及溃疡性结肠炎组织中miR-21与Bcl-2的mRNA水平 与正常结肠组织比较,溃疡性结肠炎组织中miR-21的mRNA水平显著升高,Bcl-2的mRNA水平显著降低(P<0.001,图1)。与溃疡性结肠炎组织比较,经英夫利昔单抗治疗的溃疡性结肠炎组织中miR-21的mRNA水平显著降低,Bcl-2的mRNA水平显著升高(P<0.001),提示miR-21上调和Bcl-2下调可能与溃疡性结肠炎发生发展有关。
2.2TNF-α影响miR-21和Bcl-2的mRNA水平 利用TNF-α处理肠上皮细胞HT29构建了体外炎症细胞模型,与未处理组比较,经TNF-α处理后miR-21的mRNA水平显著升高,Bcl-2的mRNA水平显著降低(P<0.001,图2)。提示miR-21上调和Bcl-2下调可能与TNF-α诱导的细胞炎症过程有关。
2.3沉默miR-21表达可升高Bcl-2的mRNA水平 与空白HT29炎症模型细胞比较,转染scramble细胞中miR-21和Bcl-2的mRNA水平变化无显著差异,转染miR-21 inhibitor细胞中miR-21的mRNA水平显著降低,Bcl-2的mRNA水平显著升高(P<0.001,图3)。实验结果说明miR-21 inhibitor 转染成功,并提示miR-21对Bcl-2有潜在调节作用。
2.4miR-21靶向结合Bcl-2 生物信息学分析结果表明 miR-21与Bcl-2之间存在连续结合片段。miR-21 mimic 显著降低Bcl-2 wt质粒的荧光素酶活性(P<0.01,图4),对结合片段核苷酸位点突变的Bcl-2 mut质粒并无影响。实验结果说明miR-21可以靶向结合Bcl-2并抑制Bcl-2的表达。
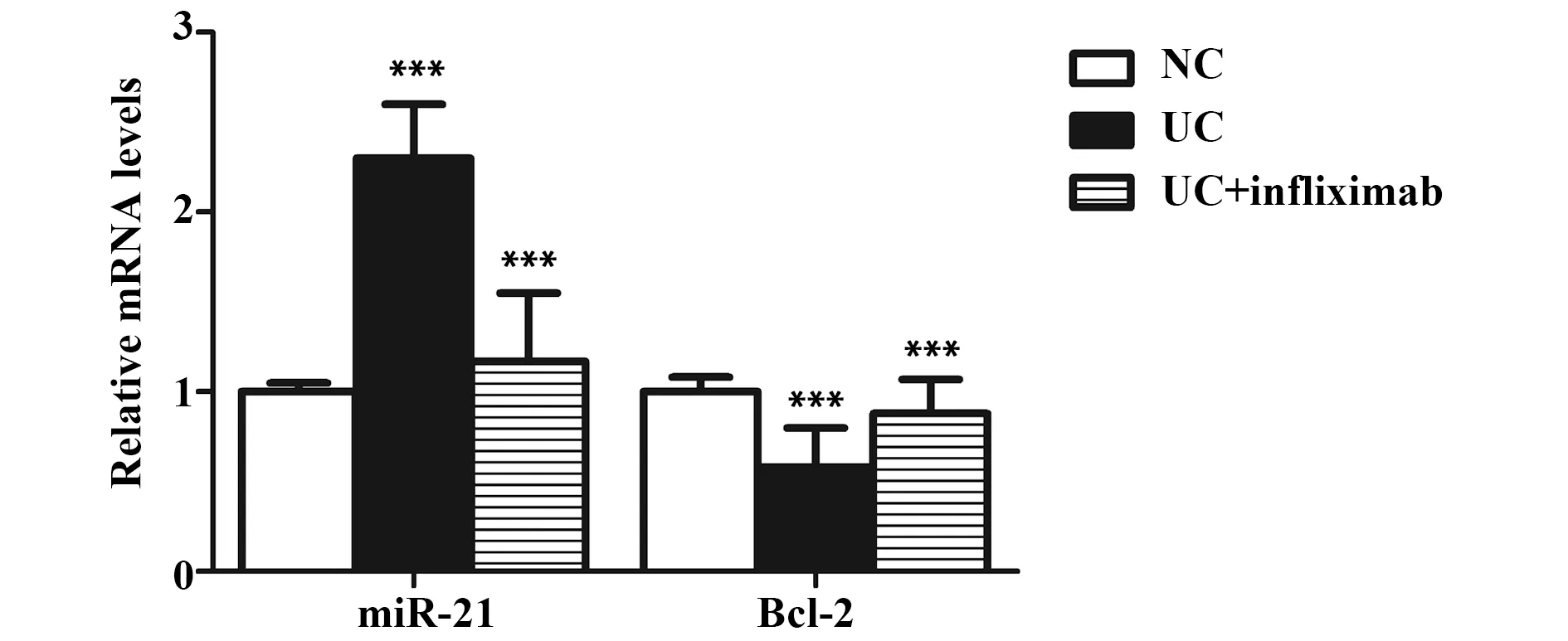
图1 正常结肠组织及溃疡性结肠炎组织中miR-21与Bcl-2的mRNA水平Fig.1 mRNA level of miR-21 and Bcl-2 in normal human colon tissues and ulcerative colitis tissuesNote: n=25,***.P<0.001 versus normal control group.
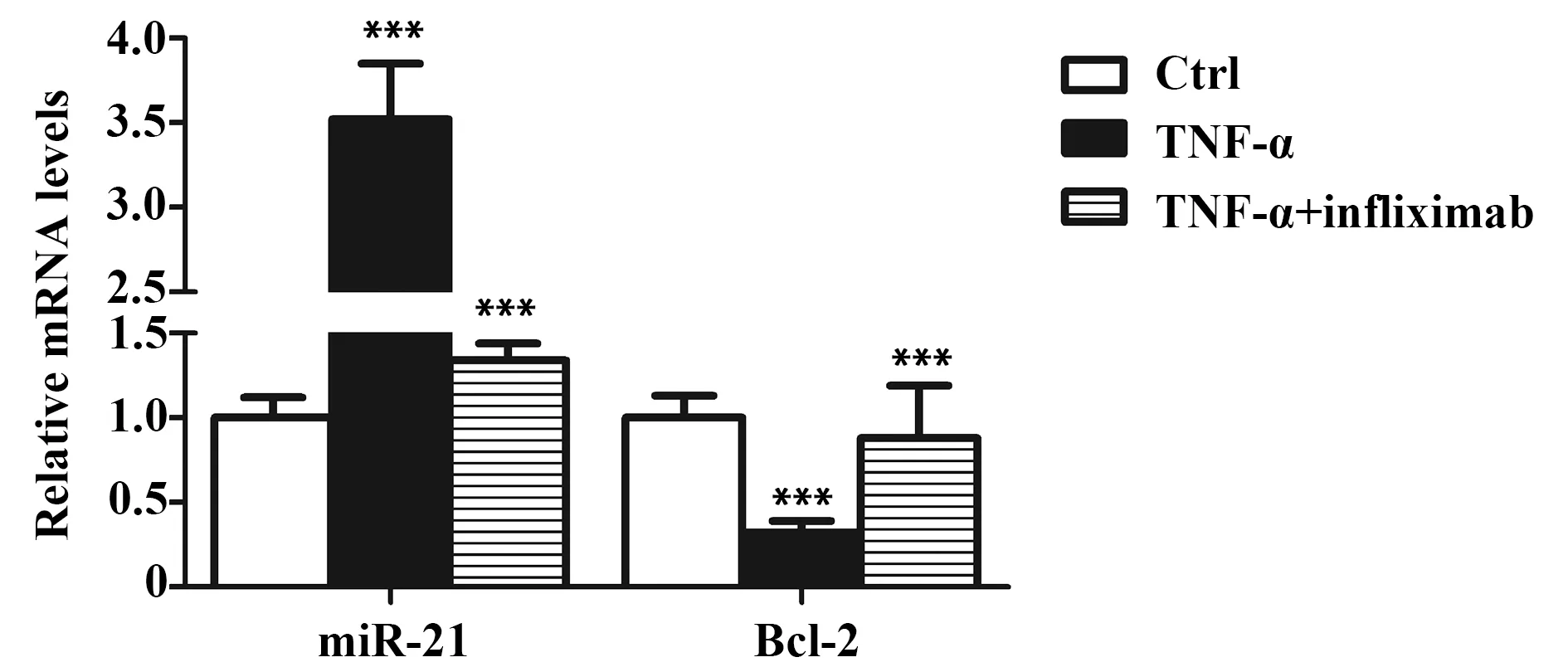
图2 TNF-α对miR-21和Bcl-2的mRNA水平的影响Fig.2 Effect of TNF-α on mRNA level of miR-21 and Bcl-2Note: n=6,***.P<0.001 versus control group.
2.5miR-21 inhibitor上调Bcl-2的表达 与HT29组比较,miR-21 inhibitor组中Bcl-2的表达显著上升(P<0.001,图5),si-Bcl-2组中Bcl-2的表达显著下降(P<0.01,图5)。同时,与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组中Bcl-2的表达显著下降(P<0.001,图5)。实验结果说明si-Bcl-2 转染成功,miR-21 inhibitor可通过抑制miR-21上调Bcl-2的表达。
2.6miR-21 inhibitor提高HT29细胞存活 对各组细胞的活力进行了测定,与HT29组比较,miR-21 inhibitor组活细胞所占百分比显著升高,si-Bcl-2组活细胞所占百分比显著降低(P<0.001,图6)。同时,与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组所占百分比显著降低(P<0.001,图6)。此外,与HT29组比较,miR-21 inhibitor组中细胞增殖相关蛋白PCNA和Ki67的表达显著增加(P<0.001,图7),si-Bcl-2组中PCNA和Ki67的表达显著减少(P<0.001,P<0.01,图7)。与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组中PCNA和Ki67的表达显著减少(P<0.001,图7)。实验结果说明miR-21 inhibitor 可通过上调Bcl-2提高HT29细胞存活并诱导细胞增殖,提示miR-21可通过下调Bcl-2降低细胞存活。
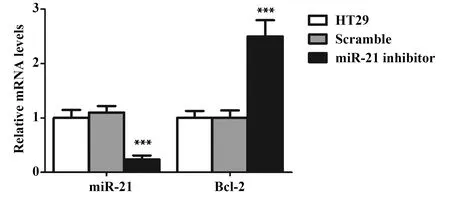
图3 miR-21 inhibitor对Bcl-2 mRNA水平的影响Fig.3 Effect of miR-21 inhibitor on mRNA level of Bcl-2Note: n=6,***.P<0.001 versus HT29 group.
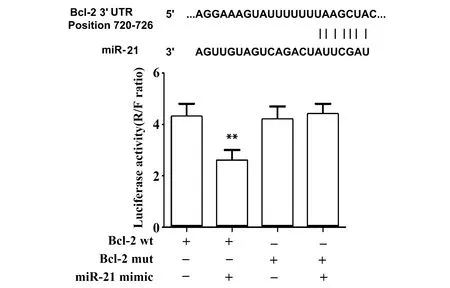
图4 miR-21与Bcl-2的靶向关系Fig.4 Targeted relationship between miR-21 and Bcl-2Note: n=6,**.P<0.01 versus Bcl-2 wt group.
2.7miR-21 inhibitor 抑制HT29细胞凋亡 与HT29组比较,miR-21 inhibitor组细胞凋亡率显著下降(P<0.001,图8),si-Bcl-2组细胞凋亡率显著上升(P<0.01,图8)。同时,与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组细胞凋亡率显著上升(P<0.001,图8)。此外,与HT29组比较,miR-21 inhibitor组细胞凋亡执行蛋白Cleaved Caspase-3和Cleaved Caspase-9的表达显著减少(P<0.001,图7),si-Bcl-2组Cleaved Caspase-3和Cleaved Caspase-9的表达显著增加(P<0.01, 图7)。同时, 与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组Cleaved Caspase-3和Cleaved Caspase-9的表达显著增加(P<0.001,图7)。实验结果说明miR-21 inhibitor 可通过上调Bcl-2抑制HT29细胞凋亡,提示miR-21可通过下调Bcl-2促进细胞凋亡。
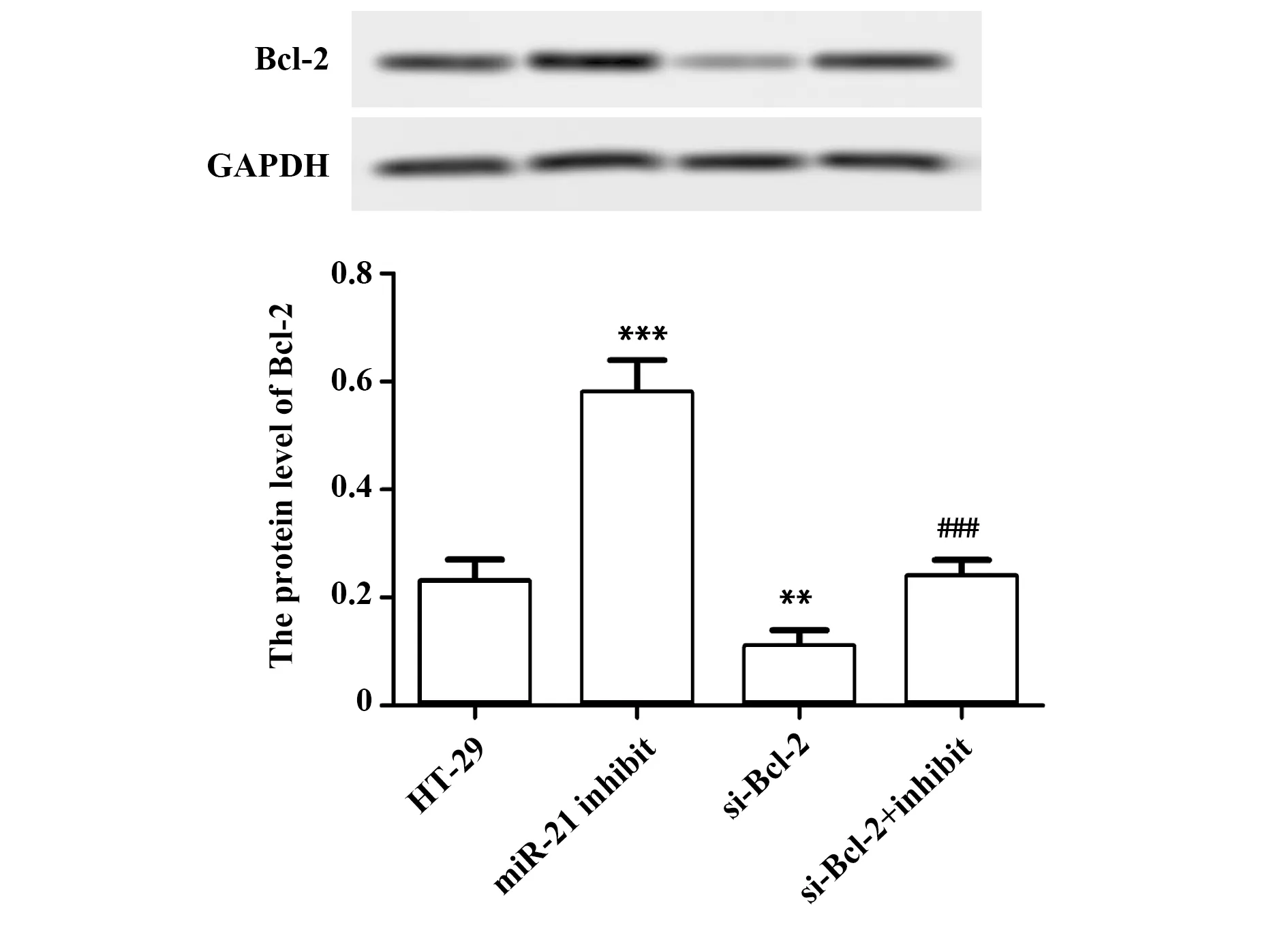
图5 miR-21 inhibitor 对Bcl-2表达的影响Fig.5 Effect of miR-21 inhibitor on expression of Bcl-2Note: n=6,**.P<0.01,***.P<0.001 versus HT29 group;###.P<0.001 versus miR-21 inhibitor group.
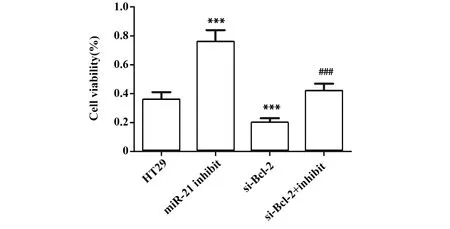
图6 miR-21 inhibitor对HT29细胞存活的影响Fig.6 Effect of miR-21 inhibitor on HT29 cell viabilityNote: n=6,***.P<0.001 versus HT29 group;###.P<0.001 versus miR-21 inhibitor group.
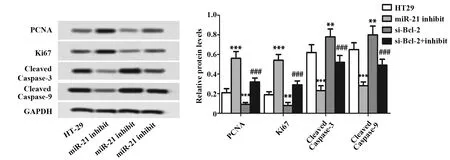
图7 miR-21 inhibitor 对HT29细胞表达PCNA、Ki67、cleaved Caspase-3和Cleaved Caspase-9蛋白的影响Fig.7 Effect of miR-21 inhibitor on expressions of PCNA,Ki67,Cleaved Caspase-3 and Cleaved Caspase-9 in HT29 cellsNote: n=6,**.P<0.01 ***.P<0.001 versus HT29 group;###.P<0.001 versus miR-21 inhibitor group.
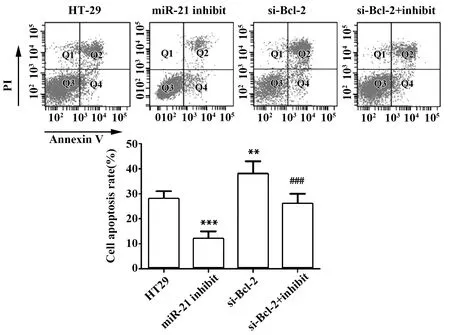
图8 miR-21 inhibitor 对HT29细胞凋亡的影响Fig.8 Effect of miR-21 inhibitor on HT29 cell apoptosisNote: n=6,**.P<0.01 ***.P<0.001 versus HT29 group;###.P<0.001 versus miR-21 inhibitor group.
2.8miR-21 inhibitor 降低HT29细胞上清中炎症细胞因子的浓度 与HT29组比较,miR-21 inhibitor组中炎症细胞因子IL-6、IL-1β、IL-8的浓度显著降低(P<0.001,图9),si-Bcl-2组中IL-6、IL-1β、IL-8的浓度显著升高(P<0.01,图9)。同时,与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组中IL-6、IL-1β、IL-8的浓度显著升高(P<0.001,图9)。实验结果说明miR-21 inhibitor 可通过上调Bcl-2抑制HT29细胞产生炎症细胞因子,不利于炎症反应的发生,提示miR-21可通过下调Bcl-2促进炎症细胞因子的产生,有助于炎症反应的发生。
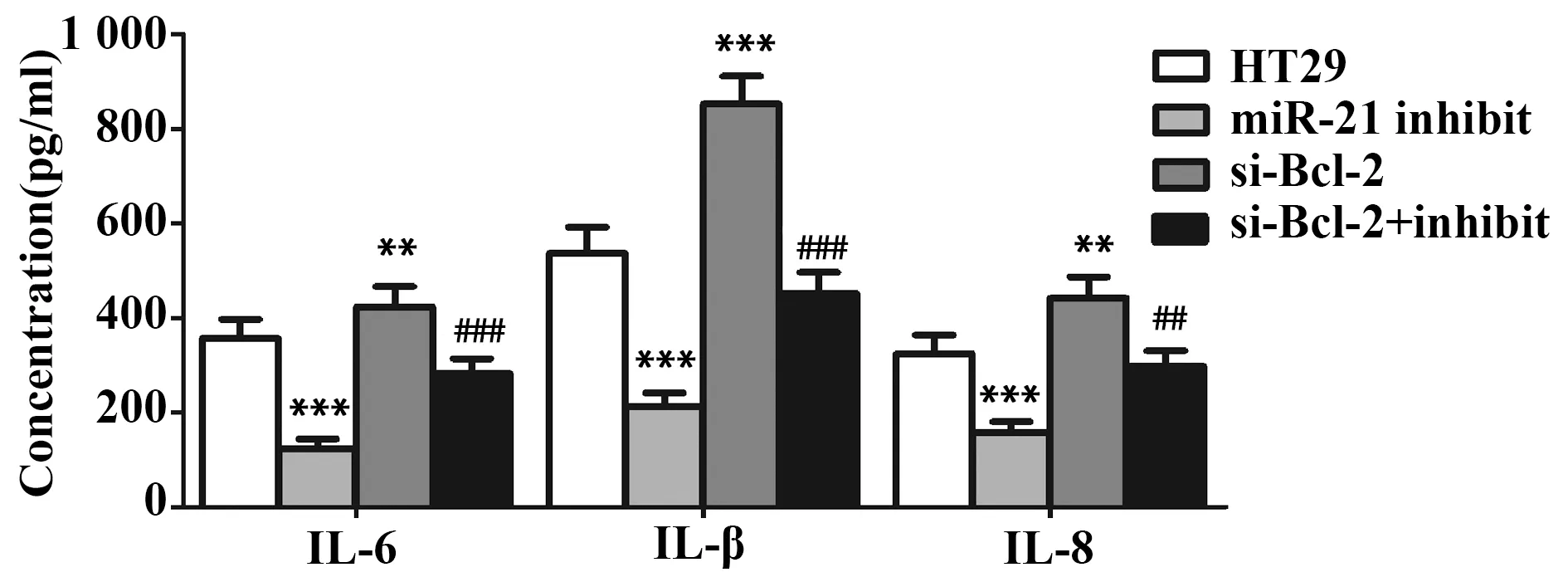
图9 miR-21 inhibitor 对HT29细胞产生IL-6、IL-1β和IL-8的影响Fig.9 Effect of miR-21 inhibitor on production of IL-6,IL-1β and IL-8 by HT29 cellsNote: n=6,**.P<0.01,***.P<0.001 versus HT29 group;##.P<0.01,###.P<0.001 versus miR-21 inhibitor group.
3 讨论
miRNA是一类调节基因表达的小型单链非编码RNA,在各种生物过程中发挥着至关重要的作用,比如细胞增殖、分化、发育和凋亡过程[9]。有研究表明,miRNA还参与炎症发生过程[10]。如miR-21在溃疡性结肠炎组织中高度表达,导致肠上皮屏障功能受损并促进炎症发生[5]。同时,miR-21在胰岛β细胞中降低抗凋亡因子Bcl-2的转录和翻译,促进细胞的凋亡。另外临床研究表明,在溃疡性结肠炎组织中肠道上皮细胞发生过度凋亡[3]。推测在溃疡性结肠炎中miR-21可能与Bcl-2存在相互作用的关系,对炎症发生起到调控作用。于是本文首先检测了miR-21与Bcl-2在正常结肠组织及溃疡性结肠炎组织、TNF-α未处理或处理的HT29细胞中的mRNA水平,发现在溃疡性结肠炎组织和TNF-α处理后的HT29细胞中miR-21 mRNA水平显著升高,Bcl-2 mRNA水平显著降低。TNF-α是一类促炎细胞因子,在炎症性肠道疾病中过度表达,并促进肠道炎症发生,抗TNF-α单克隆抗体可抑制溃疡性结肠炎肠道上皮细胞过度凋亡[11]。实验结果提示miR-21上调和Bcl-2下调可能与溃疡性结肠炎发生发展有关。
大多数情况下,miRNA往往通过介导靶基因mRNA切割、抑制mRNA翻译或影响mRNA稳定的方式对靶基因的表达进行调控,下调miRNA可降低其对靶基因的调控。已有研究表明在其他组织或细胞如胰岛β细胞中miR-21可靶向抑制Bcl-2的表达,诱导细胞凋亡[6]。然而同样有研究发现miR-21对Bcl-2表达的促进作用,如miR-21可上调Bcl-2的表达,促进心肌纤维化和心力衰竭[12]。可能是因为在不同的组织细胞中miR-21表现出了不同的作用。本文中利用miR-21 inhibitor下调miR-21的mRNA水平后,Bcl-2的mRNA水平显著升高。提示miR-21对Bcl-2有潜在的调控作用。同时,生物信息预测两者之间存在连续结合片段,通过荧光素酶报告实验进一步验证,发现miR-21 mimic可显著降低Bcl-2 wt质粒的荧光素酶活性,但对结合片段核苷酸位点突变的Bcl-2 mut质粒并没有影响。说明miR-21对Bcl-2的确有调节作用,miR-21通过靶向结合Bcl-2而抑制Bcl-2的表达。此外,与单用TNF-α处理的HT29组比较,miR-21 inhibitor组中Bcl-2的表达显著上升,si-Bcl-2组中Bcl-2的表达显著下降。而与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组中Bcl-2的表达显著下降。实验结果说明si-Bcl-2转染成功,miR-21 inhibitor可通过下调miR-21上调Bcl-2的表达,反向证明miR-21靶向下调Bcl-2。Bcl-2是一类抗凋亡蛋白,可作为癌症发生的标志蛋白[13],它可帮助辅助性T细胞17避免糖皮质激素诱导的细胞凋亡[14],并参与黏液细胞炎症反应的恢复过程[15]。
临床检测发现,溃疡性结肠炎组织中炎症细胞因子大量产生,肠道上皮细胞过度凋亡[16]。而研究表明,某些miRNA可通过调控靶蛋白抑制细胞存活并促进细胞凋亡。如在甲状腺乳头状癌细胞中,miR-21通过抑制Bcl-2的表达降低细胞存活率并提高细胞凋亡率,抑制甲状腺乳头状癌症的发生发展[17]。在肠道上皮HT29细胞中,高度表达的miR-29a靶向下调抗凋亡家族蛋白Mcl-1的表达并导致细胞凋亡率升高,有利于溃疡性结肠炎的发生发展[18]。在溃疡性结肠炎组织中,肠道上皮细胞存活率降低且凋亡水平升高,导致肠道黏膜完整性被严重破坏,肠道炎症反复发生。之前的研究报道了miR-21对溃疡性结肠炎的促进作用,然而miR-21对结肠细胞存活和凋亡的机制还未见报道[5],本研究发现,在溃疡性结肠炎组织中高度表达的miR-21靶向下调Bcl-2,于是进一步对肠道上皮HT29细胞存活和凋亡情况进行检测。发现与单用TNF-α处理的HT29组比较,miR-21 inhibitor组细胞存活率及PCNA、Ki67的表达显著上升,细胞凋亡率及Cleaved Caspase-3、Cleaved Caspase-9的表达显著降低,si-Bcl-2组细胞存活率及PCNA、Ki67的表达显著下降,细胞凋亡率及Cleaved Caspase-3、Cleaved Caspase-9的表达显著上升。同时,与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组细胞存活率及PCNA、Ki67的表达显著下降,细胞凋亡率及Cleaved Caspase-3、Cleaved Caspase-9的表达显著上升。PCNA和Ki67在细胞周期调控中发挥重要作用,可作为检测细胞活性的经典指标,其蛋白表达水平越高说明处于增殖时期的细胞越多,细胞存活能力越强[19,20]。Cleaved Caspase-3和Cleaved Caspase-9是细胞凋亡过程中的主要执行者,可视为细胞凋亡级联反应中的标志性蛋白[21,22]。实验结果说明抑制miR-21表达可提高细胞的存活,降低细胞的凋亡。提示miR-21可降低肠道上皮HT29细胞存活并提高细胞凋亡。
在溃疡性结肠炎组织中,炎症细胞因子IL-6、IL-1β和IL-8大量产生,引起肠道上皮细胞大量死亡[23,24]。IL-6可介导髓样相关蛋白9的表达,促进其将免疫细胞募集到发炎的结肠组织中[25]。IL-1β可阻碍Ca2+的释放,导致溃疡性结肠炎患者的结肠平滑肌功能障碍[26]。IL-8可结合CXC趋化因子家族的G蛋白偶联受体,启动炎症发生的级联反应[24]。临床上往往通过检测IL-6、IL-1β和IL-8水平来评判治疗方法对溃疡性结肠炎是否有效[27]。在本文中,与单用TNF-α处理的HT29组比较,miR-21 inhibitor组中IL-6、IL-1β、IL-8的表达水平显著降低,si-Bcl-2组中IL-6、IL-1β、IL-8的表达水平显著升高。同时,与miR-21 inhibitor组比较,si-Bcl-2+miR-21 inhibitor组中IL-6、IL-1β、IL-8的表达水平显著升高。实验结果说明,抑制miR-21表达可降低IL-6、IL-1β、IL-8的表达水平,阻碍炎症的发展。提示miR-21可促进IL-6、IL-1β、IL-8表达,有利于溃疡性结肠炎的发生发展。
综上所述,miR-21可靶向结合并下调Bcl-2的表达,miR-21 inhibitor下调miR-21后可上调Bcl-2的表达,提高细胞的存活,降低细胞的凋亡,减少IL-6、IL-1β、IL-8的产生,阻碍肠道上皮HT29细胞炎症的发展。提示miR-21可通过靶向下调Bcl-2,降低细胞存活,提高细胞凋亡,增加IL-6、IL-1β、IL-8的产生,促进肠道上皮HT29细胞炎症的发展。miR-21靶向下调Bcl-2促进肠道上皮HT29细胞凋亡这一机制可能参与了溃疡性结肠炎的发生发展过程,为寻找根治溃疡性结肠炎的有效方法提供新的思路。而本研究仅仅通过HT29细胞研究了miR-21与Bcl-2的靶向关系及调控作用,具有一定的局限性,后期考虑构建溃疡性结肠炎体内模型,进一步研究miR-21和Bcl-2的作用机制。
