雌激素受体β在膀胱癌中的表达及对膀胱癌细胞侵袭、迁移的影响①
2019-11-20姚佳沛徐建春
姚佳沛 徐建春 刘 炜 樊 凡
(昆明医科大学第一附属医院泌尿外二科,昆明650031)
膀胱癌为常见的恶性肿瘤之一,男性发病率高于女性,考虑男性膀胱癌发病率高除了与吸烟和职业因素有关外,性激素可能是导致男性膀胱癌发病率高的重要原因[1]。研究发现膀胱癌组织中ERβ呈高表达,其表达水平与膀胱癌的发生发展关系密切[2],如杨典东等[3]研究发现膀胱癌组织中ERβ呈高表达,且与膀胱癌的浸润性进展和分化关系密切。本文对膀胱癌中ERβ的表达水平和沉默ERβ对膀胱癌细胞侵袭、迁移的影响及机制进行研究,从细胞水平探讨ERβ在膀胱癌侵袭、转移中的作用,为膀胱癌的诊治提供依据。
1 材料与方法
1.1材料 收集我院2017年1至12月60例行膀胱癌根治术患者的膀胱癌组织标本及相应的癌旁组织标本,60例膀胱癌患者签署知情同意书,手术前未进行放化疗等治疗。人膀胱癌细胞T24和正常膀胱上皮细胞SV-HUC-1购自上海中科院细胞库。Matrigel基质胶(美国Sigma公司),DAB显色试剂盒、免疫组化试剂盒、一抗、二抗(美国Santa Cruz公司),ERβ及阴性对照siRNA(上海吉玛公司设计合成)等。ERβ siRNA-1干扰序列为5′-GCAAGCATGGAGGAGTGAC-3′,ERβ siRNA-2干扰序列为5′-GGCCTGTGAAACAGTGACC-3′,ERβ siRNA-3干扰序列为5′-GAGGCATTCTCGTCAGATG-3′,对3组ERβ siRNA序列进行预实验,选择最佳RNA组(即ERβ siRNA-3组)作为本研究的ERβ siRNA序列。阴性对照干扰序列为5′-TTCTGGCAAGGTCTCA-CGT-3′。
1.2方法
1.2.1膀胱癌及癌旁组织中ERβ表达测定 将膀胱癌组织和癌旁组织经福尔马林固定,石蜡包埋,切成4 μm厚的切片,采用SP免疫组织化学法测定膀胱癌及癌旁组织中ERβ表达(具体步骤和操作严格按照说明书进行),以鼠抗人ERβ单克隆抗体为一抗,阴性对照以磷酸盐缓冲液代替一抗,阳性对照用已知乳腺癌ERβ阳性反应片。结果判断:ERβ阳性细胞为细胞核呈淡黄色或棕黄色颗粒,每张切片选择5个高倍视野,计数100个细胞中以ERβ阳性细胞数,取平均值,每100个细胞中ERβ阳性细胞≥10个为阳性,<10个为阴性。
1.2.2膀胱癌细胞和正常膀胱上皮细胞中ERβ表达测定 提取膀胱癌细胞T24和正常膀胱上皮细胞SV-HUC-1蛋白,BCA法测定T24细胞和SV-HUC-1细胞蛋白浓度,采用Western blot法测定细胞ERβ水平。取细胞蛋白上样进行电泳、转膜、封闭,并孵育一抗及辣根过氧化物标记二抗,以GAPDH为内参,ECL显影,置于暗室中,开启红外灯,将X胶片覆盖PVDF膜条带上,1皿中取出X胶片放入显影液中10 s,清水冲洗,再放入定影液中15 s,清水冲洗、晾干,扫描仪记录保存,采用Quantity one软件测定各蛋白条带灰度值,ERβ相对表达量=ERβ条带灰度值/GAPDH条带灰度值。
1.2.3ERβ siRNA逆转录病毒载体构建、鉴定、包装 将互补的ERβ siRNA序列、退火Buffer混合,90℃水浴4 min,冷却至室温。用连接酶将pRNAT-H1.4/Retro和退火产物进行连接,连接产物转化至感受态细菌JM109,筛选重组质粒,扩大培养,抽提并纯化质粒,测序重组质粒(华大基因科技公司)证实ERβ siRNA已正确插入逆转录病毒重组质粒(pRNAT-H1.4/Retro)。将重组质粒、PVSV-G载体和DMEM混匀孵育5 min,加入Lipofectamine 2000孵育20 min,然后转移至293包装细胞中培养8 h,更换培养液再培养48 h。荧光显微镜下观察GFP荧光表达证实逆转录病毒重组质粒高效、成功转染到293包装细胞中。
1.2.4T24细胞分组及转染 将T24细胞分为空白对照组、阴性对照组和si-ERβ组,将各组生长良好且达80%以上融合的细胞进行细胞铺板,准备转染。细胞转染前将培养皿中的细胞消化后铺在6孔板中,在24 h内进行细胞转染,转染前1 h更换无抗体培养基,按照Lipofectamine 2000说明书步骤进行细胞转染;空白对照组细胞不转染,阴性对照组细胞转染阴性对照siRNA,si-ERβ组细胞转染ERβ siRNA。转染后利用倒置荧光显微镜观察,发现siRNA转染组细胞中大部分可见明显的绿色荧光,证实已成功转染。流式细胞仪检测发现阴性对照siRNA和ERβ siRNA转染的细胞GFP荧光表达效率分别为72.13%、72.46%。显微镜下观察各组细胞形态变化。
1.2.5转染后各组细胞ERβ和N-cadherin、Vimen-tin、MMP9蛋白水平测定 取各组转染24 h后T24细胞,加入蛋白裂解液裂解细胞,采用Western blot法测定各组细胞ERβ和N-cadherin、Vimentin、MMP9蛋白水平,具体方法同1.2.2。
1.2.6转染后各组细胞侵袭、迁移能力测定 采用细胞划痕实验和Transwell小室测定各组T24细胞侵袭、迁移能力。细胞划痕实验:将各组转染24 h细胞接种到6孔板中(4×105个/孔),用200 μl枪头划痕,PBS冲洗3次,用含丙酮酸钠和胎牛血清的培养基培养,划痕0 h和24 h对划痕进行拍照观察。Transwell小室测定侵袭能力:将转染24 h后各组细胞用胰蛋白酶消化,终止消化后弃去培养液,用无血清培养基重悬,将细胞密度调整为5×105ml-1。取Matrigel稀释液包被Transwell小室底部膜上室面,使Matrigel聚合成凝胶,取细胞悬液加入Transwell小室,下室加入含FBS的培养基,在培养箱中培养48 h,取出Transwell小室,弃去培养液,甲醇固定,结晶紫染色,棉签擦掉未侵袭细胞,高倍显微镜下观察侵袭细胞数。Transwell小室测定迁移能力:Transwell小室不用Matrigel包被,其他步骤同细胞侵袭实验。结晶紫可将细胞核染成蓝色,显微镜下观察到的蓝色为结晶紫染色的穿膜细胞。

2 结果
2.1ERβ在膀胱癌和癌旁组织中的表达 ERβ阳性细胞呈淡黄色或棕黄色颗粒,位于细胞核中,膀胱癌组织中ERβ阳性率明显高于癌旁组织(P<0.05)。见表1和图1。
2.2ERβ在膀胱癌细胞和正常膀胱上皮细胞中的表达 膀胱癌细胞T24中ERβ相对表达量(0.43±0.08)高于正常膀胱上皮细胞SV-HUC-1(0.11±0.02)(t=10.976,P<0.001)。见图2、3。
2.3siRNA干扰对T24细胞中ERβ水平的影响
表1 膀胱癌和癌旁组织中ERβ阳性率比较
Tab.1 Positive rate comparison of ERβ between bladder cancer tissues and adjacent tissues
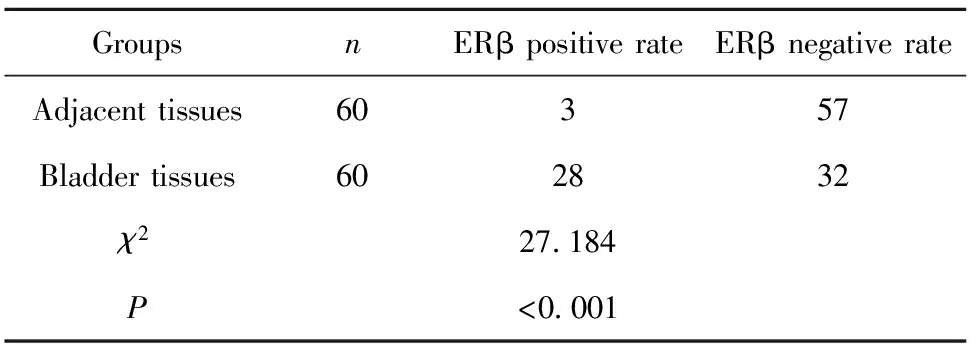
GroupsnERβ positive rateERβ negative rateAdjacent tissues60357Bladder tissues602832χ227.184P<0.001
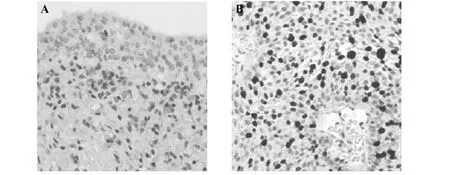
图1 膀胱癌和癌旁组织中ERβ免疫组化染色(×200)Fig.1 Immunohistochemistry stain of ERβ in bladder cancer and adjacent tissues(×200)Note: A.Bladder tissue;B.Adjacent tissues.
与空白对照组(0.38±0.07)和阴性对照组(0.39±0.06)比较,si-ERβ组T24细胞中ERβ相对表达量(0.08±0.01)降低(t=12.001、14.415,P<0.001),空白对照组和阴性对照组T24细胞中ERβ相对表达量比较差异无统计学意义(t=0.307,P=0.763)。见图4、5。
2.4沉默ERβ对T24细胞侵袭、迁移的影响 划痕实验:与空白对照组[(59.43±2.64)mm]和阴性对照组[(60.74±2.57)mm]比较,si-ERβ组T24细胞0~24 h二维迁移距离[(25.75±1.83)mm]短(t=29.656、31.369,P<0.001),空白对照组和阴性对照组T24细胞0~24 h二维迁移距离比较差异无统计学意义(t=1.006,P=0.330)。见图6。
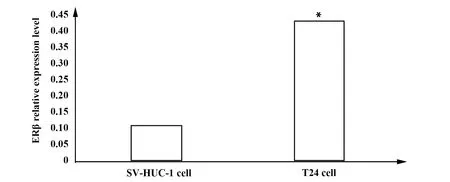
图2 膀胱癌细胞T24和正常膀胱上皮细胞SV-HUC-1中ERβ表达水平比较Fig.2 Comparison of ERβ expression levels between bladder cancer cell line T24 and normal bladder epithelial cells SV-HUC-1Note: Comparison on two groups,*.P<0.05.
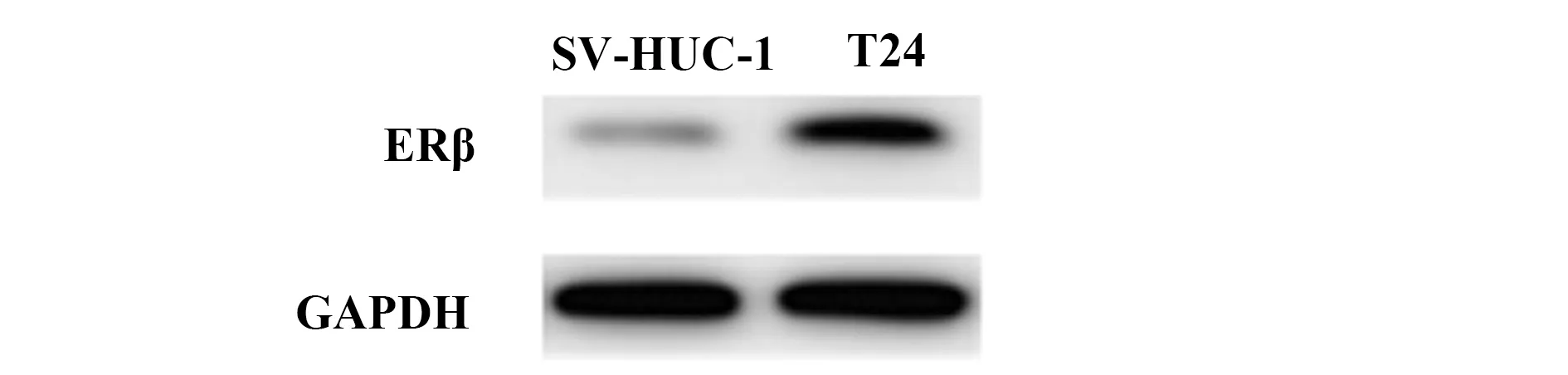
图3 膀胱癌细胞T24和正常膀胱上皮细胞SV-HUC-1中ERβ的Western blot电泳图Fig.3 Western blot results of ERβ between bladder cancer cell line T24 and normal bladder epithelial cells SV-HUC-1

图4 三组T24细胞中ERβ水平比较Fig.4 ERβ expression levels of cell line T24 in three groupsNote: Compared with blank control group,*.P<0.05;compared with negative control group,#.P<0.05.
与空白对照组和阴性对照组比较,si-ERβ组T24细胞侵袭和迁移能力降低(t=13.814、13.415、14.011、14.316,P<0.001),空白对照组和阴性对照组T24细胞侵袭和迁移能力比较差异无统计学意义(t=0.157、0.109;P=0.877、0.915)。见表2和图7。

图5 三组T24细胞中ERβ的Western blot电泳图Fig.5 Western blot results of ERβ in cell line T24 in three groupsNote: A.Blank control group;B.Negative control group;C.si-ERβ group.
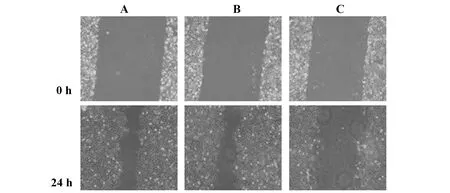
图6 三组T24细胞划痕实验(×25)Fig.6 Transwell chamber trail on cell line T24 in three groups (×25)Note: A.Blank control group;B.Negative control group;C.si-ERβ group.
表2 三组T24细胞侵袭迁移细胞数比较
Tab.2 Cell amount comparsion of migration cell line T24 in three groups
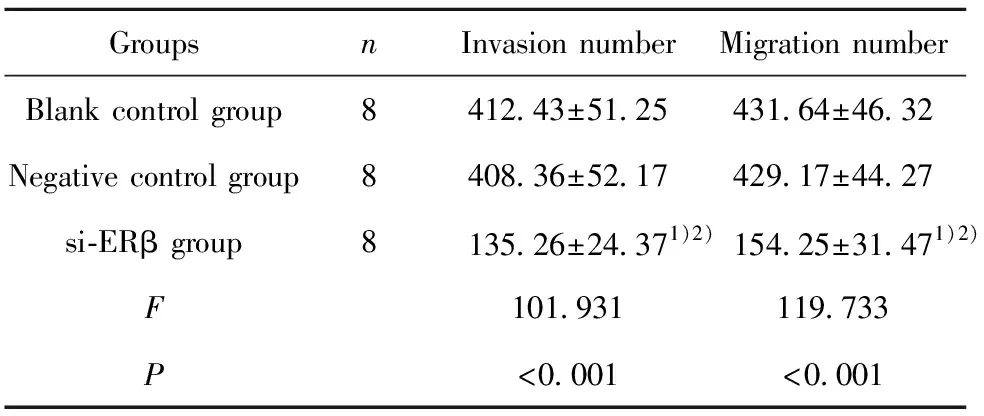
GroupsnInvasion numberMigration numberBlank control group8412.43±51.25431.64±46.32Negative control group8408.36±52.17429.17±44.27si-ERβ group8135.26±24.371)2)154.25±31.471)2)F101.931119.733P<0.001<0.001
Note:Compared with blank control group,1)P<0.05;compared with negative control group,2)P<0.05.
2.5沉默ERβ对T24细胞形态变化的影响 空白对照组和阴性对照组呈细长的梭形样间充质细胞,si-ERβ组细胞呈紧凑的多边形,类似上皮样细胞特征。见图8。
2.6沉默ERβ对T24细胞中N-cadherin、Vimentin、MMP9蛋白水平的影响 与空白对照组和阴性对照组比较,si-ERβ组T24细胞中N-cadherin、Vimentin、MMP9蛋白水平降低(t=11.024、12.652;9.435、8.050、11.094、11.063,P<0.05),空白对照组和阴性对照组T24细胞中N-cadherin、Vimentin、MMP9蛋白水平比较差异无统计学意义(t=0.166、0.352、0.551,P=0.870、0.730、0.590)。见表3和图9。
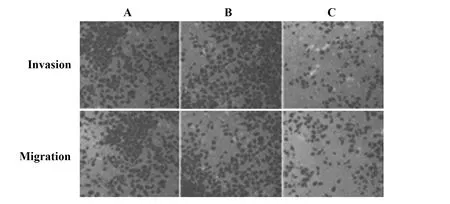
图7 三组T24细胞侵袭迁移能力(×200)Fig.7 Invasion and migration ability of cell line T24 in three groups(×200)Note: A.Blank control group;B.Negative control group;C.si-ERβ group.
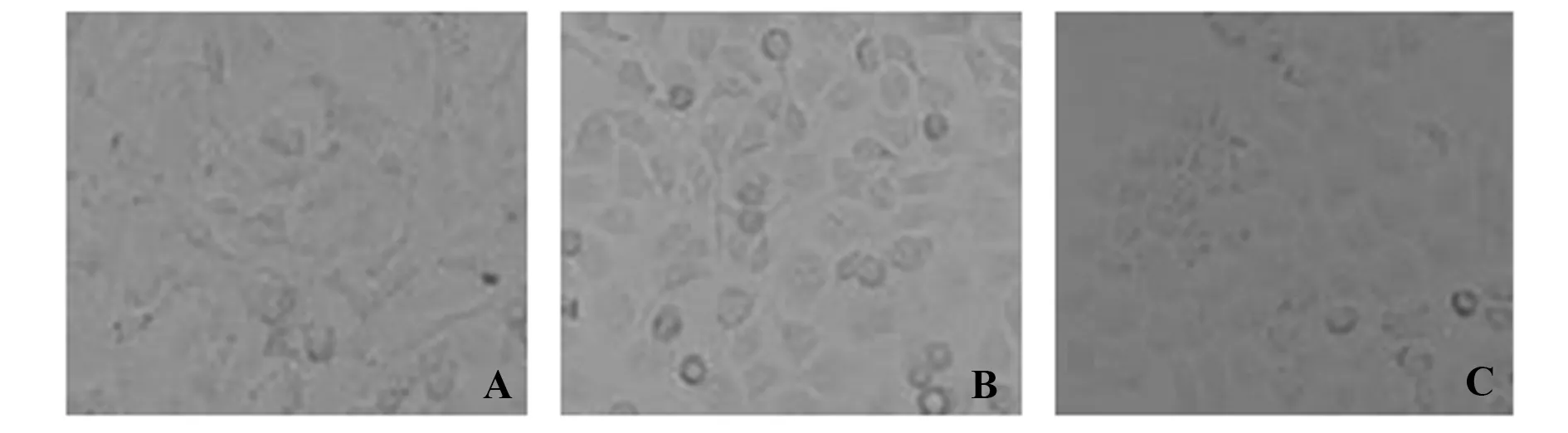
图8 三组T24细胞形态学变化(×400)Fig.8 Change on cell line T24 morphology in three groups (×400)Note: A.Blank control group;B.Negative control group;C.si-ERβ group.
表3 三组T24细胞中N-cadherin、Vimentin、MMP9蛋白水平比较
Tab.3 Expression levels of protein N-cadherin,Vimentin and MMP9 in cell line T24 of three groups
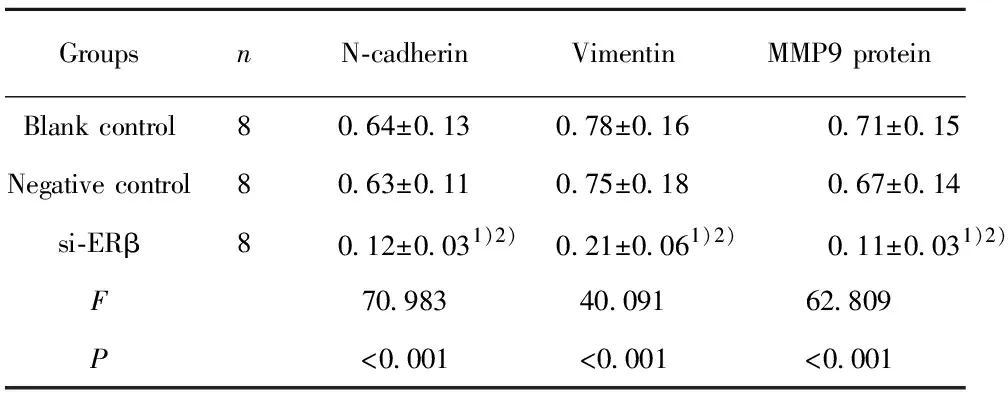
GroupsnN-cadherinVimentinMMP9 proteinBlank control80.64±0.130.78±0.160.71±0.15Negative control80.63±0.110.75±0.180.67±0.14si-ERβ80.12±0.031)2)0.21±0.061)2)0.11±0.031)2)F70.98340.09162.809P<0.001<0.001<0.001
Note:Compared with blank control group,1)P<0.05;compared with negative control group,2)P<0.05.
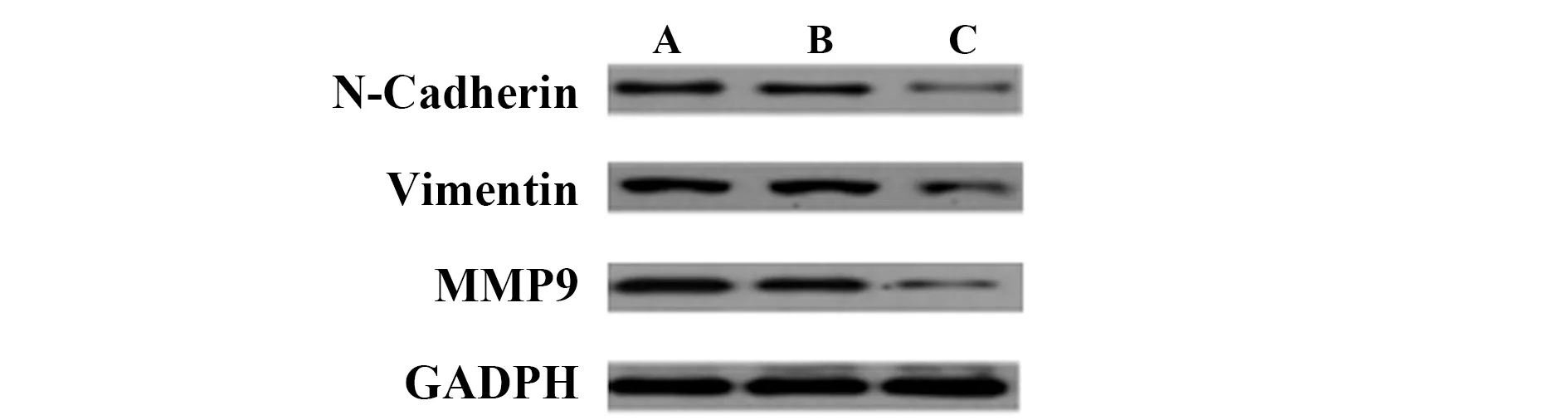
图9 三组T24细胞中N-cadherin、Vimentin、MMP9蛋白Western blot电泳图Fig.9 Western bolt results of protein N-cadherin,Vimentin and MMP9 in cell line T24 of three groupsNote: A.Blank control group;B.Negative control group;C,si-ERβ group.
3 讨论
我国膀胱癌的发病率逐年升高,是泌尿系统常见的恶性肿瘤,对人们的健康造成严重威胁,男性膀胱癌的发病率高于女性,其原因可能与性激素及其受体有关[4],研究发现ER信号途径与膀胱癌的发生发展关系密切[5],ER是核受体超家族成员,是有配体激活的转录因子;ER包括ERα和ERβ两种亚型,ERα在膀胱癌组织中表达降低,ERβ在膀胱癌组织中呈高表达[6,7],因此ERβ在膀胱癌发生发展中的作用受到广大学者的关注,如Nguyen等[8]研究发现ERβ在膀胱癌组织中表达上调,其表达水平与膀胱癌的浸润关系密切;Tan等[9]研究发现ERβ在膀胱癌中高表达,ERβ可作为膀胱癌预后标志物,并有可能成为膀胱癌的治疗靶标;Han等[10]研究发现ERβ是非肌层浸润性膀胱癌的预后标志物,其可抑制钙黏蛋白转换,并可能成为膀胱癌治疗的潜在靶点;Hsu等[11]发现通过ERβ敲除或拮抗剂抑制ERβ信号传导可防止膀胱癌发展。本研究结果发现ERβ在膀胱癌组织及膀胱癌细胞中均呈高表达,和上述研究结果一致,表明ERβ可能参与膀胱癌的发生发展过程。
上皮间质转化(Epithelial mesenchymal transition,EMT)在肿瘤的发生发展过程中可使上皮肿瘤细胞失去极性,降解细胞和细胞之间的紧密连接结构,使肿瘤细胞骨架发生重组,并获得间质细胞特性,具有间质细胞特性的细胞可引起肿瘤细胞穿过组织基底膜,转移播散到远处器官,促进肿瘤的转移[12-14]。EMT可以引起细胞侵袭、迁移等一系列肿瘤学行为[15],MMP9为MMP家族成员,可以降解细胞基底膜和细胞外基质,诱导细胞转移,在肿瘤中上调MMP9表达可增强细胞的侵袭、迁移能力[16,17]。RNA干扰技术可以特异性关闭或剔除特定基因的表达,在恶性肿瘤的治疗领域被广泛应用,本文通过RNA干扰技术沉默膀胱癌细胞中ERβ水平,观察其对膀胱癌细胞形态、侵袭、迁移和N-cadherin、Vimentin、MMP9蛋白水平的影响,发现RNA可干扰膀胱癌细胞由细长的梭形样向紧凑的多边形转化,可降低膀胱癌细胞中ERβ水平,沉默ERβ可抑制膀胱癌细胞侵袭、迁移,降低膀胱癌细胞中N-cadherin、Vimentin、MMP9蛋白水平。细长的梭形样为间充质细胞特征形态,紧凑的多边形为类似上皮样细胞特征形态,N-cadherin、Vimentin为EMT过程中的间质标志物,N-cadherin、Vimentin水平下降表明EMT过程受到抑制[18,19]。由此分析沉默ERβ水平可能通过抑制EMT过程抑制膀胱癌细胞的侵袭、迁移。
综上所述,膀胱癌组织中ERβ呈高表达,沉默ERβ水平可抑制膀胱癌的侵袭、迁移,其机制可能与ERβ抑制EMT过程有关。ERβ有望成为治疗膀胱癌的潜在靶点。
