通过两种糖多孢菌属菌株原生质体融合提高多杀菌素产量研究
2019-11-01易卓夏立秋丁学知胡胜标罗玉双王海龙唐滢黄鑫
易卓 夏立秋 丁学知 胡胜标 罗玉双 王海龙 唐滢 黄鑫
(1 湖南师范大学生命科学学院 微生物分子生物学湖南省重点实验室/省部共建淡水鱼类发育生物学国家重点实验室,长沙 410081;2 益阳广播电视大学 开放教育学院,益阳 413000)
多杀菌素类化合物(spinosyns)是由土壤放线菌刺糖多孢菌(Saccharopolyspora spinosa)经有氧发酵后产生的胞内次级代谢产物[1],是一种新型的极具前景的绿色广谱生物杀虫剂。其主要活性成分为spinosyn A和spinosyn D,其中A组分约占85%~90%,D组分约占10%~15%,因此被命名为spinosad,中文名为多杀菌素[2-3]。与一般杀虫剂相比,多杀菌素具有见效快,无副作用,选择性强,半衰期短,易降解,产生抗性的可能性低,兼有化学农药的速效性和生物农药的安全性。当其浓度为1mg/L时能保护谷物至少4个月[4],可用于防治蔬菜、水果等农作物害虫[5],因此已经在许多作物上有所应用[6]。多杀菌素属于大环内酯类化合物,由一个四环结构骨架外加连结的两个不同的六碳糖组成。两个六碳糖中一个是福乐糖,另一个是鼠李糖[7](图1)。自从Boeck等[8]首次从S.spinosaNRRL-18395培养物中分离出了多杀菌素组分A~E、F、H、J和spinosad A假糖苷配基以来,已经分离到20多种多杀菌素类化合物(spinosyns A-Y),并且它们的结构都已得到阐明。在所有天然多杀菌素分离提取物中,两个最高活性组分是 spinosyn A和D,其差别在于聚酮骨架C6上取代基是甲基还是氢。
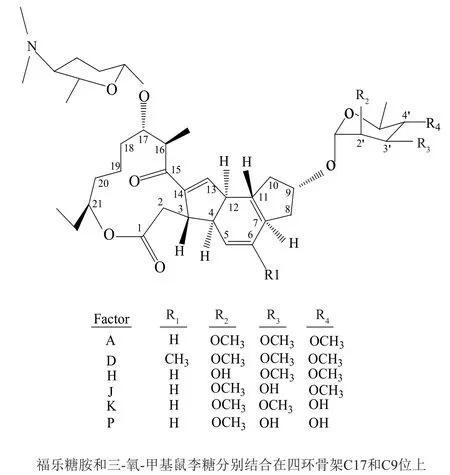
图1 多杀菌素类化合物的分子结构[7]Fig.1 Structure of spinosyns
目前对刺糖多孢菌进行遗传改良主要是从两方面入手:一是理化诱变与筛选。常规理化诱变育种是提高多杀菌素产量的有效方法,应用普遍,但该方法有着工作量大及不能定向等缺点[9-12]。二是定向的基因改造。增加编码限速酶基因的拷贝数或者修饰调节基因可能提高多杀菌素产量。在刺糖多孢菌中,鼠李糖的合成既用于细胞壁的合成,也用于产生多杀菌素。而在多杀菌素的两个糖基鼠李糖和福乐糖胺的生物合成过程中,前期两个步骤又是共同的。Madduri等[13]将同时带有限速酶基因gtt、gdh和kre的质粒整合到S.spinosa染色体中,发现重组菌株的多杀菌素产量是原始菌的3倍。Pan等[14]通过使gtt、gdh基因分别在强启动子PermE*控制之下,并整合到S.spinosa染色体中,使多杀菌素产量提高3倍多,达到800μg/mL。Tang等[15]通过Red/ET同源重组技术直接克隆了参与转化环形聚酮化合物到多杀菌素的约18kb基因簇,同样使多杀菌素产量提高近3倍。肖洁等[16]使调节基因gln A在强启动子PermE*控制之下,并整合到S.spinosa染色体中,使多杀菌素产量相比原始菌株提高到170%。定向的基因改造相比于理化诱变与筛选方法虽有周期短、工作量小的优点,但局限于对菌株代谢调控的结构基因和调节基因进行操作,且刺糖多孢菌的限制修饰系统使得外源质体转入胞内的效率低下[17-18]。
原生质体融合是工业上微生物育种中定向选育优势菌株的最有效方法之一,应用广泛。不同菌株的优势基因在原生质体融合之后能够发生重组,这样有着优良性状的融合菌株可能获得。该方法能够绕过一些障碍,如对菌体基因组信息不了解、代谢调控所知甚少、遗传修饰系统不成熟等情况,直接达到育种目的。近年来,该方法已成功地应用于在天蓝色链霉菌上发现新的中间产物及具有优良特性的杂合抗生素[19]、大范围提升代谢物产量[20-21]、改进乳酸杆菌酸抗性[22-23]、提升鞘氨醇杆菌(Sphingobium chlorophenolicum)对五氯苯酚抗性[24]和增加链霉菌对(2S,3R)-柠檬酸的抗性[25]。最近,对刺糖多孢菌进行原生质体融合操作也有所报道。Jin等[26]首先通过亚硝基胍和紫外线辐射复合诱变得到一株多杀菌素产量提高78.43%的突变株UN-90,然后将UN-90进行4轮原生质体融合处理,得到了一株高产菌株刺糖多孢菌4-7,其产量比UN-90和原始菌株分别提高了200.55%和436.27%。Wang等[27]分别制备野生型刺糖多孢菌和阿维链霉菌的原生质体,然后对其进行紫外辐射处理,将两者原生质体融合,得到两株高产菌株F17和F70,其多杀菌素产量较原始菌株分别提高了447.22%和409.21%。F17与刺糖多孢菌有相似的形态及产多杀菌素性质,并且对发酵条件有较强的耐受性。此外,F17还具有利用淀粉作为发酵唯一碳源的特性,该特性是母本菌阿维链霉菌所具有的。
野生型刺糖多孢菌产多杀菌素的生长发酵周期长达2~3周,并且产量低下,使得该种杀虫剂生产成本极高,严重限制了该种杀虫剂的生产和农田大面积的应用。因此,提高刺糖多孢菌产多杀菌素的能力成为一个迫切需要解决的问题。
红霉素是由放线菌红色糖多孢菌(Saccharopolyspora erythraea)经有氧发酵后产生的一类对病原性革兰阳性菌具有广谱活性的抗生素[28],属胞内次级代谢产物。其主要成分为红霉素A,由一个特征性的14元内酯大环外加连接着的两个脱氧糖基mycarose和desosamine组成。刺糖多孢菌和红色糖多孢菌同属于糖多孢菌属菌株,亲缘关系较近。红霉素和多杀菌素生物合成酶同属于I型聚酮合酶,合成途径相似。两种抗生素的生物合成不仅具有共同的合成底物丙酸,而且在两个脱氧糖基合成步骤上,同样具有相似性。本研究尝试通过将刺糖多孢菌和红色糖多孢菌做原生质体融合来筛选高产多杀菌素的融合菌株。
1 材料与方法
1.1 菌种和质粒
本研究中所使用的菌株和质粒,如表1所示。
1.2 抗生素、培养基
大肠埃希菌培养基为LB[29],阿泊拉霉素使用终浓度为50mg/L,氯霉素为25mg/L,卡那霉素为50mg/L,萘啶酮酸为25mg/L。种子活化培养基TSB、产色素固体培养基YMG、大肠埃希菌-红色糖多孢菌接合转移培养基MS和接合子转接培养基BHI按Kieser等[30]方法配置。再生平板培养基(g/L)[26]:蔗糖100,葡萄糖10,酵母提取物5,蛋白胨0.1,MgCl2·H2O 10,KH2PO40.25,CaCl2·2H2O 3,微量元素溶液2mL,TES缓冲液(5.73%,pH7.2)20mL,琼脂20,pH值在高压蒸汽灭菌前调节到6.5。发酵培养基(g/L):葡萄糖120,棉籽粉32,酵母粉1,豆饼粉6,玉米浆8,碳酸钙4,pH7.0。
1.3 主要试剂和仪器
限制性内切酶、连接酶、高保真酶及LATaq酶、DNA分子量标准均为TaKaRa公司产品;PCR仪-5415R为Eppendorf公司产品;电转化仪GenepulserTM为Bio-Rad公司产品;凝胶成像系统为美国Kodak公司产品。
1.4 DNA的提取和转化
大肠埃希菌感受态细胞制备和质粒DNA提取、转化等常规DNA操作参照文献[29],红色糖多孢菌基因组DNA提取及大肠埃希菌-红色糖多孢菌属间接合转移操作参照文献[30]。
1.5 PCR 扩增
根据已知红色糖多孢菌全基因组序列(AccessionNo.NC_009142),设计引物F1(TTAGAATTCATCG CGCGCTGGCTCGCC,加粗表示EcoRI位点)和R1(CGCAAGCTTCATGCCGACGATCGCGAT,加粗表示HindIII位点),以红色糖多孢菌全基因组为模板扩增eryAI基因内部1.1kb DNA同源片段。PCR反应条件:30μL反应体系,94℃ 2min;94℃ 30s,62℃30s,72℃ 1min,30 个循环;72℃ 10min。

表1 菌株和质粒Tab.1 Strains and plasmids
1.6 原生质体融合及融合菌株的筛选
原生质体融合参照Jin等[26,30]的方法。将100μL刺糖多孢菌菌液和100μL重组红色糖多孢菌菌液接种于相应的20mL TSB中,摇瓶30℃活化培养48h,然后两种菌液分别按2mL接种量标准转接入相应的含0.2%甘氨酸的20mL TSB中同样条件下摇瓶培养48h。在培养之后,两种菌液细胞分别通过离心(4000g,10min,4℃)收获,用10mL原生质体缓冲液洗2次,然后用溶菌酶处理2h。通过相差显微镜观察到原生质体形成后,将两种溶液混合,去除溶菌酶(4000g,10min,4℃)。两种原生质体在10mL含有50% PEG1000的原生质体缓冲液中融合5min。然后用20mL原生质体缓冲液洗原生质体2次,离心收集。稀释后的100μL原生质体悬浮液涂布到再生平板培养基上培养。16~20h后涂布终浓度为50mg/L的阿泊拉霉素,平板胶带封住,倒置继续培养10~12d。
经过10~12d培养后,随机挑取再生平板培养基上80个单菌落连续在再生平板培养基和YMG平板培养基(含有50mg/L的阿泊拉霉素)上分别转接培养1次,然后摇瓶发酵培养,HPLC检测分析多杀菌素产量。
1.7 摇瓶培养
摇瓶种子液培养:培养温度3 0℃,装量20mL/250mL三角瓶,摇床转速220r/min,培养时间48h;摇瓶发酵培养:培养温度30℃,装量20mL/300mL三角瓶,摇床转速240r/min,培养时间10d。
1.8 多杀菌素和红霉素高效液相色谱(HPLC)检测分析
多杀菌素:丙酮与发酵液1:1体积比例混合,30℃浸提8~10h获得多杀菌素抽提物,经AKTA purifier10高效液相色谱仪纯化分析。色谱柱为AQ12S05-1546WT(150mm×4.6mm I.D.S-5μm,12nm)。流动相:甲醇/乙腈/2%醋酸铵(V/V/V)= 45/45/10,流速1.5mL/min,紫外检测波长250nm。根据标准曲线Y=1.1956476+0.22728109X(X:多杀含量,mg/L;Y:峰值,mAU/mL;相关系数:0.9992),计算多杀菌素含量。
红霉素:与多杀菌素检测方法类似,紫外检测波长210nm。
1.9 质谱分析融合菌发酵所产多杀菌素组分
融合菌株发酵液中的多杀菌素组分采用HPLCMS仪进行分析。样品用包含有0.1%甲酸的甲醇洗脱,梯度洗脱过程为甲醇含量从50%变为80%,时间为18min。收集(m/z)范围为300.00~2000.00的数据。
2 结果与分析
2.1 红色糖多孢菌产红霉素阻断表达载体的构建
以红色糖多孢菌NRRL 2338的全基因组为模板,采用引物L1和R1扩增红色糖多孢菌产红霉素基因簇中的eryAI基因内部的1.1kb序列,得到1100bp的目的片段(图2)。将PCR片段用EcoRI和HindIII双酶切后与载体pOJ260连接,转化大肠埃希菌GB2005得到重组质粒pOJ260D。构建的整合型载体pOJ260D(图3)含有1.1kb的同源臂、阿泊拉霉素抗性基因aac3(Ⅳ)、接合转移起始位点oriT。
2.2 载体pOJ260D在大肠埃希菌与红色糖多孢菌间接合转移及在染色体上的整合
将构建好的质粒pOJ260D转化大肠埃希菌ET12567(pUZ8002),得到的大肠埃希菌ET12567(pUZ8002,pOJ260D)作为供体菌与红色糖多孢菌NRRL 2338接合,得到的接合子在含有阿泊拉霉素的BHI平板上传代生长2次。挑取转化子并提取基因组DNA,用阿泊拉霉素抗性基因特异引物进行PCR扩增验证,出现约750bp目的条带(图4)。将该转化子命名为红色糖多孢菌D。

图2 红色糖多孢菌eryAI基因内部序列的PCR扩增产物的凝胶电泳Fig.2 Agrose gel eletrophoresis of PCR products of eryAI gene internal sequence of S.erythraea
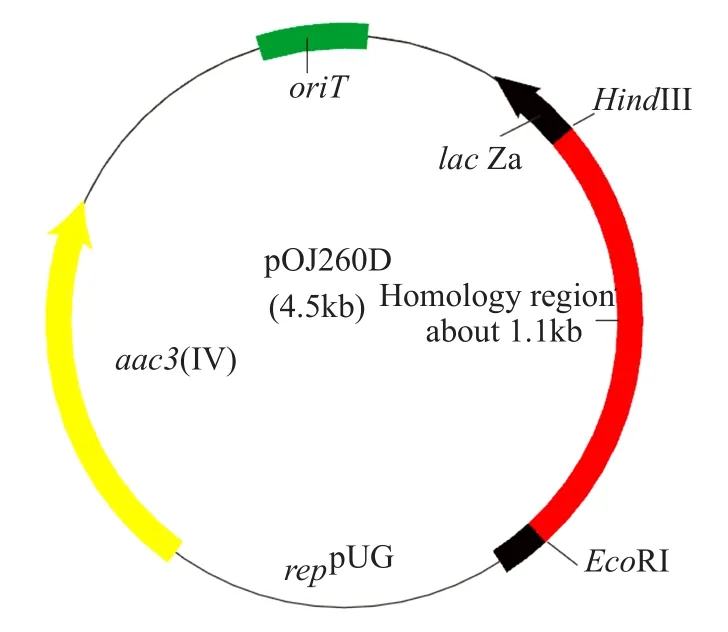
图3 载体pOJ260D图谱Fig.3 Map of vector pOJ260D
2.3 红色糖多孢菌D特征分析
构建的红色糖多孢菌D在原生质体再生平板培养基上产生的菌落褶皱较野生型红色糖多孢菌NRRL 2338少,且产色素的量增加(图5)。将两种菌株分别发酵培养,取发酵液HPLC检测分析,发现红色糖多孢菌D不产红霉素(图6)。
2.4 原生质体融合及融合菌株的筛选
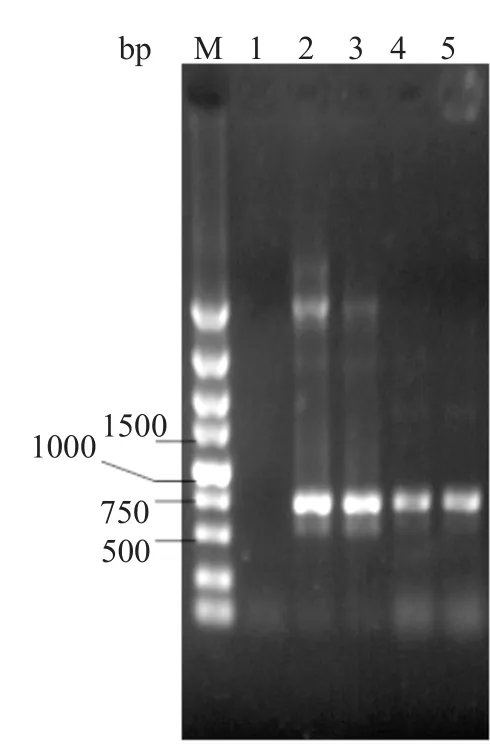
图4 重组菌株红色糖多孢菌D的PCR检测Fig.4 PCR confirmation of recobinants S.erythraea D
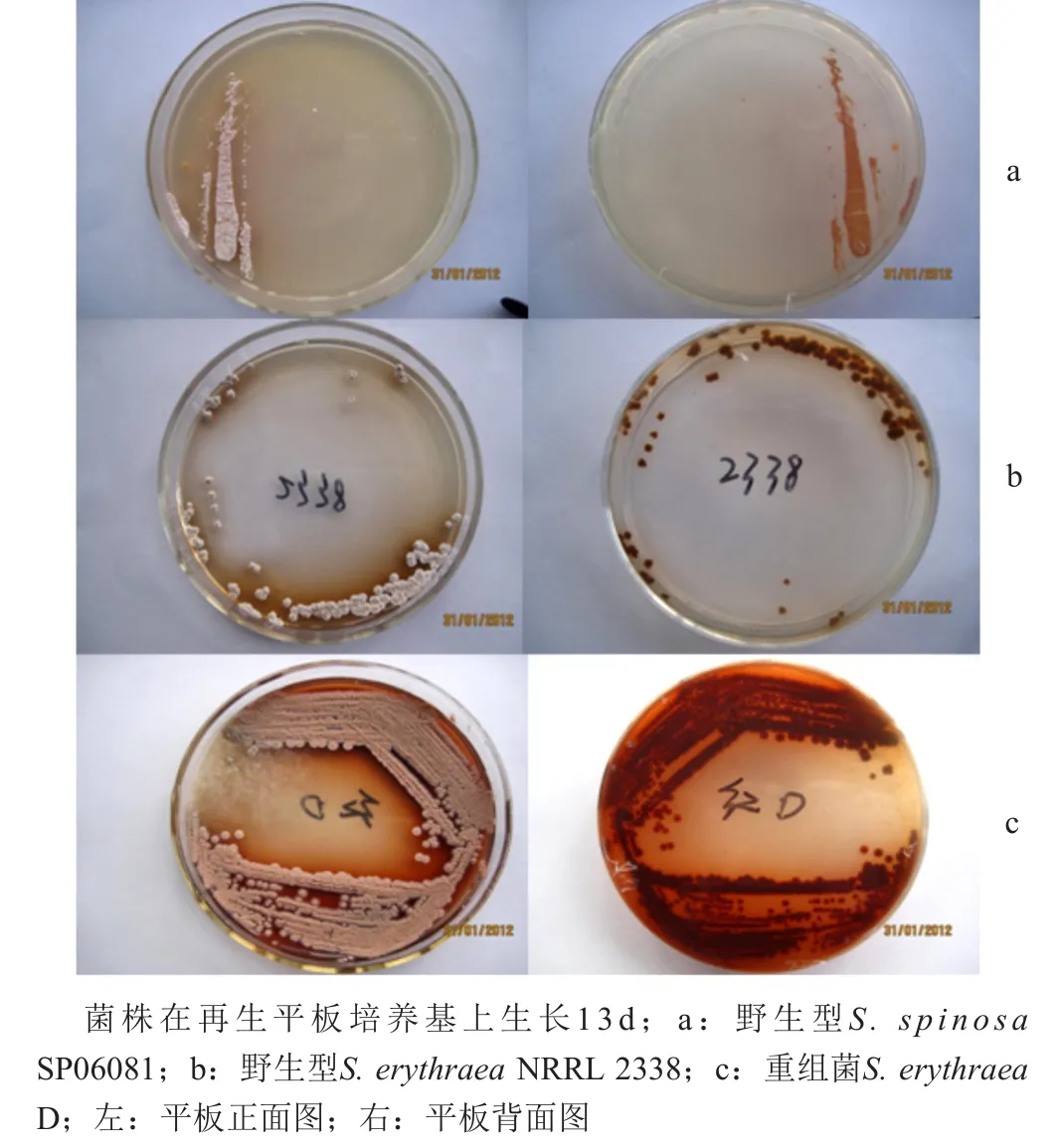
图5 红色糖多孢菌D在固体平板培养基上的生长形态特征Fig.5 Morphological characteristics of recobinants S.erythraea D grown on solid plates

图6 构建的红色糖多胞菌D发酵液的红霉素HPLC分析Fig.6 HPLC Analysis of erythromycins of fermentation broth of recombinants S.erythraea D
将重组菌株红色糖多胞菌D与刺糖多孢菌SP06081进行原生质体融合,融合操作后的原生质体稀释液涂布在再生平板培养基上培养10d后,随机挑取再生平板培养基上80个单菌落连续在再生平板培养基和YMG平板培养基(含有50mg/L的阿泊拉霉素)上分别转接培养1次,然后摇瓶发酵培养,HPLC检测分析多杀菌素产量。结果发现,大部分菌株不产多杀菌素,获得4株产多杀菌素的融合菌株(图7),分别将其命名为C5、C6、C9和B9,其相对产量如图8所示。用野生型刺糖多孢菌SP06081先制备原生质体然后让其直接在再生平板培养基上再生作为对照,发现野生型刺糖多孢菌原生质体再生后其多杀菌素产量低于原始野生型菌株。
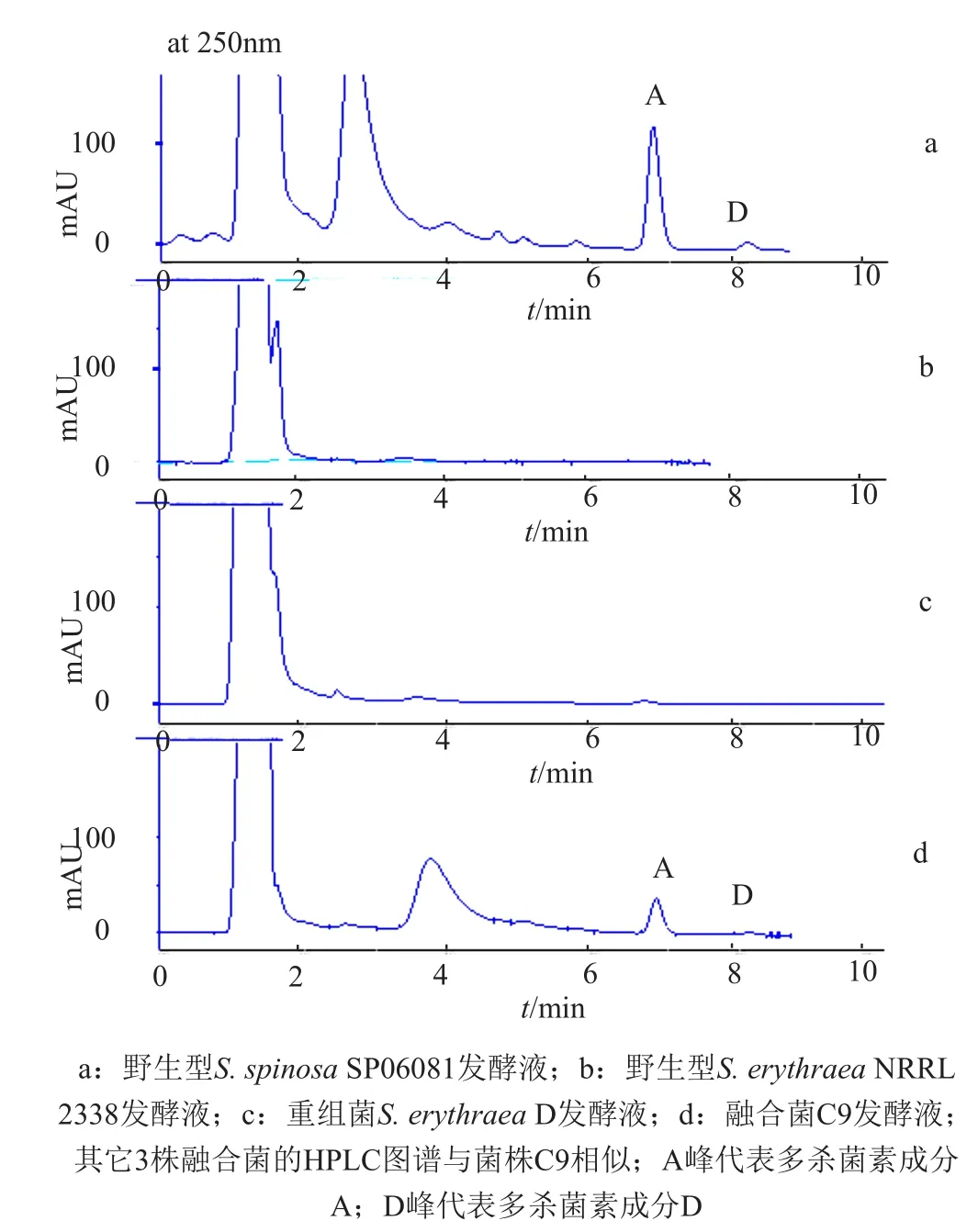
图7 融合菌株发酵液的多杀菌素组分的HPLC分析Fig.7 HPLC Analysis of spinosyns of fermentation broth of fused strains
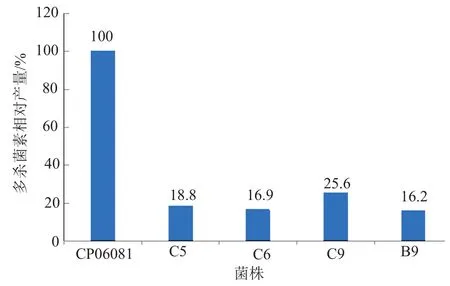
图8 初次筛选得到的融合菌株的多杀菌素相对产量Fig.8 Spinosad relative production of fused strains from initial screening
2.5 融合菌株的再次筛选
在原生质体再生平板培养基上,刺糖多孢菌产生白色孢子,菌落无褶皱;红色糖多孢菌产生粉红色孢子,菌落褶皱明显,产红色色素。基于抗生素筛选融合菌株多杀菌素产量偏低,接下来参照Wang等[27]的方法,考虑不采用抗生素筛选的方法,将原生质体融合后涂布不加阿泊拉霉素的再生平板培养基进行培养,待孢子成熟后直接挑取菌落形态近似刺糖多孢菌的菌落做摇瓶发酵,HPLC分析确定多杀菌素产量。随机选取27个单菌落用于摇瓶发酵检测。相比野生型菌株刺糖多孢菌SP06081,10株融合菌的多杀菌素产量有所提高(表2),其中一株菌株B-2多杀菌素产量增加最高,达453.4mg/L,较原始菌株刺糖多孢菌SP06081产量(105.2mg/L)提高了331%。
2.6 质谱分析融合菌株所产多杀菌素
收集融合菌株B-2发酵液HPLC出峰时间近似多杀菌素A和D的峰液,进行质谱分析。正如Schwedler等[31]先前报道的,这两种成分的m/z比率是732[M+H]+和746[M+H]+(图9)。因此,这两种成分分别确定为多杀菌素A和多杀菌素D。
2.7 融合菌株的遗传稳定性
将融合菌株B-2在YMG平板上传5代,并检测每代的多杀菌素产量,每代的多杀菌素产量与起始菌株B-2的产量接近,表明得到的高产融合菌株B-2是遗传稳定的。

表2 再次筛选融合菌株多杀菌素产量结果Tab.2 Spinosad production of protoplast fusion recombinants from the second screening

图9 融合菌株发酵所产多杀菌素A和D的质谱分析Fig.9 Mass spectrometry analysis of spinosyns A and D produced by fermentation of fused strains
3 讨论
由于红色糖多孢菌所产红霉素可能对刺糖多孢菌具有杀伤作用,并且在融合菌株的生物代谢过程中,它的生物合成可能竞争性地消耗多杀菌素合成所需要的原料和能量。因此先构建了不产红霉素的红色糖多孢菌菌株,然后将其与刺糖多孢菌做原生质体融合。
在再生平板培养基上,不产红霉素的红色糖多孢菌D菌株产色素的量较野生型菌株红色糖多孢菌多,并且在TSB液体培养基中培养2d后培养基颜色更深。究竟红色糖多孢菌D不产生红霉素后其胞内代谢产生了怎样的变化有待进一步研究。
重组红色糖多孢菌D和刺糖多孢菌经原生质体融合后大致有3种情况:①两株刺糖多孢菌的融合菌;②两株红色糖多孢菌的融合菌;③刺糖多孢菌和红色糖多孢菌的融合菌。因融合起始母本菌株红色糖多孢菌D含有阿泊拉霉素(apramycin)抗性基因,而刺糖多孢菌对阿泊拉霉素敏感,所以经含有阿泊拉霉素的平板培养基培养筛选之后的菌落可确定为未融合的红色糖多孢菌、两株红色糖多孢菌的融合菌及刺糖多孢菌和红色糖多孢菌的融合菌。挑单菌落发酵后取其发酵液HPLC检测,能够产生多杀菌素的菌株即可确定为目的菌株—刺糖多孢菌和红色糖多孢菌的融合菌。将融合菌株摇瓶发酵培养,收集发酵液HPLC目标峰液做进一步质谱分析,起到了辅证的作用。
本研究中,初次筛选到的4株融合菌的产量都不及原始菌株高,推测有以下几个原因:①出发菌株都是产次级代谢产物能力偏低的野生型菌株,其利用底物、次级代谢能力都不强,可能严重制约了融合菌产次级代谢产物的代谢能力。文献报道的高产多杀菌素融合菌株的获得普遍采用的是产次级代谢产物能力强的高产出发菌株[26-27]。②含有阿泊拉霉素的再生平板培养基可能对融合菌株具有较强的杀伤作用,不利于融合菌株的生长,影响了高产多杀菌素融合菌株的筛选。在本研究中,先将原生质体融合操作后的原生质体稀释液涂布在不含有阿泊拉霉素的再生平板培养基上,16~20h后再涂布适宜浓度的阿泊拉霉素进行融合菌株的抗性筛选。在《链霉素操作手册》中,Kesier等[30]曾提到原生质体融合后直接将融合菌株涂布在含有抗生素的平板上培养可能会对融合菌株产生较强的杀伤作用。
基于以上分析,本研究改进了筛选方法,进行了第二次高产多杀菌素菌株筛选工作。本次筛选采用非抗生素筛选的方法,直接筛选再生平板培养基上菌落形态近似刺糖多孢菌的菌株,成功获得若干多杀菌素产量增加的菌株,其中B-2菌株产量增加最为明显,较原始菌株刺糖多孢菌SP06081提高了331%。比起传统的理化诱变菌株改良方法,该方法效果明显,再次证明原生质体融合在改进多杀菌素产量上是有效的。
Matsushima等[32-33]于1994年就建立了对刺糖多孢菌进行遗传基因转移操作的两种方法:一种是体外修饰后的质粒转化原生质体法;另外一种是大肠埃希菌与其接合转移法,但这两种操作方法复杂,并且转化效率低下。该菌株的限制修饰系统成为对其进行遗传操作的技术难题,使得不少学者考虑将多杀菌素生物合成基因簇异源表达[17-18]。最近,已有探索对该菌株进行基因遗传修饰系统改进的报道。如张求学等[34]摸索了在菌体培养48h至对数中期制备的感受态,在电场强度为12kV/cm,最小DNA浓度为0.1μg时可获得较高的转化效率。本文研究即是对刺糖多孢菌进行遗传改良研究的一次有力补充。
本文对红色糖多孢菌和刺糖多孢菌原生质体融合进行了研究并且成功提高了多杀菌素的产量,这为具有优良发酵特性且高产多杀菌素的红色糖多孢菌和刺糖多孢菌融合菌株的构建提供了重要基础。在后续工作中,将考虑选择工业上使用的高产红霉素的红色糖多孢菌工程菌株与经诱变育种筛选到的高产多杀菌素的刺糖多孢菌菌株作为融合起始菌株,扩大供筛选菌落的总量,做多轮原生质体融合以及优化发酵培养基配方,可能有助于进一步提高融合菌株的多杀菌素的产量。此外,部分融合菌株可能会有一些新的发酵有益特性,如阿维链霉菌和刺糖多孢菌的融合菌株对发酵条件有较强的耐受性及利用淀粉作为发酵唯一碳源的特性。
